掺杂Mo对Li1+xV3O8物相和高温阴极放电性能的影响
曹笃盟, 李志友, 周科朝
(中南大学 粉末冶金国家重点实验室, 湖南 长沙, 410083)
摘要: 利用固相反应法制备Li1+xV3-yMoyO8(0≤y≤0.6)并对其进行了500 ℃和550 ℃时的放电性能测试。 采用X射线衍射测定掺杂Mo对Li1+xV3O8物相的影响, 用电子扫描电镜观察粉末的形貌, 用函数记录仪记录电压随时间的变化。 研究结果表明: 当y>0.2时, 物相为Li1+xV3O8和V2O5; 当y≤0.2时, 物相为Li1+xV3O8; 掺杂Mo后的粉末形貌基本不发生变化; 当放电电流密度为100 mA/cm2, 终止电压为1.8 V时, Mo的掺杂使Li1+xV3O8在500 ℃的最高电压提高约0.3 V, 比容量提高约300 A·s/g; 550 ℃时嵌入Li+的量最多可达x=3.8, 接近Li1+xV3O8嵌锂量的理论值x=4。
关键词: Li1+xV3O8; 热电池; 钼掺杂; 比容量
中图分类号:TM911 文献标识码:A 文章编号: 1672-7207(2005)05-0766-05
Influence of doping Mo on Li1+xV3O8 phase and cathodical discharge behaviors at elevated temperature
CAO Du-meng, LI Zhi-you, ZHOU Ke-chao
(State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Abstract: The powder of Li1+xV3-yMoyO8 (0≤y≤0.6) was synthesized by solid state reaction and their cathodical discharge performances at 500 ℃ and 550 ℃ were measured. X-ray diffraction of powder was used to identify the influence of doping contents of Mo on Li1+xV3O8 phase. The shape and appearance were observed by scanning electron microscope. The curves of voltage vs. discharge time were measured by function note-taker. The results show the single Li1+xV3O8 phase will be obtained when the utmost limits of doping contents of Mo are y≤0.2; when y>0.2 Li1+xV3O8 and V2O5 phases will be attained. Because of the doping of Mo, the discharge voltage and specific capacity at current density of 100 mA/cm2 and cut-off voltage of 1.8 V increase by about 0.3 V and 300 A·s/g, respectively, and the maximum lithium content x is 3.8 at 550 ℃, which approaches the theoretical value of 4.
Key words: Li1+xV3O8; thermal cell; doping of molybdenum; specific capacity
热电池由于具有较高的比功率和比能量、 使用温度范围广、 贮存时间长和激活迅速、 可靠等优点, 而广泛用作军用电源。 其目前最常用的正极材料是二硫化铁, 具有较高的比容量和稳定的放电电压。 但是, 锂合金(Li-Al、 Li-Si、 Li-B)/二硫化铁热电池的热稳定性差, 放电电压较低, 致使电池的比功率和比能量降低[1]。 美国的圣地亚(Sandial)和阿[CM(22] 贡(Argonne)国家实验室、 法国的萨福(Saft)进行有关热电池新的高电压正极材料的研究, 研究对象包括一组锂嵌入式金属氧化物。 其中Li1+xV3O8因具有良好的结构稳定性及高容量、 容易制备、 在空气中稳定和呈现出优良的放电动力学性能等优点而备受重视[2, 3]。 实验证明: Li1+xV3O8正极的特点是热稳定性和热导性好, 电压高, 比容量和比能量高; 缺点是出现初始电压峰包和个别的放电台阶[1]。
对Li1+xV3O8的掺杂研究主要集中在以下几个方面:
a. 用Al, P, Cr, Mn, Mo和W等元素部分替代V[4, 5];
b. 用碱金属离子(如Na+, K+)和H+部分或全部替代Li+[6-10]。
这些研究主要集中于掺杂各种离子对常温锂离子电池中Li1+xV3O8充/放电性能的影响, 但是, 对于在高温热电池当中的应用则没有涉及。 在此, 作者采用高温固相反应合成Li1+xV3-yMoyO8(0≤y≤0.6), 研究掺杂Mo对Li1+xV3O8物相及高温阴极放电时比容量和工作电压的影响。
1 实 验
将NH4VO3, Li2CO3和(NH4)6Mo7O24·4H2O按n(Li)∶n(V)∶n(Mo)=1.2∶(3-y)∶y(y分别为0.2, 0.4和0.6)配好, 用无水乙醇作为介质, 混料8 h, 然后在85 ℃将无水乙醇除去。 残留固体物在160~180 ℃真空干燥后升温至550~600 ℃并保温48 h。 缓慢冷却后研磨使粒度〈76 μm。
模拟Li-B/LiCl-KCl/ Li1+xV3-yMoyO8的片型单电池在500 ℃和550 ℃进行放电试验。 含Li 67%(质量分数)的Li-B合金是Li7B6和Li的两相材料(自制, 厚度为0.6~0.65 mm), 电解质隔离片(0.4 g)是含30%轻质MgO的LiCl-KCl共熔盐(质量比为45∶55, 熔点为352 ℃)的粉末压制片。 正极片是将上述制得各种配比的正极活性物质中加入20%的LiCl-KCl, 混合均匀后, 在空气中于400 ℃保温1 h, 快速冷却后捣碎压片, 极片直径为17.5 mm, 集流片厚为1.5 mm的不锈钢片, 极片的制作及电池的组装均在通入干燥空气的手套箱内(相对湿度≤2%)完成, 以防止吸潮。 将模拟电池送入2块500 ℃或550 ℃恒温的金属压块间, 加上负载进行放电试验。
采用Rigaku D/max2550型X射线衍射仪进行物相分析, 采用JSM-5600LV型扫描电子显微镜观察样品的形貌, 采用函数记录仪测量电压随时间的变化曲线。 根据电压—时间曲线即可求出电压与x的关系曲线。
2 结果与讨论
2.1 Mo掺杂对物相的影响
图1所示为掺杂Mo量不同时, 高温固相反应所得产物的X射线衍射图谱(XRD)。 由于Mo6+离子半径为0.062 nm; V5+离子半径为0.059 nm, 两者相差很小, 当y≤0.2时, 掺杂Mo没有改变Li1+xV3O8相, 掺杂的Mo有可能取代了一部分V5+而形成置换固溶体; 当y为0.4和0.6时, Li1+xV3O8最强的(100)衍射峰产生分化, 出现了V2O5峰。 J.Kawakita等的研究结果表明[11], 当y>0.3时, 会有V2O5衍射峰出现。 因此, 要得到单一的Li1+xV3O8相, Mo的掺杂量上限为y≤0.2。
表1所示为根据X射线衍射图数据, 按照单斜晶系公式计算出的Li1+xV3-yMoyO8的点阵参数。 Li1+xV3O8的结构如图2所示[12]。 Mo的掺杂使晶体结构发生微小变化, β和b基本上保持不变, a和c变化较大, 单胞体积则逐渐增大。
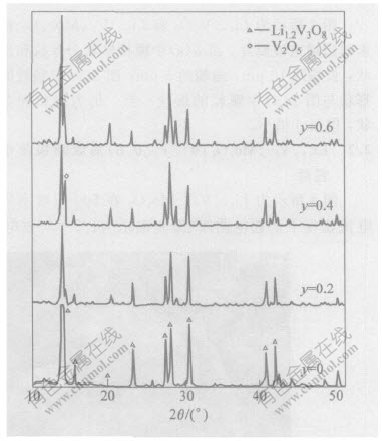
图 1 Li1+xV3-yMoyO8的X射线衍射图谱
Fig. 1 XRD patterns of Li1+xV3-yMoyO8 obtained by solid state reaction at different y values
表 1 Li1+xV3-yMoyO8的晶胞参数
Table 1 Lattice parameters of Li1+xV3-yMoyO8
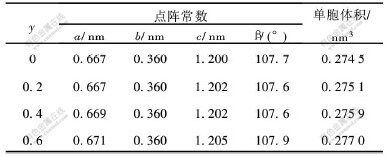
图 2 Li1+xV3O8的结构(010)晶面投影方向
Fig. 2 Projection of Li1+xV3O8 on to(010) showing positions of all atoms
图3所示为Li1+xV3O8和Li1+xV2.8Mo0.2O8粉末的扫描电镜照片。 图3(a)中颗粒形状为棒状和条状, 长端约10 μm, 短端约5 μm; 图3(b)中颗粒的形状与图3(a)中颗粒的形状一致, 仍为棒状和条状, 但尺寸稍小。
2.2 Li1+xV3-yMoyO8(0≤y≤0.6)高温阴极放电性能
图4所示为Li1+xV3-yMoyO8在500 ℃时不同电流密度下的放电曲线(终止电压为1.2 V)。 放电比容量和嵌入阴极中的Li+量x可分别由式(1)和(2)求出。
![]()
式中: C为比容量; F为法拉第常数; F=96485; x为嵌入阴极的Li+的量; M为LiV3-yMoyO8的相对分子质量, y=0时, M=288; S为阴极面积, cm2; I为电流, I=J·S/1000, A; t为放电时间, s; m为阴极活性物质的质量, g; J为电流密度, mA/cm2。 式(1)中比容量的单位为mA·h/g, 乘上3.6则单位为A·s/g。 由式(1)可得,
![]()
当电流密度为100 mA/cm2时, Li1+xV3O8的最高电压为2.77 V, 终止电压为1.8 V时的比容量为713 A·s/g, 比FeS2 100 mA/cm2时的最高电压高出约0.4 V(同一条件下测得FeS2的最高电压为2.40 V)。 在同样条件下, Li1+xV2.8Mo0.2O8的最高电压为3.06 V, 比FeS2的最高电压高出约0.7 V。 电流密度为100 mA/cm2、 电压为1.8 V时的比容量为1011 A·s/g, 且当电流密度为200和400 mA/cm2时, 其比容量分别为875和795 A·s/g。 Li1+xV2.6Mo0.4O8的最高电压为3.07 V, 电流密度为100, 200和400 mA/cm2, 终止电压为1.2 V时, 比容量分别为1068, 1031和1020 A·s/g。 Li1+xV2.4Mo0.6O8的最高电压为3.03 V, 当电流密度为100 mA/cm2、 电压为1.8 V时, 比容量为913 A·s/g。 从以上数据可以看出, Mo的适量掺杂使Li1+xV3O8的最高电压和比容量尤其是大电流放电时的比容量得到较大提高; 当掺Mo的量为0.6时, 最高电压和比容量都有所降低。 从图4还可以看[CM(22]出, 对于同一种材料, 随着电流密度的增大, 电池的工作电压和放电容量均有所降低。 电压降低一方面是由于Li1+xV3O8中的Li+在扩散时, 表面层Li+浓度高而内层Li+浓度低, 处于一种非平衡状态放电; 另一方面与电解质隔离层中Li+的扩散有关, 电池在放电过程中, Li+通过电解质从阳极向阴极扩散, 在电解质中形成浓度梯度, 这就使得阳极附近Li+浓度增加, 而阴极附近K+浓度增加, 于是造成电解质中各区域内的Li+与K+的浓度比发生变化, 结果导致局部电解质的熔点升高, Li+的扩散速度降低。 电解质中局部Li+与K+的浓度比变化率与电池的放电电流密度有关, 当电流密度增大时, Li+与K+浓度比的变化率也随之增大。

图 3 Li1+xV3-yMoyO8粉末的扫描电镜照片
Fig. 3 Scanning electron microscope images of Li1+xV3-yMoyO8 powder
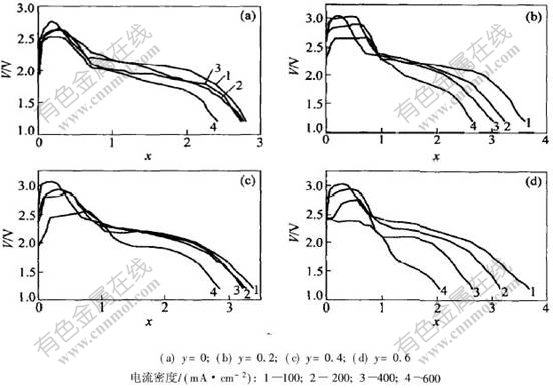
图 4 Li1+xV3-yMoyO8在500 ℃时不同电流密度放电曲线(终止电压为1.2 V)
Fig. 4 Discharge curves of Li1+xV3-yMoyO8 at 500 ℃ with different current densities
放电曲线分2个阶段: 当x〈1.5时, 比容量与温度无关, 基本保持不变; 当x>1.5时, 掺杂材料的比容量随温度的升高而增加, 如图5所示。 原因是当x〈1.5时, Li+在原始相Li1+xV3O8中的扩散很快; 当x>1.5时, Li1+xV3O8表层出现了Li4V3O8相, 影响了Li+向内的扩散。 Li+在Li1+x-V3O8相中的扩散系数是10-8 cm2/s, 基本与温度的变化无关; 但在Li4V3O8相中, 扩散系数受温度的影响很大, 高温时的扩散系数大于低温时的扩散系数, 例如当温度从5 ℃升高到45 ℃时, 扩散系数也从10-11 cm2/s升高到10-9 cm2/s[13]。 所以, 深度 放电时, Li1+xV3O8的比容量受电流密度和温度的影响很大, 这也可以从图5中看出。 随着温度的升高, 2种材料的比容量均有所提高。 温度升高也使Li+的振动加剧, 跃过能垒进入V3O-8层间的概率增加, 使常温下难以被占据的Li+位也被占据, 比容量提高。 常温锂离子电池正极材料的研究表明[4], V5+和Mo6+阳离子半径的差异导致掺杂后的晶体畸变加剧, 这些都有利于Li+的扩散和嵌入。
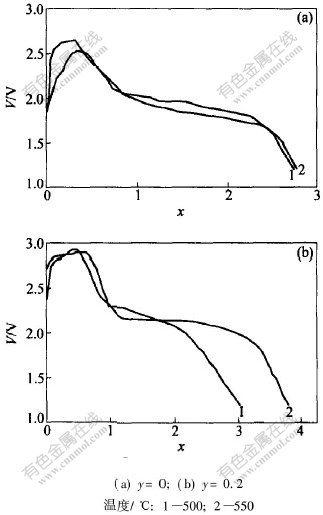
图 5 Li1+xV3-yMoyO8在不同温度时的放电曲线(终止电压为1.2 V, 电流密度为400 mA/cm2)
Fig. 5 Discharge curves of Li1+xV3-yMoyO8at different temperatures
通常高温合成的Li1+xV3O8的有效容量几乎不能超过x=3时的容量, 但是Mo的掺入影响了Li+的嵌入, 使Li1+xV2.8Mo0.2O8具有更高的比容量, 图2所示Li1+xV3O8结构中所有可能占据的四面体和八面体锂位几乎充满(500 ℃时, x=3.6; 550 ℃时, x=3.8; 完全充满时x=4)。 S.V.Pouchko等[14, 15]在研究常温锂离子电池用Li1+xV2.8Mo0.2O8薄膜的嵌锂性能时, 得到了相似的结果(x=3.9), 并且认为在Li1+xV3O8基体结构中, 由于Li+和极化粒子(与嵌入的Li+同时进入的电子集中在钒离子周围, 从而形成的一种极化型电子导体)协同扩散能力增强, 造成了其放电容量的增加。
3 结 论
a. 当Mo掺入量y>0.2时, 物相为Li1+x-V3O8和V2O5; 掺入量y≤0.2时, 物相为Li1+x-V3O8;
b. 掺杂Mo后Li1+xV3O8粉末的形貌基本不发生变化, 仍为棒状和条状;
c. Mo的掺入使Li1+xV3O8高温条件下的最高电压提高约0.3 V, 比容量增加约300 A·s/g, 嵌入的Li量最高可达x=3.8, 接近Li1+xV3O8嵌锂量的理论值x=4.0, 但电压平稳性有待进一步提高。
参考文献:
[1]李登彩.热电池最新进展[J].电源技术, 1992, 16(6): 33-35, 40.
LI Deng-cai. Current status of development of thermal batteries[J].Chinese Journal of Power Sources, 1992, 16(6): 33-35, 40.
[2]李志友, 黄伯云, 汤春峰, 等. LiV3O8的溶胶-凝胶法合成及500 ℃阴极放电性能[J].功能材料, 2001, 32(2): 181-183.
LI Zhi-you, HUANG Bai-yun, TANG Chun-feng, et al. Synthesis of LiV3O8 by sol-gel method and its cathodical discharge behavior at 500 ℃[J]. Functional Material, 2001, 32(2): 181-183.
[3]LI Zhi-you, HUANG Bai-yun, ZHU Yong-li, et al. Synthesis of lithium cobalt oxides by sol-gel method and their cathodical discharge behavior at 500 ℃[J]. J Cent South Univ Technol(English Edition), 2000, 7(2): 57-60.
[4]Thackeray M M. Modified lithium vanadium oxide electrode materials products and methods[P]. US: 6004697, 1999-12-21.
[5]Thackeray M M. Modified lithium vanadium oxide electrode materials and products[P]. US: 6322 928, 2001-11-27.
[6]Kawakita J, Makino K, Katayama Y, et al. Preparation and lithium insertion behavior of LiyNa1.2-yV3O8[J].Solid State Ionics, 1997, 99(3-4): 165-171.
[7]Pasquali M, Pistoia G. Lithium intercalation in Na1+x-V3O8 synthesized by a solution technique[J].Electrochim Acta, 1991, 36(10): 1549-1553.
[8]Kawakita J, Miura T, Kishi T. Comparison of Na1+x-V3O8 with Li1+xV3O8 as lithium insertion host[J]. Solid State Ionics, 1999, 124(1-2): 21-28.
[9]Oka Y, Yao T, Yamamoto N.Hydrothermal synthesis and structure refinements of alkali-metal trivanadates AV3O8 (A=K, Rb, Cs)[J].Materials Research Bulletin, 1997, 32(9): 1201-1209.
[10]Kumagai N, Yu A, West K. Li1-xNaxV3O8 as positive materials for secondary lithium batteries[J]. J Applied Electrochemistry, 1997, 27(8): 953-958.
[11]Kawakita J, Katagiri H, Miura T, et al. Lithium insertion behavior of manganese or molybdenum substituted Li1+xV3O8[J]. J Power Sources, 1997, 68 (2): 680-685.
[12]Pistoia G, Panero S, Tocci M, et al. Solid solutions Li1+xV3O8 as cathodes for high rate secondary Li batteries[J]. Solid State Ionics, 1984, 13(4): 311-318.
[13]Kawakita J, Miura T, Kishi T. Lithium insertion and extraction kinetics of Li1+xV3O8[J]. J Power Sources, 1999, 83 (1-2): 79-83.
[14] Pouchko S V, Ivanov-schitz A K, Kulova T L, et al. Sol-gel fabrication and lithium insertion kinetics of the Mo-doped lithium vanadium oxide thin films Li1+x-MoyV3-yO8[J]. Solid State Ionics, 2002, 151(1-4): 129-140.
[15]Pouchko S V, Ivanov-Schitz A K, Ooms F G B, et al. Lithium insertion into γ-type vanadium oxide bronzes doped with molybdenum (VI) and tungsten (VI) ions[J]. Solid State Ionics, 2001, 144(1-2): 151-161.
收稿日期:2004-09-06
基金项目: 国家自然科学基金资助项目(50002015)
作者简介:曹笃盟(1973-), 男, 河南南阳人, 博士研究生, 从事热电池正极材料研究
论文联系人: 周科朝, 男, 教授; 电话: 0731-8836264; E-mail: zhoukc2@mail.csu.edu.cn


