文章编号:1004-0609(2008)02-0342-07
喜温嗜酸硫杆菌YN12菌株的鉴定及其镉抗性能
丁建南,朱若林,康 健,张成桂,吴学玲,邱冠周
(中南大学 资源加工与生物工程学院,长沙410083)
摘 要:
自云南酸性热泉水样中分离出一株中度嗜热硫氧化菌YN12。对其形态特征和生理生化特性以及16S rDNA序列分析结果证明,该菌株归属于喜温嗜酸硫杆菌(Acidithiobacillus caldus)。重金属抗性实验表明,YN12菌株对3CdSO4?8H2O具有超强抗性,其最高初始Cd2+耐受浓度达4.8 g/L。在此基础上,不断提升3CdSO4?8H2O浓度,其最终Cd2+耐受浓度可达31.5 g /L(相当于3CdSO4?8H2O 210 g/L)。在该最终Cd2+耐受浓度下,经过连续3代的适应性生长,YN12菌株的生长速度和硫氧化活性均能得到较好的恢复。
关键词:
中图分类号:Q 93 文献标识码:A
Identification and cadmium (Ⅱ) resistance of strain YN12, Acidithiobacillus caldus
DING Jian-nan, ZHU Ruo-lin, KANG Jian, ZHANG Cheng-gui, WU Xue-ling, QIU Guan-zhou
(School of Resources Processing and Bioengineering, Central South University, Changsha 410083, China)
Abstract: A moderately thermophilic sulfur-oxidizing strain, YN12, was isolated from an acidic hot spring sample collected in Yunnan Province, southeastern China. Morphological, physiological and 16S rDNA sequence data suggest that YN12 belongs to the species, Acidithiobacillus caldus. YN12 exhibits a very high degree of resistance to cadmium (Ⅱ), with an original maximum tolerated concentration (MTC) of 4.8 g/L and an ultimate MTC of 31.5 g/L after adapted by a gradually increased concentration of 3CdSO4?8H2O. Continuously cultured in the medium containing 210 g 3CdSO4?8H2O/L (equal to 31.5 g/L of Cd2+) for three generations, the strain is capable of restoring its growth and sulfur oxidation activity to an approximately normal level.
Key words: Acidithiobacillus caldus; strain YN12; cadmium resistance; maximum tolerated concentration
喜温嗜酸硫杆菌(Acidithiobacillus caldus)是嗜酸硫杆菌属(Acidithiobacillus)中惟一的适度嗜热菌,自1994年由HALLBERG和LINDSTROM分离、鉴定以来[1],随着人们对其浸矿作用的不断认识,该菌在硫化矿生物浸出,特别是在金属硫化精矿高温生物浸矿反应器中的应用越来越广泛[2-4]。喜温嗜酸硫杆菌的应用,最早始于其对含金砷硫铁矿(毒砂)的生物预氧化,因而该菌对砷离子的抗性从一开始就备受关注。目前国内外有关喜温嗜酸硫杆菌的抗性研究主要集中于 砷[5-7],对其它有毒金属离子抗性的研究报道较少。金属硫化矿的化学组成较为复杂,随着浸矿的进行,除了砷以外,往往还有其它有毒金属离子游离出来,抑制微生物的生长和浸矿活性[8-9],因此,研究喜温嗜酸硫杆菌对这些离子的抗性,对于提高其浸矿效率具有十分重要的意义。本文作者分离纯化了21株喜温嗜酸硫杆菌新菌株,其中包括一株高抗镉(Cd2+)菌株YN12。本文报道了该菌株的分离、鉴定及其抗Cd2+性能的研究结果。
1 菌株的分离与鉴定
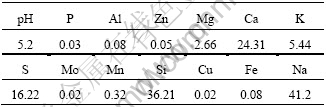
从云南瑞甸采集到酸性热泉水样一式2份,其中一份保存在45 ℃,用于菌种富集,另一份保存在4 ℃,用于元素分析。样品从采集到使用,保存时间不超过4 d。采用原子吸收分光光度法(Atomic absorption spectrometry,AAS)分析水样化学成分。该酸性热泉水样的主要特性见表1。
表1 酸性热泉样品80 ℃时的主要特性
Table 1 Main properties of acidic hot spring sample at 80 ℃
将3 mL 45 ℃下保存的水样加到装有47 mL富集培养基的三角瓶中,用硫酸调整pH值至2.5,然后加入灭菌升华硫(S0),于45 ℃、转速180 r/min下振荡培养5~7 d,每天监测pH值变化,待pH值降到1.0左右时,按同样方法转接培养,待pH值再次降到1.0左右时,进行又一次转接培养,如此富集3次。第3次富集物用来进行菌株分离。富集培养基[10]包括以下基本盐成分(g/L):(NH4)2SO4 (3.0)、Na2SO4?10H2O (3.2)、KCl (0.1)、K2HPO4 (0.05)、MgSO4?7H2O (0.5)、Ca(NO3)2 (0.01),并含0.02%(w/v)酵母提取物(YE)。该培养基另含数种微量元素,微量元素的配方如下(mg/L):FeCl3?6H2O (11.0)、CuSO4?5H2O (0.5)、HBO3 (2.0)、MnSO4?H2O (2.0)、Na2MoO4?2H2O (0.8)、CoCl2? 6H2O (0.6)、ZnSO4?7H2O (0.9)、Na2SeO4 (0.1)。基本盐培养基和YE采用常规高压灭菌法灭菌,微量元素过滤除菌,S0采用间歇灭菌法连续灭菌3次。
将第3次富集培养物涂布在配方与富集培养基相同但能量物质不同、pH值为2.5的0.7%(w/v)琼脂平板上。该固体培养基的能量物质由富集培养基的S0改为1.5 g K2O6S4/L(过滤除菌)。将涂布好的平板置于45 ℃下培养7 d后,挑取单菌落接入与上述富集培养基相同,pH 2.5的液体培养基中,振荡培养5~7 d,然后再用前述固体培养基分离,如此反复分离3次,最后得到纯培养的YN12菌株。该菌株在4 ℃下保存于液体富集培养基中,定期活化。除另有说明外,以下实验所用培养基均为该培养基。
1.2.1 16SrRNA基因分析
将YN12菌株培养在液体培养基中,当菌体生长达到稳定期时,用无菌定性滤纸过滤2次,除去硫粉,取100 mL菌液,离心收集菌细胞,先后用pH 1.8值为左右的稀硫酸溶液和pH值为8.0的TE缓冲液分别洗涤2次,然后悬浮于200 μL TE缓冲液中。使用EZ-10 Spin Column Genomic DNA Minipreps Kit (Bio Basic Inc.)试剂盒,按说明提取基因组DNA。用63f(5’- CAGGCCTAACACATGCAAGTC-3’)/1387r (5’-GGG- CGGWGTGTACAAGGC-3’)引物对,扩增YN12菌株的16S rDNA序列。PCR体系25 μL,包含:2.5 μL 10×PCR 缓冲液、2.5 μL (25 mmol) MgCl2、1 μL (10 mmol) dNTP mix (Fermentas)、1 μL 63f引物和相同体积的1387r引物、1 μL (5 units) Taq酶 (Fermentas)、1 μL模板DNA 以及15 μL 灭菌双蒸水。对照体系除模板DNA被相同体积的灭菌双蒸水代替外,其它与前述体系完全相同。PCR程序如下:94 ℃初始变性5 min,33个循环,每个循环包括94 ℃变性45 s,55 ℃退火45 s,72 ℃下延伸90 s,循环过后,最后在72 ℃下延伸10 min。PCR产物使用E.Z.N.A? Gel Extraction Kit (Omega Bio-Tek, Inc.)纯化试剂盒纯化,纯化后的PCR产物用pBS-T PCR Products Clone Kit (Tiangen Biotech Co., Ltd., Beijing)克隆试剂盒克隆转化。具体方法参照夏金兰等[11]的研究成果。将阳性克隆菌液送北京三博远志生物技术有限责任公司,进行16S rDNA测序。
使用Clustal X (1.8) 和 MEGA3软件构建16S rDNA系统发育树,以表明YNTC-1菌株与其相近菌株的亲缘关系。
1.2.2 菌株形态特征
将菌体处于稳定期的YN12菌液用无菌定性滤纸过滤,收集菌细胞,再用pH值为2.5左右的稀硫酸洗涤2次,取少量细胞制片,做革兰氏染色,在光学显微镜下观察,剩余细胞送湖南师范大学生命科学学院电镜室进行扫描电镜分析。
1.2.3 菌株生理生化特性
将YN12菌株接种于液体培养基中,分别置于30、35、40、45、50、55和60 ℃的温度下培养,起始pH值为2.5,培养100 h后,采用直接计数法,结合光密度,评价其生长状况。大致温度范围确定后,再缩小温度间隔,继续以同样的方式进行实验,直至精确到±1 ℃。
以上述同样的方式接种,用稀硫酸分别调整培养基起始pH值为1.0、1.5、2.0、2.5、3.0、3.5、4.0和4.5,于YN12菌株的最适温度下培养100 h后,用上述同样的方法观察其生长状况。
将YN12菌液离心,收集菌细胞,用pH值为2.0左右的稀硫酸洗涤2次,以相同接种量接种在分别以S0(5 g/L)、Na2S2O3(10 g/L,过滤除菌)、K2O6S4(1.5 g/L,过滤除菌)、FeSO4?7H2O (5 g/L,过滤除菌) 、蛋白胨(2 g/L)、YE(0.2 g/L)、葡萄糖(1 g/L)、S0(5 g/L)+蛋白胨(1 g/L)、S0(5 g/L)+YE(0.2 g/L)和S0(5 g/L)+葡萄糖(1 g/L)为能源物质的液体培养基中,在YN12菌株的最适起始pH值、最适温度和转速180 r/min下,振荡培养100 h,用直接计数法,结合光密度,检测菌株的生长,考察其能源物质利用情况。
2 菌株的镉抗性
实验前先将YN12菌株接种在前述S0培养基中,于最佳生长条件(表2)下活化,待pH值降到1.0时,从摇床中取出,室温下静置24 h后,在一系列装有47 L 相同培养基的三角瓶中分别接种3 L活化的菌液,这些三角瓶中含不同浓度的分析纯3CdSO4?8H2O。实验在相同pH值(2.5)、相同振摇速度(180 r/min)以及菌株的最适温度下进行。共设置10个浓度,构成一组,其中包括0 g 3CdSO4?8H2O/L的对照。分别取各实验瓶菌液在UV 2300分光光度计(Techcomp)上,于波长440 nm处,测定起始光密度(Optical Density, OD)值,测得各实验瓶的起始OD值为0.020~.025;另取3瓶菌液做活细胞计数,测得各组的平均起始活细胞数为2.1×106 /mL。每组实验重复一次。实验过程中定期测定各组对照菌液的pH值,当pH值降到1.0时,实验停止,立即测定该组其它实验瓶的pH值,再在实验温度下静置3 h后取各瓶菌液上清液,加入适量的CS2,溶解可能悬浮于菌液中的元素硫,立即测定最终OD值。另从各实验瓶中取少量菌液,经适当稀释后,采用血球计数板直接计数法,在Olympus CX31光学显微镜下测定最终活细胞数。当最终OD值比起始OD值平均高0.005、最终活细数平均达到2.5×106/ mL时,实验瓶中的Cd2+浓度就是该菌株对Cd2+的最高初始耐受浓度(Original maximum tolerated concentration, OMTC)。
未经Cd2+驯化的YN12菌株已对Cd2+具有较高的初始抗性,为研究其抗Cd2+能力是否还可以通过Cd2+驯化得到进一步的提高,我们从菌株的最高初始Cd2+耐受浓度(4.8 g/L)起步,对YN12进行逐步提升Cd2+浓度的抗性驯化。驯化过程中定期测定菌液OD值、活菌数及pH,观察逐步提升的Cd2+浓度对该菌株生长和氧化活性的影响。3CdSO4?8H2O浓度的具体提升步骤为:32 g/L→64 g/L→96 g/L→120 g/L→144 g/L→173 g/L→210 g/L。每级浓度均设不加3CdSO4? 8H2O 的对照,各处理分别重复3次,所用培养基与最高初始耐受浓度实验相同。每次接种前先收集前一级Cd2+浓度下培养的菌细胞,并用无菌水洗涤2次,然后再接入实验瓶中;对照瓶接种,用前次对照培养基培养的菌细胞,处理方法与实验瓶接种物完全相同,对照瓶和实验瓶的接种量也完全相同。OD值、活菌数和pH测定方法与最高初始耐受浓度实验相同。以前后两次,相差24 h,OD值和活菌数不发生变化作为实验终止的依据,此时的OD值和活菌数代表该Cd2+浓度下的最终菌浓度。
实验分两阶段进行。第一阶段是按上述步骤逐步提升Cd2+浓度的连续驯化阶段,目的是确定各级Cd2+浓度下YN12菌液能达到的最大菌浓度,以及达到该菌浓度所需要的时间;第二阶段是已驯化菌株生长特性研究阶段,该阶段是将经过最终Cd2+浓度驯化的第一代YN12菌株,继续在此Cd2+浓度下转接2次,得到驯化第二代和第三代菌株,观察YN12菌株的生长速度、最终菌浓度和pH是否会随着转接代数的增加而发生变化。
3 结果与讨论
对采集的酸性热泉水样进行了3次富集后,再对第3次富集物进行连续3次琼脂平板分离,得到纯培养的YN12菌株。
YN12菌株革兰氏染色反应为阴性,光学显微镜和扫描电镜显示该菌为典型的短杆状,大小为0.5~0.6 μm× 1.3~1.4 μm,与同处于稳定期的同种其它20株菌株比较,YN12细胞较短(其它菌株大小约0.4~0.6 μm×1.4~1.8 μm),详见图1和表2。
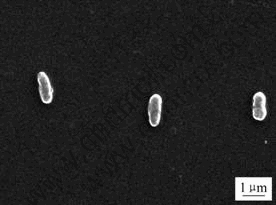
图1 YN12菌株扫描电镜照片
Fig.1 SEM image of strain YN22 (×10 000)
表2 YN12菌株的主要特征
Table 2 Main properties of strain YN12
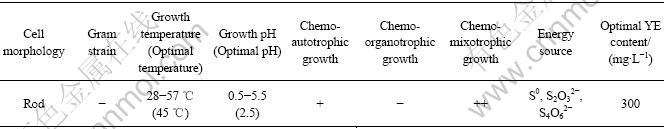
表2列出了YN12菌株的主要形态特征与生理生化特性。该菌株的生长温度为28~57 ℃(最适温度为45 ℃),生长pH值为0.5~5.5(最适pH值为2.5)。能利用S0、S2O32-和S4O62- 进行化能自养生长,不能进行专性异养生长;在以S0为能源物质的情况下可以进行混合营养生长,在这种情况下,蛋白胨、YE和葡萄糖可以促进菌株的生长,最佳YE浓度300 mg/L。图2所示为不同能源物质下YN12菌株的生长情况,该菌株不能氧化Fe2+,S0为能源时生长最好,酵母提取物可以显著促进其生长。
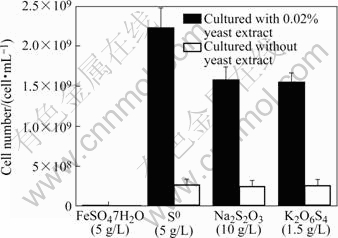
图2 不同能源物质对YN12菌株生长的影响
Fig.2 Effect of energy source on growth of YN12
采用NCBI中的BLAST(blastn)程序对YN12菌株的16S rDNA序列片断与GenBank中收录的16S rDNA序列进行同源性比较,发现YN12菌株的16S rDNA序列与GenBank中已有的喜温嗜酸硫杆菌菌株(Acidithiobacill caldus) 16SrDNA序列的相似性都在99%以上。图3所示为使用3.1版本MEGA软件[12]构建的基于16S rDNA序列的系统发育树,很明显YN12菌株与喜温嗜酸硫杆菌标准菌株 DSM 8584及其它同种菌株聚在同一组,氧化亚铁嗜酸硫杆菌(A. ferrooxidans)菌株和氧化硫嗜酸硫杆菌(A. thiooxidans)菌株则分别聚在另外两组。
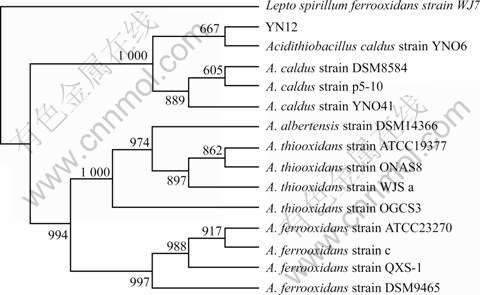
图3 基于16SrRNA基因序列的系统发育树
Fig.3 Phylogenetic tree based on 16S rRNA gene sequences of strain YN12 and related species
YN12菌株的主要形态特征和生理生化特性,以及16S rDNA序列分析结果均与已报道的喜温嗜酸硫杆菌菌株相同[1, 13-15]。研究结果证明YN12菌株归属于喜温嗜酸硫杆菌。
3.2.1 初始Cd2+耐受浓度
YN12菌株对3CdSO4?8H2O的最高初始耐受浓度为32 g/L,其实际Cd2+浓度达到4.8 g/L,是其它菌株的4~32倍(其它菌株的数据未列出),表现出较强的抗Cd2+性能。从图4可以看出0.5~2.0 g/L的3CdSO4?8H2O浓度对YN12菌株生长没有明显影响,而当3CdSO4?8H2O浓度增加到4 g/L时,YN12菌液的最终光密度值比同期的对照菌液提高了25.1%,这种现象值得深入研究。在3CdSO4?8H2O浓度增加到8.0 g/L时,开始对YN12生长产生抑制作用,随着3CdSO4?8H2O浓度的增加,对YN12生长的抑制作用进一步加强,至16 g/L时,OD值比对照下降了22.2%。在此基础上将3CdSO4?8H2O浓度再提高100%,达到32.0 g/L时,菌细胞已不能正常增殖,此时的OD值只比起始OD值高0.005,活菌数也只有2.5×106 /mL,仅略高于起始值(2.1×106 /mL),这表明该浓度已是YN12对3CdSO4?8H2O的最高初始耐受浓度。
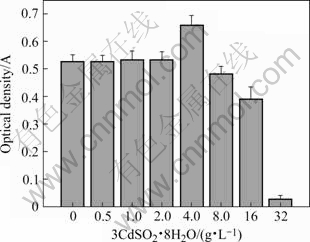
图4 3CdSO4?8H2O对YN12菌株生长的影响
Fig.4 Effect of 3CdSO4?8H2O on growth of strain YN12
3.2.2 Cd2+抗性驯化
图5所示为不同Cd2+浓度下,YN12菌株培养液能达到的最大OD值及其所需时间。随着Cd2+浓度的逐级提升,OD值渐次下降,从对照样品(0 g/L 3CdSO4?8H2O)的0.536降到最终Cd2+浓度(210 g/L 3CdSO4?8H2O)下的0.313,以64 g/L到96 g/L 3CdSO4?8H2O之间的OD值下降幅度最大;同时,随着Cd2+浓度提高,达到相应Cd2+浓度下最大OD值的所需时间也逐渐增加,3CdSO4?8H2O的浓度为0 g/L时,达到0.536的最大OD值只需100 h,而当3CdSO4?8H2O为210 g/L的最终浓度时,需要288 h才能达到最大OD值0.313。
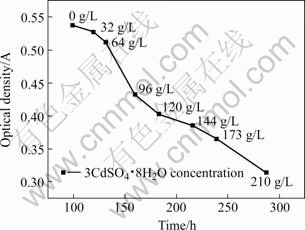
图5 不同3CdSO4?8H2O浓度对YN12菌株生长的影响
Fig.5 Effect of various 3CdSO4?8H2O concentrations on growth of strain YN12
经过最终浓度Cd2+(210 g/L 3CdSO4?8H2O)驯化的YN12菌株再在相同Cd2+浓度下转代培养,生长速度呈逐步提高的趋势(图6)。不但最大OD值由驯化一代(210 g/L 3CdSO4?8H2O-Ⅰ)的0.313提高到驯化二代(210 g/L 3CdSO4?8H2O-Ⅱ)的0.4,并进而提高到驯化三代(210 g/L 3CdSO4?8H2O-Ⅲ)的0.46,而且达到最高菌浓度的时间也由288 h(驯化一代)缩短到240 h(驯化二代)和192 h(驯化三代)。从pH值的变化情况来看,随着驯化代数的增加,越来越接近无Cd2+对照样品(图7),说明菌株对硫的氧化能力在逐步恢复。YN12的最适生长pH值为2.5,在Ac base-S0培养基中生长时,随着S0的氧化,SO42+不断累积,pH值快速下降,过低的pH值会抑制细胞的正常增殖和生长,并导致细胞自溶。结合图6和图7,可以清楚地看到,所有菌液的最大菌浓度均出现在pH值为1.0附近,随着pH值的逐步下降,菌浓度不断降低。在实验期内,因为对照菌液的pH值下降幅度最大,下降速度最快,所以菌浓度下降也最迅速;相反,驯化一代菌液的pH值下降最为缓和,因而,至实验结束时菌浓度仍未出现明显的降低。

图6 最终Cd2+浓度下连续传代的YN12菌株生长曲线
Fig.6 Growth curves of strain YN12 continuously grown at final Cd2+ concentration
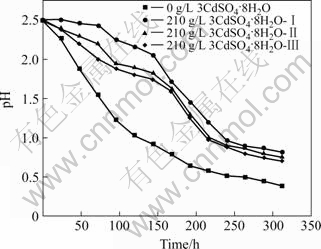
图7 最终Cd2+浓度下连续传代的YN12菌液中pH值的演化
Fig.7 pH evolution in cultures of strain YN12 continuously grown at final Cd2+ concentration
YN12菌株对Cd2+的抗性十分突出,未经驯化的菌株对Cd2+的最高初始耐受浓度达到4.8 g/L(32.0 g/L 3CdSO4?8H2O),不断提升Cd2+浓度的驯化实验进一步表明,YN12菌株的最终Cd2+耐受浓度可以高达罕见的31.5 g/L(相当于210 g/L 3CdSO4?8H2O),其抗Cd2+能力远远强于其它浸矿或非浸矿微生物[16-18],YN12是目前所报道的抗Cd2+能力最强的菌株。
在最终Cd2+耐受浓度(31.5 g/L)下,对驯化后的YN12菌株进行连续转代培养,结果显示该菌在该Cd2+浓度下,经过连续三代的适应性生长,其生长速度和硫氧化活性均得到了较好的恢复,说明该菌还有进一步提高Cd2+抗性的潜力。
有趣的是,YN12来源于并不含镉的酸性热泉(表1),但对Cd2+却具有如此高的抗性,其对Cd2+的抗性机理值得深入研究。此外,该菌在富镉硫化矿加工方面的应用前景也值得深入探讨。本文作者将在此基础上,就YN12菌株抗Cd2+的生理生化和分子生物学机制,以及该菌在富镉硫化矿加工方面开展进一步的工作,以初步阐明其抗Cd2+机理和应用潜力。
4 结论
1) 对采自云南的酸性热泉水样进行3次定向富集,然后对第3次富集物进行琼脂平板分离,得到适度嗜热硫氧化菌单菌落,该单菌落再经两次平板分离,最后得到纯培养的YN12菌株,该菌株经形态学观察、生理生化研究和16S rRNA基因序列分析,证明为喜温嗜酸硫杆菌。
2) 使用分析纯3CdSO4?8H2O对未经Cd2+驯化的YN12菌株进行的初始Cd2+耐受浓度实验表明,其Cd2+最高初始耐受浓度达4.8 g Cd2+/L(相当于32 g/L 3CdSO4?8H2O)。不断提升Cd2+浓度的驯化实验进一步表明,YN12菌株对Cd2+的抗性可以通过驯化不断增强,其对Cd2+的最终耐受浓度达到罕见的31.5 g/L(相当于210 g/L 3CdSO4?8H2O)。
3) 在31.5 g/L的最终Cd2+耐受浓度下,对YN12菌株进行连续传代,发现该菌在该Cd2+浓度下,经过连续三代的适应性生长,其生长速度和硫氧化活性均能得到较好的恢复,说明该菌还有进一步提高Cd2+抗性的潜力。
4) YN12菌株来源于并不含镉的酸性热泉,但对Cd2+却具有如此高的抗性,其Cd2+抗性机理值得深入研究。同时,该菌在富镉硫化矿加工方面也具有较好的应用前景,值得深入探讨。
REFERENCES
[1] HALLBERG K B, LINDSTROM E B. Characterization of Thiobacillus-Caldus sp-nov, amoderately thermophilic acidophile[J]. Microbiology, 1994, 140: 3451-3456.
[2] DOPSON M, LINDSTORM E B. Potential role of Thiobacillus caldus in arsenopyrite bioleaching[J]. Appl Environ Microbiology, 1999, 65(1): 36-401.
[3] SEMENZA M, VIERA M, CURUTCHET G, DONATI E. The role of Acidithiobacillus caldus in the bioleaching of metal sulfides[J]. Latin American Applied Research, 2002, 32: 303-306.
[4] OKIBE N, JOHNSON D B. Biooxidation of pyrite by defined mixed cultures of moderately thermophilic acidophiles in pH-controlled bioreactors: Significance of microbial interactions[J]. Biotechnology and Bioengineering, 2004, 87(5): 574-583.
[5] 赵 清, 刘相梅, 詹 杨, 林建群, 颜望明. 一株高效抗砷喜温硫杆菌工程菌的构建[J]. 微生物学报, 2005, 45(5): 675-679.
ZHAO Qing, LIU Xiang-mei, ZHAN Yang, LIN Jian-qun, YAN Wang-ming. Construction of an engineered Acidithiobacillus caldus with high efficiency arsenic resistance[J]. Acta Microbiologica Sinica, 2005, 45(5): 675-679.
[6] TUFFIN I M, HECTOR S B, DEANE S M, RAWLINGS D E. Resistance determinants of a highly arsenic-resistant strain of Leptospirillum ferriphilum isolated from a commercial biooxidation tank[J]. Applied and Environmental Microbiology, 2006, 72(3): 2247-2253.
[7] KOTZE A A, TUFFIN I M, S M DEANE, RAWLINGS D E. Cloning and characterization of the chromosomal arsenic resistance genes from Acidithiobacillus caldus and enhanced arsenic resistance on conjugal transfer of ars genes located on transposon TnAtcArs[J]. Microbiology, 2006, 152(12): 3551-3560.
[8] SILVER S, SCHOTTEL J, WEISS A. Bacterial resistance to toxic metal ions—A review[J]. Gene, 1996, 179(1): 9-19.
[9] RAWLINGS D E. Heavy metal mining using microbes[J]. Annu Rev Microbiol, 2002, 56: 65-91.
[10] DOPSON M, LINDSTROM E B. Potential role of Thiobacillus caldus in arsenopyrite bioleaching[J]. Applied and Environmental Microbiology, 1999, 65(1): 36-40.
[11] XIA Jin-lan, PENG An-an, HE Huan. A new strain Acidithiobacillus albertensis BY-05 for bioleaching of metal sulfides ores[J]. Trans Nonferrous Met Soc China, 2007, 17(1): 168-175.
[12] KUMAR S, TAMURA, K, NEI M. Integrated software for molecular evolutionary genetics analysis and sequence alignment[J]. Briefings in Bioinformatics, 2004, 5(2): 150-163.
[13] OKIBE N, GERICKE M, HALLBERG K B, JOHNSON D B. Enumeration and characterization of acidophilic microorganisms isolated from a pilot plant stirred-tank bioleaching operation[J]. Applied and Environmental Microbiology, 2003, 69(4): 1936-1943.
[14] KAMIMURA K, OKAYAMA T, MURAKAMI K, SUGIO T. Isolation and characterization of a moderately thermophilic sulphur-oxidizing bacterium[J]. Microbios, 1999, 99(392): 7-18.
[15] 刘 缨, 齐放军, 林建群, 田克立, 颜望明. 一株中度嗜热嗜酸硫氧化杆菌的分离和系统发育分析[J]. 微生物学报, 2004, 44(3): 382-3851.
LIU Ying, QI Fang-jun, LIN Jian-qun, TIAN Ke-li, YAN Wang-ming. Isolation and phylogenetic analysis of a moderately thermophilic acidophilic sulfur oxidizing bacterium[J]. Acta Microbiologica Sinica, 2004, 44(3): 382-3851.
[16] 潘园园, 陈雯莉, 黄巧云. 一株抗重金属铜镉细菌的分离、鉴定及其16SrDNA的序列分析[J]. 微生物学通报, 2005, 32(3): 68-72.
PAN Yuan-yuan, CHEN Wen-li, HUANG Qiao-yun. Isolation, identification and16SrDNA sequences analysis of a bacterial resistant to copper and cadmium[J]. Microbiology Aviso, 2005, 32(3): 68-72.
[17] ABOU-SHANAB R A I, VAN BERKUM P, ANGLE J S. Heavy metal resistance and genotypic analysis of metal resistance genes in gram-positive and gram-negative bacteria present in Ni-rich serpentine soil and in the rhizosphere of Alyssum murale[J]. Chemosphere, 2007, 68: 360-367.
[18] SHENG Xia-fang, XIA Juan-juan. Improvement of rape (Brassica napus) plant growth and cadmium uptake by cadmium-resistant bacteria[J]. Chemosphere, 2006, 64: 1036-1042.
基金项目:国家重点基础研究发展计划资助项目(2004CB619201); 国家自然科学基金创新研究群体科学基金资助项目(50621063)
收稿日期:2007-05-08;修订日期:2007-11-04
通讯作者:邱冠周, 教授, 博士; 电话: 0731-8879212; E-mail: guanzhouqiu@yahoo.com.cn


