NO在多壁碳纳米管修饰电极的电氧化行为
李丽1, 2,史克英1, 2
(1. 黑龙江大学 功能材料无机化学教育部重点实验室,黑龙江 哈尔滨,150080;
2. 黑龙江大学 化学化工与材料学院物理化学重点实验室,黑龙江 哈尔滨,150080)
摘 要:
摘 要:为研制生物医学和环境检测的NO电化学传感器,用碱和硝酸对多壁碳纳米管(MWCNTs)进行功能化。采用循环伏安法(CV)和电化学阻抗法(EIS)研究NO在多壁碳纳米管修饰电极上的电氧化行为,并探讨相应的反应机理。研究结果表明:当氧化电位较低(0.50~0.65 V)时,NO的电氧化受电极电位驱动,氧化速度随着电极电位的升高而加快;当电极电位达到一定值(0.70~0.80 V)时,其电极反应受电荷转移和扩散混合控制;当电极电位较高(0.85 V)时,NO的电极反应受扩散控制;与MWCNTs修饰电极相比,MWCNT-COOH修饰电极上反应的活化能(氧化峰电位)明显降低,其峰电流密度(反应速度)是MWCNTs修饰电极的1.4倍,说明MWCNT-COOH修饰电极能够有效地提高NO氧化的电催化活性和检测灵敏度。
关键词:
多壁碳纳米管;修饰电极;NO电氧化;电化学阻抗谱;扩散传质;
中图分类号:O643.3 文献标志码:A 文章编号:1672-7207(2010)06-2143-06
NO electrooxidation at multi-walled carbon
nanotubes modified electrodes
LI Li1, 2, SHI Ke-ying1, 2
(1. Key Laboratory of Functional Inorganic Material Chemistry, Ministry of Education, Heilongjiang University,
Harbin 150080, China;
2. Key Laboratory of Physical and Chemistry, School of Chemistry and Materials Science, Heilongjiang University,
Harbin 150080, China)
Abstract: To provide theoretical basis for the fabrication of electrochemical sensors for NO detection in biomedicine and ecological environment, multi-walled carbon nanotubes (MWCNTs) were chemically treated by alkali and nitric acid. The cyclic voltammetry (CV) and electrochemical impedance spectroscopy (EIS) were carried out for the study of NO electrooxidation on the MWCNTs modified electrodes, and the reaction mechanism was discussed. The results show that when oxidation potential is lower (0.50-0.65 V), the NO electrooxidation is driven by the electrode potential, the rate of NO electrooxidation increases with the increase of electrode potential; when the electrode potential is in the middle (0.70-0.80 V), the electrode reaction of NO is controlled by charge transfer and diffusion; and when electrode potential is higher (0.85 V), the electrode reaction is controlled by diffusion of NO. The activation energy of NO electrooxidation reaction (anode peak potential) at modified electrode of MWCNT-COOH decreases obviously, and current density (reaction rate) is almost 1.4 times of that of the MWCNT modified electrode. MWCNT-COOH modification for the electrodes is an effective method to improve the sensitivity of electrodes for NO detection.
Key words: multi-walled carbon nanotubes; modified electrode; NO electrocatalytic oxidation; electrochemical impedance spectroscopy; mass transfer of diffusion
近年来,碳纳米管(Carbon nanotubes,CNTs)因其具有独特的结构和物理化学性质(如可显著改变传感器材料的选择性和灵敏度等)成为各种气体传感器的首选材料[1-3]。但由于CNTs难溶于水及有机溶剂,且具有因静电吸引而易聚集成束等不足,极大地限制了它在传感器领域尤其是生物医学领域的应用。众多研究表明[4-6]:通过化学反应对CNTs表面进行修饰可以很好地解决这一问题。表面修饰不仅可以改善其分散效果,而且修饰后引入新的官能团能使其功能化,能够增加材料的生物相容性等,因而受到广泛关注。NO作为大气中的主要污染物,很容易被空气中的氧气氧化,因此,很难对其进行检测。现报道的检测手段有热导法、半导体电传导法[7]等等。Lucci等[8-10]将碳纳米管作为气体传感传感器;Jani等[11]制备了以表面羧基化的单壁和多壁碳纳米管为材料的NO传感器。也有基于卟啉[12]、酞菁[13]和纳米材料[14]作为电极修饰材料对NO电氧化的研究。但上述研究都存在着所制材料灵敏度低、选择性差等缺点,因此,需要寻找一种新的电极材料以提高对NO的选择性和灵敏度。目前,Yuan等[15-16]利用电氧化的方法探测到CO和CH4。Fu等[17]使用碳纳米管做成的网格材料对NO电氧化反应进行的研究中,电流密度较低,而且对于NO和碳纳米管电极材料的作用机制未进行研究。Li等[18]采用单壁碳纳米管和离子液体组成的微电极研究了NO的电氧化,指出单壁碳纳米管电极在NO传感器领域有一定的应用前景。在此,本文作者针对未改性碳纳米管修饰电极材料灵敏度低、选择性差的问题,将多壁碳纳米管功能化,用其修饰玻碳电极,通过循环伏安法、电化学交流阻抗法研究NO在碳纳米管修饰电极上的电催化行为,并探讨NO的电氧化机制,以便为开发研制生物医学和环境检测的NO电化学传感器提供理论根据。
1 实验
1.1 试剂与仪器
使用的多壁碳纳米管(MWCNTs)购自深圳纳米港有限公司,纯度大于90%,长度为1~20 mm,直径小于20 nm。所用化学试剂均为分析纯,水均为二次蒸馏去离子水。
在CV和EIS测试实验中,均采用传统的三电极电解池研究NO电化学氧化行为,以GC电极或MWCNTs修饰电极为工作电极,Pt片为辅助电极,Ag/AgCl为参比电极。电解液为0.1 mol/L KH2PO4和0.1 mol/L 的NaOH混合溶液(pH=6.8)。每次实验前通入N2 30 min,再通入NO 30 min使其达到饱和。循环伏安扫描速度均为50 mV/s,电位扫描范围为300~ 1 400 mV,电化学交流阻抗测试的频率范围为10-2~ 105 Hz,交流电压振幅为10 mV。采用Zview2软件进行数据拟合。实验在室温下进行。
采用美国Perkin Elmer公司的FTIR Spectrometer光谱仪进行红外光谱测定。循环伏安的测量仪器为天津市兰力科电子科技发展有限公司制造的LK9805电化学分析仪,采用德国的ZAHNER Elektrik IM6e交流阻抗测试仪测定电化学交流阻抗(EIS)。采用日本岛津公司制造的HIC-6A型离子色谱仪分析产物浓度。
1.2 实验过程
1.2.1 多壁碳纳米管的处理
(1) MWCNTs的碱活化。将质量比为3?1的KOH和MWCNTs放入一定量的二次蒸馏水中混合、超声并搅拌均匀,于110 ℃烘干。在N2下(流速约400 mL/min)于800 ℃恒温活化2 h后降温。将样品研磨、洗涤至滤液pH=7,烘干,得到的黑色粉末为碱活化的MWCNTs,命名为MWCNT-OH。
(2) MWCNTs的羧基化。将MWCNT-OH放入一定量、浓度为4 mol/L的硝酸溶液,于110 ℃回流24 h。洗涤、干燥,即得羧基化的MWCNTs样品,命名为MWCNT-COOH。
1.2.2 碳纳米管修饰电极的制备
将玻碳(GC)电极(直径为4 mm)用金相砂纸和粒度为0.05 μm的Al2O3粉末打磨至光亮,并依次在NaOH溶液、乙醇、丙酮及水中超声洗涤。将2.5 mg的各种MWCNTs分别分散到10 mL丙酮中,超声制得质量浓度为0.25 g/L MWCNTs的悬浮液,取10 μL悬浮液滴加到GC电极表面,在红外灯光照下使丙酮挥发,即为碳纳米管修饰电极。
2 结果与讨论
2.1 功能化的多壁碳纳米管的红外光谱表征
图1所示为纯MWCNTs,MWCNT-OH和MWCNT-COOH的红外光谱对比图。从图1可见:2个样品的红外光谱均在3 435~3 131 cm-1处有明显的特征吸收峰,这是MWCNT-OH和MWCNT-COOH样品中表面羟基的伸缩振动峰,与之对应的表面吸附水的特征吸收峰在1 637 cm-1处;很明显,经过碱活化的MWCNT-OH(见曲线(b)),其O—H的伸缩振动峰最强;1 401 cm-1处的吸收峰是MWCNTs表面C—OH基团中O—H的变形振动振引起的特征吸收峰。图1中1 748~1 710 cm-1处的特征吸收峰是—COOH中的C=O伸缩振动峰(也可能存在类酯键),说明MWCNTs经过碱活化后能够更有效地羧基化。
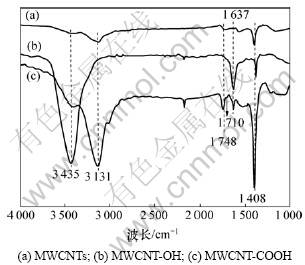
图1 多壁碳纳米管的红外光谱图
Fig.1 IR spectra of MWCNTs
2.2 NO在碳纳米管修饰电极上电氧化的循环伏安 曲线
图2所示是扫描速度为0.05 V/s时裸玻碳(GC)电极和不同MWCNTs修饰电极在NO饱和溶液中电氧化的循环伏安对比结果。从图2可见:与裸 GC电极相比(图2(a)),经MWCNTs修饰的电极其峰电流密度都显著增加,峰电位也出现了不同程度的移动。通常,电氧化反应的循环伏安曲线中峰电流密度与电极反应的速率成正比,峰电位与电极反应的活化能成正比,即峰电流密度越大,电极反应速度也越快;峰电位越大,反应所需要的活化能也越大,反之,峰电位越小,反应所需要的活化能越小。图2中MWCNTs修饰的电极NO电氧化的反应速度均有不同程度的增加(见曲线(b), (c)和(d)),其中,经过MWCNT-COOH的修饰电极(图2(d))较其他电极的NO 电氧化反应速度大,并且具有最高的峰电流密度和最小的峰电位。该电极的氧化峰电位为0.926 V,峰电流密度约为23.78 mA/cm2 (是MWCNTs修饰电极的1.4倍,是裸GC电极的7.2倍)。说明MWCNT-COOH修饰的电极其NO的电催化反应活性最强。其原因是:用KOH对MWCNTs进行碱活化时,高温下管壁中的碳(尤其是缺陷处碳)与碱反应,导致MWCNTs被截短,比表面积增大[19],使表面的羟基数量增加,并增加了开口端的面积和缺陷位的数量;进一步羧基化处理后,MWCNTs-OH表面羟基基团被羧基所取代,从而使MWCNTs-COOH表面的羧基数量增加;而羧基所含的羰基氧上的孤电子对NO有较强的吸附作用,很容易与NO形成共价吸附,因而降低了反应的活化能,使NO的电氧化反应可以在较低的电位下发生。因此,碱活化后羧基化制备的MWCNT-COOH,其修饰电极对NO的电氧化催化活性较强。
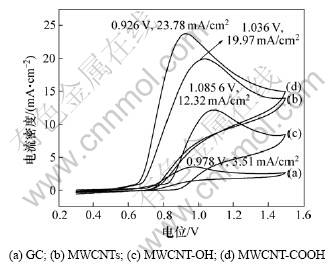
图2 NO在玻碳(GC)电极和碳纳米管修饰电极上电氧化循环伏安曲线
Fig.2 Electrooxidation cyclic voltammograms of GC(a), GC electrode modified with MWCNTs(b), MWCNT-OH (c) and MWCNT-COOH (d) in PBS saturated with NO
图2中曲线(c)为NO在MWCNT-OH修饰电极上的电氧化循环伏安图。NO在MWCNT-OH修饰电极上的氧化峰的峰电位正移;与MWCNT-COOH修饰电极(曲线(d))相比,其峰电流密度降低了一半。出现这一现象原因主要有以下2点:一方面,经过碱活化处理后,MWCNT-OH修饰电极表面被大量的羟基基团占据,羟基中的氧原子与氢原子已经形成共价键,使氧原子无法与本体溶液中的NO形成吸附;另一方面,由于被羟基基团所占据,MWCNT-OH修饰电极表面的活性位数量远远少于MWCNTs修饰电极表面的活性位数量,羟基基团的屏蔽作用阻碍了NO与修饰电极表面的接触,降低了MWCNTs对NO的吸附能力和吸附容量。因此,对于NO的电催化氧化来说,可以认为MWCNT-COOH是一种性能优异的电极材料。
2.3 NO在MWCNT-COOH修饰电极上的交流阻抗
图3~5所示是NO在MWCNT-COOH修饰电极上不同电极电位的阻抗Nyquist对比结果(其中,Z′为阻抗实部;Z″阻抗虚部)。可见:在不同电极电位下,MWCNT-COOH修饰电极表现出不同的阻抗行为,Nyquist曲线大致都可分为3个特征区。
从图3可以看出:在电位为0.50~0.65 V时,出现了不完整的容抗弧,随着电位的增大,其曲线逐渐偏离纵轴;当电极电位达到0.55 V时,容抗弧突然降低,表明NO的电氧化反应加速,此时的电极电位恰好对应于图2中循环伏安图(曲线(c))中刚刚开始起峰的位置,因此,该电位可以认为是能够使NO的氧化反应速率加快的最低电压;随着电极电位的升高,Nyquist图中阻抗弧半径迅速减小;当电极电位为0.65 V时,阻抗弧的半径已经减至很小。

图3 电极电位为0.50~0.65 V时NO在MWCNT-COOH修饰电极上的阻抗Nyquist图
Fig.3 Nyquist plots of MWCNT-COOH modified electrode in NO saturated solution when electrode’s potential is 0.50-0.65 V
从图4可以看出2个特征区:高频区出现了相对完整的容抗弧,而在低频区出现了扩散阻抗,其倾斜的角度大约为45°。说明在这个电位区间内,随着电位的升高,反应速度加快,电极反应由原来的电荷转移控制逐渐转为反应物向电极表面的扩散控制;当电位达到0.80 V时(见图5),NO的电氧化反应已经完全变为反应物向电极表面的扩散控制。因此,在这一电极电位区域内,电极反应表现为电荷转移和反应物向电极表面液相扩散的混合控制。
从图5可见:随着电极电位的升高,容抗弧越来越大,说明电荷转移电阻增加。由于电化学反应的速度加快,电极反应的中间产物可能来不及从电极表面除去,即其净结果相当于延长了占据反应活性位的时间,从而导致反应活性位数目减少,因而电荷转移的电阻增加,单位时间内反应物得到的电子数降低。结合图2中曲线(c)可以看出:在该电极电位处(小于0.92 V),随着电极电位的增加,电化学反应速度仍增加。这是因为电极表面附近反应物浓度虽然减少,但并未降低到0 mol/L,因此,扩散传质速度仍可进一步加快。由于扩散速度增加导致电极反应速度增加的量大于电荷转移时电阻增加导致的电极反应速度减小的量,因此,其净结果是电极反应速度仍然增加,但增加的趋势减缓,并在电位为0.926 V处出现峰值。

图4 电极电位为0.70~0.80 V时NO在MWCNT-COOH修饰电极上的阻抗Nyquist图
Fig.4 Nyquist plots of MWCNT-COOH modified electrode in NO saturated solution when electrode’s potential is 0.70-0.80 V
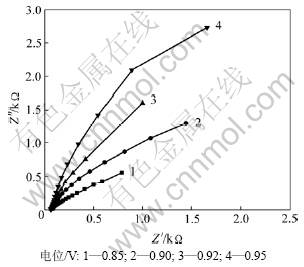
图5 电极电位为0.85~0.95 V时NO在MWCNT-COOH修饰电极上的阻抗Nyquist图
Fig.5 Nyquist plots of MWCNT-COOH modified electrode in NO saturated solution when electrode’s potential is 0.85-0.95 V
图6所示为NO在MWCNT-COOH修饰电极上不同电位下的Bode图。从图6可以看出:在不同电位时只有1个相角(峰),说明在NO电氧化过程中只有1个时间常数;电极电位在0.50~0.75 V内(见图6(a)),随着电极电位的升高,峰相角向高频方向移动,表明电氧化反应速度增加,当电极电位大于0.75 V(见图6(b)),由于活性位因产物或中间产物占据脱离速度慢的变化趋势增强,使得峰相角向低频方向移动,电氧化反应速度减小。整个电位区间没有出现负相角,即在阻抗谱图中没有出现电感现象,由此可以推断:此区域没有出现反应物和中间产物强烈吸附现象,即在NO电氧化反应过程中没有出现电极材料中毒现象。
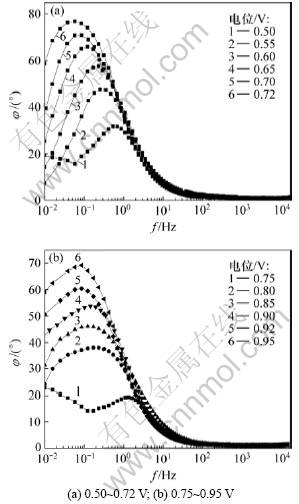
图6 NO在MWCNT-COOH修饰电极上的Bode图
Fig.6 Bode plots of MWCNT-COOH modified electrode in PBS saturated with NO at different applied potentials
NO电氧化过程机理的模型和描述如图7所示。图7中最下面的曲线是NO在MWCNT-COOH修饰电极上的电氧化循环伏安曲线,最上面的是表面修饰MWCNT-COOH的玻碳(GC)电极,中间部分是附在玻碳(GC)电极表面的MWCNT-COOH中羰基氧上的孤电子对NO的吸附作用(图)、生成产物的反应过程及不同电位下对应的电荷转移或扩散过程。
采用离子色谱对NO在MWCNT-COOH修饰电极上电氧化过程中产物进行分析,结果表明:在未进行电化学实验前,电解液中有少量的NO2-和NO3-,浓度分别为1.9×10-4和0.1×10-4 mol/L左右,这是电解池空间内残存氧发生化学反应产生的。反应进行后, NO2-和NO3-浓度明显增大,分别为2.0×10-3和9.9×10-3 mol/L,即NO电氧反应3 min后,溶液中NO2-浓度增加了10倍左右,NO3浓度增加了大约990倍,表明NO在电氧化反应过程中能够同时产生NO2-和NO3-,且生成NO3-的速度比生成NO2-的速度快得多。因此,可以说明NO2-是中间产物,NO3-是最终 产物。
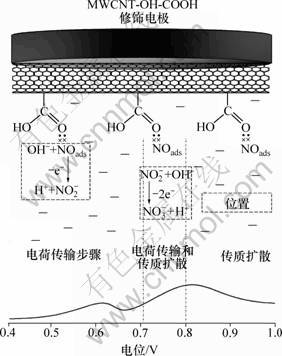
图7 MWCNT-COOH 修饰电极上NO电氧化过程机理模型
Fig.7 Model of NO electrooxidation mechanism on MWCNT-COOH modified electrode
3 结论
(1) 与玻碳(GC)电极和MWCNT修饰电极相 比,NO在MWCNT-COOH修饰电极上氧化峰的峰电流明显增大,峰电位提前,说明MWCNT-COOH修饰电极对NO电氧化有较强的电催化活性和较高的检测灵敏度。
(2) NO在MWCNT-COOH修饰电极上的电氧化反应机理为:当电极电位较低时,NO电氧化反应受电极电位的驱动;当电极电位中等时,NO电氧化反应受电荷转移和NO液相扩散(或传质)混合控制;当电极电位较高时,由于电极反应受扩散控制会导致电荷转移电阻增加,反应速度减缓,但随着电极电位的持续增大,会抑制这一现象发生,使NO液相扩散(或传质)速度仍然增大,总的电极反应速度增大。
参考文献:
[1] Li Yong-xin, Wang Po, Wang Lun, et al. Overoxidized polypyrrole film directed single-walled carbon nanotubes immobilization on glassy carbon electrode and its sensing applications[J].Biosensors and Bioelectronics, 2007, 22(12): 3120-3125.
[2] Alexeyeva N, Tammeveski K, Lopez-Cudero A, et al. Electroreduction of oxygen on Pt nanoparticle/carbon nanotube nanocomposites in acid and alkaline solutions[J]. Electrochimica Acta, 2010, 55(3): 794-803.
[3] Bhalchandra A K, Vijayamohanan K P. Tuning the wetting properties of multiwalled carbon nanotubes by surface functionalization[J]. Journal of Physics and Chemistry of Solids, 2008, 112(9): 3183-3186.
[4] Dumortier H, Lacotte S, Pastorin G, et al. Functionalized carbon nanotube are non-cytotoxic and preserve the functionality of primary immune cells[J]. Nano Letters, 2006, 6(7): 1522-1528.
[5] 汪晓, 张晨, 刘演新, 等. 聚氨酯接枝多壁碳纳米管的制备及表征[J]. 高等学校化学学报, 2007, 28(2): 366-370.
WANG Xiao, ZHANG Chen, LIU Yan-xin. Synthesis and characterization of polyurethane-grafted multi-walled carbon nanotubes[J]. Chemical Journal of Chinese Universities, 2007, 28(2): 366-370.
[6] Zhou Hong-yu, Mu Qing-xin, Gao Ning-ning, et al. A nano-combinatorial library strategy for the discovery of nanotubes with reduced protein-binding, cytotoxicity, and immune response[J]. Nano Letters, 2008, 8(3): 859-865.
[7] Mcneil C J, Manning P. Sensor-based measurements of the role and interactions of free radicals in cellular systems[J]. Reviews in Molecular Biotechnology, 2002, 82(4): 443-455.
[8] Lucci M, Reale A, Di Carlo A, et al. Optimization of a NOx gas sensor based on single walled carbon nanotubes[J]. Sensors and Actuators B: Chemical, 2006, 118(1/2): 226-231.
[9] Pumera M, Merkoci A, Alegret S. Carbon nanotube-epoxy composites for electrochemical sensing[J]. Sensors and Actuators B: Chemical, 2006, 113(2): 617-622.
[10] Tero m, krisztián K, Sami S, et al. Inkjet printing of electrically conductive patterns of carbon nanotubes[J]. Physica Status Solidi (b), 2007, 244(11): 4336-4340.
[11] Jani M, Tero M, Krisztián K, et al. Nitric oxide gas sensors with functionalized carbon nanotubes[J]. Physica Status Solidi (b): Basic Research, 2007, 244(11): 4298-4302.
[12] Lei Jian-ping, Ju Huang-xian, Ikeda O. Catalytic oxidation of nitric oxide and nitrite mediated by water-soluble high-valent iron porphyrins at an ITO electrode[J]. Journal of Electroanalytical Chemistry, 2004, 567(2): 331-338.
[13] Chang S C, Pereira-Rodrigues N, Henderson J R, et al. An electrochemical sensor array system for the direct, simultaneous in vitro monitoring of nitric oxide and superoxide production by cultured cells[J]. Biosensors and Bioelectronics, 2005, 21(6): 917-922.
[14] WANG Shu-qing, LIN Xiang-qin. Electrodeposition of Pt-Fe(III) nanoparticle on glassy carbon electrode for electrochemical nitric oxide sensor[J]. Electrochimica Acta, 2005, 50(14): 2887-2891.
[15] Yuan H, Guo D, Li X, et al. The effect of CeO2 on Pt/CeO2/CNT catalyst for CO electrooxidation[J]. Fuel Cells, 2009, 9(2): 121-127.
[16] QIAO Jie, TANG Sheng-nan, TIAN Yan-ni, et al. Electro-catalytic oxidation of methane at multi-walled carbon nanotubes-Nafion/nickel hydroxide modified nickel electrode[J]. Sensors Actuators B: Chemical, 2009, 138(2): 402-407.
[17] Fu Dong-liang, Xu Yan-ping, Li Lain-jong, et al. Electrical detection of nitric oxide using single-walled carbon nanotube network devices[J]. Carbon, 2007, 45(9): 1911-1914.
[18] Li Chang-ming, Zang Jian-feng, Zhan Dong-ping, et al. Electrochemical detection of nitric oxide on a SWCNT/RTIL composite gel microelectrode[J]. Electroanalysis, 2006, 18(7): 713-718.
[19] Raymundo-Pin?ero E, Aza?¨s P, Cacciaguerra T, et al. KOH and NaOH activation mechanisms of multiwalled carbon nanotubes with different structural organizations[J]. Carbon, 2005, 43(4): 786-795.
收稿日期:2010-04-12;修回日期:2010-06-28
基金项目:国家自然科学基金资助项目(20676027);黑龙江省博士后科研启动基金资助项目(LBH-Q07111)
通信作者:史克英(1965-),女,山东莒南人,博士,教授,博士生导师,从事纳米材料与环境催化材料研究;电话:0451-86609141;E-mail: shikeying2008@yahoo.cn


