DOI: 10.11817/j.issn.1672-7207.2019.08.002
锑酸锂与六氟锑酸锂制备新技术集成
刘伟锋,唐攒浪,陈霖,张杜超,杨天足
(中南大学 冶金与环境学院,湖南 长沙,410083)
摘 要:
制备的传统工艺,提出间接锂盐法、直接锂盐法和钾盐法3种新技术制备锑酸锂,即以Sb2O3为原料在水溶液中氧化后制备得到锑酸锂晶体;以LiSb(OH)6和Sb2O3为原料,分别经过锑酸锂法和六氟锑酸法制备得到LiSbF6溶液,再经过浓缩、结晶和干燥后得到LiSbF6晶体。研究结果表明:锑酸锂产品中Sb(Ⅲ)的质量分数极低(< 0.01%),锂与锑的化学配比精准,产品纯度高(≥ 98%),微观形貌为分布均匀的六边形层状和六方柱2种结构。六氟锑酸锂产品物相组成为单一的LiSbF6相,锂、锑和氟的化学配比精准,产品纯度高(≥98%),在550~850 cm-1的波数范围内存在
关键词:锑白;锑酸锂;六氟锑酸锂
中图分类号:TF818 文献标志码:A 文章编号:1672-7207(2019)08-1768-10
An integration of new technologies for preparation of lithium antimonite and lithium hexafluoroantimonate
LIU Weifeng, TANG Zanlang, CHEN Lin, ZHANG Duchao, YANG Tianzu
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: To improve the traditional preparation process of LiSb(OH)6 crystal, three new methods including indirect lithium salt, direct lithium salt and potassium salt were proposed to synthesize LiSb(OH)6 crystal by the oxidation of Sb2O3 in solution.LiSb(OH)6 and Sb2O3 were used as the raw materials, and LiSbF6 solutions were prepared by lithium antimonate and hexafluoroantimonic acid methods. Then, the crystalline LiSbF6 was obtained from these solutions after concentration, crystallization and drying procedures. The results show that the mass fraction of Sb(Ⅲ) is fairly low (<0.01%), the molar ratio between Li and Sb is accurate, and the purity of LiSb(OH)6 also exceeds 98%. Furthermore, these LiSb(OH)6 crystals uniformly distribute in the form of hexagonal layered structure and hexagonal prism structure. Synthesized LiSbF6 crystals are in single-phase with good crystallinity. The molar ratio among Li, Sb and F is accurate, which indicates that the purity of LiSbF6 crystals is extremely high (≥98%). Moreover, there exists characteristic vibrational peaks of SbF6- in the wavenumber range of 550~850 cm-1 in these LiSbF6 crystals.
Key words: antimony white; lithium antimonate; lithium hexafluoroantimonate
锑酸锂(LiSb(OH)6)的相对分子质量为230.74,密度为3.112 g/cm3,是一种六边形层状结构的白色粉末状晶体,由[Li2Sb(OH)6]+和[Sb(OH)6]-沿c轴排列而成,其晶格常数a=5.381 2×10-10 m,c=9.819 5×10-10 m, Sb—O键长为1.978×10-10 m,Li—O键长为2.137×10-10 m。LiSb(OH)6是一种制备偏锑酸锂(LiSbO3)的前躯体,LiSb(OH)6晶体会在210 ℃左右发生热分解并失去结晶水,形成LiSbO3晶体[1]。LiSbO3晶体可以作为锂离子电池的负极材料,并且能提高电池的倍率性能、循环性能及库仑效率,具有196 mA·h/g的初始比容量[2-3]。此外,LiSbO3也用作无铅压电陶瓷材料中的添加剂,改善压电材料的电学性能[4-5]。HSbO3可用在含有6Li/7Li的溶液中选择性地吸附锂的同位素并生成6LiSbO3, 以实现6Li与7Li的分离[6-7]。 六氟锑酸锂(LiSbF6)是一种斜六面体结构的白色状晶体,该晶体中Sb—F键长为1.88×10-10 m,Li—F键长为2.03×10-10 m,Li—Sb—F间的夹角为147.5°,整个晶体结构呈扭曲的立方NaSbF6排列[8],其中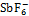
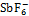
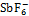
1 锑酸锂制备方法的研究进展
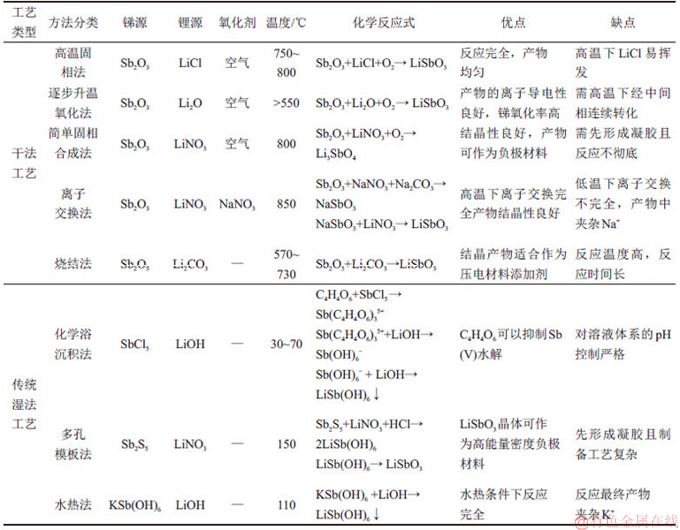
LiSbO3·3H2O的制备方法主要有干法工艺和湿法工艺。在无水高温环境下一般采用干法工艺,最终产物是偏锑酸锂(LiSbO3);在水溶液体系中一般采用湿法工艺,最终产物是含结晶水的锑酸锂(LiSb(OH)6)。干法工艺主要有高温固相法、离子交换法、逐步升温氧化法、简单固相合成法以及烧结法;湿法工艺有化学浴沉积法、多孔模板法、水热法。各种制备锑酸锂的方法比较如表1所示。
1.1 锑酸锂制备的干法工艺
高温固相法是将Sb2O3和LiCl按一定配比混合均匀后放入瓷方舟中后置于管式炉中,保持温度为750~800 ℃,并通入空气氧化反应约24 h形成熔融物后冷却,其中LiCl在高温下具有挥发性,期间需要补加LiCl,冷却后的产物用水浸洗后干燥处理得到针状LiSbO3晶体[24]。在这种晶体中,氧原子紧靠着锑原子形成扭曲的六边形结构,而锂原子位于该结构的八面体孔隙之中,在沿c轴排列的链状结构中,锑和氧排列于晶体的长轴方向,使得LiSbO3的结构与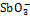
离子交换法是将分析纯的Sb2O3,NaNO3和Na2CO3按化学反应计量比混合均匀后置于550 ℃的反应炉中保温1 h,取出产物充分研磨并在850 ℃下煅烧2 h后得到NaSbO3前躯体。一次煅烧后产物为单相物质,二次煅烧主要是除去多余的杂质和提高产物结晶性[25]。将锑酸钠前躯体充分研磨成粉末,再加入物质的量为理论用量20倍的LiNO3在310 ℃下反应2 h后,产物用蒸馏水洗涤干燥后得到锑酸锂晶体。由于NaSbO3和LiSbO3之间发生的固相反应不充分,在产物中能够检测到NaSbO3的存在。在850 ℃下煅烧后,交换反应完全,形成物相组成单一的LiSbO3晶体。逐步升温氧化法是以Sb2O3和过量5%(质量分数)的Li2O为原料混合均匀后放入银质管中,然后置于石英管中并通入空气,升温到800 ℃并保温72 h进行反应。在温度低于400 ℃时生成LiSbO2稳定相,当温度为400~580 ℃时生成Sb(Ш)与Sb(V)的共存相LiSbO2.5,最后在更高温度(580~800 ℃)和O2共同作用下生成最终产物LiSbO3。当温度为300 ℃时,低温下生成的LiSbO2的Li+电导率可达10-6 S/cm [26]。
简单固相合成法是将LiNO3与Sb2O3均匀混合3 h后,在800 ℃下煅烧24 h制得正锑酸锂(Li3SbO4)。将Li3SbO4粉末,PVDF黏结剂与乙炔黑导电剂按质量比65:25:10 加入到甲基吡硌烷酮(NMP)溶剂中,搅拌均匀后形成涂层浆料,再将该浆料涂在铜箔上形成锂离子电池的负极,金属锂作为对应电极,LiPF6溶解于乙烯碳酸酯(EC)和碳酸二甲酯(DMC)体积比为1:2的混合溶剂中作为电解质组装成电池进行电化学性能检测[3]。Li3SbO4的理论容量为259.5 mA·h/g,初始充电和放电容量分别为126和53 mA·h/g,首次充电有58%的容量用于形成固体电解质界面(SEI)膜,其嵌锂和脱锂电位分别为0.72 V和1.05 V,且Li3SbO4中Sb(V)还原为Sb(Ш)涉及2个电子的转化过程。经倍率性能检测发现,在高倍率(40C)下循环至200次的过程中,Li3SbO4的放电容量先降低至65 mA·h/g,然后增加至73 mA·h/g,库仑效率接近100%,这一结果说明Li3SbO4在高能量密度的负极材料方面极具应用前景。
低温烧结法以Li2CO3和Sb2O5为原料,按物质的量比1:1配料,采用乙醇作为分散剂,氧化锆球作为球磨介质,球磨12 h后产出的混合料在80 ℃下干燥10 h,然后研磨30 min,之后用孔径为0.180 mm的网筛进行筛分,将筛下的物料置于氧化铝坩埚中,在温度为570~730 ℃的电阻炉中预焙烧2 h,然后将合成的LiSbO3冷却至室温,最后再研磨成粉末。将质量分数为0.06%的锑酸锂粉末添加到铅基五元压电陶瓷材料中,使得压电常数与烧结性能提高,介电耗损降低,有利于材料压电性能的改善[4-5]。
1.2 锑酸锂制备的传统湿法工艺
化学浴沉积法是以SbCl5和LiOH·H2O为原料,以0.5 mol/L的酒石酸作为稳定剂,调整SbCl5浓度到0.1 mol/L后,在室温下搅拌24 h。然后,将2 mol/L的LiOH溶液缓慢加入SbCl5溶液中,使溶液体系的pH为9.0~11.5,然后在30~70 ℃保温3 h,将沉淀物在60 ℃下干燥4 h后得到锑酸锂结晶粉末[27]。酒石酸的加入可以防止Sb5+水解并配位生成Sb(C4H4O6)35+。随着沉淀时溶液pH和沉淀物保存温度的升高,沉淀物颗粒会由小颗粒状向片状颗粒转化,这种小颗粒在800 ℃热处理后成为斜方晶系的LiSbO3,而片状颗粒经热处理后成为斜方晶系的LiSbO3和四方晶系的Li3SbO4的共存物,这可能是由于片状颗粒在高温下更易失去结晶水。因此,在制备LiSbO3的过程中,应适当地控制形成沉淀物时的pH和沉淀物的保存温度。
多孔模板法是将由LiNO3和丙氨酸组成的溶液与含盐酸的Sb2S5溶液充分混匀后,在150 ℃下磁力搅拌并用有孔的蜂窝状样板吸收该溶液以形成凝胶。将该凝胶在850 ℃下热处理10 h,制备出粒径为40~80 nm,分布均匀并呈立方结构的LiSbO3粉末[2]。将LiSbO3粉末、乙炔黑导电剂和PVDF黏结剂按质量比65:25:10加入到甲基吡硌烷酮(NMP)溶剂,混匀后涂在铜箔上形成电池的一极,以金属锂作为对应电极,将LiPF6溶解于EC+DMC(体积比为1:2)的混合溶剂中,制成电解质,三者一起组装成2032型纽扣电池,经检测,嵌锂电位为0.78 V(vs Li/Li+),脱锂电位为1.1和1.4 V (vs Li/Li+)。该粉末作为锂离子电池的负极材料后具有196 mA·h/g的初始比容量,在100次充放电循环后能保持48%的初始比容量,而未采用多孔模板制备LiSbO3仅能保持28%的初始比容量,这种方法有效地改善了锑酸锂的电化学性能。
水热法是以KSb(OH)6和LiOH·H2O为原料在110 ℃的四氟内衬的水热釜中保温24 h,使晶体充分发育完整,取出分离的沉淀物先后用蒸馏水和丙酮洗涤除去钾离子后,在50 ℃的空气中干燥得到六边形的层状LiSb(OH)6晶体。检测出该晶体在约210 ℃热处理后,完全脱水得到LiSbO3晶体,LiSb(OH)6晶体由[Li2Sb(OH)6]+和[Sb(OH)6]-沿c轴排布而成,在空间群上为P31m结构[1]。采用水热法还可以Sb2O3和高浓度LiOH为原料,按物质的量比为0.01~5.00,填充率为50~90%加入双氧水或者蒸馏水,调节原料比,使LiOH浓度在1~20 mol/L,然后加入到水热釜中以1~5 ℃/min速率升温并保持温度在120~240 ℃,反应4~72 h后取出产物,多次浸洗除去氢氧化锂,然后在40~100 ℃下干燥6 h得到锑酸锂产品。在水热转化过程中,使Sb2O3发生溶解并且生成纯度高且晶型发育良好的锑酸锂[28-30]。
偏锑酸锂与锑酸锂制备方法对比如表1所示。由表1可知:干法制备工艺对反应温度要求高,而且在高温下会出现成分不均匀、锂化物挥发后导致锂与锑的配比发生偏差等问题,且可能会产生团聚现象。在湿法制备工艺中,虽然加入稳定剂可以避免锑水解,但沉淀产物中包裹有杂质离子,最终影响产品纯度,且氢氧化锂利用率较低。考虑到上述制备锑酸锂方法的不足,本文作者提出湿法制备锑酸锂的新技术。
表1 偏锑酸锂与锑酸锂制备方法对比
Table 1 Comparison of preparation methods of LiSbO3 and LiSb(OH)6
2 湿法制备锑酸锂的新技术
由于湿法制备锑酸锂的新技术是在溶液体系下进行的,在一定程度上可以避免干法工艺中出现的产物成分不均及结晶水和锂化物的挥发。本文提出的新技术是以锑白为原料,在常压水溶液中以双氧水为氧化剂制备锑酸锂的工艺,反应条件容易控制,产物纯度高,杂质离子的质量分数低,可作为制备六氟锑酸锂的前驱体。LiSb(OH)6与LiSbF6制备流程如图1所示。
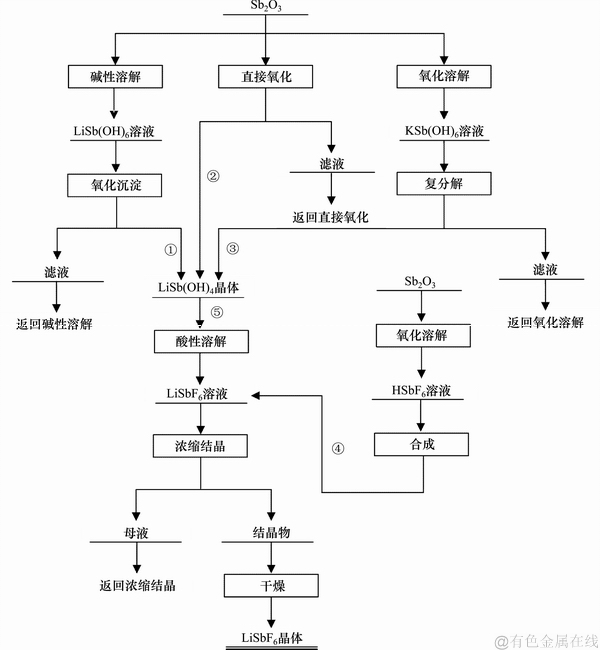
图1 LiSb(OH)6与LiSbF6制备工艺流程图
Fig. 1 Flow chart of LiSb(OH)6 and LiSbF6 preparation
2.1 间接锂盐法制备锑酸锂的新技术
间接锂盐法是基于锑白为两性氧化物,在高浓度的氢氧化锂水溶液中溶解后生成可溶性LiSb(OH)4溶液,采用清洁氧化剂双氧水将Sb(Ш)氧化生成锑酸锂的沉淀。间接锂盐法主要发生的化学反应如下。
Sb2O3+2LiOH+3H2O=2LiSb(OH)4 (1)
LiSb(OH)4+H2O2+1.28H2O=LiSb(OH)6·1.28H2O↓ (2)
该工艺中产生的锑酸锂沉淀物通过液固分离,沉淀物经干燥后即得到锑酸锂产品,而滤液中仍含有大量的氢氧化锂,可返回溶解工序继续用于溶解锑白。该工艺在氧化沉淀过程中,发生的是液-固反应,避免了产品中包裹Sb2O3现象的发生,产品质量得以保证。
间接锂盐法中锑酸锂制备过程如下:在浓度为6.40 mol/L的氢氧化锂水溶液中加入5 g锑白,在90 ℃下溶解反应2 h后趁热过滤后得到105 mL的LiSb(OH)4溶液,将该溶液升温到85 ℃后,以1 mL/min的流速加入8 mL的双氧水,氧化沉淀2 h再过滤。沉淀物在80 ℃下干燥10 h后得到锑酸锂产品(制备的工艺流程见图1中的合成路线①)。本工艺中,配合溶解后液中LiSb(OH)4的质量浓度可达16.50 g/L,氧化沉淀工序中Sb(Ⅲ)的氧化率大于98%,锑沉淀率大于97%。
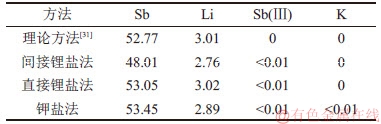
不同方法制备的锑酸锂晶体的化学成分如表2所示。由表2可以看出:间接锂盐法制备的锑酸锂晶体中Li和Sb的质量分数接近理论值,Sb(Ⅲ)质量分数小于0.01%,说明该产品中锂与锑的化学配比精准,Sb(Ⅲ)氧化完全。
不同方法制备的锑酸锂晶体的X线衍射(XRD)图谱如图2所示。由图2(a)可知:间接锂盐法制备的锑酸锂物相以LiSb(OH)6·1.28H2O的形态均匀分布,可能是因为在高浓度LiOH溶液体系下有部分水分子参与氧化沉淀而以结晶水的形态固化在产物中。
不同方法制备的锑酸锂晶体的扫描电子显微镜(SEM)图谱如图3所示。由图3(a)和(b)可知:间接锂盐法制备的沉淀产物形貌为分布均匀的六方柱结构。
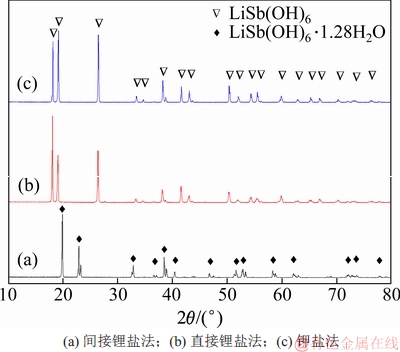
图2 不同方法制备的锑酸锂晶体的XRD图谱
Fig. 2 XRD patterns of LiSb(OH)6 crystals with different methods
表2 不同方法制备的锑酸锂晶体的化学成分(质量分数)
Table 2 Chemical composition of crystalline LiSb(OH)6 prepared by different methods %
2.2 直接锂盐法制备锑酸锂的新技术
Sb2O3在氢氧化锂溶液中,以双氧水作为氧化剂直接将Sb(Ш)氧化成Sb(V)并以难溶性的LiSb(OH)6沉淀析出,其化学反应如下:
Sb2O3+2LiOH+2H2O2+3H2O=2LiSb(OH)6↓ (3)
直接锂盐法具有工艺流程短,锑酸锂的产率及氢氧化锂利用率高的特点,但该方法是一种液相体系下的固-固转化反应,如果条件控制不当就会出现锑酸锂产品中包裹锑白的现象,因此,需要按照制备条件进行强化反应以消除这种包裹现象。
直接锂盐法制备锑酸锂的工艺如下:向300 mL浓度为0.27 mol/L的LiOH水溶液,按液固比为30:1加入锑白10 g,在85 ℃下以1 mL/min的流速加入11 mL的双氧水后反应4 h,再转移至25 ℃的冷水浴中搅拌冷却0.5 h后过滤。沉淀物在80 ℃的烘箱中干燥10 h后得到锑酸锂产品(制备工艺流程见图1中的路线②)。本工艺中,Sb(Ⅲ)的氧化率大于98.5%,锑沉淀率大于98%。由表2还可以看出:直接锂盐法制备的沉淀产物中Li和Sb的质量分数同样接近理论值,Sb(Ⅲ)质量分数小于0.01%,说明锑氧化完全,产品中LiSb(OH)6的纯度高( ≥ 98%)。从图2(b)可知:直接锂盐法制备的沉淀物物相组成为单相的LiSb(OH)6,结晶发育良好。从图3(c)和(d)可知:沉淀物微观形貌为分布均匀的六边形层状结构,晶粒完整。

图3 不同方法制备的锑酸锂晶体的SEM照片
Fig. 3 SEM images of LiSb(OH)6 crystals prepared by different methods
2.3 钾盐法制备锑酸锂的新技术
锑白在氢氧化钾双氧水体系下被氧化生成溶解度大的锑酸钾溶液,向该溶液中加入氢氧化锂后沉淀出粗锑酸锂。粗锑酸锂中一般含有4%~5%(质量分数)的钾,用低浓度的氢氧化锂水溶液充分洗涤净化后二次沉淀出的高纯锑酸锂产品,发生的化学反应如下。
Sb2O3+2H2O2+2KOH+3H2O=2KSb(OH)6 (4)
KSb(OH)6+LiOH=LiSb(OH)6↓+KOH (5)
在氧化溶解过程中锑白溶解率达99.9%,在复分解沉淀工序中,锑的沉淀率可达95%以上。钾盐法制备锑酸锂的过程为液相体系中的液-固转化反应,避免了Sb2O3夹杂于沉淀物中,且经过低浓度的氢氧化锂溶液洗涤后不仅可除去K+,而且由于Li+的同离子效应能降低锑酸锂的溶解度使其产率提高。
钾盐法制备锑酸锂的工艺过程如下:取10 g的锑白加入到100 mL浓度为1.5 mol/L的KOH水溶液中,在85 ℃下以1 mL/min的流速加入21.20 mL的双氧水进行氧化溶解,0.5 h后过滤。将滤液升温到85 ℃后,以1 mL/min的流速加入浓度为3.45 mol/L的氢氧化锂水溶液20 mL进行复分解沉淀反应,2 h后转移至室温下冷却,40 h后过滤;将粗锑酸锂转移至体积为700 mL,温度为90 ℃的热水中,搅拌溶解完全后再加入LiOH·H2O,使其在水溶液中维持0.2 mol/L的浓度,二次沉淀0.5 h后过滤,沉淀物在80 ℃下干燥10 h后得到锑酸锂产品(制备的工艺流程见图1中路线③)。从表2可知:钾盐法制备的沉淀产物中Li和Sb的化学配比精准,K+和Sb(Ⅲ)质量分数均低于0.01%,说明净化除钾彻底且产物纯度高(≥98%)。从图2(c)可知:本法制备的沉淀物的物相组成为单一的LiSb(OH)6且结晶程度良好。从图3(e)和(f)可知:本法制备的锑酸锂为分布均匀的六边形层状结构。这进一步表明钾盐法和直接锂盐法制备的锑酸锂在物相和微观形貌上基本一致。
3 六氟锑酸锂制备的新技术
3.1 六氟锑酸锂制备的研究进展
六氟锑酸锂制备的传统方法为氢氟酸溶剂法[8-9],其主要制备过程如下:在无水氢氟酸体系中加入SbF5和LiF,反应生成LiSbF6溶液,产物经过浓缩结晶析出LiSbF6晶体,其化学反应方程如下。
SbF5+LiF=LiSbF6 (6)
该方法采用腐蚀性极强的无水氢氟酸为反应介质,条件苛刻,而且SbF5的制备比较复杂,整体上这种生产工艺所需的成本较高。因此,为从工艺上解决LiSbF6的制备难题,本文提出2种在水溶液体系下制备六氟锑酸锂的方法。第1种方法为六氟锑酸法,即在水溶液体系中Sb2O3与氢氟酸和双氧水进行氧化溶解反应后制备出HSbF6溶液,然后加入锂源(Li2CO3)与HSbF6反应生成LiSbF6溶液,该溶液经过浓缩、结晶和干燥后得到LiSbF6晶体。第2种为锑酸锂法,即以锑酸锂为前驱体制备LiSbF6的方法。首先将LiSb(OH)6加入到HF水溶液反应后产生LiSbF6溶液,然后经过浓缩结晶、干燥后得到LiSbF6晶体。与传统制备方法比较,这2种方法具有反应条件温和、综合成本低和产品质量较好的优势,有望成为高效生产六氟锑酸锂晶体的新技术。
3.2 六氟锑酸法制备六氟锑酸锂的新技术
利用Sb2O3为原料直接通过六氟锑酸法制备六氟锑酸锂可以减少中间前驱体锑酸锂的制备。该法的基本原理是锑白在氢氟酸双氧水体系下氧化溶解,使Sb(Ш)被氧化为Sb(V)并与F-配位生成HSbF6的强酸溶液,加入Li2CO3作为锂源反应生成LiSbF6盐溶液,该溶液经过浓缩、结晶和干燥后得到LiSbF6晶体。
Sb2O3+12HF+2H2O2=2HSbF6+7H2O (7)
2HSbF6+Li2CO3=2LiSbF6+H2O+CO2 (8)
六氟锑酸法制备六氟锑酸锂的工艺过程如下:称取20 g锑白,蒸馏水与锑白液固比为7:1(mL/g)加入300 mL聚四氟乙烯烧杯中,在85 ℃下缓慢加入36.50 mL的氢氟酸水溶液,同时按1 mL/min的流速加入25 mL的双氧水,氧化反应2 h后生成HSbF6溶液再过滤。将氧化后液装入聚四氟乙烯烧杯中,在85 ℃下加入5.20 g碳酸锂反应1 h后生成LiSbF6盐溶液再次过滤。将反应后液装入聚四氟乙烯烧杯,在95 ℃下浓缩至料液密度为2.5 g/cm3后,在25 ℃下水浴冷却结晶4 h后过滤,将结晶物在110 ℃下干燥15 h,得到LiSbF6晶体(制备工艺流程见图1中路线④)。本工艺中,Sb(Ⅲ)的氧化率大于99%,中和转化率接近100%。
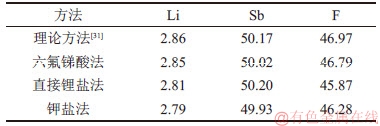
不同方法制备的六氟锑酸锂晶体的化学成分如表3所示。从表3可知:六氟锑酸法制备的六氟锑酸锂晶体中Li,Sb和F的质量分数与理论值接近,说明其纯度极高(≥98%)。不同方法制备的六氟锑酸锂晶体的XRD图谱如图4所示。由图4(b)可知:本法制备的结晶物的物相组成为单一的LiSbF6,衍射峰的位置和相对强度与粉末衍射文件(PDF卡片)中标准的LiSbF6的衍射峰位置基本一致。不同方法制备的六氟锑酸锂晶体的红外光谱图(FT-IR)如图5所示。由图5(a)可知:在波数为550~850 cm-1的范围内存在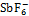
表3 不同方法制备的六氟锑酸锂晶体的化学成分(质量分数)
Table 3 Chemical composition of crystalline LiSbF6 prepared by different methods %
3.3 锑酸锂法制备六氟锑酸锂的新技术
锑酸锂的一个重要用途是作为制备六氟锑酸锂的前驱体。因此,本文进一步提出制备六氟锑酸锂的新工艺。首先,利用LiSbF6中Sb-F与LiSb(OH)6中Sb-OH在键长、结合力上存在的差异,作为制备LiSbF6晶体的出发点。在氢氟酸体系下LiSb(OH)6进行酸性溶解反应生成溶解度大的LiSbF6盐溶液。此外,锑酸锂前驱体中含有的少量的Sb2O3可以通过向溶液中加入双氧水氧化生成HSbF6后再与LiF反应生成LiSbF6溶液。制备的LiSbF6盐溶液经浓缩结晶、干燥后得到LiSbF6晶体,主要的化学反应如下:
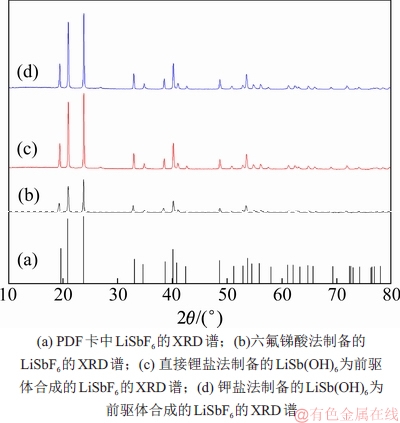
图4 不同方法制备的六氟锑酸锂晶体的XRD图谱
Fig. 4 XRD pattern of crystalline LiSbF6 prepared by different methods
LiSb(OH)6+6HF=LiSbF6+6H2O (9)
Sb2O3+12HF+2H2O2=2HSbF6+7H2O (10)
HSbF6+LiF=LiSbF6+HF (11)
锑酸锂法制备六氟锑酸锂的工艺过程如下:取15 g锑酸锂加入到装有50 mL的蒸馏水的聚四氟乙烯烧杯中,在85 ℃下缓慢加入体积为17.40 mL氢氟酸水溶液,并按双氧水与锑酸锂体积液固比1:4(mL/g)的比例加入双氧水(3.75 mL的H2O2),中和反应2 h后过滤。将中和后滤液装入聚四氟乙烯烧杯中,然后再添加0.20 g的LiF,在80 ℃下反应2 h后过滤,滤液在95 ℃下浓缩至料液密度为2.5 g/cm3,然后在25 ℃下冷却结晶4 h后过滤,将结晶物在110 ℃下干燥16 h后得到LiSbF6晶体(工艺流程见图1中路线⑤)。本工艺中,反应物中Sb(Ⅲ)氧化率大于97%,酸性溶解反应完全。
图5 不同方法制备的六氟锑酸锂晶体的红外光谱图
Fig. 5 Infrared spectrum of crystalline LiSbF6 with different methods
从表3可知:在以直接锂盐法和钾盐法制备的锑酸锂为前驱体,经过锑酸锂法合成的LiSbF6晶体中,Li,Sb和F的质量分数与理论值极为接近,说明产物纯度极高(≥98%)。从图4(c)和(d)可知:本文制备的结晶产物的物相组成均为单一的LiSbF6相,且这些衍射的峰位置和相对峰强均与PDF卡中标准LiSbF6完全一致,进一步说明制备的六氟锑酸锂纯度高、结晶程度良好。图5(b)和(c)所示的红外光谱结果与图5(a)的基本相同,说明六氟锑酸锂产品与六氟锑酸法制备的LiSbF6产品基本一样。
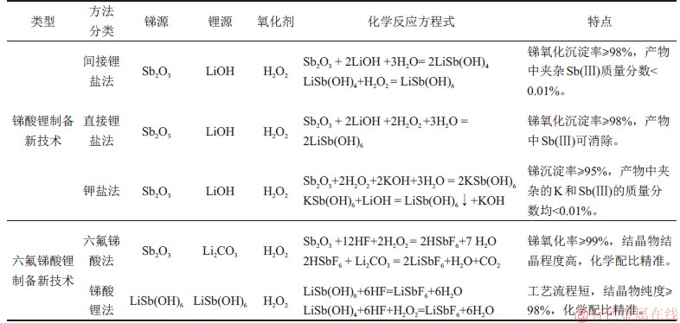
与传统的六氟锑酸锂制备方法相比,上述2种方法具有如下特点:1) 所需的氢氟酸质量分数为40%,与传统无水氢氟酸相比对设备的要求降低;2) 以Sb2O3和LiSb(OH)6作为原料,省去LiF和SbF5的复杂制备过程;3) 反应条件容易控制,氧化剂为清洁的双氧水,不会引入其他杂质。锑酸锂与六氟锑酸锂制备的新技术对比见表4。总体来看,这些关键新技术实现了对传统的制备六氟锑酸锂工艺的改进,为2种锑深加工产品的合成提供了新思路。
表4 锑酸锂与六氟锑酸锂制备新技术对比
Table 4 Comparison of novel technologies for preparation of LiSb(OH)6 and LiSbF6
4 结论
1) 以Sb2O3为主要原料,分别通过间接锂盐法、直接锂盐法和钾盐法3种新技术制备LiSb(OH)6晶体,制备出的晶体化学配比精准、物相组成单一,Sb(Ⅲ)质量分数均低于0.01%且形貌为分布均匀的六边形层状和六方柱2种结构。
2) 提出了以LiSb(OH)6和Sb2O3为原料,分别通过锑酸锂法和六氟锑酸法制备六氟锑酸锂的新技术,制备出的LiSbF6晶体的物相单一、产品纯度高(≥98%),存在SbF6-的特征振动峰。
3) 本文提出的3种制备LiSb(OH)6的新技术实现了对传统制备方法的改进,制备的LiSb(OH)6可作为合成LiSbO3和LiSbF6的前驱体;2种制备LiSbF6晶体的新技术也实现了对传统制备工艺的技术提升,制备的LiSbF6晶体可作为具有良好应用前景的锂离子电池电解质锂盐。
参考文献:
[1] MIZOGUCHI H, BHUVANESH N S P, KIM Y, et al. Hydrothermal crystal growth and structure determination of double hydroxides LiSb(OH)6, BaSn(OH)6, and SrSn(OH)6[J]. Inorganic Chemistry, 2014, 53(19): 10570-10577.
[2] KUNDU M, MAHANTY S, BASU R N. Improved electrochemical performance of natural honeycomb templated LiSbO3 as an anode in lithium-ion battery[J]. Materials Chemistry and Physics, 2011, 130(1/2): 20-23.
[3] KUNDU M, MAHANTY S, BASU R N. Li3SbO4: a new high rate anode material for lithium-ion batteries[J]. Materials Letters, 2011, 65(7): 1105-1107.
[4] KIM J, KOH J H. Improved aging behavior of lead-free (Na, K)NbO3-LiSbO3 piezoelectric actuators[J]. Ceramics International, 2017, 43: S92-S96.
[5] 杨祖培, 晁小练. 低温烧结锑酸锂掺杂的五元系压电陶瓷材料及其制备方法: CN 101337814A[P]. 2009-01-07.
YANG Zupei, CHAO Xiaolian. Method for low temperature sintered lithium antimonite doped quaternary piezoelectric ceramics and their preparation CN 101337814A[P]. 2009-01-07.
[6] KANZAKI Y, SUZUKI N. 7Li/6Li isotope separation on inorganic ion-exchangers and NMR study of the H+/Li+ ion-exchange reaction[J]. The Journal of Physical Chemistry B, 2002, 106(5): 988-995.
[7] 李建生, 王少杰, 王泽江, 等. 一种导电的锑酸锂离子吸附剂及其制备方法: CN 201810075142.2[P]. 2018-07-06.
LI Jiansheng,WANGShaojie, WANG Zejiang, et al. Method for conductive lithium antimonite adsorbent and its preparation. CN 201810075142.2[P]. 2018-07-06.
[8] BURNS J H. The crystal structure of lithium fluoroantimonate(V)[J]. Acta Crystallographica, 1962, 15(11): 1098-1101.
[9] BEGUN G M, RUTENBERG A C. Vibrational frequencies and force constants of some group IVa and group va hexafluoride ions[J]. Inorganic Chemistry, 1967, 6(12): 2212-2216.
[10] SILVA M M, BARBOSA P, EVANS A, et al. Novel solid polymer electrolytes based on poly(trimethylene carbonate) and lithium hexafluoroantimonate [J]. Solid State Sciences, 2006, 8(11): 1318-1321.
[11] NANJUNDIAH C, GOLDMAN J L, DOMINEY L A, et al. Electrochemical stability of LiMF6 (M: P, As, Sb) in tetrahydrofuran and sulfolane[J]. Journal of Cheminformatics, 1989, 20(13): 2914-2917.
[12] PONIKVAR M, LIEBMAN J F, JENKINS H D B. The redox chemistry of 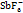
[13] FRECH R, SENEVIRATNE V, GADJOUROVA Z, et al. Vibrational study of the crystalline phases of (CH3(OCH2CH2)2OCH3)2LiSbF6 and P(EO)6LiMF6(M = P, As, Sb)[J]. The Journal of Physical Chemistry B, 2003, 107(41): 11255-11260.
[14] RODRIGUES L C, FERNANDES M, DE ZEA BERMUDEZ V , et al. Structural studies of novel di-ureasil ormolytes doped with lithium hexafluoroantimonate[J]. Solid State Ionics, 2012, 226: 7-14.
[15] BARBOSA P, RODRIGUES L, SILVA M M, et al. Characterization of lithium-based solid polymer electrolytes[J]. ECS Transactions, 2009, 19(25): 135-140.
[16] SENEVIRATNE V, FRECH R, FURNEAUX J E. Phases and phase transitions of P(EO)6LiSbF6[J]. Electrochimica Acta, 2003, 48(14): 2221-2226.
[17] LIU Jianwen, LI Xinhai, WANG Zhixing, et al. Preparation and characterization of lithium hexafluorophosphate for lithium-ion battery electrolyte[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(2): 344-348.
[18] WANG Xianming, YASUKAWA E, MORI S. Inhibition of anodic corrosion of aluminum cathode current collector on recharging in lithium imide electrolytes[J]. Electrochimica Acta, 2000, 45(17): 2677-2684.
[19] 武山, 庄全超. 锂离子电池有机电解液材料研究进展[J]. 化学研究与应用, 2005, 17(4): 433-438.
WU Shan, ZHUANG Quanchao. Progress in studies of organic electrolyte materials for Li-ion batteries[J]. Chemical Research and Application, 2005, 17(4): 433-438.
[20] 刘亚利, 吴娇杨, 李泓. 锂离子电池基础科学问题(Ⅸ): 非水液体电解质材料[J]. 储能科学与技术, 2014, 3(3): 262-282.
LIU Yali, WU Jiaoyang, LI Hong. Fundamental scientific aspects of lithium ion batteries(Ⅸ): Nonaqueous electrolyte materials[J]. Energy Storage Science and Technology, 2014, 3(3): 262-282.
[21] 杨良军. LiTFSI电解液应用于锂一次电池研究进展[J]. 船电技术, 2013, 33(12): 12-16.
YANG Liangjun. Investigation on key questions of LiTFSI based electrolytes used in lithium batteries[J]. Marine Electric & Electronic Engineering, 2013, 33(12): 12-16.
[22] SENEVIRATNE V, FRECH R, FURNEAUX J E, et al. Characterization of crystalline and solution phases of diglyme–LiSbF6[J]. The Journal of Physical Chemistry B, 2004, 108(24): 8124-8128.
[23] YORK S S, BUCKNER M, FRECH R. Ion–polymer and ion–ion interactions in linear poly(ethylenimine) complexed with LiCF3SO3and LiSbF6[J]. Macromolecules, 2004, 37(3): 994-999.
[24] EDSTRAND M, INGRI N, BONNICHSEN R, et al. The crystal structure of the double lithium Antimony(V)oxide LiSbO3[J]. Acta Chemica Scandinavica, 1954, 8: 1021-1031.
[25] NALBANDYAN V B, AVDEEV M, POSPELOV A A. Ion exchange reactions of NaSbO3 and morphotropic series MSbO3[J]. Solid State Sciences, 2006, 8(12): 1430-1437.
[26] DE LAUNE B P , BAYLISS R D, GREAVES C. LiSbO2: synthesis, structure, stability, and lithium-ion conductivity[J]. Inorganic Chemistry, 2011, 50(16): 7880-7885.
[27] YAMAMOTO O, LI Shenghua, SASAMOTO T. Preparation of crystalline LiSb(OH)6 powders prepared by chemical bath deposition and its thermal decomposition process[J]. Journal of Materials Synthesis and Processing, 1998, 6(3): 203-207.
[28] 刘伟锋, 黄克洪, 杨天足, 等. 高砷锑金矿湿法选择性浸出锑[J]. 中国有色金属学报, 2018, 28(1): 205-211.
LIU Weifeng, HUANG Kehong, YANG Tianzu, et al. Selective leaching of antimony from high-arsenic antimony-gold concentrate[J]. The Chinese Journal of Nonferrous Metals, 2018, 28(1): 205-211.
[29] 刘来君, 樊慧庆, 方亮, 等. 一种锑酸锂粉体的水热合成方法:CN 200910114200.9[P]. 2009-12-09.
LIU Laijun, FAN Huiqing, FANG Liang, et al. Method for hydrothermal synthesis of lithium antimonite powder: CN 200910114200.9[P]. 2009-12-09.
[30] 陈朴. 粗锑白湿法制取焦锑酸钠试验研究[J]. 矿冶工程, 2014, 34(5): 113-117.
CHEN Pu. Preparation of sodium pyroantimonate with crude antimony trioxide by wet process[J]. Mining and Metallurgical Engineering, 2014, 34(5): 113-117.
[31] 刘双生, 苏连舫. 谈物质中元素的质量分数[J]. 政治思想史, 2002, (12): 20-21.
LIU Suangsheng, SU Lianfang. A brief discussion the mass fraction of elements in substance [J]. Journal of the History of Political Thought, 2002, (12): 20-21.
(编辑 伍锦花)
收稿日期: 2019 -01 -04; 修回日期: 2019 -03 -04
基金项目:国家重点研发计划项目(2018YFC1901604);国家自然科学基金资助项目(51404296);国家留学基金委访问学者项目(201806375047);中南大学中央高校基本科研业务费专项资金资助项目(1053320170238)
Foundation: (Project (2018YFC1901604) supported by the National Key Research and Development Program of China; Project(51404296) supported by the National Natural Science Foundation of China; Project(201806375047) supported by the Visiting Scholar Program of China Scholarship Council); Project(1053320170238) supported by the Fundamental Research Funds for the Central Universities of Central South University)
通信作者:刘伟锋,博士,副教授,从事贵重金属提取冶金及二次资源利用研究; E-mail: liuweifeng@csu.edu.cn
摘要:为了改进锑酸锂制备的传统工艺,提出间接锂盐法、直接锂盐法和钾盐法3种新技术制备锑酸锂,即以Sb2O3为原料在水溶液中氧化后制备得到锑酸锂晶体;以LiSb(OH)6和Sb2O3为原料,分别经过锑酸锂法和六氟锑酸法制备得到LiSbF6溶液,再经过浓缩、结晶和干燥后得到LiSbF6晶体。研究结果表明:锑酸锂产品中Sb(Ⅲ)的质量分数极低(< 0.01%),锂与锑的化学配比精准,产品纯度高(≥ 98%),微观形貌为分布均匀的六边形层状和六方柱2种结构。六氟锑酸锂产品物相组成为单一的LiSbF6相,锂、锑和氟的化学配比精准,产品纯度高(≥98%),在550~850 cm-1的波数范围内存在
[5] 杨祖培, 晁小练. 低温烧结锑酸锂掺杂的五元系压电陶瓷材料及其制备方法: CN 101337814A[P]. 2009-01-07.
[7] 李建生, 王少杰, 王泽江, 等. 一种导电的锑酸锂离子吸附剂及其制备方法: CN 201810075142.2[P]. 2018-07-06.
[19] 武山, 庄全超. 锂离子电池有机电解液材料研究进展[J]. 化学研究与应用, 2005, 17(4): 433-438.
[20] 刘亚利, 吴娇杨, 李泓. 锂离子电池基础科学问题(Ⅸ): 非水液体电解质材料[J]. 储能科学与技术, 2014, 3(3): 262-282.
[21] 杨良军. LiTFSI电解液应用于锂一次电池研究进展[J]. 船电技术, 2013, 33(12): 12-16.
[28] 刘伟锋, 黄克洪, 杨天足, 等. 高砷锑金矿湿法选择性浸出锑[J]. 中国有色金属学报, 2018, 28(1): 205-211.
[29] 刘来君, 樊慧庆, 方亮, 等. 一种锑酸锂粉体的水热合成方法:CN 200910114200.9[P]. 2009-12-09.


