文章编号:1004-0609(2013)05-1356-06
催化剂对LiAlH4+MgH2体系放氢性能的影响及催化机理
丁向前,朱云峰,卫灵君,宦清清,李李泉
(南京工业大学 材料科学与工程学院,南京 210009)
摘 要:
采用机械球磨法在LiAlH4+MgH2体系中添加不同种类催化剂,以提高复合体系的放氢性能。运用XRD、SEM、EDS、XPS以及Sieverts法研究复合体系的结构以及放氢性能,并探讨TiF3 的催化机理。结果表明:TiF3催化剂的添加显著降低了复合体系的起始放氢温度,提高了放氢动力学性能,该体系在84.1 ℃开始脱氢,放氢量(质量分数)达8.0%。热脱附过程中TiF3参与了反应,并生成含Tix+的未知化合物,有效地促进了LiAlH4和MgH2之间的协同放氢。复合体系掺杂TiF3后,其热脱附反应的活化能Ea为79.1 kJ/mol,与未添加TiF3的复合体系的活化能(91.3 kJ/mol)相比,TiF3的添加极大地降低了放氢反应动力学势垒。
关键词:
中图法分类号:TG139 文献标志码:A
Effect of catalysts on dehydrogenation of LiAlH4+MgH2 composite and catalytic mechanism
DING Xiang-qian, ZHU Yun-feng, WEI Ling-jun, HUAN Qing-qing, LI Li-quan
(College of Materials Science and Engineering, Nanjing University of Technology, Nanjing 210009, China)
Abstract: The LiAlH4+MgH2 composites doped with different catalysts were prepared by mechanical milling to improve the hydrogen desorption properties. Structural and dehydrogenation properties of the composites were investigated by XRD, SEM, EDS, XPS and Sieverts method. The catalytic mechanism of TiF3 was also discussed. The results show that doping with TiF3 decreases effectively the onset hydrogen desorption temperature, and increases the dehydrogenation kinetics of the composite. The TiF3-doped system exhibits the onset hydrogen desorption temperature of 84.1 ℃ and hydrogen desorption capacity (mass fraction) of 8.0%. The unknown Tix+-containing compound forms during thermal desorption of the composite, which promotes effectively the synergetic dehydrogenation of LiAlH4 and MgH2. In addition, the dehydrogenation activation energy Ea of the composite doped with TiF3 is calculated by JMA equation to be 79.1 kJ/mol, which is much lower than that of the composite without TiF3 addition (91.3 kJ/mol), indicating that TiF3 addition decreases greatly the kinetic barrier for dehydrogenation.
Key words: LiAlH4; MgH2; TiF3; catalytic mechanism
氢能因清洁和高效被认为是未来的理想能源。开发性能优越的储氢材料在氢能研究中非常重要。众多的储氢材料中,络合氢化物[1-4]、镁基氢化物[5-6]备受关注,其中LiAlH4和MgH2 因其较高的储氢容量而成为研究热点。
LiAlH4的放氢分为以下3个阶段[7]:
3LiAlH4→Li3AlH6+2Al+3H2 (1)
Li3AlH6→3LiH+Al+3/2H2 (2)
3LiH+3Al→3LiAl+3/2H2 (3)
前2步反应在150~220 ℃之间发生,分别放出5.3%和2.6%的H2(质量分数)。第3步的脱氢温度较高,实际应用中不予考虑。过高的放氢温度及较差的吸放氢动力学是制约LiAlH4应用的重要原因。近几年来,对LiAlH4的研究主要集中在选择合适的催化剂或通过复合的手段以改善其吸放氢性能。刘淑生等[8]的研究表明,掺杂2% TiF3(摩尔分数)的LiAlH4从80 ℃开始放氢,比未作任何处理的LiAlH4的起始放氢温度低70 ℃,放氢量(质量分数)高达6.6%。VITTETOE等[9]对LiAlH4/纳米晶MgH2的失稳研究发现,该复合物的脱氢焓变较任何一个单独组分的脱氢焓变都低。LiAlH4 +7% MnFeO4(摩尔分数)样品前两步放氢总量(质量分数)为7.45%, 分别在62和119 ℃开始脱氢,比未经处理的LiAlH4对应的脱氢温度降低了88和71 ℃[10]。
对MgH2的改性研究,加入合适的添加剂是常用的手段。XIE等[11]研究了纳米MgH2颗粒添加5% TiF3(质量分数)在氢气氛下球磨后的储氢性能。研究发现,在300 ℃、100 Pa氢压下,样品6 min内放氢总量为4.5%。周惦武等[12]对Ni掺杂MgH2体系解氢性能的机理研究表明:低温下Ni替代MgH2晶格中的Mg, 使结构稳定的MgH2发生转变,生成结构不稳定的Mg2NiH4,有利于MgH2体系解氢。GASAN等[13] 发现MgH2和5%不同添加剂( V,Nb,Ti)分别进行机械球磨后的脱氢温度比未处理的MgH2降低了40~50 ℃。
上述研究表明,通过复合或者添加合适的催化剂可以有效改善LiAlH4和MgH2的放氢性能。氢化燃烧合成法(Hydriding combustion synthesis,HCS)是一种镁基储氢合金制备新方法,该法制备所得产物具有组织疏松、比表面积大和活性高等优点[14]。因此,本文作者为了进一步提高LiAlH4和MgH2的放氢性能,将本实验室自制HCS MgH2和LiAlH4复合制备新的体系,并在该体系中添加不同种类的催化剂,系统研究了复合体系的结构以及放氢性能,并探讨了TiF3催化剂的催化机理。
1 实验
LiAlH4、FeCl2、LaCl3和TiO2(纯度分别为98%、99.5%、99.9%和99.99%),ZnCl2(纯度等级:PT)购于上海阿拉丁试剂有限公司;TiF3(纯度99.5%)购于Alfa Aesar公司;Ti粉(纯度99.0%)购于上海国药试剂有限公司。MgH2为HCS法制备而得的产物[14]。LiAlH4 和MgH2 以1:1的摩尔比混合,加入3%催化剂(质量分数)及2%作为助磨剂的石墨,密封在氩气氛保护的不锈钢球磨罐中,采用机械球磨方式混料。球磨机型号为南京大学仪器厂的 QM-3SP2,球磨速度为400 r/min,球料比为40:1,所有样品的球磨时间均为2 h。
材料的相结构由XRD测定,其型号为 Thermo Electron Corporation生产的ARL X’TRA衍射仪。相关参数:Cu Kα射线, 45 kV,35 mA,步长0.02°。材料的微观形貌采用型号为JSM-6360LV的扫描电子显微镜表征,材料表面Ti元素的面分布采用EDS测定。材料表面元素化学状态采用PHI-550型X射线光电子能谱(XPS)仪测定。
样品的脱氢性能采用Sieverts法测定,仪器为美国先进材料公司的Gas Reaction Controller。测试时样品在真空条件下从室温升温至350 ℃,升温速率为20 K/min,通过记录样品室中压力和温度的变化而得到样品脱氢量和温度的关系曲线。
为了避免样品接触氧气和水分,上述实验过程中装样和取样均在充满氩气的手套箱中进行(MIKROUNA,Super (1220/750/900),水和氧的含量小于1×10-6)。
2 结果与讨论
2.1 催化剂添加对复合体系热脱附性能影响
图1所示为催化剂添加前后LiAlH4+MgH2体系的热脱附放氢曲线。表1列出了不同样品的起始放氢温度和总放氢量。分析可知,金属氯化物的添加,改善了体系第一、三阶段的脱氢动力学性能,脱氢总量均在6.7%左右。而Ti系催化剂的添加,不但大幅度降低了复合体系的起始放氢温度,同时还显著提高了放氢动力学。放氢量也得到了不同程度的提升。其中TiF3的催化效果最为显著,LiAlH4+MgH2+TiF3复合体系在84.1 ℃即开始脱氢,较未添加催化剂体系的127.9 ℃降低了43.8 ℃,且放氢总量达8.0%,与文献[9]中的LiAlH4+纳米晶MgH2体系的起始放氢温度118 ℃及脱氢量5.2%相比,具有明显优势。
2.2 TiF3添加对复合体系微观结构影响
图2所示为LiAlH4+MgH2复合体系添加3% TiF3球磨后的XRD谱。由图2可知,体系相组成为LiAlH4和MgH2。可见,虽然样品球磨2 h,但是没有出现新相,这意味着MgH2和LiAlH4在球磨过程中没有发生化学反应。此外,样品中并未发现Li3AlH6相,说明LiAlH4在球磨过程中没有发生分解。TiF3未被检测到,这可能是由于添加量较少并且经过球磨后转变成纳米晶/非晶结构的缘故。
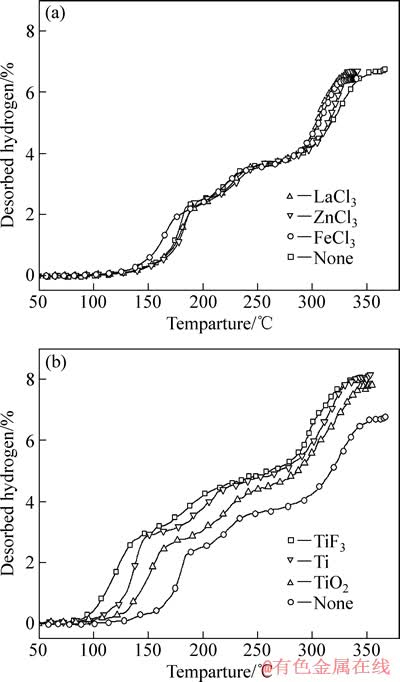
图1 添加催化剂前后LiAlH4+MgH2体系的热脱附曲线
Fig. 1 Thermal desorption profiles of LiAlH4+MgH2 composite before and after doping with different catalysts
表1 添加催化剂前后LiAlH4+MgH2体系的起始放氢温度与放氢总量
Table 1 Onset hydrogen desorption temperature and total hydrogen desorption capacity of LiAlH4+MgH2 composite before and after doping with different catalysts
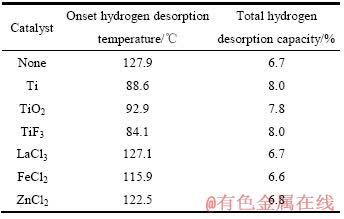
图3所示为添加TiF3后LiAlH4+MgH2体系的SEM像和Ti元素的面分布图。由图3(a)可知,大部分的颗粒尺寸约为1 μm,且分布比较均匀,表明经过2 h球磨处理后,LiAlH4和MgH2已经均匀复合。从图3(b)可以看到,Ti元素总体分布较均匀,说明TiF3在球磨的过程中已经均匀地分布在复合体系的颗粒表面上,这将有利于其催化体系的放氢反应。
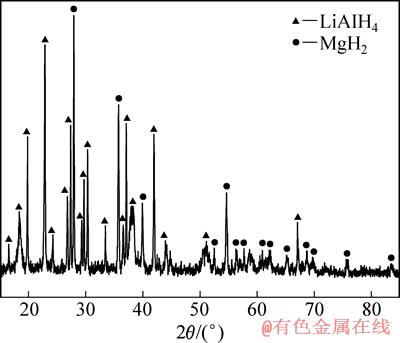
图2 LiAlH4+MgH2体系添加TiF3球磨后的XRD谱
Fig. 2 XRD pattern of LiAlH4+MgH2 composite doped with TiF3

图3 LiAlH4 +MgH2体系添加TiF3球磨后的SEM像和Ti元素的面分布图
Fig. 3 SEM image(a) of LiAlH4+MgH2 composite doped with TiF3 and EDS map(b) showing distribution of Ti on surface
图4所示为LiAlH4+MgH2+3%TiF3脱氢产物的XRD谱。样品脱氢后由Al12Mg17、LiH/Al和MgO组成。LiAlH4分解生成的Al和MgH2 反应生成了合金相Al12Mg17,该合金相的出现意味着LiAlH4和MgH2 之间存在着失稳作用,有利于提升体系的脱氢性能[15]。MgO的出现是由于样品在转移过程中表面被氧化所致。
图5所示为添加TiF3复合体系放氢后的SEM像和Ti元素的面分布图。热脱附后,Ti元素依然分布均匀,但与放氢反应前相比,颗粒出现明显团聚,尺寸变大。原因可能是热脱附过程中,由于生成Mg-Al合金,导致MgH2颗粒和LiAlH4颗粒之间相互聚集所致。
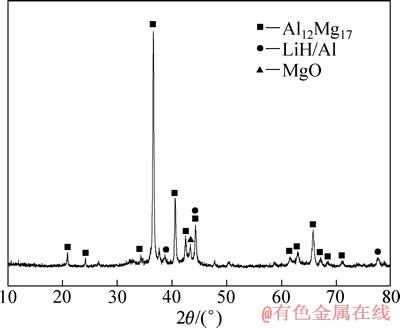
图4 LiAlH4+MgH2+3%TiF3 复合体系脱氢产物的XRD谱
Fig. 4 XRD pattern of LiAlH4+MgH2+3%TiF3 composite after dehydrogenation

图5 LiAlH4+MgH2+3%TiF3 复合体系放氢后的SEM像和Ti元素的面分布图
Fig. 5 SEM image(a) of LiAlH4+MgH2+3% TiF3 composite after dehydrogenation and Ti EDS map(b) showing distribution of Ti on surface
2.3 TiF3催化机理研究
为了研究TiF3的催化机理,对添加TiF3的样品热脱附前后进行XPS测试,明确Ti的存在形式,图6所示为测试结果。
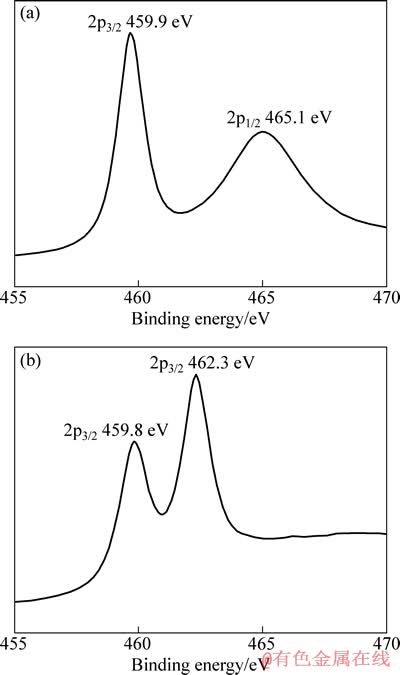
图6 LiAlH4+MgH2+3%TiF3复合体系放氢前和放氢后表面Ti 2p电子的XPS结合能谱
Fig. 6 XPS spectra of Ti 2p on surface of LiAlH4+MgH2+ 3%TiF3 composite before (a) and after (b) dehydrogenation
从图6 可以看出,样品放氢前表面Ti 2p电子的结合能为459.9和465.1 eV,对应化合物为TiF3,说明在机械球磨的过程中,TiF3并未与MgH2或LiAlH4发生反应。放氢后Ti 2p3/2电子的结合能为459.8和462.3 eV,前者对应TiF3。在XPS标准谱中,Ti 2p3/2电子结合能为462.3 eV时,对应的化合物为Na2TiF6。根据结构相似原理,推断样品中可能含有Li-Ti-F三元未知化合物。而这种类型的三元化合物据报道拥有较好的催化效果[16]。因此,可认为部分TiF3在复合体系的热脱附过程中参与了反应,生成了含Ti x+的未知化合物。
在热脱附反应的初期,这种含Ti x+的化合物依附在LiAlH4的表面,对其分解反应起到催化作用,降低了LiAlH4分解反应的能垒并增加氢的扩散通道,有利于LiAlH4分解放氢[17]。另一方面,在样品脱氢的过程中,MgH2中的Mg-H键被催化剂失稳。TSUDA等[18]认为,MgH2成键轨道上的电子将被给予催化剂中空着的电子轨道,而后催化剂电子轨道上的电子将给予MgH2的反键轨道。含Tix+的化合物可能拥有大量的空电子轨道,这将增大其与MgH2发生电子交换的几率,使Mg—H键更容易断裂,进而促进LiAlH4 和MgH2之间的协同放氢效应,并生成Al12Mg17合金。
本研究在423、443和473 K条件下对复合体系进行了等温脱氢测试。根据Johnson-Mehl-Avrami (JMA)方程[19]:
ln{-ln[1-a(t)]}=nln(t)+nln(k) (4)
式中:a(t)为反应时间为t时的反应率,n 为Avrami指数,k为反应速率常数。将ln{-ln[1-a(t)]}对ln(t)作图,并拟合得反应速率常数k。然后,根据Arrhenius方程[20]:
ln k=-Ea/(RT)+lnA (5)
式中:A为指前因子,Ea为活化能,R为摩尔气体常数,T为热力学温度。将ln(k)对1/T作图,拟合可得到活化能Ea。结果表明:LiAlH4+MgH2+3%TiF3复合体系热脱附反应的表观活化能为79.1 kJ/mol,而未添加TiF3的LiAlH4+MgH2复合体系的放氢反应表观活化能为91.3 kJ/mol,说明TiF3的添加能有效地降低LiAlH4+MgH2复合体系放氢反应的动力学势垒,改善复合体系的放氢性能。
3 结论
1) 添加Ti系催化剂后,大幅度地降低了LiAlH4+ MgH2复合体系的起始放氢温度,提高了放氢动力学,并且放氢总量也得到了不同程度的提升。其中TiF3的催化效果最为显著:复合体系在84.1 ℃开始脱氢,放氢总量达8.0%。
2) TiF3在复合体系热脱附过程中发生反应生成了含Tix+的未知化合物。这种含Tix+的化合物均匀分布在LiAlH4+MgH2复合物的表面,不仅催化LiAlH4和MgH2放氢,而且有利于促进LiAlH4和MgH2之间的协同放氢反应。
3) TiF3的添加有效降低了LiAlH4+MgH2复合体系放氢反应的动力学势垒,体系的放氢活化能由未添加TiF3时的91.3 kJ/mol下降为添加TiF3时的79.1 kJ/mol。
REFERENCES
[1] 马 俊, 李 洁, 唐仁英, 李文章, 陈启元. 孔道Al2O3/SiO2对NaAlH4-Tm2O3体系储氢性能的影响[J]. 中国有色金属学报, 2012, 22(6): 1659-1666.
MA Jun, LI Jie, TANG Ren-ying, LI Wen-zhang, CHEN Qi-yuan. Effects of porous Al2O3/SiO2 on hydrogen storage capacities of NaAlH4-Tm2O3 system[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(6): 1659-1666.
[2] KOU Hua-qin, XIAO Xue-zhang, CHEN Li-xin, LI Shou-quan, WANG Qi-dong. Formation mechanism of MgB2 in 2LiBH4+MgH2 system for reversible hydrogen storage[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(5): 1040-1046.
[3] 孙大林, 陈国荣, 江建军, 雷永泉, 王启东. 新型贮氢材料研究的最新动态[J].材料导报, 2004, 18(5): 72-75.
SUN Da-lin, CHEN Guo-rong, JIANG Jian-jun, LEI Yong-quan, WANG Qi-dong. New progress in the study of novel hydrogen storage materials[J]. Materials Review, 2004, 18(5): 72-75.
[4] 庄鹏辉, 刘晓鹏, 李志念, 王树茂, 蒋利军, 李华玲. TiZr氢化物掺杂NaAlH4的储氢性能[J]. 中国有色金属学报, 2008, 18(4): 671-675.
ZHUANG Peng-hui, LIU Xiao-peng, LI Zhi-nian, WANG Shu-mao, JIANG Li-jun, Li Hua-ling. Hydrogen storage properties of NaAlH4 doped by Ti-Zr alloy hydride[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(4): 671-675.
[5] 胡壮麒, 张海峰, 王爱民, 丁炳哲. 球磨和催化反应球磨制备的镁基复合贮氢材料及其性能[J]. 中国有色金属学报, 2004, 14(S1): 285-291.
HU Zhuang-qi, ZHANG Hai-feng, WANG Ai-min, DIN Bing-zhe. Mg base hydrogen storage material prepared by ball-milling and reactive ball-milling and its properties[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(S1): 285-291.
[6] ZHANG Yang-huan, SONG Chun-hong, REN Hui-ping, LI Zhi-gang, HU Feng, ZHAO Dong-liang. Enhanced hydrogen storage kinetics of nanocrystalline and amorphous Mg2Ni-type alloy by substituting Ni with Co[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(9): 2002-2009.
[7] GARNER W E, HAYCOCK E W. The thermal decomposition of lithium aluminium hydride[J]. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences, 1952, 211(1106): 335-351.
[8] 刘淑生, 孙立贤, 宋莉芳, 姜春红, 张 箭, 张 耀, 徐 芬, 张志恒. TiF3对LiAlH4放氢性能的影响[J]. 高等学校化学学报, 2010, 31(4): 796-799.
LIU Shu-sheng, SUN Li-xian, SONG Li-fang, JIANG Chun-hong, ZHANG Jian, ZHANG Yao, XU Fen, ZHANG Zhi-heng. Effect of TiF3 on the dehydrogenation of LiAlH4[J]. Chemical Journal of Chinese Universities, 2010, 31(4): 796-799.
[9] VITTETOE A W, NIEMANN M U, SRINIVASAN S S, MCGRATH K, KUMAR A, GOSWAMI D Y, STEFANAKOS E K, THOMAS S. Destabilization of LiAlH4 by nanocrystalline MgH2[J]. International Journal of Hydrogen Energy, 2009, 34(5): 2333-2339.
[10] ZHAI F Q, LI P, SUN A Z, WU S, WAN Q, ZHANG W N, LI Y L, CUI L Q, QU X H. Significantly improved dehydrogenation of LiAlH4 destabilized by MnFe2O4 nanoparticles[J]. The Journal of Physical Chemistry C, 2012, 116(22): 11939-11945.
[11] XIE L, LIU Y, WANG Y T, ZHENG J, LI X G. Superior hydrogen storage kinetics of MgH2 nanoparticles doped with TiF3[J]. Acta Materialia, 2007, 55(13): 4585-4591.
[12] 周惦武, 张 健, 刘金水. Ni掺杂MgH2体系解氢性能的机理[J]. 中国有色金属学报, 2009, 19(2): 315-321.
ZHOU Dian-wu, ZHANG Jian, LIU Jin-shui. Mechanism of dehydrogenating properties of Ni doped MgH2 systems[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(2): 315-321.
[13] GASAN H, CELIK O N, AYDINBEYLI N, YAMAN Y M. Effect of V, Nb, Ti and graphite additions on the hydrogen desorption temperature of magnesium hydride[J]. International Journal of Hydrogen Energy, 2012, 37(2): 1912-1918.
[14] 柳东明, 巴志新, 韦 涛, 李李泉. 镁基储氢合金制备新方 法—氢化燃烧合成法[J]. 粉末冶金技术, 2005, 23(3): 224-228.
LIU Dong-ming, BA Zhi-xin, WEI Tao, LI Li-quan. Innovative processing of magnesium based hydrogen storage alloys—Hydriding combustion synthesis[J]. Powder Metallurgy Technology, 2005, 23(3): 224-228.
[15] ZHANG Y, TIAN Q F, LIU S S, SUN L X . The destabilization mechanism and de/re-hydrogenation kinetics of MgH2-LiAlH4 hydrogen, storage system[J]. Journal of Power Sources, 2008, 185(2): 1514-1518.
[16] LI Z B, LIU S S, SI X L, ZHANG J, JIAO C L, WANG S. Significantly improved dehydrogenation of LiAlH4 destabilized by K2TiF6[J]. International Journal of Hydrogen Energy, 2012, 37(4): 3261-3267.
[17] CHEN J, KURIYAMA N, XU Q, TAKESHITA H T, SAKAI T. Reversible hydrogen storage via titanium-catalyzed LiAlH4 and Li3AlH6[J]. Journal of Physical Chemistry B, 2001, 105(45): 11214-11220.
[18] TSUDA M,  W A, KASAI H, NAKANISHI H, AIKAWA H. Mg-H dissociation of magnesium hydride MgH2 catalyzed by 3d transition metals[J]. Thin Solid Films, 2006, 509(1/2): 157-159.
W A, KASAI H, NAKANISHI H, AIKAWA H. Mg-H dissociation of magnesium hydride MgH2 catalyzed by 3d transition metals[J]. Thin Solid Films, 2006, 509(1/2): 157-159.
[19] FANFONI M, TOMELLINI M. The Johnson-Mehl- Avrami-Kolmogorov model: A brief review[J]. Il Nuovo Cimento D, 1998, 20(7/8): 1171-1182.
[20] LAIDLER K J. The development of the Arrhenius equation[J]. Journal of Chemical Education, 1984, 61(6): 494.
(编辑 何学锋)
基金项目:国家自然科学基金资助项目(51071085,51171079);江苏省“青蓝工程”资助项目;江苏高校优势学科建设工程资助项目
收稿日期:2012-07-18;修订日期:2012-12-28
通信作者:朱云峰,教授,博士;电话:025-83587242;E-mail:yfzhu@njut.edu.cn
摘 要:采用机械球磨法在LiAlH4+MgH2体系中添加不同种类催化剂,以提高复合体系的放氢性能。运用XRD、SEM、EDS、XPS以及Sieverts法研究复合体系的结构以及放氢性能,并探讨TiF3 的催化机理。结果表明:TiF3催化剂的添加显著降低了复合体系的起始放氢温度,提高了放氢动力学性能,该体系在84.1 ℃开始脱氢,放氢量(质量分数)达8.0%。热脱附过程中TiF3参与了反应,并生成含Tix+的未知化合物,有效地促进了LiAlH4和MgH2之间的协同放氢。复合体系掺杂TiF3后,其热脱附反应的活化能Ea为79.1 kJ/mol,与未添加TiF3的复合体系的活化能(91.3 kJ/mol)相比,TiF3的添加极大地降低了放氢反应动力学势垒。
[3] 孙大林, 陈国荣, 江建军, 雷永泉, 王启东. 新型贮氢材料研究的最新动态[J].材料导报, 2004, 18(5): 72-75.
[4] 庄鹏辉, 刘晓鹏, 李志念, 王树茂, 蒋利军, 李华玲. TiZr氢化物掺杂NaAlH4的储氢性能[J]. 中国有色金属学报, 2008, 18(4): 671-675.
[5] 胡壮麒, 张海峰, 王爱民, 丁炳哲. 球磨和催化反应球磨制备的镁基复合贮氢材料及其性能[J]. 中国有色金属学报, 2004, 14(S1): 285-291.
[8] 刘淑生, 孙立贤, 宋莉芳, 姜春红, 张 箭, 张 耀, 徐 芬, 张志恒. TiF3对LiAlH4放氢性能的影响[J]. 高等学校化学学报, 2010, 31(4): 796-799.
[12] 周惦武, 张 健, 刘金水. Ni掺杂MgH2体系解氢性能的机理[J]. 中国有色金属学报, 2009, 19(2): 315-321.
[14] 柳东明, 巴志新, 韦 涛, 李李泉. 镁基储氢合金制备新方 法—氢化燃烧合成法[J]. 粉末冶金技术, 2005, 23(3): 224-228.


