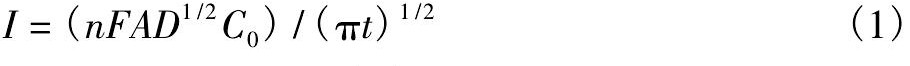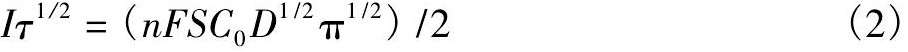网络首发时间: 2015-05-22 17:17
NaCl-KCl-Na2 WO4 共融体系的计时电流与计时电位曲线分析
廖春发 房孟钊 王旭 杨少华 罗林生
摘 要:
采用铂丝(RE)-钨丝(WE)-钨棒(AE)组成三电极系统,通过计时电流法与计时电位法相结合,系统分析在一定温度及配比条件下NaCl-KCl-Na2 WO4 共融体系的电化学特性,重点考察和分析钨(Ⅵ)离子的电子转移步骤、电化学还原过程的可逆性、活性钨(Ⅵ)离子的扩散系数、钨金属单质的成核过程,结果表明:计时电流曲线得出钨(Ⅵ)离子在阴极区的电极过程是由扩散控制,扩散系数为1.645×10-10 cm2 ·s-1 ,金属钨在阴极上析出为三维瞬时形核过程,不存在成核极化现象;由计时电位法得出钨(Ⅵ)离子的电极还原过程亦为扩散控制,扩散系数为2.349×10-11 cm2 ·s-1 ,钨(Ⅵ)离子在电子转移过程分两步,第一步为钨(Ⅵ)离子→钨(Ⅳ)离子的2电子转移,其为准可逆反应,第二步为钨(Ⅳ)离子→钨(0)的4电子转移过程,此过程为高度不可逆反应。同时,采用不同的电化学方法得到的活性钨(Ⅵ)离子的扩散系数差异表明实验过程中存在时效性和偶然性因素影响,对扩散系数等动力学参数的计算有待优化。
关键词:
共融体系 ;电化学特性 ;电极过程 ;计时电流法 ;计时电位法 ;
中图分类号: TF841.1
作者简介: 廖春发(1965-),男,江西吉安人,博士,研究方向:有色金属分离及材料制备;E-mail:liaochfa@163.com;; 王旭,副教授;电话:0797-8312222;E-mail:269338425@qq.com;
收稿日期: 2015-01-22
基金: 国家自然科学基金项目(51074081)资助;
Chronoamperometry and Chronopotentiometry Curves of NaCl-KCl-Na2 WO4 Eutectic System
Liao Chunfa Fang Mengzhao Wang Xu Yang Shaohua Luo Linsheng
School of Metallurgy and Chemical Engineering,Jiangxi University of Science & Technology
Abstract:
The three-electrode system including platinum wire( RE)-tungsten( WE)-tungsten rods( AE) was adopted and the electrochemical properties including electron transfer steps,the reversibility of electrode process,diffusion coefficient of active tungsten( Ⅵ) ion,nucleation process of tungsten in NaCl-KCl-Na2 WO4 eutectic system at given temperature and proportion were analyzed by chronoamperometry and chronopotentiometry. The results showed that the electrode process of tungsten( Ⅵ) in cathode zone was controlled by diffusion and the diffusion coefficient was 1. 645 × 10-10 cm2 ·s-1 indicated by chronoamperometry. The precipitation process of tungsten on the cathode was three-dimensional instantaneous nucleation without nuclear polarization. Similarly,the chronopotentiometry indicated that electrode process of tungsten( Ⅵ) in cathode zone was also controlled by diffusion,but the diffusion coefficient was2. 349 × 10-11 cm2 ·s-1 . The reduction of tungsten was pided into two steps,the first step was tungsten( Ⅵ) ions→tungsten( Ⅳ) ions,which was quasi-reversible reaction,the second step was tungsten( Ⅳ) ions → tungsten( 0),which was highly irreversible.Meanwhile,the difference of diffusion coefficient on active tungsten( Ⅵ) ion obtained by different electrochemical methods showed the timeliness and contingency factors existing in the process of experiment and the calculated kinetic parameters,such as diffusion coefficient,needed to be optimized.
Keyword:
eutectic system; electrochemical properties; electrode process; chronoamperometry; chronopotentiometry;
Received: 2015-01-22
钨具有良好的抗蚀性、耐热性和耐磨性,但纯钨坚硬又脆,很难加工,因而它都是与其他金属形成合金或者是以钨的化合物的形式被广泛应用。难熔金属一般都很难从水溶液中电沉积出来,所以目前国内外对难熔金属的研究很多局限在熔融盐体系中
[1 ,2 ]
。1956年Bloom等
[3 ]
,利用熔融的硼酸盐-钨酸盐电解体系,从中电解沉积出了钨粉,但至今没有用于工业化生产。1964年Senderoff等利用电解钨的氟化物熔融盐体系得到了致密的钨镀层,且在以后的生产中实现了应用
[4 ]
。但是,此方法的实现与生产应用,必须以钨离子合理的价态存在于槽液中,实际操作的控制工程中很难把握。后来,又有很多学者进一步研究在新熔盐体系下可以电沉积出钨粉。如Pavlovskii等利用钨的氧化物、钨酸盐研究其在熔融盐Na Cl-Na F电解质中的一些电化学行为,并提出了一些专利
[5 ,6 ,7 ,8 ]
。冯乃祥等
[9 ]
利用Na Cl-Na2 WO4 -WO3 体系熔盐电解法制备超细钨粉的研究。但上述体系的工作温度较高,熔盐的成分较复杂,仍有待深入研究。为此选择一条能耗低,污染环境小,钨的回收率高,实现分离和废水零排放的无酸碱钨冶炼工艺迫在眉睫,而本文用钨酸钠为活性物质,以Na Cl,KCl为混合电解质的熔盐体系,在直接电沉积出金属钨粉的基础上
[10 ,11 ,12 ,13 ,14 ,15 ]
研究Na2 WO4 在熔融温度较低的Na ClKCl组成的混合电解质体系中的电化学特性。
1 实验
1.1 原料
分析纯的Na Cl,KCl,Na2 WO4 为试剂,恒温150℃烘干24 h备用。以直径为1 mm的钨丝为工作电极,直径为9 mm的钨棒为辅助电极,直径0.5 mm的纯铂丝为参比电极,钨棒和钨丝使用前用稀Na OH溶液煮沸2 h,用蒸馏水清洗并烘干备用。
1.2 测量装置及设备
实验装置如图1所示,其中工作电极、辅助电极和参比电极用刚玉管保护。电极插入熔体的长度控制在4 cm,电极间距约为1 cm。使用Autolab电化学工作站进行测试,工作站包括两个部分,分别为PGSTAT30恒电位仪和BOOSTER 20 A电流扩展。
2 结果与讨论
2.1 共融体系的计时电流曲线分析
如图2所示是正六价钨离子在钨丝工作电极上的计时电流曲线。在极化电位-1.8 V下,钨离子在钨丝工作电极上电化学还原反应速度很快,电流(I)很快阶跃至一定值而达到平衡状态,说明了整个还原反应的发生造成了工作电极附近钨离子浓度迅速降低,熔融盐体系中的钨离子来不及扩散至工作电极表面;所以电流迅速衰减的过程,即为钨离子在熔融盐主体中发生电化学还原反应的过程;电流经过一段时间后趋于一恒定值,即为钨离子向工作电极表面的扩散和电沉积析出趋于平衡。通过计时电流曲线可以看出,钨离子在熔融盐主体中的电化学还原过程是受扩散控制的。
图1 测量装置示意图Fig.1 Schematic diagram of experiment device
1-Resistance furnace,2-Molten salt,3-Argon gas exports,4-Reference electrode(platinum wire),5-Counter electrode(tungsten rod),6-Working electrode(tungsten filament),7-Argon gas imports,8-Cooling water,9-Corundum crucible
图2 700℃时Na Cl-KCl-5%Na2WO4(质量分数)熔盐体系的计时电流曲线Fig.2Chronoamperometry curve of Na Cl-KCl-5%Na2WO4(mass fraction)molten system at 700℃
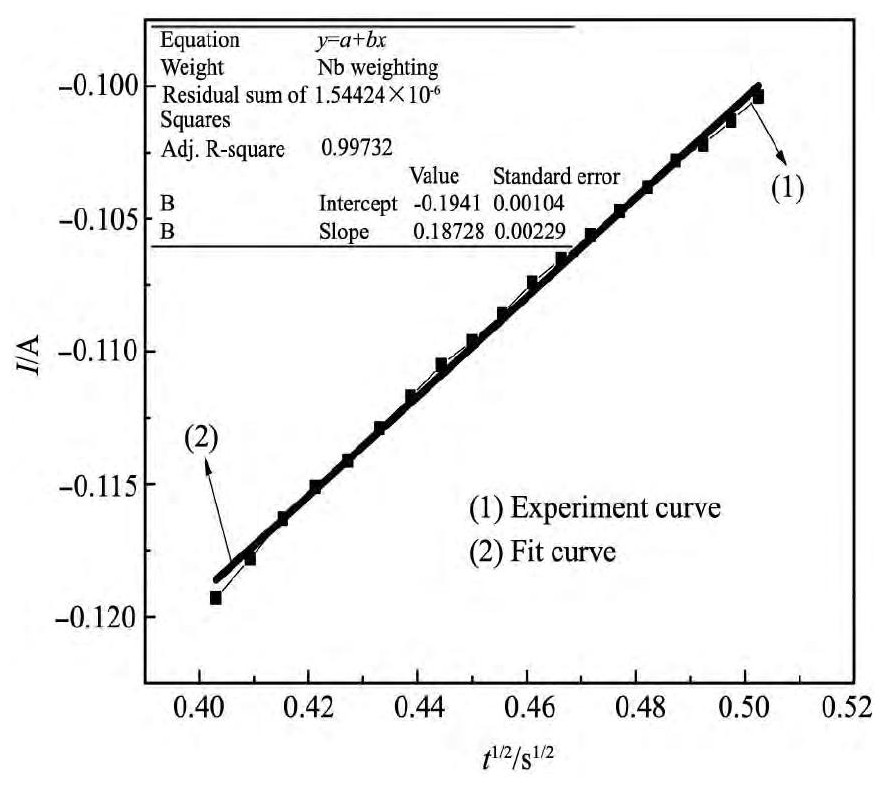
为了确定钨离子在工作电极上的电化学还原反应过程,即成核过程是瞬时成核还是逐渐成核,利用计时电流曲线图2中转折部分,作I与t1/2 (t为扫描时间,s)图,如图3所示,呈较好的线性曲线关系,说明工作电极上电沉积钨粉的成相过程为瞬时成核过程。作I与t-1/2 图
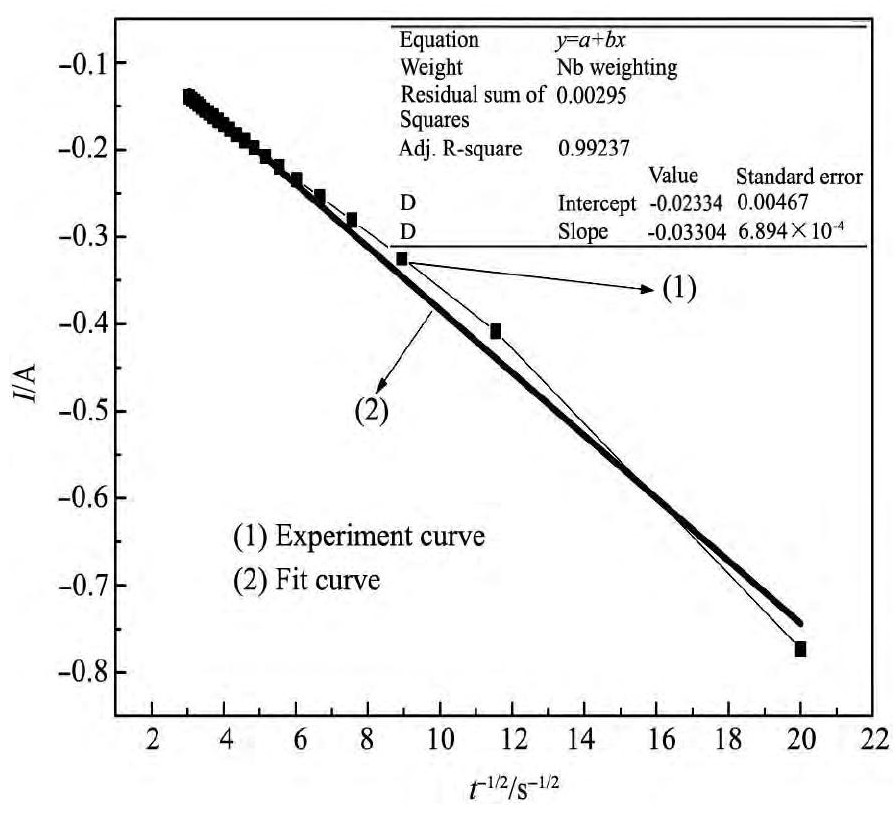
[16 ]
,如图4中的曲线(1)所示,阴极电位为-1.8 V时,I与t-1/2 呈较好的线性曲线关系,因此确定钨离子在此熔盐体系中的阴极还原过程是受扩散控制的。一般采用Cottrel公式
[17 ]
进行计时电流曲线的扩散系数的分析,在熔盐电解质的配比、电解温度和电子转移数目确定的条件下,(n FAD1/2 C0 )/π1/2 是一个常数,即I应与t-1/2 成比例关系,如图3中的曲线(2)所示,数据拟合得到的线性曲线为Y=-0.02334-0.03604x,计算方差为0.99237,考虑到误差的存在,可以认为(n FAD1/2 C0 )/π1/2 =0.03604。如康泰尔方程(1)所示:
图3 计时电流与t1/2线性曲线Fig.3 Curves of chronoamperometry and t1/2
图4 计时电流与t-1/2线性曲线Fig.4 Curves of chronoamperometry and t-1/2
式中I为电流强度(A),n为电子转移数,F为法拉第常数(96485 C·mol-1 ),A为研究电极的表面积(0.00785 cm2 ),C0 为反应物浓度(3.2878164g·mol-1 ),D为扩散系数(cm2 ·s-1 ),π是圆周率。利用Cottrel方程可以得到的扩散系数的数值为1.645×10-10 cm2 ·s-1 。
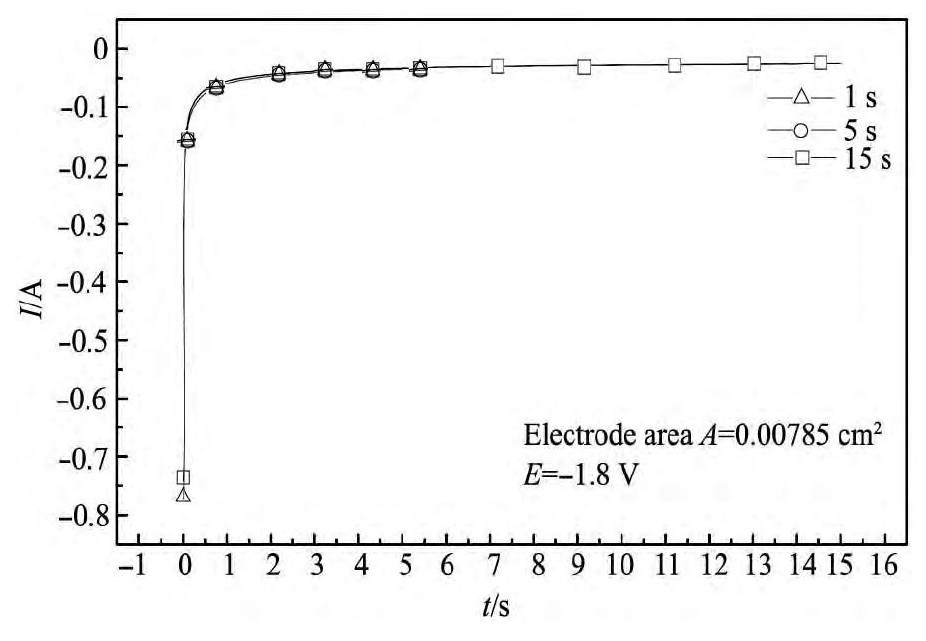
图5所示是进行计时电流曲线的测量,阶跃电势为-1.8 V,结果所示,经过扫描时间1,5,15 s的计时电流曲线几乎接近,表明体系稳定,数据是可靠的。在计时电流曲线中,电流的变化都是很快经过一段时间的衰减,迅速达到平稳,更加确定了在电极上析出钨粉的过程是成核长大过程,而图5中电流开始衰减部分也说明了钨晶核开始长大,当电极中的电流越来越小,电位发生了阶跃,电流迅速减小即金属钨晶核开始形成;电流逐渐达到一定值后即为钨的新相形成,不再继续长大,形成粉体而从电极表面脱落,导致实际阴极面积的稳定而使电流平稳。
由图3可知,从测量的W6+ 离子在电极上的计时电流曲线图2中取I与t1/2 作图
[18 ]
,成较好的线性曲线关系,符合半球形晶核瞬间成核理论
[19 ]
即晶核的整个孕育过程中电流与时间的变化关系式为:I(t)=ZFN0 π(2D0 C0 )3/2 M1/2 t1/2 /p-1/2 。其中N0 为晶核的数量,Z为离子价态数,D0 为扩散系数值(cm2 ·s-1 ),C0 是反应物浓度(mol·L-1 ),M是沉积金属的分子量,p是沉积物的密度(g·cm-3 )。所以正六价钨离子在以钨丝为工作电极上的晶核形成过程为三维瞬时形核。
图5 700℃时Na Cl-KCl-5%Na2WO4(质量分数)熔盐体系扫描不同时间的计时电流曲线Fig.5Chronoamperometry curve of Na Cl-KCl-5%Na2WO4(mass fraction)molten system(700℃,scanning time:1~15 s)
2.2 共融体系的计时电位曲线分析
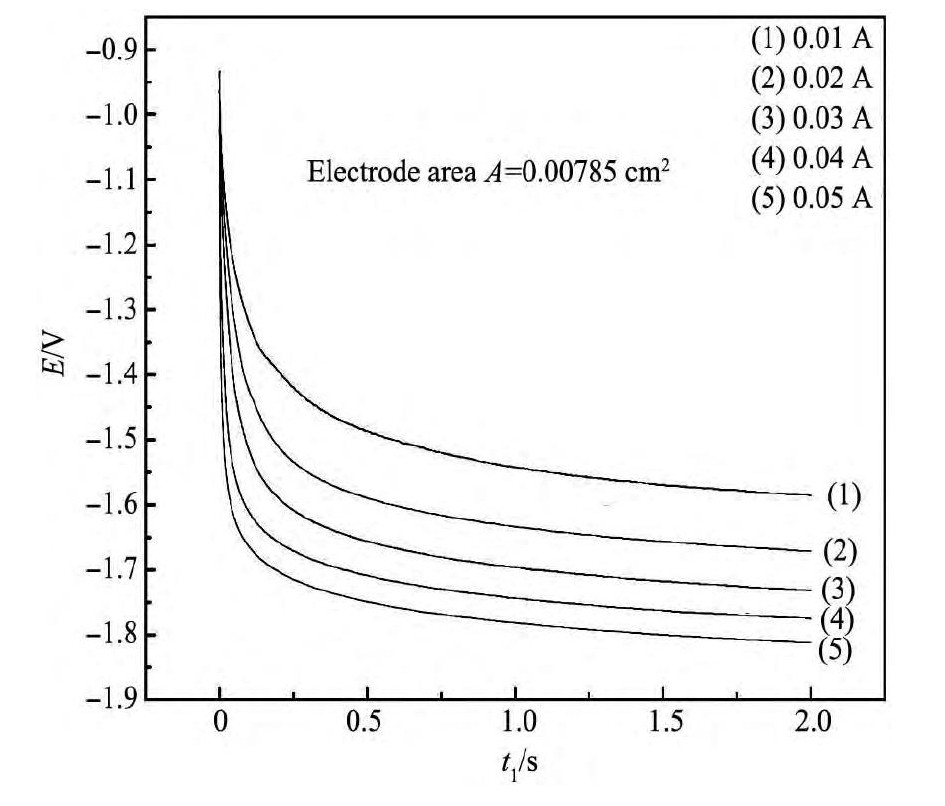
如图6所示,在700℃时对Na Cl-KCl-5%Na2 WO4 (质量分数)熔盐体系进行不同电流强度下的计时电位曲线扫描,可以看出整个钨离子电沉积还原过程时间极短,基本2 s内就达到平衡。从图7中可以看出再延时10 s的曲线电压值基本稳定,充分证明了电极反应的过渡时间短,反应迅速。在图6中可以得到当电流强度为0.01 A时,计时电位曲线中有一个电位平台,电位为-1.586V,且比较平稳;当电流强度为0.05 A时,计时电位曲线的电位平台的电位为-1.812 V,比较平稳。表明电流强度不断增加,计时电位曲线中出现的电位平台一直不断地向负方向移动即电位逐渐增大,平台电位增大了0.226 V。由此说明电流强度不断增大,钨离子的电化学还原过程可逆性不断减小,即W(Ⅵ)→W粉电解还原的过程中存在可逆过程与高度不可逆过程。
采用图6中的计时电位曲线,根据方程
[20 ]
E=C+RT/n Fln[(τ1/2 -t1 1/2 )/t1 1/2 ],其中E为即时电位,R是气体常数(8.314 J·mol-1 ·K-1 ),T是实验温度(973.15 K),n是电极反应的电子转移数,τ为过渡时间(s),t1 为即时时间(s)。如图8所示,计时电位E与ln[(τ1/2 -t1 1/2 )/t1 1/2 ]的关系图为较好的直线关系,拟合得到的关系式为Y=-1.63219+0.05056x,计算方差为0.9937,即直线斜率为RT/n F=0.05056,反应电子数n=1.7≈2,即W6+ 离子在电极上的析出过程为两步,第一步得到两个电子的反应接近可逆的准可逆反应,第二步得到4个电子,表现出不可逆性。
图6 700℃时熔盐体系在电流0.01~0.05 A下扫描的计时电位曲线Fig.6 Chronopotentiometry curves of molten system(700℃,scanning current:0.01~0.05 A)
图7 700℃时熔盐体系在电流0.05 A下扫描的计时电位曲线Fig.7Chronopotentiometry curve of molten system(700℃,scanning current:0.05 A)
图8 计时电位与ln[(τ1/2-t11/2)/t11/2]的关系图Fig.8 Relationship curve of chronopotentiometry and ln[(τ1/2-t11/2)/t11/2](Source of date:chronopotentiometry curve with scanning current of 0.01 A in Fig.6)
由图6可求得不同工作电流时的Iτ1/2 值
[21 ]
。且Iτ1/2 值与I值有很好的线性关系,即为一条直线,说明Iτ1/2 值与I值没关系,是一常数,进一步肯定了正六价钨离子在熔融盐主体中的还原过程受扩散控制。为了更加清晰地表明电流强度I与过渡时间τ之间的关系,进行了W6+ 的还原过程中I对τ-1/2 作图,如图9所示,得到的是一条斜线。此外,施加的电流不断增大,过渡时间就越短,计时电位曲线中电位平台向负方向发生明显移动逐渐增大,这种现象说明了正六价钨离子的电化学还原过程中存在不可逆的过程。根据这些结果,充分证明了正六价钨离子的电沉积过程是受扩散控制的。因此,可以由Sand方程(2)
[22 ,23 ,24 ]
计算熔融盐主体中正六价钨离子的扩散系数,
式中S为研究电极的表面积(0.00785 cm2 )。由此可以得到扩散系数的数值为2.349×10-11 cm2 ·s-1 。其计算结果与计时电流曲线分析所得扩散系数数值存在一定的差异,这种差异是因为采用不同的电化学方法对时间的响应不同,以及高温测量过程的时效性变化快,致使得到的扩散系数值不同。
图9 电流强度与τ-1/2的关系图Fig.9 Relationship curve of current strength andτ-1/2(Source of date:chronopotentiometry curve with scanning cur-rent of 0.01~0.05 A in Fig.6)
3 结论
1.通过计时电流曲线分析,得到了钨(Ⅵ)离子的电化学还原过程是由熔体中钨(Ⅵ)离子的扩散控制,扩散系数的数值为1.645×10-10 cm2 ·s-1 ,在阴极上析出的过程为三维瞬时形核过程,不存在成核极化现象。
2.通过计时电位曲线分析,得到了钨(Ⅵ)离子的电化学还原过程是受扩散控制的,扩散系数的数值为2.349×10-11 cm2 ·s-1 ,钨(Ⅵ)离子在电极还原分两步,第一步为钨(Ⅵ)离子→钨(Ⅳ)离子,其为准可逆反应,第二步为钨(Ⅳ)离子→钨(0),其为高度不可逆反应。
参考文献
[1] Wu Z D.Study on the electrodeposition of tungsten from Li Cl-Na F-Na2WO4melten salts[J].Journal of Beijing Chemical,1990,48:894.(吴仲达.Li Cl-Na F-Na2WO4熔盐体系中电沉积钨的研究[J].北京化学学报,1990,48:894.)
[2] Wang Z,Li J,Hua Y X,Zhang Z,Zhang Y,Ke P C.Research progress in production technology of titanium[J].Chinese Journal of Rare Metals,2014,38(5):915.(王震,李坚,华一新,张志,张远,柯平超.钛制取工艺研究进展[J].稀有金属,2014,38(5):915.)
[3] Bloom H,Doull N J.Transport number measurements in pure fused salts[J].J.Phys.Chem.,1956,60(5):620.
[4] Mellors G W,Senderoff S.The density and surface tension of molten fluorides[J].J.Electrochem.Soc.,1964,111(12):1355.
[5] Baraboshkin V V,Didenko A N.Effect of superconductivity on breakdown delay time in liquid helium[J].Soviet Physics-Technical Physics,1983,28(12):1489.
[6] Cohen U.Electrodeposition of niobium-germanium alloys from molten fluorides[J].J.Electrochem.Soc.,1983,130(7):1480.
[7] Pavlovskij V A,Reznichenko V A.Electrolytes for tungsten refining in melts[J].Izvestiya Akademii Nauk SSSR,Metally,1982,14(8):26.
[8] Saraboshkin A N,Plaksin S V.Electrodeposition of islet epitaxial tungsten films on monocrystalline silver substrates[J].Doklady Akademii Nauk SSSR,1983,270(2):348.
[9] Feng N X,Liu X C,Sun Y.Preparation of ultrafine tungsten powder by electrolyzine in molten salts[J].Chinese Journal of Materials Research,2001,15:459.(冯乃祥,刘希诚,孙阳.用熔盐电解法制备超细钨粉[J].材料研究学报,2001,15:459.)
[10] Wang X,Liao C F.Preparation and characterization of tungsten powder through molten salt electrolysis in a CaWO4-Ca Cl2-Na Cl system[J].International Journal of Refractory Metals and Hard Materials,2012,31(3):205.
[11] Wang X,Liao C F,Yang W Q,Xie Q W.Characterization and electrochemical analysis of tungsten powder prepared by molten salt electrolysis in Ca WO4-Ca Cl2-Na Cl system[J].Chinese Journal of Nonferrous Metals,2012,22(5):1482.(王旭,廖春发,杨文强,谢泉文.Ca WO4-Na ClCa Cl2体系熔盐电解制备钨粉的表征与电化学分析[J].中国有色金属学报,2012,22(5):1482.)
[12] Liao C F,Yang W Q,Wang X,Xie Q W,Xiao Z H.The feasibility of tungsten powder preparation by molten salt electrolysis from tungstate[J].Nonferrous Metals Science and Engineering,2011,2(4):4.(廖春发,杨文强,王旭,谢泉文,肖志华.由钨酸盐熔盐电解直接制备钨粉的可行性分析[J].有色金属科学与工程,2011,2(4):4.)
[13] Yang W Q,Liao C F.The Study of Preparation Tungsten Powder by Molten Salt Electrolysis from Tungstate[D].Ganzhou:Jiangxi University of Science and Technology,2011.27.(杨文强,廖春发.由钨酸盐熔盐电解直接制备钨粉研究[D].赣州:江西理工大学,2011.27.)
[14] Wang X,Liao C F,Wang K.Dissociation and ion movement forms of Na2WO4and Ca WO4in tungsten preparing process by molten salt electrolysis method[J].Nonferrous Metals Science and Engineering,2013,4(5):39.(王旭,廖春发,王坤.Na2WO4与Ca WO4在电解制钨过程中的解离及离子运动形式分析[J].有色金属科学与工程,2013,4(5):39.)
[15] Li Y J,Wang S L,Zhong H X,Sun H.Mechanism and electro electro-potential of Ti O2electrochemieal reduetion[J].Nonferrous Metals,2003,55:68.(李颖君,王淑兰,钟和香,孙华.电化学还原Ti O2反应机理及电极电势的研究[J].有色金属,2003,55:68.)
[16] Fan S D,Lu G M.Study on Preparation Mg-Sr Alloy by Molten Salt Electrolysis[D].Shanghai:East China University of Science and Technology,2011.27.(范书迪,路贵民.熔盐电解制备镁锶合金的研究[D].上海:华东理工大学,2011.27.)
[17] Chen Z,Zhang M L,Han W,Li S J,Wang J,Yan Y D,Hou Z Y.Electrochemical reduction of Zr(Ⅳ)in the Li Cl-KCl molten salt[J].Rare Metal Materials and Engineering,2009,38:456.(陈增,张密林,韩伟,李胜军,王君,颜永得,候智尧.在Li Cl-KCl熔盐体系中Zr(IV)的电化学还原[J].稀有金属材料与工程,2009,38:456.)
[18] Liang X F,Ma H J,Duan S Z,Shi Q R,Wang X D.Study on the cathode process of neodymium ions in fluoride molten salt[J].Journal of the Chinese Society of Rare Earths,1999,20:21.(梁行方,马宏军,段淑贞,石青荣,王新东.在氟盐体系中钕离子阴极过程的研究[J].中国稀土学报,1999,20:21.)
[19] Li B S,Su L Y.Sm Cl3reaction in the Li Cl-KCl melt salt electrochemistry[J].Journal of Gansu Lianhe University(Natural Science),2006,20(3):55.(李宝善,苏连永.Sm Cl3在Li Cl-KCl熔盐中的电化学反应[J].甘肃联合大学学报(自然科学版),2006,20(3):55.)
[20] Han L Y,Han W,Wang G J,Sun Y,Sun T T.Preparation of Al-Li-La alloys by electrochemical codeposition in Li Cl-KCl-Al Cl3-La2O3melts[J].Chinese Journal of Applied Chemistry,2013,30(6):698.(韩丽艳,韩伟,王冠娟,孙怡,孙婷婷.熔盐电解Li Cl-KCl-Al Cl3-La2O3共析出制备Al-Li-La合金[J].应用化学,2013,30(6):698.)
[21] Zhang Y J,Luo L M.Study on the mechanism of the cathode process and the morphology of liquid magnesium deposit in electrolysis of magnesium chloride[J].Journal of Central South Mining and Metallurgy College,1994,25(2):176.(张永健,罗亮明.氯化镁电解阴极过程机理及液镁析出状态的研究[J].中南矿冶学院学报,1994,25(2):176.)
[22] Liu J N,Sun Z,Jin X W,Li B,Song X F,Yu J G.The cathodic reduction of magnesium in KCl-Na Cl-Mg Cl2melts on a platinum electrode[J].Non-ferrous(Metal Smelting Part),2007,(6):35.(刘江宁,孙泽,晋心文,李冰,宋兴福,于建国.KCl-Na Cl-Mg Cl2熔盐中镁在铂电极上的阴极还原[J].有色金属(冶炼部分),2007,(6):35.)
[23] Wang Z,Ouyang Y G,Wang C S,Shi H X,Zheng HY.Research of electrochemical behavior of thorium in Li Cl-KCl melets[J].Atomic Energy Science and Technology,2012,46(S):180.(王喆,欧阳应根,王长水,石胡欣,郑海洋.Li Cl-KCl熔盐中钍的电极过程研究[J].原子能科学技术,2012,46(S):180.)
[24] Chen L J,Zhang M L,Han W,Yan Y D,Cao P.Electrochemical behavior of Mn(Ⅱ)in the melt Li CIKCl-Mg Cl2-Mn Cl2[J].Chemical Journal of Chinese Universities,2012,33(2):327.(陈丽军,张密林,韩伟,颜永得,曹鹏.Mn(Ⅱ)在Li CI-KCl-Mg Cl2-Mn Cl2熔盐体系中的电化学行为[J].高等学校化学学报,2012,33(2):327.)