DOI:10.19476/j.ysxb.1004.0609.2017.10.22
氨-硫酸铵溶液中萃取分离锌镉
唐福利,李兴彬,魏 昶,樊 刚,朱如龙,李存兄,邓志敢
(昆明理工大学 冶金与能源工程学院,昆明 650093)
摘 要:
研究Mextral54-100(HA)和Mextral54-100+TRPO(HA+TRPO)两种萃取体系从氨-硫酸铵溶液中萃取分离锌镉的性能,确定出锌镉分离的最佳工艺。结果表明:HA+TRPO萃取体系在初始pH为7.2时对锌具有较高的选择性萃取能力,而不同pH条件下两种萃取体系对镉的萃取能力均很低。因此,宜采用HA+TRPO体系在初始pH为7.2条件下萃取锌,镉不被萃取而留在溶液中,实现锌与镉的分离。对于锌的萃取,采用0.4 mol/L HA+0.05 mol/L TRPO的协同萃取体系,在温度为25 ℃,初始pH为7.2,O/A相比为1:1的条件下,经2级萃取,锌萃取率为99.2%,镉的萃取率小于5%;对负载锌有机相,在温度为25 ℃,相比为2:1,硫酸浓度为0.1 mol/L的条件下,经2级反萃,锌反萃率为99.9%。萃余液中的镉可通过化学沉淀法将其沉淀回收。通过选择合适的萃取体系和萃取条件,获得了氨-硫酸铵溶液中萃取分离锌和镉的最佳工艺流程和技术参数。
关键词:
文章编号:1004-0609(2017)-10-2136-09 中图分类号:TF813;TF819.2;TF804.2 文献标志码:A
随着锌矿资源的不断开发利用,高品质锌资源逐渐枯竭,低品位氧化矿、硫氧混合矿和含锌冶金渣尘等非传统锌资源的开发利用引起人们的广泛关注[1-2]。非传统锌资源具有锌品位较低、多金属共生、碱性脉石含量高以及复杂难选的特点,目前,非传统锌资源的冶金处理工艺有还原挥发富集法[3]、硫酸浸出法[4]和氨性浸出法[5]等。相比较而言,氨浸法具有能耗低、除杂简单、污染少、适应性强等优点,在处理高碱性脉石矿物[6]、低品位含锌物料或含锌尾矿[7-8]、镀锌废料[9-10]和炼钢粉尘[11-12]等非传统锌资源时具有显著的技术优势和经济效益。由于氨浸液中锌浓度较低且含有多种有价金属,需要对其中的有价金属进行分离和富集。锌和镉往往一同伴生在非传统含锌资源中,浸出时锌和镉会一同被浸出进入溶液中。生产中为获得单一目标金属,锌与镉的分离成为一项重要的研究内容。溶剂萃取技术具有生产能力大、过程简单、易于实现连续化生产等优点,是实现多金属溶液中有价金属分离和富集的有效方法。通过萃取可使氨浸液中锌等有价金属得到分离和富集。再通过反萃,得到高浓度的硫酸锌溶液,达到后续电积工艺的要求。
用于氨性溶液中萃取分离锌的萃取剂有β-二酮[13-18]和8-羟基喹啉类螯合萃取剂及其衍生物[19-20]。HOH等[19-20]采用LIX34(有效成分是8-烷基磺胺喹啉)从氨性溶液中萃取锌,虽然能有很高的锌萃取率,但萃取剂成本太高而应用前景受限。β-二酮萃取剂具萃取速度快、不萃氨和易反萃等优点,是适合用于氨性溶液中萃取锌的有效萃取剂。目前研究较多的有LIX54[13-17]和Hostarex DK-16[18]。但是,β-二酮易与氨反应生成酮亚胺而变质,在其结构中用其他基团将α碳原子上的氢原子取代,使其形成高位阻的β-双酮,能有效抑制其变质[21]。何静等[22-23]使用新型高位阻β-双酮(2-乙酰基-3-氧代-二硫代丁酸-十四烷基酯(YORS))从Zn-NH3配合物体系中萃取锌,萃取剂性能良好。HU等[24]等采用合成的高位阻β-二酮(1-(4′-十二烷基)苯基-3-叔丁基-1,3-丙二酮)从氨性溶液中萃取锌,在以离子液体[BMIM]PF6作稀释剂条件下取得良好的的萃锌效果,且萃取有机相再生利用及反萃的性能非常理想。朱如龙等[25]采用新型β-二酮类萃取剂Mextral54-100从Zn(Ⅱ)-NH4Cl-NH3配合物溶液中萃取锌,并对其萃取机理进行了深入探究。单独β-二酮的萃锌的能力并不理想,协同萃取是可以提高锌萃取率的有效途径。FU等[26]、CHEN等[27]和HU等[28]研究了高位阻β-二酮(1-苯基-4乙基-1,3-辛二酮)与TOPO组成的协同萃取体系从氨性体系中萃取分离锌,发现具有明显的协同效应,通过两级逆流萃取,锌萃取率为85%。HU等[29]采用高位阻的β-二酮(1- (4′-十二烷基)苯基-3-叔丁基-1,3-丙二酮)与CYANEX923或LIX84I组成的协同萃取体系从氨性溶液中萃取分离锌,发现该β-二酮与CYANEX923组合具有更明显的协同效应。
采用氨浸法处理非传统锌资源,矿物中的锌、镉、镍、铜和钴等有价金属会与氨形成金属氨配合物进入氨浸液中。为有效利用氨浸液中的有价金属,一般须在萃取段对氨浸液中的有价金属进行分离和富集。一些研究者采用溶剂萃取法对溶液中的有价金属镉进行提取[30-32],但其萃取效果并不理想,而对于从氨性溶液中萃取镉的研究目前尚未见诸报道。含镉溶液的除镉方法主要有化学沉淀法、离子交换法、吸附法、膜分离法、生物法和电凝聚法等[33-35],其中化学沉淀法因具有适用范围广、处理量大、残渣稳定和回收相对容易等优点而应用最为广泛。化学沉淀法包括提高水体pH值生成氢氧化镉沉淀和添加碱式磷酸盐生成磷酸镉沉淀等,而后者在氨性溶液中沉淀除镉更具优势。本文作者以含锌、镉的模拟氨浸液为原料,以β-二酮(Mextral54-100, HA)、TRPO作为萃取剂和协萃剂,研究HA和HA+TRPO两种萃取体系从氨-硫酸铵溶液中萃取、分离锌镉的行为及规律,并获得萃取分离锌镉的最佳工艺流程,为氨-硫酸铵体系中锌和镉的分离和回收提供数据参考与技术支持。
1 实验
1.1 原料及试剂
含锌、镉的氨-硫酸铵溶液由分析纯的氧化锌、硫酸镉、硫酸铵和氨水配制而成,其中x(NH3): x((NH4)SO4)=1:1,溶液中锌离子浓度为0.05 mol/L,镉离子浓度为0.05 mol/L,上述试剂均由天津市风船有限公司提供;所用萃取剂为Mextral54-100(HA),由重庆浩康医药化工集团有限公司提供,其活性成分为1-苯甲酰-2壬酮,具有β-二酮结构;协萃剂三烷基氧化膦(TRPO)由江西新信有限公司提供;稀释剂为磺化煤油。
1.2 实验方法
取一定体积水相和有机相加入梨型分液漏斗中,置于恒温水浴振荡器中进行萃取。达到预定萃取时间后,取出分液漏斗并静置5 min,经两相分离,得到负载有机相和萃余液。采用PHSJ-5型pH计测定萃余液的pHeq。将优化条件下制得的负载有机相用一定浓度的硫酸溶液反萃,然后静置分相,得到反萃液和空载有机相。采用WFX-110B型原子吸收分光光度计测定萃余液和反萃液中金属离子的浓度,对应有机相中金属离子浓度根据质量守恒计算得到。
1.3 锌镉分离基本原理
Mextral54-100是一种新型的β-二酮螯合萃取剂,在其分子内存在着酮式-烯醇式之间的异构化转变,而其烯醇式羟基上的H+可以和金属离子交换生成配合物,其羰基上的氧原子可以和金属离子配位形成稳定的螯合物。溶液中的自由Zn2+能被萃取,并以萃合物ZnA2形式进入有机相[14]。该萃取剂从氨-硫酸铵体系萃取锌的反应可表示为:
[Zn2+]aq+2[HA]org=[ZnA2]org+2[H+]aq (1)
当萃取反应达到化学平衡时,其萃取平衡常数Kex可表示为:
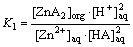 (2)
(2)
添加少量TRPO(B)后,通过配位取代作用,TRPO可挤掉配位数不饱和的锌螯合物中的水分子,有效提高锌的萃取率。TRPO与锌螯合物的加合反应如式(3)所示:
[ZnA2]org+[B]org=[ZnA2·B]org (3)
式中:B为TRPO。
由式(1)和(3),可得出协同萃取锌的反应式如下:
[Zn2+]aq+2[HA]org+[B]org=[ZnA2·B]org+2[H+]aq (4)
反应平衡后,锌的协同萃取平衡常数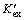 可表示为:
可表示为:
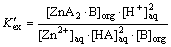 (5)
(5)
此外,氨性体系中Zn2+还可以配合离子形态存在,萃取过程与配合离子的解离过程同时进行,萃取过程中发生的配合离子解离反应主要为:
[NH4+]aq=[NH3]aq+[H+]aq (6)
[Zn(NH3)m2+]aq=[Zn2+]aq+m[NH3]aq (7)
式中:m=1~4。
与锌离子的萃取行为不同,氨性溶液中的镉离子难以被β-二酮类萃取剂萃取,因此可通过溶剂萃取实现锌、镉的分离。在氨性溶液中,Cd2+能与自由氨分子形成镉氨络合离子(Cd(NH3)n),使得镉离子在碱性条件下(pH>7)依然不能以Cd(OH)2形式析出[32-33],故可采用添加碱式磷酸盐生成磷酸镉沉淀的方法对萃余液中的镉离子进行回收[34]。
2 结果及讨论
2.1 氨-硫酸铵体系中锌和镉萃取分离行为
2.1.1 萃取时间对锌和镉萃取率的影响
在温度25 ℃,相比O/A=1:1,初始pH=8.0,被萃水相中[NH3]T=3 mol/L,萃取有机相中[HA]=0.4 mol/L、[TRPO]=0.05 mol/L的条件下,考察萃取时间对锌和镉萃取率的影响,结果如图1所示。
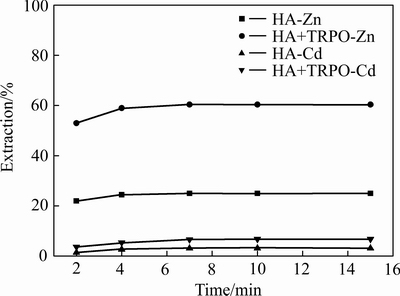
图1 萃取时间对锌、镉萃取率的影响
Fig. 1 Effect of extraction time on extraction rate of zinc and cadmium
萃取平衡时间主要取决于萃取反应的速率和萃合物在有机相中的溶解速率,两者的速率越大,达到萃取平衡需要的时间越短。从图1可知,无论是单独萃取体系还是协同萃取体系,锌、镉约在7 min内就可基本达到萃取平衡。为了使萃取反应尽可能达到平衡,萃取时间以10 min为宜。
2.1.2 初始pH值对锌和镉萃取率的影响
在温度25 ℃,相比O/A=1:1,萃取时间t=10 min,被萃水相中[NH3]T=3 mol/L,萃取有机相中[HA]=0.4 mol/L、[TRPO]=0.05 mol/L的条件下,考察初始pH对锌和镉萃取率的影响,结果如图2所示。
从图2可看出,锌萃取率受溶液pH影响十分显著。两种萃取体系中锌萃取率均随着初始pH的升高而增大,在初始pH=7.2时达到最大值,然后逐渐下降。由式(2)、(5)可知,因为锌的萃取平衡常数K与H+的2次方有关,所以不管是是HA单独萃体系还是HA与TRPO组成的协萃体系,初始pH的变化对锌离子的萃取率特别敏感,升高pH有利于锌的萃取。此外,β-二酮萃取剂酸性很弱,同时具有烯醇式和酮式两种结构,酮式不能和金属离子螯合,而其烯醇式中羟基上氢酸性较强,因此烯醇式能和金属离子形成稳定的螯合物并萃取,碱性溶液能够促进酮式向烯醇式的转变,因此pH值升高,锌的萃取率不断增大。对于协萃体系锌萃取率明显高于单萃体系的,原因是有机相中锌萃合物与TRPO配位,取代锌萃合物中的部分或全部水分子,使其疏水性和稳定性增强,从而提高了锌萃合物在非极性碳氢溶剂中的溶解度。
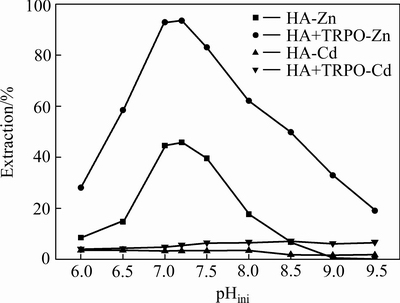
图2 初始pH值对锌、镉萃取率的影响
Fig. 2 Effect of initial pH value on extraction rate of zinc and cadmium
氨性溶液中pH值还与锌氨配位离子的形态密切相关,从而影响锌离子的萃取行为。由图2可看出,随着初始pH值的升高,锌萃取率增大到最大值后出现下降。随着pH值的升高,式(6)平衡向右移动,促使水相中游离的NH3浓度增大,从而使式(7)平衡向左移动,促进了锌氨络合离子的形成。当pH>7.2时,水相中锌的优势物种为Zn(NH3)32+和Zn(NH3)42+,当pH>8.0时,水相中锌主要以Zn(NH3)42+形式存在。Zn(NH3)32+和Zn(NH3)42+的配位结构均是非常稳定的四配位的四面体构型,萃取过程萃取剂的配位能力竞争不过游离氨分子,降低了锌离子的反应活性,这是氨性溶液中锌的萃取率在pH>7.2时急剧降低的主要原因[26]。
由图2可知,随着初始pH值的升高,两种体系中锌的萃取率均呈先增后减的规律。在pH=7.2时,两种萃取体系中锌的萃取率均达到最大值,HA体系和HA+TRPO体系中锌的萃取率分别为45.85%、93.54%,呈现明显的协同萃锌效应。对于镉离子的萃取,随着pH的升高,镉的萃取率很低且变化不大,HA+TRPO体系比HA体系镉的萃取率略高,在pH=7.2时,HA体系和HA+TRPO体系中镉的萃取率分别为3.31%、4.50%。由此说明,氨性溶液中镉难以被β-二酮萃取剂萃取,从而可以采用选择性萃取的方法将锌从氨性溶液中萃取出来,实现锌和镉的分离。由图3可知,HA体系和HA+TRPO体系中锌镉分离系数均在pHini=7.2时达到最大值,分别为24.81和307.30,采用协萃体系能更好地实现锌、镉的分离。由图4可知,两种萃取体系下萃取前后水相pH值变化不大,在初始pH=7.2时,两体系中△pH≈0,这对连续多级萃取锌有利。综合考虑,选择在pH=7.2条件下采用HA+TRPO协同萃取体系选择性萃取锌,镉几乎全部留在溶液中,从而实现锌与镉的分离。
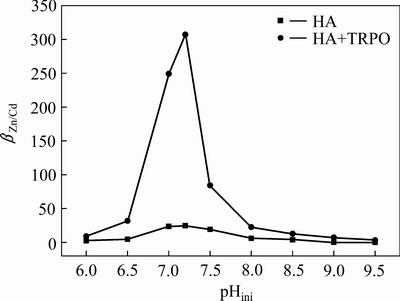
图3 初始pH值对锌镉分离系数的影响
Fig. 3 Effect of initial pH value on separation factor of zinc and cadmium
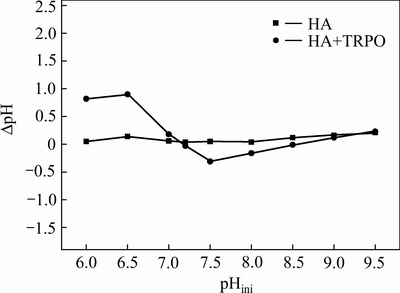
图4 △pH与pHini的关系
Fig. 4 Relationship between △pH and initial pH
2.1.3 萃取剂浓度对锌和镉萃取率的影响
在温度25 ℃,相比O/A=1:1,萃取时间t=10 min,初始pH=7.2,被萃水相中[NH3]T=3 mol/L的条件下,考察萃取剂HA浓度对锌、镉萃取率的影响,结果如图5所示。
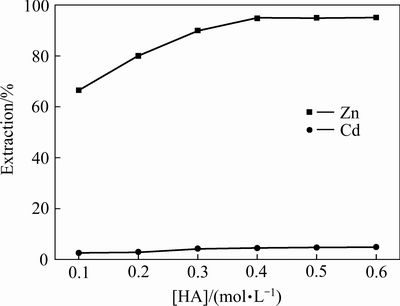
图5 萃取剂浓度对锌、镉萃取率的影响
Fig. 5 Effect of extractant concentration on extraction rate of zinc and cadmium
由图5可知,对于HA+TRPO体系,随着萃取剂HA浓度的增大,锌的萃取率随之增大,当HA浓度达到0.4 mol/L时,锌的单级萃取率达到了94.70%,随着HA浓度继续增大,锌萃取率几乎保持不变。由式(4)可知,当水相中各离子浓度保持不变时,随着有机相中萃取剂浓度的增大,根据萃取反应平衡原理,必将促进萃取反应向正向进行。由图5可见,镉的萃取率随HA浓度的增大而缓慢增大,在HA浓度达到0.4 mol/L时镉萃取率仅为4.50%。为了实现锌、镉的有效分离,选择萃取剂浓度为0.4 mol/L是合适的。
2.1.4 协萃剂浓度对锌和镉萃取率的影响
在温度25 ℃,相比O/A=1:1,萃取时间t=10 min,初始pH=7.2,萃取有机相中[HA]=0.4 mol/L的条件下,考察协萃剂浓度对锌和镉萃取率的影响,结果如图6所示。
由图6可知,锌的萃取受协萃剂浓度影响显著,其萃取率随着TRPO浓度的增大而增大。在加入少量TRPO的情况下,锌萃取率就能显著提高,说明TRPO对HA的萃锌过程具有明显的协萃效应。由式(4)可知,根据反应平衡原理,TRPO浓度的增大将促使反应正向进行,从而提高锌的萃取率。TRPO浓度达到0.05 mol/L时,锌萃取率达到94.70%,继续增大TRPO浓度,锌萃取率略有增加。实验过程中发现,TRPO浓度过大,萃取之后有机相和水相间分相缓慢。镉的萃取率随协萃剂浓度增大而缓慢增大,在TRPO浓度达到0.05 mol/L时,镉萃取率为4.50%。综合考虑,协萃剂TRPO浓度选取为0.05 mol/L。
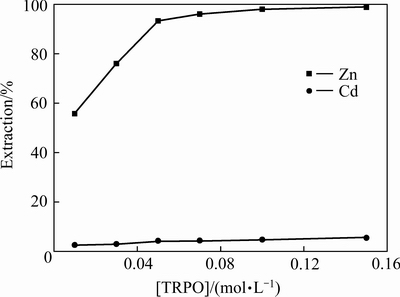
图6 协萃剂浓度对锌和镉萃取率的影响
Fig. 6 Effect of synergistic extractant concentration on extraction rate of zinc and cadmium
2.1.5 锌的萃取等温线
在温度25 ℃,萃取时间t=10 min,水相平衡pH≈7.2,被萃水相中[NH3]T≈3 mol/L,萃取有机相中[HA]=0.4 mol/L,[TRPO]=0.05 mol/L的条件下,采用相比法测定锌的萃取等温线。相比实验表明,随着相比(O/A)的增大,锌萃取率也随之增大。当相比(O/A)从1:4增大到1:1时,锌萃取率由40.18%增大到94.17%,而后趋于平缓。故萃取相比选为l:l。在相比O/A=l:l时对锌的萃取等温线进行图解结果如图7所示。结果显示,对含锌0.05 mol/L的氨性溶液,在O/A=1:1的条件下,经2级萃取即可使溶液中的锌由3.25 g/L降至0.01 g/L以下。在实验条件下,经过2级逆流萃取,萃余液中含锌小于0.01 g/L,锌萃取率为99.2%,而镉的萃取率小于5%。通过上述选择性萃取工艺,锌几乎全部从溶液中被萃取出来,而镉仍然留在水相中,从而实现锌与镉的有效分离。

图7 锌的萃取等温线
Fig. 7 Extraction isotherm of zinc
2.2 锌的反萃富集行为
综上所述,实验采用HA+TRPO体系对锌、镉进行萃取与分离,锌被萃取进入有机相中,镉几乎全部留在水相中。锌反萃过程所采用的负载有机相为最佳萃取条件下得到的锌负载锌有机相,反萃剂为硫酸溶液。制取负载锌有机相的条件为:T=25 ℃,t=10 min,pHini=7.2,O/A=1:1,水相中[NH3+NH4+]T=3 mol/L,[Zn2+]=0.05 mol/L,[Cd2+]=0.05 mol/L,有机相中[HA]=0.4 mol/L,[TRPO]=0.05 mol/L,根据上述条件所得负载锌有机相中锌浓度为3.15 g/L,镉浓度为0.20 g/L。因为镉的共萃率很低,因此,在后续的锌反萃实验中,忽略镉离子对负载锌有机相反萃的影响。
2.2.1 硫酸浓度对锌反萃率的影响
在温度25 ℃,反萃时间10 min,相比O/A=1:1的条件下,考察硫酸浓度对锌反萃率的影响,结果如图8所示,锌反萃率随硫酸浓度的增大而增大。锌的反萃非常容易,在硫酸浓度仅为0.1 mol/L条件下,锌的反萃率已达到99.7%。因此,反萃硫酸浓度选为0.1 mol/L。
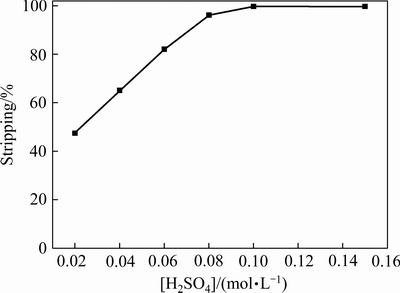
图8 硫酸浓度对锌反萃率的影响
Fig. 8 Effect of sulfuric acid concentration on stripping rate of zinc
2.2.2 锌的反萃等温线
在温度25 ℃,反萃时间10 min,负载有机相锌浓度为3.12 g/L,硫酸浓度为0.1 mol/L的条件下,采用相比法测定锌的反萃等温线。由相比实验可知,相比由1:4变化至2:1时,锌反萃率基本保持不变,依然保持在99.4%以上;当相比变为3:1时,锌反萃率急剧下降为68.2%。为有效利用反萃剂和提高反萃液中锌的浓度,锌的最佳反萃相比应为2:1。在相比O/A=2:l时用McCabe-Thiele图解法对等温线进行图解。结果显示,在O/A=2:1的条件下,得出锌的理论反萃级数为2级。经过2级逆流反萃实验,锌反萃率为99.9%,有机相中锌浓度小于0.01 g/L,锌反萃完全。
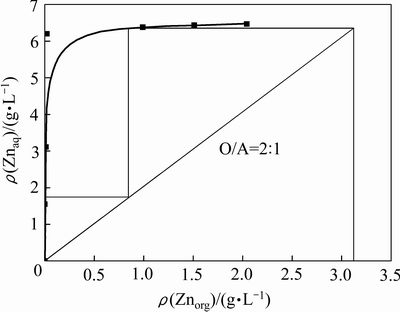
图9 锌的反萃等温线
Fig. 9 Stripping isotherm of zinc
2.3 萃取有机相的FT-IR光谱
对新鲜有机相和负载有机相进行红外光谱检测,其结果如图10所示。
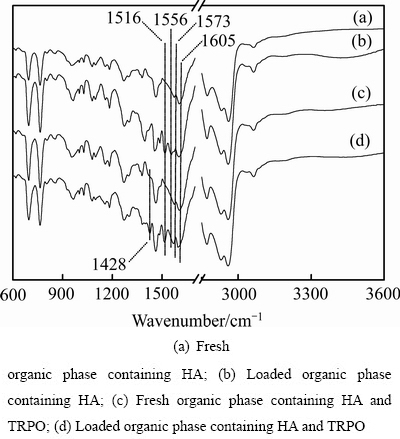
图10 萃取有机相的FT-IR谱
Fig. 10 FT-IR spectra of extracted organic phase
从图10可以看出,对于HA和HA+TRPO两个萃取体系来说,萃取锌过后,负载有机相的FT-IR谱上均出现明显的特征吸收峰,HA单萃体系的吸收峰位置为1516 cm-1和1556 cm-1,而HA+TRPO协萃体系的吸收峰位置为1428 cm-1和1516 cm-1,说明萃取剂结构在萃取前后发生了变化。对于单萃体系,由于β-二酮结构的特殊性,其存在酮式和烯醇式互变异构,萃取剂在1605 cm-1和1573 cm-1附近的特征吸收峰分别归属于υC=O和υC=C伸缩振动频率,萃取后,υC=O和υC=C吸收峰分别移至1556 cm-1和1516 cm-1处。这主要是由于萃取剂分子与锌发生螯合配位后形成螯合环,共轭作用增强,致使振动频率向低频方向移动,这也证实了β-二酮的烯醇式结构参与配位键的形成。对于协萃体系,其吸收峰位置相比于单萃体系出现了偏移,即由1516 cm-1和1556 cm-1变为1428 cm-1和1516 cm-1,说明HA单萃体系和HA+TRPO协萃体系的萃合物结构有所不同,这是由于TRPO能以加合形式与锌螯合物反应生成更为稳定的锌加合萃合物,从而有效促进了锌的萃取。另外,如果萃合物分子中含有氨,将会在645、1145、1596和3350 cm-1处出现吸收峰,但在负载有机相的红外谱中并没有发现氨的特征吸收,说明了锌氨络合物不会被萃取到有机相中。
2.4 锌镉萃取与分离的工艺流程图
根据上述分离步骤和最佳条件,获得从氨-硫酸铵溶液中萃取分离锌和镉的工艺流程,如图11所示。对于氨-硫酸铵溶液中锌和镉的萃取分离,宜在水相pH值为7.2,萃取体系组成为:0.4 mol/L Mextral54-100+0.05 mol/L TRPO,温度为25 ℃,相比O/A为1:1的条件下萃取锌,经过2级逆流萃取,锌萃取率达到99.2%,实现锌的高效萃取。对于得到的负载锌有机相,采用0.1 mol/L硫酸溶液在温度为25 ℃,相比O/A为2:1的条件下反萃锌,经2级逆流反萃,锌反萃率达到99.9%,得到的硫酸锌反萃液可采用传统电积方法回收锌,反萃锌后的空载有机相循环使用。对于萃锌后的含镉萃余液,采用添加碱式磷酸盐的方法,将镉转化为磷酸镉沉淀并加以回收。对于沉淀除镉后的萃余液,通过补充氨和调节pH值后,可返回用于非传统含锌物料的浸出。通过上述工艺流程,可实现氨-硫酸铵溶液中锌和镉的有效分离与回收,萃取有机相和浸出剂得到循环利用,有利于降低生产成本和提高经济、社会效益,对氨-硫酸铵体系中锌和镉的萃取分离具有很好的指导和现实意义。
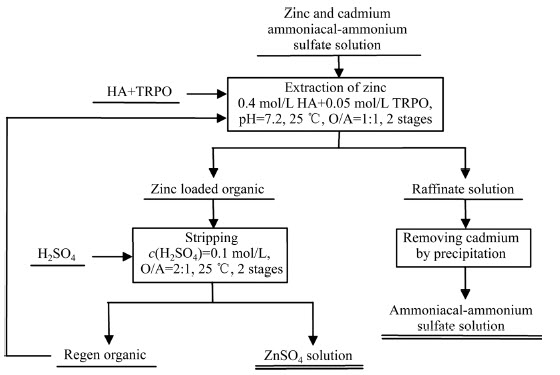
图11 锌镉萃取与分离的工艺流程图
Fig. 11 Flow sheet for extraction and separation of zinc and cadmium
3 结论
1) 水相初始pH值对锌萃取影响较大,锌萃取率均随初始pH的升高呈先增后减趋势,添加TRPO对萃锌有明显协同萃取效应。氨性溶液中镉难以被萃取,改变初始pH时镉的萃取率变化不大,HA+TRPO体系比HA体系镉萃取率略高。HA+TRPO体系在pHini=7.2条件下锌镉分离系数达到最大值,即(βZn/Cd)max=307,所以选择性萃取分离锌、镉的方式为:采用HA+TRPO协同萃取体系在pHini=7.2条件下选择性萃取锌,镉不被萃取而留在溶液中,实现锌与镉的分离。
2) 采用HA+TRPO协同萃取体系萃取锌的最佳萃取条件为:萃取时间10 min,温度25 ℃,pHini=7.2,O/A=1:1,有机相中[HA]=0.4 mol/L,[TRPO]=0.05 mol/L。经过2级萃取,锌萃取率达到99.2%,而镉的共萃率小于5%,实现锌与镉的有效分离。对含锌3.15 g/L的负载锌有机相,其最佳反萃条件为:反萃时间10 min,温度25 ℃,O/A=2:1,硫酸浓度0.1 mol/L。经过2级逆流反萃,锌反萃率为99.9%,有机相中锌浓度小于0.01 g/L。锌萃余液采用化学沉淀法可沉淀回收其中的镉。
REFERENCES
[1] DOU Ai-chun, YANG Tian-zu, YANG Ji-xing, WU Jiang-hua, WANG An. Leaching of low grade zinc oxide ores in Ida2--H2O system[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(11): 2548-2553.
[2] 凌江华, 尹周澜, 胡慧萍, 李珊珊, 胡久刚, 陈启元. 兰坪低品位氧化锌矿NH3-(NH4)2SO4体系浸出[J]. 中南大学学报, 2011, 42(9): 2577-2583.
LING Jiang-hua, YIN Zhou-lan, HU Hui-ping, LI Shan-shan, HU Jiu-gang, CHEN Qi-yuan. Leaching process of low grade zinc oxide ore of Lanping in NH3-(NH4)2SO4 system[J]. Journal of Central South University, 2011, 42(9): 2577-2583.
[3] 郭天立, 高良宾. 当代竖罐炼锌技术述评[J]. 中国有色冶金, 2007(1): 5-6, 36.
GUO Tian-li, GAO Liang-bin. Review on today’s zinc vertical retorting technology[J]. China Nonferrous Metallurgy, 2007(1): 5-6, 36.
[4] LI Cun-xiong, XU Hong-sheng, DENG Zhi-gan, LI Xing-bin, LI Ming-tin, WEI Chang. Pressure leaching of zinc silicate ore in sulfuric acid medium[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(5): 918-923.
[5] 张玉梅, 李 洁, 陈启元, 丁红青. 超声波辐射对低品位氧化锌矿氨浸行为的影响[J]. 中国有色金属学报, 2009, 19(5): 960-966.
ZHANG Yu-mei, LI Jie, CHEN Qi-yuan, DING Hong-qing. Influence of ultrasonic irradiation on ammonia leaching of zinc from low-grade oxide zinc ore[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(5): 960-966.
[6] WANG Rui-xiang, TANG Mo-tang, YANG Sheng-hai, ZHAGN Wen-hai, TANG Chao-bo, HE Jing, YANG Jian-guang. Leaching kinetics of low grade zinc oxide ore in NH3-NH4Cl-H2O system[J]. Journal of Central South University of Technology (English Edition), 2008, 15(5): 679-683.
[7] 唐谟堂, 张家靓, 王 博, 杨声海, 何 静, 唐朝波, 杨建广. 低品位氧化锌矿在MACA体系中的循环浸出[J]. 中国有色金属学报, 2011, 21(1): 214-219.
TANG Mo-tang, ZHANG Jia-liang, WANG Bo, YANG Sheng-hai, HE Jing, TANG Chao-bo, YANG Jian-guang. Cycle leaching of low grade zinc oxide ores in MACA system[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(1): 214-219.
[8] BUCKETT G A, FOUNTAIN C R, SINCLAIR R J. Carbothermic smelting of zinc sulfide ores with oxidation of crude zinc vapor and purification of oxide by leaching: WO Patent, 9,836,102, pp. 62[P]. 1998.
[9] KASAI T, NIIKURA T, SATO M, HASHIMOTO T, YAMASHITA R. System for dissolution-purification of zinc-containing materials: US Patent, 4,689,146, pp. 11[P]. 1987.
[10] LOZANO B L J, MESEGUER Z V F, DE J G D. Statistical analysis of laboratory results of Zn wastes leaching[J]. Hydrometallurgy, 1999, 54: 41-48.
[11] DREISINGER D B, PETERS E, MORGAN G. The hydrometallurgical treatment of carbon steel electric arc furnace dusts by the UBC chaparral process[J]. Hydrometallurgy, 1990, 25: 137-152.
[12] NYIRENDA R L, LUGTMEIJER A D. Ammonium carbonate leaching of carbon steelmaking dust-detoxification potential and economic feasibility of a conceptual process[J]. Minerals Engineering, 1993, 6(7): 785-793.
[13] ALGUACIL F J, COBO A. Extraction of zinc from ammoniacal/ ammonium sulphate solutions by LIX54[J]. Journal of Chemical Technology and Biotechnology, 1998, 71(2): 162-166.
[14] ALGUACIL F J, ALONSO M. The effect of ammonium sulphate and ammonia on the liquid-liquid extraction of zinc using LIX 54[J]. Hydrometallurgy, 1999, 53(2): 203-209.
[15] 王延忠, 朱云, 胡 汉. 从氨浸出液中萃取锌的试验研究[J]. 有色金属, 2004, 56(1): 37-39.
WANG Yan-zhong, ZHU Yun, HU Han. Zinc extraction from ammonia leaching solution with LIX54[J]. Nonferrous Metals, 2004, 56(1): 37-39.
[16] 陈 浩, 朱 云, 胡 汉. Zn-NH3-H2O体系中Lix54萃取锌[J]. 有色金属, 2003, 55(3): 50-51.
CHEN Hao, ZHU Yun, HU Han. Zinc extraction with LIX54 in Zn-NH3-H2O SYSTEM[J]. Nonferrous Metals, 2003, 55(3): 50-51.
[17] 吴贤文, 尹周澜, 刘春轩, 胡慧萍, 丁治英, 陈启元. LX84和LIX54混合萃取剂从氨性溶液中萃取锌的研究[J]. 中南大学学报(自然科学版), 2011, 42(3): 605-609.
WU Xian-wen, YIN Zhou-lan, LIU Chun-xuan, HU Hui-ping, DING Zhi-ying, CHEN Qi-yuan. Zinc extraction from ammoniacal solutions with mixture of LIX84 and LIX54[J]. Journal of Central South University (Science and Technology), 2011, 42(3): 605-609.
[18] RAO K S, SAHOO P K, JENA P K. Extraction of zinc from ammoniacal solutions by hostarex DK-16[J]. Hydrometallurgy, 1992, 31(1/2): 91-100.
[19] HOH Y C, CHOU N P, WANG W K. Extraction of Zinc by LIX 34[J]. Industrial & Engineering Chemistry Process Design and Development, 1982, 21(1): 12-15.
[20] HOH Y C, CHUANG W S. Influence of temperature on the extraction of zinc by LIX34[J]. Hydrometallurgy, 1983, 10(1): 123-128.
[21] KORDOSKY G A, VIRNIG M J, MATTISON P. β-Diketone copper extractants: Structure and stability[C]// International Solvent Extraction Conference. South Africa: South African Institute of Mining and Metallurgy, 2002: 360-365.
[22] 何 静, 黄 玲, 陈永明, 唐谟堂, 金胜明, 冯瑞姝, 吴胜男. 新型萃取剂YORS萃取Zn(Ⅱ)-NH3配合物体系中的锌[J]. 中国有色金属学报, 2011, 21(3): 687-692.
HE Jing, HUANG Ling, CHEN Yong-ming, TANG Mo-tang, JIN Sheng-ming, FENG Rui-zhu, WU Sheng-nan. Solvent extraction of zinc from Zn(II)-NH3 complex system by new extractant YORS[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(3): 687-692.
[23] HUANG Ling, HE Jing, CHEN Yong-ming, YANG Sheng-hai, JIN Sheng-ming, TANG Mo-tang. Extraction kinetics of zinc by new extractant in ammoniacal system[J]. Journal of Central South University, 2013(20): 1797-1804.
[24] HU Jiu-gang, CHEN Qi-yuan, YANG Xu-ming, HU Feng-chun, HU Hui-ping, YIN Zhou-lan. Extraction of zinc from ammoniacal solution with β-diketone: A comparative study of solvents used[J]. Separation and Purification Technology, 2012, 87: 15-21.
[25] 朱如龙, 李兴彬, 魏 昶, 黄 卉, 李存兄, 邓志敢, 樊 刚. 采用 Mextral54-100从Zn(Ⅱ)-NH4Cl-NH3配合物溶液中萃取锌[J]. 中国有色金属学报, 2015, 25(4): 1056-1062.
ZHU Ru-Long, LI Xing-Bin, WEI Chang, HUANG Hui, LI Cun-Xiong, DENG Zhi-gan, FAN Gang. Solvent extraction of zinc from Zn(Ⅱ)-NH4Cl-NH3 complex solution using Mextral54-100[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(4): 1056-1062.
[26] FU Weng, CHEN Qi-yuan, WU Qian, HU Hui-ping, BAI Lan. Solvent extraction of zinc from ammoniacal/ammonium chloride solutions by a sterically hindered β-diketone and its mixture with tri-n-octylphosphine oxide[J]. Hydrometallurgy, 2010, 100: 116-121.
[27] CHEN Qi-yuan, LI Liang, BAI Lan, HU Hui-ping, LI Jian, LIANG Qi-wen, LING Jiang-hua. Synergistic extraction of zinc from ammoniacal ammonia sulfate solution by a mixture of a sterically hindered beta-diketone and tri-n-octylphosphine oxide (TOPO)[J]. Hydrometallurgy, 2011, 105: 201-206.
[28] HU Jiu-gang, CHEN Qi-yuan, HU Hui-ping Hu, HU Feng-chun, CHEN Xiang, YIN Zhou-lan. Extraction enhancement of zinc(Ⅱ) in ammoniacal media through solvent and synergistic effects: A structural and mechanistic investigation[J]. Chemical Engineering Journal, 2013, 215/216: 7-14.
[29] HU Jiu-gang, CHEN Qi-yuan, HU Hui-ping, YIN Zhou-lan. Synergistic extraction of zinc from ammoniacal solutions using β-diketone mixed with CYANEX923 or LIX84I[J]. Transactions of Nonferrous Metals Society of China, 2012, 22(5): 1217-1223.
[30] 王红艳, 周丹红, 王 坤. 聚乙二醇-硫酸铵双水相体系萃取分离镉(Ⅱ)[J]. 光谱实验室, 2011, 28(1): 31-35.
WANG Hong-yan, ZHOU Dan-hong, WANG Kun. Extraction separation of cadmium(Ⅱ)by aqueous two-phase system[J]. Chinese Journal ol Spectroscopy Laboratory, 2011, 28(1): 31-35.
[31] 王 勤, 陈艳红. P204萃取分离钴镉的实验研究[J]. 湖南有色金属, 2014, 30(3): 34-36, 73.
WANG Qin, CHEN Yan-hong. Study on separation of Co and Cd solution by using P204[J]. Hunan Nonferrous Metals, 2014, 30(3): 34-36, 73.
[32] 廖春发, 金 军. 从某铜冶炼厂高砷高酸硫酸铜溶液中萃取镉[J]. 有色金属工程, 2015, 5(1): 27-31.
LIAO Chun-fa, JIN Jun. Cadmium extraction from copper sulfate solution with high arsenite and acid content in a copper smelter[J]. Nonferrous Metals Engineering, 2015, 5(1): 27-31.
[33] 丁春生, 黄 燕, 缪 佳, 曾海明, 彭 芳. 电凝聚法去除废水中重金属离子Cr6+、Cd2+的研究[J]. 中国给水排水, 2012, 28(3): 71-74.
DING Chun-sheng, HUANG Yan, MIU Jia, ZENG Hai-ming, PENG Fang. Removal of heavy metal ions Cr6+ and Cd2+ from waste water by electrocoagulation process[J]. China Water & Wastewater, 2012, 28(3): 71-74.
[34]  A N, THEODORO P S,
A N, THEODORO P S,  S M, TRIGUEROS D E G. Optimization of the iron electro-coagulation process of Cr, Ni, Cu, and Zn galvanization by-products by using response surface methodology[J]. Separation Science and Technology, 2012, 47(5): 688-699.
S M, TRIGUEROS D E G. Optimization of the iron electro-coagulation process of Cr, Ni, Cu, and Zn galvanization by-products by using response surface methodology[J]. Separation Science and Technology, 2012, 47(5): 688-699.
[35] 党明岩, 郭洪敏, 谭艳坤, 赵春英. 壳聚糖及其衍生物吸附电镀废水中重金属离子的研究进展[J]. 电镀与精饰, 2012, 34(7): 9-13.
DANG Ming-yan, GUO Hong-min, TAN Yan-kun, ZHAO Chun-ying. Recent progress of the study on adsorption for heavy metal ions in electroplating wastewater by chitosan and its derivatives[J]. Plating and Finishing, 2012, 34(7): 9-13.
Extraction and separation of zinc and cadmium from ammoniacal/ammonium sulfate solutions
TANG Fu-li, LI Xing-bin, WEI Chang, FAN Gang, ZHU Ru-long, LI Cun-xiong, DENG Zhi-gan
(Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China)
Abstract: The performances of extraction systems, Mextral54-100 (HA) and Mextral54-100+TRPO (HA+TRPO), on extraction and separation of zinc and cadmium from ammoniacal/ammonium sulfate solutions were investigated, and the optimal process of zinc-cadmium separation was determined. The results show that high selective extractability of zinc is achieved with HA+TRPO extraction system at initial pH 7.2, while low extractabilities of cadmium are achieved with both extraction systems at different pH values. Therefore, it is supposed to extract zinc with HA+TRPO system at initial pH 7.2, and cadmium is left in the solution as it can not be extracted, which achieves the separation of zinc and cadmium. For extraction of zinc, the extraction ratio of zinc reaches 99.2% with two extraction stages under the conditions of 0.4 mol/L HA+0.05 mol/L TRPO synergistic extraction system, 25 ℃, initial pH 7.2, and phase ratio (O/A) 1:1, while the extraction ratio of cadmium is less than 5%. For loaded organic phase containing zinc, the stripping ratio of zinc is 99.9% with two stripping stages. The cadmium consisting in extraction raffinate can be recycled by chemical precipitation method. In this work, by means of selecting the appropriate extraction system and extraction conditions, the best technical process and parameters for extraction and separation of zinc and cadmium from ammoniacal/ammonium sulfate solutions are acquired.
Key words: solvent extraction; β-diketone; ammoniacal solution; zinc-cadmium separation
Foundation item: Project(2014CB643404) supported by the National Basic Research Development Program of China; Projects(51304093, 51174104, 51364022, 51474115) supported by the National Natural Science Foundation of China
Received date: 2015-09-16; Accepted date: 2017-04-07
Corresponding author: FAN Gang; Tel: +86- 871-65188819; E-mail: kgfangang2008@163.com
(编辑 王 超)
基金项目:国家重点基础研究发展计划项目(2014CB643404);国家自然科学基金资助项目(51304093, 51174104, 51364022, 51474115)
收稿日期:2015-09-16;修订日期:2017-04-07
通信作者:樊 刚,教授;电话:0871-65188819;E-mail: kgfangang2008@163.com
摘 要:研究Mextral54-100(HA)和Mextral54-100+TRPO(HA+TRPO)两种萃取体系从氨-硫酸铵溶液中萃取分离锌镉的性能,确定出锌镉分离的最佳工艺。结果表明:HA+TRPO萃取体系在初始pH为7.2时对锌具有较高的选择性萃取能力,而不同pH条件下两种萃取体系对镉的萃取能力均很低。因此,宜采用HA+TRPO体系在初始pH为7.2条件下萃取锌,镉不被萃取而留在溶液中,实现锌与镉的分离。对于锌的萃取,采用0.4 mol/L HA+0.05 mol/L TRPO的协同萃取体系,在温度为25 ℃,初始pH为7.2,O/A相比为1:1的条件下,经2级萃取,锌萃取率为99.2%,镉的萃取率小于5%;对负载锌有机相,在温度为25 ℃,相比为2:1,硫酸浓度为0.1 mol/L的条件下,经2级反萃,锌反萃率为99.9%。萃余液中的镉可通过化学沉淀法将其沉淀回收。通过选择合适的萃取体系和萃取条件,获得了氨-硫酸铵溶液中萃取分离锌和镉的最佳工艺流程和技术参数。
[2] 凌江华, 尹周澜, 胡慧萍, 李珊珊, 胡久刚, 陈启元. 兰坪低品位氧化锌矿NH3-(NH4)2SO4体系浸出[J]. 中南大学学报, 2011, 42(9): 2577-2583.
[3] 郭天立, 高良宾. 当代竖罐炼锌技术述评[J]. 中国有色冶金, 2007(1): 5-6, 36.
[5] 张玉梅, 李 洁, 陈启元, 丁红青. 超声波辐射对低品位氧化锌矿氨浸行为的影响[J]. 中国有色金属学报, 2009, 19(5): 960-966.
[7] 唐谟堂, 张家靓, 王 博, 杨声海, 何 静, 唐朝波, 杨建广. 低品位氧化锌矿在MACA体系中的循环浸出[J]. 中国有色金属学报, 2011, 21(1): 214-219.
[15] 王延忠, 朱云, 胡 汉. 从氨浸出液中萃取锌的试验研究[J]. 有色金属, 2004, 56(1): 37-39.
[16] 陈 浩, 朱 云, 胡 汉. Zn-NH3-H2O体系中Lix54萃取锌[J]. 有色金属, 2003, 55(3): 50-51.
[30] 王红艳, 周丹红, 王 坤. 聚乙二醇-硫酸铵双水相体系萃取分离镉(Ⅱ)[J]. 光谱实验室, 2011, 28(1): 31-35.
[31] 王 勤, 陈艳红. P204萃取分离钴镉的实验研究[J]. 湖南有色金属, 2014, 30(3): 34-36, 73.
[32] 廖春发, 金 军. 从某铜冶炼厂高砷高酸硫酸铜溶液中萃取镉[J]. 有色金属工程, 2015, 5(1): 27-31.
[33] 丁春生, 黄 燕, 缪 佳, 曾海明, 彭 芳. 电凝聚法去除废水中重金属离子Cr6+、Cd2+的研究[J]. 中国给水排水, 2012, 28(3): 71-74.
[35] 党明岩, 郭洪敏, 谭艳坤, 赵春英. 壳聚糖及其衍生物吸附电镀废水中重金属离子的研究进展[J]. 电镀与精饰, 2012, 34(7): 9-13.


