离子液体负载型碳纳米管吸附除砷研究
彭长宏,程晓苏,曹金艳,陈带军
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘 要:
摘 要:通过浸渍法制备4种离子液体负载型碳纳米管吸附材料,分别采用静态法和动态法考察其对溶液中As(Ⅲ)和As(Ⅴ)的去除性能。研究结果表明:负载离子液体的碳纳米管对As(Ⅲ)和As(Ⅴ)具有较强的吸附作用,吸附过程属于单分子层的化学吸附,吸附行为符合Langmiur吸附;Im-CNT, tBu-CNT, Nme-CNT和Nmb-CNT这4种吸附材料对As(Ⅲ)的去除效果优于对As(Ⅴ)的去除效果;负载氮氧杂冠醚型离子液体的碳纳米管对砷的去除效果比负载咪唑型离子液体的碳纳米管的去除效果更优,说明冠醚型离子液体的空腔结构对砷具有良好的配合性能,同时,冠醚结构中取代烃基的长度对砷的去除也有一定的影响。
关键词:
中图分类号:O647.3 文献标志码:A 文章编号:1672-7207(2010)02-0416-06
Removal performance of arsenic by carbon nanotube
adsorbents loaded with ionic liquid
PENG Chang-hong, CHENG Xiao-su, CAO Jin-yan, CHEN Dai-jun
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The removal efficiencies of arsenic from solution by ionic liquids loaded carbon nanotubes (ILs/CNT) composite adsorption material was investigated by static and dynamic adsorption experiments respectively. The results show that carbon nanotubes loaded with ionic liquid have a strong adsorption effect on As(Ⅲ) and As(Ⅴ), which belongs to single-layer chemical adsorption and can be described by Langmiur formula. The removal efficiency of As(Ⅲ) with four adsorbents i.e., Im-CNT, tBu-CNT, Nme-CNT and Nmb-CNT, is better than that of As(Ⅴ). The arsenic removal efficiency of carbon nanotubes loaded with monoazacrown ether type ionic liquids is superior to that carbon nanotubes loaded with imidazole type ionic liquids, which shows that the crown ether structure has a good coalescent performance with arsenic, meanwhile the length of alkyl in monoazacrown ether ionic liquids has a certain impact on arsenic removal.
Key words: ionic liquid; carbon nanotubes; adsorption; removal of arsenic
有色行业的发展带来了严重的砷污染问题,产生人畜中毒和死亡事故[1]。欧洲、美国及日本等国家实行饮用水的最高允许含砷质量浓度为10 ?g/L[2],我国目前规定的饮用水的最高允许含砷质量浓度为50 ?g/L[3]。如何防治有色行业砷危害成为当前研究的重点和难点。常见的有色成分提取、富集和分离方法有共沉淀、离子交换和溶剂萃取等,其中,对砷的溶剂萃取分离有诸多报道[4-6]。但是,常规的有机萃取剂存在溶剂挥发、交叉污染等环境问题。离子液体[6-9]作为一种新型萃取剂,由于具有环境友好性和可设计 性,被用来替代常规的有机萃取剂作为离子分离的介质成为当前研究的热点,如:Yasuhiro等[10]设计合成了3种具有离子识别功能的离子液体;Visser等[11]报道了6种专门为萃取Hg2+和Cd2+而设计的离子液体。目前,对离子液体萃取砷的研究未见报道。彭长宏 等[12-13]的研究表明,新型离子液体萃取剂对金属离子具有良好的配合性能。但将离子液体直接用于液-液萃取除砷,存在用量大、成本高的问题。采用吸附或固载化方法[14-15]将离子液体负载在无机多孔材料或有机高分子材料上,可大大降低离子液体的用量及流失等问题,同时,可把离子液体的特性转移到固体材料上。在此,本文作者通过浸渍法制备出离子液体负载型碳纳米管吸附剂,并研究其对As(Ⅲ)和As(Ⅴ)的去除效果。
1 实验
1.1 离子液体负载型碳纳米管吸附材料的制备
试剂与原料为:N-甲基、乙基单氮杂-15-冠-5溴化季铵盐离子液体,实验室制备[16-17];N-甲基、丁基单氮杂-15-冠-5溴化季铵盐离子液体,实验室制 备[16-17];1-丁基-3-甲基咪唑六氟磷酸盐离子液体,购于杭州科默化学有限公司;1-己基-3-甲基咪唑六氟磷酸盐离子液体,购于杭州科默化学有限公司;工业级单壁碳纳米管,纯度>85%,购于北京纳辰科技发展有限公司;二氯甲烷为分析纯,购于湖南师大化学试 剂厂。
采用等体积浸渍法进行制备,其原理是:将一定量的碳纳米管与一定量的二氯甲烷溶液混合,在室温下于恒温振荡箱中振荡24 h,过滤,再于50 ℃真空干燥10 h,得到4种离子液体负载型碳纳米管的吸附材料:负载N-甲基、乙基单氮杂-15-冠-5溴化季铵盐离子液体碳纳米管(Nme-CNT),负载N-甲基、丁基单氮杂-15-冠-5溴化季铵盐离子液体碳纳米管(Nmb-CNT),负载1-丁基-3-甲基咪唑六氟磷酸盐离子液体碳纳米管(tBu-CNT),负载1-己基-3-甲基咪唑六氟磷酸盐离子液体碳纳米管(Im-CNT)。
1.2 吸附动力学曲线的测定
移取20 mL砷的质量浓度为5 mg/L的溶液,置于50 mL锥形瓶中,再准确称取1.0 g离子液体负载型碳纳米管吸附材料加入到含砷溶液中,然后,在水浴恒温振荡器中于20 ℃恒温振荡,间隔一定时间取出一定体积的上清液用微孔滤膜过滤,用电感耦合等离子体发射光谱仪(ICP)测定砷的浓度,根据式(1)计算砷的吸附容量,绘制吸附率与时间的关系曲线,即吸附动力学曲线。
![]()
式中:x为吸附剂吸附溶质的质量,mg;W为吸附材料的质量,g;V为水溶液的体积,L;qe为单位吸附剂吸附溶质的质量,mg/g;ρ0和ρe为溶液中砷离子的初始和平衡质量浓度,mg/L。
1.3 等温吸附线的测定
分别移取20 mL砷的质量浓度为5,10,15,20,25,30和35 mg/L的溶液置于若干个50 mL锥形瓶中,用缓冲溶液调节溶液的pH值,再加入准确称量的离子液体负载型碳纳米管吸附材料1.0 g,然后,在水浴恒温振荡器中恒温振荡一定时间,使吸附达平衡,取上清液用微孔滤膜过滤,用ICP测定砷的浓度,根据式(1)计算吸附容量,绘制平衡吸附容量-平衡浓度的关系曲线,即离子液体负载型碳纳米管吸附材料的等温吸附线。
1.4 动态吸附性能的考察
称取2.0 g离子液体负载型碳纳米管吸附材料,装在内径为8 mm、容积为2.0 mL的玻璃吸附柱内,形成柱体积为2.0 mL的吸附柱,在室温下将砷的质量浓度为100 mg/L的含砷溶液以一定流速通过吸附柱,收集一定体积的流出液,测定流出液中砷的浓度,绘制动态吸附曲线,得出贯穿吸附容量及饱和吸附容量。
2.1 吸附动力学曲线
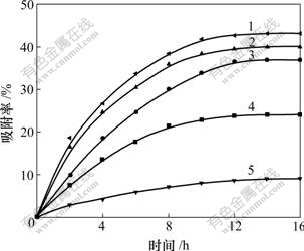
利用式(1)计算4种吸附材料对As(Ⅲ)和As(Ⅴ)的吸附容量,离子液体负载型碳纳米管吸附除砷的动力学曲线如图1和图2所示。

1—Nmb-CNT; 2—Nme-CNT; 3—tBu-CNT;
4—Im-CNT; 5—CNT
图1 As(Ⅲ)的吸附动力学曲线
Fig.1 Adsorption dynamics graph of As(Ⅲ)
1—Nmb-CNT; 2—Nme-CNT; 3—tBu-CNT;
4—Im-CNT; 5—CNT
图2 As(Ⅴ)的吸附动力学曲线
Fig.2 Adsorption dynamics graph of As(Ⅴ)
由图1和2可以看出:离子液体负载型吸附材料Nmb-CNT,Nme-CNT,tBu-CNT和Im-CNT对As(Ⅲ)和As(Ⅴ)的吸附表现出相似的动力学性质,在1~8 h内吸附最快,15 h达到吸附平衡。碳纳米管对As(Ⅲ)和As(Ⅴ)有一定的去除效果,负载离子液体后吸附率明显提高,说明吸附材料上负载的离子液体对砷的去除起主要作用。负载不同离子液体的吸附材料对砷的去除率不同,含氮氧杂冠醚结构的离子液体的吸附材料对砷的去除率高于2种常规咪唑型离子液体的去除效果,说明氮氧杂冠醚对砷有较好的配合作用。同时,官能团上的取代烃基对除砷性能也有一定影响,氮氧杂冠醚结构中,取代烷基链的增长有利于砷的去除,而负载咪唑型离子液体则出现相反的现象,这可能是取代烃基产生的空间效应对冠醚和咪唑有不同影响的缘故[18]。
2.2 等温吸附线
利用式(1)计算绘制平衡吸附容量(qe)-平衡浓度(ρe)的关系曲线,得到离子液体负载型碳纳米管吸附材料吸附除砷的等温吸附线,结果如图3和图4所示。
从图3和图4可以看出:4种吸附材料对As(Ⅲ)和As(Ⅴ)的吸附能力由大至小均为Nmb-CNT,Nme-CNT,tBu-CNT和Im-CNT。原因可能与吸附材料Nmb-CNT和Nme-CNT负载的离子液体含氮氧杂冠醚环有关,冠醚与金属离子形成配合物,是借助于醚环上带负电氧原子与金属离子间的离子-偶极静电作用[17]。同时,氮杂冠醚环上的氮原子、氧原子也可以提供孤对电子与AsO43-和AsO33-发生配合,因此,吸附容量大[19-20]。tBu-CNT和Im-CNT负载的咪唑型离子液体中只含胺基,发生配合反应的活性中心较少,同时,吸附材料tBu-CNT和Im-CNT吸附的咪唑型离子液体形成的共轭结构降低了胺基的配位性能,因此,吸附容量较小。

1—tBu-CNT; 2—Im-CNT; 3—Nme-CNT; 4—Nmb-CNT
图3 As(Ⅲ)的吸附热力学曲线
Fig.3 Isothermal adsorption graph of As(Ⅲ)

1—Im-CNT; 2—tBu-CNT; 3—Nme-CNT; 4—Nmb-CNT
图4 As(Ⅴ)的吸附热力学曲线
Fig.4 Isothermal adsorption graph of As(Ⅴ)
2.3 等温吸附方程拟合
负载离子液体型碳纳米管对砷的吸附行为采用Langmuir等温吸附方程和Freundlich等温吸附方程来描述。
Langmuir等温吸附方程的线性化可表示为:
![]()
Freundlich等温吸附方程的线性化表示为:
![]()
式中:qm为与吸附容量的极限值有关的常数;qe为平衡吸附量;a和b为与吸附容量有关的常数。
根据式(2),得到各吸附材料吸附As(Ⅲ)和As(Ⅴ)的Langmuir公式拟合的等温吸附曲线图,结果如图5和图6所示。根据式(3),得到各吸附材料吸附As(Ⅲ)和As(Ⅴ)的Freundlich公式拟合的等温吸附曲线图,结果如图7和图8所示。
对比图5~8可以看出:利用Langmuir公式拟合的等温曲线图,线性相关系数均大于99%,说明实验数据宜用Langmuir公式表征。根据图5和图6 中Langmuir拟合直线的截距和斜率得到各吸附材料对As(Ⅲ)和As(Ⅴ)的Langmuir等温吸附方程,如表1 所示。

1—tBu-CNT; 2—Im-CNT; 3—Nme-CNT; 4—Nmb-CNT
图5 As(Ⅲ)的Langmuir公式拟合等温曲线图
Fig.5 Isothermal graph of As(Ⅲ) simulated using
Langmuir formula

1—Im-CNT; 2—tBu-CNT; 3—Nme-CNT; 4—Nmb-CNT
图6 As(Ⅴ)的Langmuir公式拟合等温曲线图
Fig.6 Isothermal graph of As(Ⅴ) simulated using
Langmuir formula

1—tBu-CNT; 2—Im-CNT; 3—Nme-CNT; 4—Nmb-CNT
图7 As(Ⅲ)的Freudlich公式拟合等温曲线图
Fig.7 Isothermal graph of As(Ⅲ) simulated using
Freudlich formula
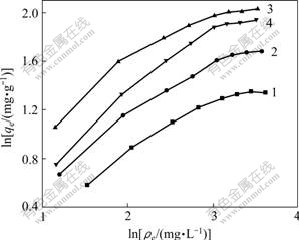
1—Im-CNT; 2—tBu-CNT; 3—Nme-CNT; 4—Nmb-CNT
图8 As(Ⅴ)的Freudlich公式拟合等温曲线图
Fig.8 Isothermal graph of As(Ⅴ) simulated using
Freudlich formula
表1 吸附材料吸附As(Ⅲ)和As(Ⅴ)的
Langmuir等温吸附方程
Table 1 Langmuir isothermal adsorption formula of
As(Ⅲ) and As(Ⅴ)

吸附实验结果表明:As(Ⅲ)和As(Ⅴ)主要是以配位形式、单分子层状态吸附于离子液体负载型碳纳米管上,吸附行为与Langmuir吸附十分吻合。Langmuir理论认为:固体表面是由大量的吸附活性中心点构成,吸附只在这些活性中心点发生,每个活性中心只能吸附1个物质分子,当表面吸附活性中心全部被占满时,吸附量达到饱和值,在吸附剂表面上分布被吸附物质的单分子层。根据Langmuir理论,在离子液体负载型碳纳米管吸附材料中,离子液体中的配位原子充当了碳纳米管表面的活性中心点,当As(Ⅲ)和As(Ⅴ)占据了这些活性点以后,吸附剂失去了吸附作用,表现为吸附达到饱和。
2.4 动态吸附性能
采用动态法研究所制备的4种吸附材料对As(Ⅲ)和As(Ⅴ)的去除情况,动态吸附曲线如图9和图10所示。
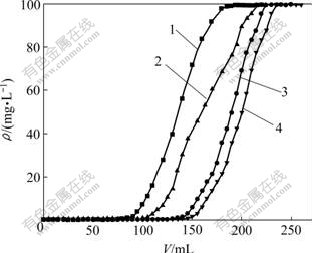
1—Im-CNT; 2—tBu-CNT; 3—Nme-CNT; 4—Nmb-CNT
图9 4种吸附材料对As(Ⅲ)的动态吸附曲线
Fig.9 Dynamic adsorption graph of As(Ⅲ)
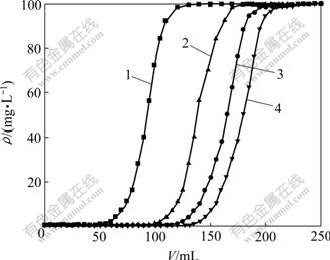
1—Im-CNT; 2—tBu-CNT; 3—Nme-CNT; 4—Nmb-CNT
图10 4种吸附材料对As(Ⅴ)的动态吸附曲线
Fig.10 Dynamic adsorption graph of As(Ⅴ)
根据贯穿吸附柱所需含砷溶液体积、流出液浓度与初始浓度相同时的流出液体积,可计算各吸附材料对As(Ⅲ)和As(Ⅴ)的贯穿吸附容量及动态饱和吸附容量。Im-CNT,tBu-CNT,Nme-CNT和Nmb-CNT对As(Ⅲ)的穿透点分别为80,100,130和145 mL;贯穿吸附容量分别为4.060,5.060,6.587和7.061 mg/g;动态饱和吸附容量分别为8.773,9.874,13.328和14.271 mg/g。Im-CNT,tBu-CNT,Nme-CNT和Nmb-CNT对As(Ⅴ)的穿透点分别为55,100,120和120 mL;贯穿吸附容量分别为3.052,5.060,6.358和6.358 mg/g;动态饱和吸附容量分别为6.145,9.184,11.823和12.175 mg/g。从图9可以看出:4种材料对As(Ⅲ) 的动态去除效果优于对As(Ⅴ)的去除效果。负载冠醚型离子液体的吸附材料对砷的贯穿吸附容量和动态饱和吸附容量均高于负载咪唑型离子液体的吸附材料的饱和吸附容量,说明冠醚结构对砷具有良好的配合行为。动态吸附的饱和吸附容量也比静态吸附时的饱和吸附容量有了一定的提高。因为动态吸附时体系的平衡浓度始终为溶液的初始浓度,此浓度比静态吸附时的平衡浓度要高很多,吸附材料可以较多地吸附砷酸根离子。
3 结论
(1) 采用静态吸附方法,研究了离子液体负载型碳纳米管吸附材料Nmb-CNT,Nme-CNT,tBu-CNT和Im-CNT对As(Ⅲ)和As(Ⅴ)的吸附性能。吸附动力学和等温吸附结果表明,负载氮氧杂冠醚型离子液体的吸附材料对砷的去除效果优于常规的咪唑型离子液体的去除效果,冠醚结构中取代烷基链的长度对砷的去除也有一定的影响;吸附材料对As(Ⅲ)和As(Ⅴ)具有较强的吸附作用,吸附属于单分子层的化学吸附,吸附行为符合Langmiur吸附。
(2) 吸附材料对As(Ⅲ)和As(Ⅴ)具有较强的吸附作用,且动态吸附时的吸附容量要高于静态吸附时的吸附容量,对As(Ⅲ)的动态吸附效果优于对As(Ⅴ)的动态吸附效果。
(3) 制备的离子液体负载型碳纳米管吸附材料对砷具有良好的去除效果,但其对砷的吸附去除机理和吸附材料的表面情况、吸附条件的选择等尚有待进一步研究。
参考文献:
[1] 陈云嫩, 柴立元, 舒余德. 骨炭去除水中砷(Ⅴ)的试验研究[J]. 中南大学学报: 自然科学版, 2008, 39(2): 279-283.
CHEN Yun-nen, CHAI Li-yuan, SHU Yu-de. Arsenic(Ⅴ) removal from drinking water by bone char[J]. Journal of Central South University: Science and Technology, 2008, 39(2): 279-283.
[2] US Environmental Protection Agency. EPA report on the expert panel on arsenic carcinogenicity: review and workshop[M]. Washington DC: US Environmental Protection Agency, 1997.
[3] GB 5749—2006, 生活饮用水卫生标准[S].
GB 5749—2006, Standards for drinking water quality[S].
[4] Iberhan L, Wisniewski M. Extraction of arsenic(Ⅲ) and arsenic(Ⅴ) with cyanex 925, cyanex 301 and their mixtures[J]. Hydrometallurgy, 2002, 63(1): 23-30.
[5] ZHAO You-cai, CHEN Jia-yong. Extraction of phosphorus, arsenic and/or sillica from sodium tungstate and molybdate solutions with primary amine and tributyl phosphate as solvent[J]. Hydrometallurgy, 1996, 42(3): 325-335.
[6] 李汝雄. 绿色溶剂—离子液体的合成与应用[M]. 北京: 化学工业出版社, 2005.
LI Ru-xiong. Green solvents-synthetic and application of ionic liquids[M]. Beijing: Chemical Industry Press, 2005.
[7] Wei G T, Yang Z, Chen C J. Room temperature ionic liquids as a novel medium for liquid/liquid extraction of metal ions[J]. Analytica Chimica Acta, 2003, 488(2): 183-192.
[8] Huddleston J G, Rogers R D. Room temperature ionic liquids as novel media for ‘clean’ liquid-liquidextraction[J]. Chem Commun, 1998(16): 1765-1776.
[9] 刘业翔. 有色金属冶金基础研究的现状及对今后的建议[J]. 中国有色金属学报, 2004, 14(1): 21-24.
LIU Ye-xiang. Current status and future proposals of fundamental research in nonferrous metallurgy[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(1): 21-24.
[10] Yasuhiro I, Daisuke S, Hiroyuki M, et al. Design and synthesis of novel imidazolium-based ionic liquids with a pseudo crown-ether moiety: diastereomeric interaction of a racemic ionic liquid with enantiopure europium complexes[J]. Tetrahedron Letters, 2004, 45(51): 9455-9459.
[11] Visser A E, Swatloski R P, Reichert W M, et al. Task-specific ionic liquids for the extraction of metal ions from aqueous solutions[J]. Chem Commun, 2001(1): 135-136.
[12] 彭长宏, 阳卫军, 唐谟堂, 等. 壳聚糖冠醚合成及结构表征[J]. 高分子材料科学与工程, 2003, 19(2): 93-96.
PENG Chang-hong, YANG Wei-jun, TANG Mo-tang, et al. Synthesis and structure characterization of chitosan-crown ethers[J]. Polymer Materials Science and Engineering, 2003, 19(2): 93-96.
[13] 汪玉庭, 谭淑英, 彭长宏, 等. 端烯丙基苯并15-冠-5接枝壳聚糖对金属离子的吸附性能[J]. 环境科学, 1999, 20(4): 55-58.
WANG Yu-ting, TAN Shu-ying, PENG Chang-hong, et al. Study on the adsorption properties for metal ions of chitosan modified by 3-allyl benzo 15-crown-5 and 4-allyl benzo 15-crown-5[J]. Environmental Science, 1999, 20(4): 55-58.
[14] Martiz B, Keyrouz R, Gmouh S, et al. Superoxide-stable ionic liquids: new and efficient media for electrosynthesis of functional siloxanes[J]. Chem Commun, 2004(6): 674-675.
[15] LI Mei-chao, MA Chun-an, LIU Bao-you, et al. A novel electrolyte 1-ethylimidazolium triuoroacetate used for electropoly-merization of aniline[J]. Electrochemistry Communications, 2005, 7(2): 209-212.
[16] Maeda H, Furuyoshi S, Nakatsuji Y, et al. Synthesis of monoaza crown ether from N,N-di[oligo(oxyalkylene)] amines and oligoethylene glycol di(p-toluenesulfonates) or corresponding dichlorides[J]. Bull Chem Soc Jap, 1983, 56(1): 212-218.
[17] Maeda H, Nakatsuji Y, Okahara M. Facile synthesis of monoaza crown ether[J]. Chem Soc Chem Commun, 1981(10): 471-472.
[18] 王开毅, 成本诚, 舒万银. 溶剂萃取化学[M]. 长沙: 中南工业大学出版社, 1991.
WANG Kai-yi, CHENG Ben-cheng, SHU Wan-yin. Solvent extraction chemistry[M]. Changsha: Central South University of Technology Press, 1991.
[19] Hiraoka M. Crown compounds: their characteristics and applications[M]. Amsterdam: Elsevier, 1982.
[20] Dai S, Ju Y H, Barnes C E. Solvent extraction of strontium nitrate by a crown ether using room-temperature ionic liquids[J]. Journal of Chem Soc Dalton Trans, 1999(8): 1201-1202.
收稿日期:2009-02-16;修回日期:2009-06-25
基金项目:国家自然科学基金资助项目(20977113,20677079)
通信作者:彭长宏(1966-),男,湖南长沙人,教授,从事磁性材料及功能性离子液体合成与应用;电话:0731-88836940;E-mail: peng9103@163.com


