壳聚糖没食子酸新型抑藻剂的制备及其对淡水微藻生长的影响
刘杨1, 2,郭沛涌1, 2,鲁贝贝1, 2,黄伟1, 2,万禁禁1, 2
(1. 华侨大学 化工学院,环境科学与工程系,福建 厦门,361021;
2. 华侨大学 环境与资源技术研究所,福建 厦门,361021)
摘 要:
究壳聚糖(CTS)吸附没食子酸(GA)的影响因素,分析得出壳聚糖对没食子酸的最佳吸附条件是:没食子酸溶液初始质量浓度为1 200 mg/L,20 mL没食子酸溶液中壳聚糖用量为0.02 g,震荡时间为60 min,温度为25 ℃。在此条件下制备出没食子酸与壳聚糖的吸附比为623 mg/g的抑藻剂,并研究其短期释放率。然后探讨该抑藻剂对水华微囊藻(Microcystis flos-aquae)和蛋白核小球藻(Chlorella pyrenoidosa)生长的影响。研究结果表明:这种新型抑藻剂对水华微囊藻存在显著的抑制作用:当抑藻剂质量浓度为30 mg/L时,抑制时间将达到15 d;当抑藻剂质量浓度为60,90和130 mg/L时,抑制时间将长达24 d,抑藻率高达99%。但是在15 d内,抑藻剂并未对蛋白核小球藻表现出明显的抑制作用,当抑藻剂质量浓度为60 mg/L时,抑藻率仅为5%。因此,壳聚糖载没食子酸新型抑藻剂可以有效控制水华藻类水华微囊藻的生长而对蛋白核小球藻的影响较弱。
关键词:
中图分类号:X524 文献标志码:A 文章编号:1672-7207(2014)07-2538-09
Effects of new algaecide chitosan-gallate on growth of Microcystis flos-aquae and Chlorella pyrenoidosa
LIU Yang1, 2, GUO Peiyong1, 2, LU Beibei1, 2, HUANG Wei1, 2, WAN Jinjin1, 2
(1. Department of Environmental Science and Engineering, College of Chemical Engineering,
Huaqiao University, Xiamen 361021, China;
2. Institute of Environmental and Resources Technology, Huaqiao University, Xiamen 361021, China)
Abstract: The factors of chitosan adsorbed gallic acid in orthogonal experiments were studied. The best adsorption condition was during shaking for 60 min at 25 ℃ with initial concentration of gallic acid of 1 200 mg/L and 0.02 g chitosan in 20 mL gallate acid. The adsorption ratio of chitosan to gallate algaecide of 623 mg/g was prepared under this condition and the short-term release rate of this algaecide as well as its effects on the growth of Microcystis flos-aquae and Chlorella pyrenoidosa were studied. The results show that the inhibitory effect on the growth of Microcystis flos-aquae can last up to 15 d when the algaecide mass concentration is 30 mg/L; when the algaecide mass concentration is 60, 90 and 130 mg/L, the inhibition time is even longer than 24 d with 99% inhibition rate. However, this algaecide does not show significant effects on Chlorella pyrenoidosa within 15 d. When the algaecide mass concentration is 60 mg/L, the inhibition is only 5%. Therefore, this algaecide can control the growth of Microcystis flos-aquae effectively, while it has weak influence on Chlorella pyrenoidosa.
Key words: algaecide; sustained-release; gallic acid; Microcystis flos-aquae; Chlorella pyrenoidosa
近年来,水体富营养化及其引发的水华问题日益严峻,水体的景观和生态功能受到严重影响[1]。在众多治理水华的研究中,利用化感作用抑制藻类的生长因其可生物降解性和生态安全性而日益受到重视。化感物质是化感作用的载体,酚酸类物质是活性较强的一类化感物质[2],其中水杨酸、没食子酸和儿茶酚普遍存在于多种植物的化感物质中,在较低浓度就有较强的化感作用,许多国外学者已经将其分离并且研究了它们对藻类和其他植物的抑制作用[3-4]。Kamaya等[5-7]的研究结果表明水杨酸对几种绿藻具有明显的抑制效果。Wang等[8]证明没食子酸等化感物质对铜绿微囊藻的生长有明显的抑制作用。但是,这些研究都是在模拟水体环境中直接投放酚酸类化感物质,容易造成局部浓度太高而对其他生物造成严重影响,并且抑藻的有效时间也较短。因此,利用具有缓释功能的抑藻剂来控制水华藻类生长,可能成为治理水华更有效的方法。壳聚糖(Chitosan)是自然界唯一的碱性多糖,并且是一类资源丰富、可生物降解的天然聚合物[9]。梁想等[10]利用甲壳素、壳聚糖等生物载体吸附水溶液中铜离子后对赤潮生物的杀灭和控制作用,避免了直接投加硫酸铜产生的局部浓度高而伤害鱼类的缺点。陈玉成等[11]以壳聚糖作载体合成缓释性的壳聚糖载铜灭藻剂,能有效控制蛋白核小球藻的生长,且随着灭藻剂用量增加,灭藻率增大。同时,壳聚糖作为吸附剂,对于水中重金属和砷等有害物质的去除以及净化水质也有了较多的研究[12-14]。综上所述,酚酸类化感物质作为抑制剂在抑藻作用机理方面已经有了一定研究,但是还存在抑藻物质浓度分部不均和持续时间不足的问题,而以壳聚糖吸附化感物质制备的抑藻剂还未见报道。因此,本文作者以壳聚糖对3种化感物质水杨酸、儿茶酚和没食子酸的吸附能力研究为切入点,筛选出吸附质量比和吸附率较高的组合,制备经济高效的抑藻剂。利用抑藻剂对水华微囊藻进行长期的抑制实验,并以蛋白核小球藻作为对比,从而为高效、安全的控制藻类生长繁殖,防止和治理水华爆发提供可靠的科学依据。
1 材料与方法
1.1 实验材料
水华微囊藻(Microcystis flos-aquae)(FACHB-1028)为水华藻种并且释放藻毒素,蛋白核小球藻(Chlorella pyrenoidosa)(FACHB-9)为蛋白资源藻种,这2种藻均购自中国科学院武汉水生生物研究所淡水藻种库,并且分别使用指定培养基:BG11培养基和Bristol培养基进行培养。实验前将对数期的藻种接种到装有400 mL新配培养基的 1 L的锥形瓶中培养,待藻细胞密度达到对数生长期时分装到100 mL经过灭菌的空锥形瓶中,稳定1 d后进行后续实验。培养温度为 (25±1) ℃,光暗比为12 h:12 h,每天摇动3次,并随机调换位置,尽量使各瓶的光通量保持一致以减小偶然误差。
壳聚糖和儿茶酚(邻苯二酚)购自国药集团化学试剂有限公司,水杨酸购自广东汕头市西陇化工,没食子酸购自华迈科。壳聚糖脱乙酰度>80%,儿茶酚、水杨酸和没食子酸均为分析纯。
1.2 壳聚糖对3种酚酸类化感物质吸附能力研究
利用紫外分光光度计扫描水杨酸、儿茶酚和没食子酸3种酚酸的吸收光谱,检测出吸收峰,然后绘制浓度吸光度相关的标准曲线。取0.05 g壳聚糖分别加入20 mL初始浓度为100,200,300,400,500,600,800,1 000,1 200和1 500 mg/L的3种酚酸溶液中,然后在25 ℃水浴恒温振荡l h后滤后,在相应波长下测定其吸光度计算溶液中未被吸附的酚酸的浓度,并计算酚酸类物质和壳聚糖的吸附比和吸附率。吸附结果如下:壳聚糖对没食子酸的吸附率最高,没食子酸浓度为1 000 mg/L时,吸附率可以达到85.7%,对应吸附比为491 mg/g。壳聚糖对水杨酸和儿茶酚的最高吸附率分别为43.3%和14.5%,对应吸附比分别为138 mg/g和46 mg/g,吸附效果相对较差,所以选取没食子酸进行后续实验。
1.3 壳聚糖载没食子酸抑藻剂的制备
分别研究没食子酸溶液初始浓度、壳聚糖初始用量、吸附时间和温度等单因子条件下壳聚糖对没食子酸吸附效果的影响,以此为基础,设计正交试验,利用壳聚糖对没食子酸的吸附率和吸附比作为响应指标,进行因子重要性排序,并找出吸附比较高的最优组合。
1.4 抑藻剂对没食子酸解析能力分析
在最优条件下合成壳聚糖载没食子酸后,过滤并将沉淀在25 ℃下真空干燥24 h即制得抑藻剂。在100 mL蒸馏水的锥形瓶中分别加入抑藻剂,使其浓度为6,10,20,30,60,90和130 mg,在与藻类培养相同条件下,于0.2,1,3,10,24和48 h吸取上清液,过0.45 μm滤膜后测定吸光度,计算没食子酸含量,以研究壳聚糖载没食子酸抑藻剂用量对没食子酸释放的影响。
1.5 壳聚糖、没食子酸和抑藻剂对2种淡水微藻生长的影响
根据抑藻剂中壳聚糖与没食子酸的比例,设置m(壳聚糖):m(没食子酸):m(抑藻剂)为2:1:3。(1) 直接投加相应质量物质分别到100 mL处于对数期的水华微囊藻液中(叶绿素a含量为1 000 μg/L左右),设置最终质量浓度分别4,6,14,20,40,60和87 mg/L的壳聚糖处理组,2,3,7,10,20,30和43 mg/L的没食子酸处理组和6,10,20,30,60,90和130 mg/L的抑藻剂处理组,60 mg/L的没食子酸为相对抑藻剂抑制时间做的对照,空白对照组为ck,每组设置3个平行样,每隔1 d测量一次叶绿素a的含量。(2) 直接投加相应质量物质分别到100 mL处于对数期的蛋白核小球藻液中(叶绿素a含量为1 000 μg/L左右),设置最终质量浓度分别为4,6,14,20,30,40和60 mg/L的壳聚糖处理组,2,3,7,10,15,20,30和43 mg/L的没食子酸处理组和6,10,20,30,45,60,90和130 mg/L的抑藻剂处理组,空白对照组为ck,每组设置3个平行样,每隔2 d测量一次叶绿素a的含量,以抑制率为响应指标,观察抑藻剂用量随时间变化对灭藻效果的影响。
抑藻剂的药效期,一般考虑在加入15 d后藻细胞不再增长时,药效期为长;加入抑藻剂后15 d内藻细胞又开始增长时,则药效期较短[15]。持续观测15 d内抑制率的变化,确定抑藻剂长效抑藻的有效用量。
由于抑藻剂、壳聚糖在藻液中成为悬浮颗粒,无法通过吸光度来表征藻类的生长情况,并且传统血细胞计数板计数法存在人为误差较大,而叶绿素是藻类进行光合作用的条件之一,关乎藻类是否能够顺利通过光合作用积累有机物和生长繁殖。叶绿素a属于叶绿素的一种,其含量的高低可反映出藻细胞进行光合作用的速率以及藻类生长情况,并且蓝藻和绿藻中都存在叶绿素a,因此,可以通过测定叶绿素a含量来评价抑藻剂、没食子酸和壳聚糖对2种藻类的影响。叶绿素a含量采用浮游植物分析仪(Phyto-PAM Phytoplankton Analyzer,德国walz公司)进行测定,测定方法参见文献[16]。
1.6 数据处理
(1) 壳聚糖对没食子酸的吸附量公式如下
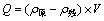 (1)
(1)
式中:Q为对没食子酸的吸附量(mg);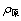 为初始没食子酸质量浓度(mg/L);
为初始没食子酸质量浓度(mg/L);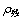 吸附后溶液中残余的没食子酸质量浓度(mg/L);V为没食子酸溶液体积(mL)。
吸附后溶液中残余的没食子酸质量浓度(mg/L);V为没食子酸溶液体积(mL)。
(2) 壳聚糖对没食子酸的吸附比公式如下:
 (2)
(2)
式中:P为壳聚糖对没食子酸的吸附比(mg/g);m为投加壳聚糖的质量(g)。
(3) 抑藻率的计算公式为:
 (3)
(3)
式中:I为抑制率;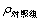 为对照组叶绿素含量(μg/L);
为对照组叶绿素含量(μg/L); 为处理组叶绿素含量(μg/L)。
为处理组叶绿素含量(μg/L)。
数据采用SPSS18.0软件包进行统计分析,利用Origin8.0进行作图。叶绿素a含量采用重复测量方差分析。
2 结果与分析
2.1 壳聚糖载没食子酸抑藻剂的制备
壳聚糖吸附没食子酸的单因子试验结果表明:当没食子酸浓度为变量时,吸附比随着没食子酸始浓度的升高而增加,增加速度先快速再趋于平缓,吸附率变化范围较大,并且在没食子酸质量浓度1 000 mg/L时达到最大值85.76%;当壳聚糖用量为变量时,吸附比变化较大,并随着壳聚糖用量的增加而逐渐降低,吸附率先快速上升,在0.06 g时取得最大值86.12%,而后缓慢降低到81.48%,这可能是由于壳聚糖过多,震荡力不足而使壳聚糖在溶液中相互影响而造成的;当吸附温度为变量时,吸附量随着温度的升高而降低,最佳吸附温度为25 ℃;当吸附时间为变量时,吸附量随着时间延长而增加,前30 min增长速率快,而后增速减缓。
正交试验结果如表1所示,在本实验范围内,以吸附比和吸附率为响应指标,首先考虑吸附比较大的组合3和4,再考虑到组合3的吸附率很低只有25.24%,而组合4的吸附率较高,为51.94%,因此选择组合4为最佳吸附组合。壳聚糖吸附没食子酸的最优条件为:20 mL没食子酸溶液中壳聚糖用量是0.02 g,温度为25 ℃,吸附时间为60 min,没食子酸初始质量浓度为1 200 mg/L,在该条件下可获得623.095 mg/g的吸附比。
吸附后滤液的循环使用:根据最佳吸附条件制备的壳聚糖载没食子酸抑藻剂,其滤液中残余的没食子酸质量浓度为659.6 mg/L,此时滤液体积约为100 mL,再向滤液中溶解54.04 mg的没食子酸可使溶液质量浓度达到1 200 mg/L,则可作为抑藻剂的原料,使滤液循环利用。但是没食子酸在水中溶解氧存在情况下,易自养化生成物质可能会对吸附造成影响。在扩大抑藻剂制备时,需要进一步实验论证滤液的重复使用次数。
表1 壳聚糖吸附没食子酸实验正交试验结果
Table 1 Orthogonal experimental results of adsorption capacity of Gallic acid by CTS

2.2 抑藻剂对没食子酸解析能力
不同抑藻剂的用量对没食子酸量释放后浓度的影响,如图1所示,抑藻剂质量浓度分别为6,10,20,30,60,90和130 mg/L时,在投加初期释放浓度上升趋势较快,释放率在24 h时达到最大值,分别为79.26%,90.80%,70.44%,84.34%,59.43%,48.46%和43.56%。随着抑藻剂投加质量增加,没食子酸释放浓度逐渐升高,释放率呈现整体降低的趋势,这说明溶液中溶解的没食子酸阻碍了抑藻剂中没食子酸的释放,当吸附与解析到达动态平衡时,没食子酸浓度稳定;当溶液中没食子酸自氧化之后,抑藻剂会释放一部分没食子酸,而达到新的平衡。此外,抑藻剂投加于水体之后,会浮于水面,释放时间足够其较均匀的分布,不会造成局部浓度过高。

图1 壳聚糖载没食子酸抑藻剂的用量对解吸的影响
Fig. 1 Effect of dosage of CTS-GA on desorption
2.3 壳聚糖、没食子酸和抑藻剂对水华微囊藻生长的影响
壳聚糖对水华微囊藻的影响如图2(a)和(b)所示。可见,处理组与对照组没有表现出显著差异(p>0.05)。壳聚糖呈粉末状态并且在培养过程中没有经过长时间的震荡培养,所以壳聚糖对藻类的絮凝作用表现不明显。不同质量壳聚糖的抑藻率在20%内波动,表现出较弱的抑制作用。这表明壳聚糖对藻类的生长影响不明显,藻类的生长对壳聚糖没有投加量的依赖性。
没食子酸对水华微囊藻的影响如图2(c)和(d)所示。可见,抑制率随没食子酸质量浓度的升高而升高。当没食子酸质量浓度为2,3和7 mg/L时,抑制作用相对较弱;当没食子酸质量浓度为10,20和30 mg/L时,抑制率随时间的延长而逐渐减弱,无法进行长效抑藻;当没食子酸质量浓度为43 mg/L时,2 d后抑藻率可达90%以上,持续到到观测的第16 d抑藻率仍能维持在接近100%,但是16 d之后,叶绿素a含量表现出上升趋势,说明没食子酸在该使用浓度下,于16 d后被消耗分解,浓度不足以抑制藻类生长而表现出藻类恢复生长的趋势;当没食子酸质量浓度为60 mg/L,抑制时间在略早于24 d时,藻类表现出恢复生长趋势,这说明高浓度的投加量仍不适合进行长期抑藻。
抑藻剂对水华微囊藻的抑制效果如图2(e)和(f)所示。可见,抑制效率随抑藻剂使用浓度的升高而升高。6 mg/L的抑藻剂处理组与对照组ck相比差异性不显著(p>0.05),其他浓度处理组能显著(p<0.05)抑制微囊藻的生长。当抑藻剂质量浓度为10和20 mg/L时,抑藻率先升高后降低,不能有效灭杀藻细胞;抑藻剂的质量浓度达到30 mg/L时,2 d后抑藻率可达90%以上,5 d后接近100%,持续到16 d抑藻率仍可达90%以上,但到了第24 d抑制率下降到80%以内,说明16 d后抑藻剂没食子酸释放殆尽,溶液中的没食子酸被分解消耗,无法继续进行藻类抑制;当抑藻剂质量浓度为60,90和130 mg/L时,3 d后抑藻率可达90%以上,5 d后可接近100%,到观测的第24 d,抑藻率仍能维持在接近100%,说明壳聚糖载没食子酸抑藻剂在该使用浓度下能在较长时间内达到较高的抑藻率。这是因为壳聚糖对没食子酸的吸附对没食子酸起到了保护的作用而防止了其同时发生自氧化而被进一步消耗。以上结果表明:抑藻剂质量浓度在30 mg/L以上时抑藻时间可持续15 d;当抑藻剂质量浓度在60 mg/L以上时抑制时间可长于24 d。

图2 CTS,GA和CTS-GA对水华微囊藻生长的影响
Fig. 2 Effects of CTS, Gallic acid and CTS-Gallic acid on growth of Microcystis flos-aquae
2.4 壳聚糖、没食子酸和抑藻剂对蛋白核小球藻生长的影响
壳聚糖对蛋白核小球藻的影响如图3(a)所示,壳聚糖对蛋白核小球藻的生长影响不显著(p>0.05),未因絮凝作用而降低小球藻的总叶绿素a含量,所投加浓度梯度壳聚糖对小球藻的影响没有表现出抑制的变化趋势,说明小球藻的生长对壳聚糖的投加量没有依赖性。没食子酸对蛋白核小球藻的影响如图3(b)所示,没食子酸在低浓度的投加量下没有表现出显著的(p>0.05)抑制作用,当没食子酸质量浓度为43 mg/L时,前3 d并未表现出明显的抑制,但是随着没食子酸的自氧化,大量抑藻物质生成,抑制率在随后几天表现出增加的趋势,在9 d达到最高值为14%,但是抑藻物质随后又被消耗,在13 d和15 d时抑制率分别下降到12%和11%。这表明在相对于可以强烈抑制水华微囊藻生长的没食子酸浓度对蛋白核小球藻的抑制作用不明显。抑藻剂对蛋白核小球藻的影响如图3(c)所示。由图3可见:抑藻剂处理组与对照组没有显著性差异(p>0.05),当抑藻剂质量浓度为60,90和130 mg/L时对蛋白核小球藻的抑制率在5%以内,而这3个浓度却可以显著抑制水华微囊藻的生长,说明抑藻剂的释放没食子酸形成的浓度不足以抑制蛋白核小球藻的生长,对蛋白核小球藻表现出生态安全性。

图3 CTS,GA和CTS-GA对蛋白核小球藻生长的影响
Fig. 3 Effects of CTS, Gallic acid and CTS-Gallic acidon growth of Chlorella pyrenoidosa
2.5 按投加比例分组比较对水华微囊藻生长的影响
按照不同梯度抑藻剂中相应所含壳聚糖和没食子酸的量分别作图进行比较,如图4所示。图4中ck代表对照空白,y代表抑藻剂,k代表壳聚糖,m代表没食子酸。由图4(a)可见:抑藻剂的释放没食子酸速率较慢,抑制率比直接在藻液中投加没食子酸要低,其释放量不足以明显抑制藻类的生长;由图4(b)可见:抑藻剂较直接投加没食子酸表现出较好的抑制效率,但是投加初期,直接投加没食子酸使其同时被消耗分解,所以后期抑制率降低。而抑藻剂呈现缓慢释放,可以较长时间抑制藻类的生长,但是由于投加量较低,释放量不足以明显抑藻;由图4(c)可见:没食子酸加入初期表现出较好的抑制效果,但是之后与图4(b)所示的趋势相同,表明此浓度下的没食子酸不能完全抑制藻类生长。而抑藻剂表现出持续的抑藻效果,但是释放速度较慢释放量还是不足以完全抑制藻类生长;由图4(d)可见:没食子酸加入初期表现出较好的抑制效果,但是到了第10 d后,随着没食子酸的消耗,抑制率降低,表明没食子酸不能持续抑制藻类生长。而抑藻剂对藻类产生很强的抑制效果,12 d内几乎将叶绿素质量浓度维持在200 μg/L以内,但是16 d之后随着抑藻剂释放以及消耗,藻类又呈现增长趋势;图4(e)和(f)所示没食子酸的抑藻效果与图4(d)所示的相似,初期有较好的抑藻效果,分别在第5 d和第10 d之后抑制率变低,藻类恢复增长。而抑藻剂都表现出持续的抑藻效果,在24 d内将叶绿素a的质量浓度维持在25 μg/L内,曲线呈平缓的趋势,抑藻剂的抑制时间可长于24 d。
3 讨论
3.1 抑藻剂中壳聚糖对没食子酸的制备以及解析
壳聚糖未经溶解和改性便可用于没食子酸的吸附,并且具有较高的吸附量和吸附效率,简化了抑藻剂的制备过程,而且吸附过程在常温等简单条件下就可以进行。抑藻剂在室温25 ℃下,贮存期为1.5~2 a[17],这对抑藻剂的大量生产以及使用期限提供了保障。
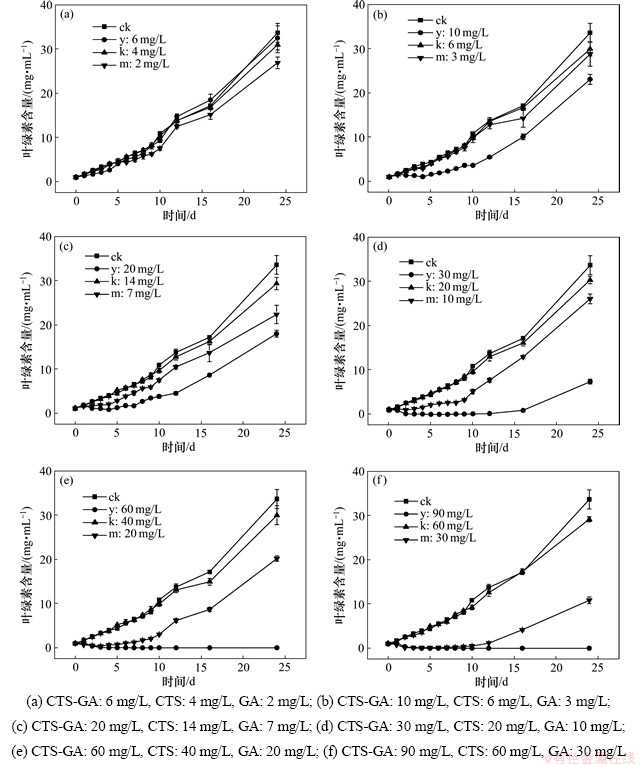
图4 CTS-GA以及GA和CTS对水华微囊藻叶绿素a含量的影响
Fig. 4 Effects of CTS-GA, GA and CTS on Chlorophyll a content of Microcystis flos-aquae
抑藻剂制备实验结果表明:壳聚糖对没食子酸的吸附容量很大,吸附量随着没食子酸浓度的升高而升高。这说明,一定量壳聚糖对没食子酸的吸附量依赖于溶液没食子酸的浓度,当壳聚糖吸附到没食子酸上的速度等于没食子酸从壳聚糖上解析下来的速度时,壳聚糖对没食子酸的吸附达到平衡,此时过滤便可得到相应吸附量的抑藻剂。这说明壳聚糖对没食子酸的吸附是一个自发的过程。壳聚糖分子中存在大量孔隙可以直接吸附没食子酸,并且这种吸附容易释放,所以在释放实验中24 h便可达到较高的浓度,足以抑制藻类的生长;壳聚糖分子中的大量羟基和氨基也可以与没食子酸生成化学键,这种吸附不容易释放[18],所以抑藻剂可以缓慢释放没食子酸进行长期抑藻。没食子酸与壳聚糖的结合部位在没食子酸的羧酸基与壳聚糖的氨基之间形成的酰胺键或与羟基之间形成的酯 键[19]。抑藻实验结果显示,壳聚糖对没食子酸的吸附起到保护作用而防止其发生自氧化而同时被降解消耗,从而达到了长期抑藻的效果,解决了直接投加没食子酸而造成的抑制时间不足的问题。
3.2 抑藻剂所释放出的没食子酸的抑藻机理
本实验研究了抑藻剂对水华微囊藻和蛋白核小球藻的抑制作用。研究发现:抑藻剂对水华微囊藻具有一定的抑制效应,且随着浓度的增加抑制效果越明显。抑藻剂释放没食子酸到培养基后,可能被藻细胞产生的抗性物质降解,或作为碳源被藻细胞吸收代谢。随着培养时间的延长,其在培养基中的浓度势必会逐渐下降,当降低到一定浓度时则不能有效抑制藻细胞生长,致使抑制率下降[20-21]。化合物结构研究显示没食子酸的细胞毒作用不是酚类化合物所共有的,而是依赖于没食子酸结构上特有的特征:3个相邻的酚羟基是主要的活性基团[22]。因此,没食子酸具有较强抑制作用,且效果快,通过进一步的室外实验和生态安全评价,可望开发成长效的抑藻剂。
还有研究表明:没食子酸的酚羟基,在过渡金属离子如Cu2+和Fe3+存在时,自氧化可能是其化感作用的主要机制,且在一定的浓度下,氧化产物的抑制作用大于它本身对藻类的抑制作用[23]。进一步研究表明:在过渡金属离子存在时,酚酸自氧化可诱导产生H2O2和醌,H2O2可进一步造成细胞脂质过氧化[24];醌则作为潜在的过氧化物,可通过氧化还原循环产生ROS,进而危害细胞的生长[25]。酚酸的自氧化与其苯环上羟基的位置和数量有关。本实验采用的Bristol和BG11培养基中含有一定量的Cu2+和Fe3+,在自然水体中一般也含有Cu2+和Fe3+,因而满足酚酸自氧化的条件。加入抑藻剂或没食子酸之后,随着时间的推移,低浓度溶液中的没食子酸逐渐自氧化,产生的醌类氧化产物对水华微囊藻具有更强的抑制作用。最后,氧化产物被消耗,浓度不足以对藻类产生抑制作用,导致其抑制率降低。
3.3 抑藻剂对2种藻生长的影响
水华微囊藻属于蓝藻为原核生物,其细胞壁主要成分肽聚糖,并且无叶绿体。蛋白核小球藻属于绿藻为真核生物,其细胞壁坚韧主要成分为纤维素,并且有叶绿体。本文中,高浓度没食子酸对水华微囊藻的抑制率在95%以上,而对蛋白核小球藻的抑制率却不足10%,正是由于蓝藻绿藻细胞结构上的不同所造成的影响效果差异。Zhu等[26]研究了没食子酸对蓝藻铜绿微囊藻和绿藻羊角月牙藻的影响,其结果表明24 h后2.65 mg/L的没食子酸造成铜绿微囊藻光系统II和整个电子传递链活动的显着减少,分别为70.95%和40.77%(P<0.05),但是对羊角月牙藻没有抑制效果。这与本文的实验结果一致,表明了蓝藻中光系统Ⅱ是酚酸类化感物质的一个攻击位点。同时,没食子酸能有效抑制塔玛亚历山大藻的生长,破坏藻细胞膜结构,抑制藻细胞的正常分裂活动[27]。塔玛亚历山大藻属于甲藻,有学者认为它是介于原核生物与真核生物之间的间核生物。这表明没食子酸对不同细胞结构藻类的化感作用机理需要进一步研究。
4 结论
(1) 壳聚糖对没食子酸的吸附受到没食子酸初始浓度、壳聚糖用量、温度以及吸附时间等因素的影响,壳聚糖吸附没食子酸的最优条件为20 mL的没食子酸溶液中壳聚糖用量为0.02 g,温度为25 ℃,吸附时间为60 min,没食子酸初始质量浓度为1 200 mg/L。
(2) 抑藻剂其解吸状况受抑藻剂的用量和解析时间的影响,表现出了缓释效果,并且壳聚糖对没食子酸起到保护的作用而防止其降解,延长了等量的没食子酸的使用时间。
(3) 抑藻剂对于水华微囊藻的有效用量在30 mg/L以上,当用量在60 mg/L以上时抑制时间可长于24 d,属于长效灭藻剂。在实验浓度范围内,抑藻剂对于蛋白核小球藻没有表现出明显抑制效果,表现出对真核藻类的生态安全性。
参考文献:
[1] Klemas V. Remote sensing of algal blooms: An overview with case studies[J]. Journal of Coastal Research, 2012, 28(1A): 34-43.
[2] LI Zhaohui, WANG Qiang, RUAN Xiao, et al. Phenolics and plant allelopathy[J]. Molecules, 2010, 15(12): 8933-8952.
[3] John J, Sarada S. Role of phenolics in allelopathic interactions[J]. Allelopathy Journal, 2012, 29(2): 215-229.
[4] Mitrovic M, Jaric S, Djurdjevic L, et al. Allelopathic and Environmental implications of plant phenolic compounds[J]. Allelopathy Journal, 2012, 29(2): 177-197.
[5] Kamaya Y, Tsuboi S, Takada T, et al. Growth stimulation and inhibition effects of 4-hydroxybenzoic acid and some related compounds on the freshwater green alga Pseudokirchneriella subcapitata[J]. Archives of Environmental Contamination and Toxicology, 2006, 51(4): 537-541.
[6] Kovacik J, Klejdus B, Hedbavny J, et al. Effect of copper and salicylic acid on phenolic metabolites and free amino acids in Scenedesmus quadricauda(Chlorophyceae)[J]. Plant Science, 2010, 178(3): 307-311.
[7] Raman V, Ravi S. Effect of salicylic acid and methyl jasmonate on antioxidant systems of Haematococcus pluvialis[J]. Acta Physiologiae Plantarum, 2011, 33(3): 1043-1049.
[8] WANG Hongqiang, WU Zhengbin, ZHANG Shenghua. Relationship between the allelopathic activity and molecular structure of hydroxyl derivatives of benzoic acid and their effects on cyanobacterium Microcystis aeruginosa[J]. Allelopathy Journal, 2008, 22(1): 205-211.
[9] Pillai C K S, Paul W, Sharma C P. Chitin and chitosan polymers: Chemistry, solubility and fiber formation[J]. Progress In Polymer Science, 2009, 34(7): 641-678.
[10] 梁想, 尹平河, 赵玲, 等. 生物载体除藻剂去除海洋赤潮藻[J]. 中国环境科学, 2001, 121(1): 15-17.
LIANG Xiang, YIN Pinghe, ZHAO Ling, et al. Removing red tide algea in the sea by biomass carrier as algaecide[J]. China Environmental Science, 2001, 121(1): 15-17.
[11] 陈玉成, 杨志敏, 李洪亮. 壳聚糖载铜灭藻剂对Chlorella pyrenoidosa的去除[J]. 环境科学学报, 2011, 31(8): 1653-1659.
CHEN Yucheng, YANG Zhimin, LI Hongliang. Removal of chlorella pyrenoidosa by copper-chitosan algaecide[J]. Acta Scientiae Circumstantiae, 2011, 31(8): 1653-1659.
[12] Gerente C, Lee V K C, Le C P, et al. Application of chitosan for the removal of metals from wastewaters by adsorption: Mechanisms and models review[J]. Critical Reviews in Environmental Science and Technology, 2007, 37(1): 41-127.
[13] Ngah W S W, Teong L C, Hanafiah M A K M. Adsorption of dyes and heavy metal ions by chitosan composites: A review[J]. Carbohydrate Polymers, 2011, 83(4): 1446-1456.
[14] Ludovico P, Massimiliano F. Use of chitosan and chitosan- derivatives to remove arsenic from aqueous solutions[J]. Carbohydrate Research, 2012, 356: 86-92.
[15] 李星, 赵亮, 杨艳玲. 锰铜复合除藻剂灭活铜绿微囊藻效能研究[J]. 北京理工大学学报, 2009, 29(10): 910-913.
LI Xing, ZHAO Liang, YANG Yanling. A study on the inactivation of Microcystis Aeruginosa by manganese-copper composite algaecide[J]. Transactions of Beijing Institute of Technology, 2009, 29(10): 910-913.
[16] WANG Zhicong, LI Dunhai, QIN Hongjie, et al. An integrated method for removal of harmful cyanobacterial blooms in eutrophic lakes[J]. Environmental Pollution, 2012, 160(1): 34-41.
[17] 郭满满, 肖卓炳, 彭密军, 等. 没食子酸的热稳定性研究[J]. 林产化学与工业, 2012, 32(4): 58-62.
GUO Manman, XIAO Zhuobing, PENG Mijun, et al. Thermal stability of gallic acid[J]. Chemistry and Industry of Forest Products, 2012, 32(4): 58-62.
[18] Cigdem Y, Gokce S K, Yesim A, et al. Gallic acid-loaded chitosan nanoparticles: A preliminary study[J]. European Biotechnology Congress, 2011, 22(1): 127-133.
[19] Wanvimol P, Garry R B, Suwabun C. Chitosan gallate as a novel potential polysaccharide antioxidant: An EPR study[J]. Carbohydrate Research, 2010, 345(1): 132-140.
[20] Poulson K L, Sieg R D, Prince E K, et al. Allelopathic compounds of a red tide dinoflagellate have species-specific and context-dependent impacts on phytoplankton[J]. Marine Ecology Progress Series, 2010, 416: 69-78.
[21] JIANG Dan, HUANG Lingfeng, LIN Shiquan, et al. Allelopathic effects of euhalophyte Salicornia bigelovii on marine alga Skeletonema costatum[J]. Allelopathy, 2010, 25(1): 163-172.
[22] Inoue M, Suzuki R, Sakaguchi N, et al. Selective induction of cell death in cancer cells by gallic acid[J]. Biological and Pharmaceutical Bulletin, 1995, 18(11): 1526-1530.
[23] Nakai S, Inoue Y, Hosomi M, et al. Myriophyllum spicatum- released allelopathic polyphenols inhibiting growth of blue-green algae Microcystis aeruginosa[J]. Water Research, 2000, 34(11): 3026-3032.
[24] Ayako F, Shinkji O, Mariko M, et al. (-)-Epigallocatechin gallate causes oxidative damage to isolated and cellular DNA[J]. Biochemical Phamacology, 2003, 66(9): 1769-1778.
[25] Wolf B, Christa M, Kurt S. Electron paramagnetic resonance studies of radical species of proanthocyanidins and gallate esters[J]. Archives of Biochemistry and Biophysics, 2000, 374(2): 347-355.
[26] ZHU Junying, LIU Biyun, WANG Jing, et al. Study on the mechanism of allelopathic influence on cyanobacteria and chlorophytes by submerged macrophyte (Myriophyllum spicatum) and its secretion[J]. Aquatic Toxicology, 2010, 98(2): 196-203.
[27] 杨维东, 张信连, 刘洁生. 酚酸类化感物质对塔玛亚历山大藻生长的影响[J]. 中国环境科学, 2005, 25(4): 417-419.
YANG Weidong, ZHANG Xinlian, LIU Jiesheng. The influence of allelochemicalo on the growth of Alexandrium tamarense[J]. China Environmental Science, 2005, 25(4): 417-419.
(编辑 杨幼平)
收稿日期:2013-07-01;修回日期:2014-03-14
基金项目:国家自然科学基金资助项目(20777021);教育部科学技术研究重点项目(210253);福建省自然科学基金资助项目(2010J01043, D0610012)
通信作者:郭沛涌(1969-),男,河北石家庄人,博士,教授,从事水污染防治及生物资源利用研究;电话:18005020185;E-mail: guopeiyong@sina.com
摘要:采用正交试验研究壳聚糖(CTS)吸附没食子酸(GA)的影响因素,分析得出壳聚糖对没食子酸的最佳吸附条件是:没食子酸溶液初始质量浓度为1 200 mg/L,20 mL没食子酸溶液中壳聚糖用量为0.02 g,震荡时间为60 min,温度为25 ℃。在此条件下制备出没食子酸与壳聚糖的吸附比为623 mg/g的抑藻剂,并研究其短期释放率。然后探讨该抑藻剂对水华微囊藻(Microcystis flos-aquae)和蛋白核小球藻(Chlorella pyrenoidosa)生长的影响。研究结果表明:这种新型抑藻剂对水华微囊藻存在显著的抑制作用:当抑藻剂质量浓度为30 mg/L时,抑制时间将达到15 d;当抑藻剂质量浓度为60,90和130 mg/L时,抑制时间将长达24 d,抑藻率高达99%。但是在15 d内,抑藻剂并未对蛋白核小球藻表现出明显的抑制作用,当抑藻剂质量浓度为60 mg/L时,抑藻率仅为5%。因此,壳聚糖载没食子酸新型抑藻剂可以有效控制水华藻类水华微囊藻的生长而对蛋白核小球藻的影响较弱。
[10] 梁想, 尹平河, 赵玲, 等. 生物载体除藻剂去除海洋赤潮藻[J]. 中国环境科学, 2001, 121(1): 15-17.
[11] 陈玉成, 杨志敏, 李洪亮. 壳聚糖载铜灭藻剂对Chlorella pyrenoidosa的去除[J]. 环境科学学报, 2011, 31(8): 1653-1659.
[15] 李星, 赵亮, 杨艳玲. 锰铜复合除藻剂灭活铜绿微囊藻效能研究[J]. 北京理工大学学报, 2009, 29(10): 910-913.
[17] 郭满满, 肖卓炳, 彭密军, 等. 没食子酸的热稳定性研究[J]. 林产化学与工业, 2012, 32(4): 58-62.
[27] 杨维东, 张信连, 刘洁生. 酚酸类化感物质对塔玛亚历山大藻生长的影响[J]. 中国环境科学, 2005, 25(4): 417-419.


