文章编号:1004-0609(2012)08-2360-06
铜阳极泥处理过程中中和渣中碲的提取与制备
郑雅杰,乐红春,孙召明
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:
摘 要:采用硫酸浸出-二氧化硫还原方法从中和渣中制取单质碲。研究表明:采用硫酸浸出中和渣,当反应温度为30 ℃、反应时间为0.5 h、硫酸浓度为53.9 g/L、硫酸用量为理论用量的1.5倍时,碲浸出率为99.99%;采用亚硫酸钠还原酸浸液中碲时,碲(Ⅳ)发生水解生成二氧化碲;采用二氧化硫还原酸浸液中碲时,当反应温度为75 ℃、反应时间为2 h、盐酸浓度为3.2 mol/L、二氧化硫流量为0.4 L/min时,碲回收率达到99.84%。X射线衍射(XRD)分析表明二氧化硫还原得到的产物为单质碲,电感耦合等离子体发射光谱(ICP)分析表明,碲粉中碲含量为98.27%。扫描电子显微系统(SEM)分析表明,碲粉的形态为针形。
关键词:
中图分类号:TF843.5 文献标志码:A
Extraction and preparation of tellurium from neutralization sludge of process for treatment of anode slime
ZHENG Ya-jie, LE Hong-chun, SUN Zhao-ming
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The elemental tellurium was prepared from neutralization sludge by the method of sulfuric acid leaching and sulfur dioxide reduction. The results shows that, in the process of sulfuric acid leaching of neutralization sludge, the leaching rate of tellurium is 100% when the reaction temperature is 30 ℃, reaction time is 0.5 h, sulfuric acid concentration is 53.9 g/L, the dosage of sulfuric acid is 1.5 times of the theoretic addition. Te(Ⅳ) turns to tellurium dioxide when the acid leaching solution is reduced by sodium sulfite. The recovery ratio of tellurium is 99.84% by sulfur dioxide reduction when the reaction temperature is 75 ℃, reaction time is 2 h, hydrochloric acid concentration is 3.2 mol/L, sulfur dioxide flow rate is 0.4 L/min. X-ray diffractometry (XRD) analysis shows that the reduction product is in the forms of elemental tellurium. Inductively coupled plasma-atomic emission spectrometry (ICP) analysis shows that the content of tellurium in the product is 98.27%. Scanning electron microscopy (SEM) analysis shows that the form of powdered-tellurium is needle.
Key words: tellurium sludge; sulfuric acid leaching; SO2; tellurium
1782年,科学家发现了碲。在20世纪30年 代,随着碲在工业上的广泛应用,碲的生产才发展起来[1]。目前,碲用途广泛,有工业味精的美誉[2],把碲加入钢和铜中可以改善其机械加工性能和抗腐蚀性能,在铅里加入少量碲可显著提高其抗腐蚀性、抗磨性及机械强度[3]。在橡胶工业中碲的用量也很大,它可增加橡胶的可塑性,提高橡胶的抗热、抗氧化和耐磨性能[4]。高纯碲用于制造化合物半导体,如碲化镉[5]、碲化铝、碲化铋等[6]。在国防、航空航天、能源等高新领域有其重要的应用[7-8]。碲虽然用途巨大,但是资源稀缺,大部分的碲伴生在铜、铅、金、银的矿物中,在四川石棉县境内的大水沟发现了世界唯一的一处独立碲 矿[9]。铜电解精炼过程中产生的阳极泥是现今提取碲的主要原料,80%的碲从中提取[10-11]。目前,从阳极泥中回收碲的方法很多,有氧化焙烧-硫酸浸出、硫酸化焙烧-碱法浸出和氧化焙烧-碱浸法等[12-14]。由铜阳极泥回收铂钯后的中和渣提取碲,其中的碲含量较低,经硫酸浸出后,一般采用铜作为还原剂,将碲置换成碲化铜,进行富集回收[15]。根据反应物的电极电位,在催化剂存在的条件下,二氧化硫能还原硫酸浸出液中的碲。本文作者采用硫酸浸出和二氧化硫还原的工艺,以盐酸作为催化剂,从铜阳极泥中回收铂钯后的中和渣中提取制备碲粉。该工艺具有流程简单、碲回收率高、碲粉中杂质含量少等优点。
1 实验
1.1 实验步骤及工艺流程
搅拌下,在盛有硫酸溶液的三颈瓶中,加入中和渣(烘干中和渣成分见表1),加热到所需温度,反应一定时间后过滤。取滤液到三颈瓶中,起动搅拌,加入盐酸,通入二氧化硫,在一定温度下,反应一定时间后过滤,得到碲粉。
表1 烘干中和渣成分
Table 1 Compositions of drying neutralization sludge (mass fraction, %)

从铜阳极泥回收铂钯后的中和渣中提取与制备碲的工艺流程如图1所示。
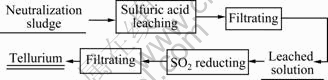
图1 从碲中和渣中提取与制备碲的工艺流程
Fig. 1 Technological flow sheet of extraction and preparation of tellurium from neutralization sludge containing tellurium
1.2 分析及检测
电感耦合等离子光谱仪(Intrepid II XSP)分析溶液中元素浓度,用X衍射(XRD)仪(日本理学,Cu Kα,50 kV,300 Ma)分析产物物相,用X荧光分析(XRF)仪(菲利浦24)分析产物成分,用扫描电子显微镜(SEM, FEI Quanta200)观察产物形貌。
2 结果与讨论
2.1 硫酸用量对碲浸出率的影响
锌粉回收铜阳极泥分金后液中的铂钯后,分铂钯后液经过氢氧化钠中和,得到含碲的中和渣,其中水含量71.5%(质量分数),其XRD谱如图2所示。
由表1可知,中和渣中主要元素的含量(质量分 数)如下,Te为11.24%,Na为18.70%,Zn为18.44%,Cu为9.06%,Cl为7.29%,S为5.11%。XRD实验结果(见图2)表明中和渣为无定型。
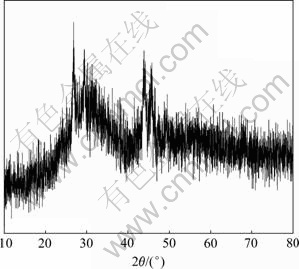
图2 中和渣的XRD谱
Fig. 2 XRD pattern of neutralization sludge
实验取150 g湿中和渣加入盛硫酸溶液的三颈瓶,起动搅拌,当硫酸溶液浓度为53.9 g/L,反应温度为30 ℃,反应时间为0.5 h,硫酸用量对碲浸出率的影响结果如图3所示(硫酸用量为硫酸物质的量与Te、Cu、Zn物质的量之和的比值)。
由图3可知,随着硫酸用量的增加,碲的浸出率增加。当硫酸用量从理论用量的0.82倍增加到1.73倍时,碲浸出率由79.66%增加到95.02%。在硫酸用量为1.5倍时,碲的浸出率为93.20%。因此,选择适宜的硫酸用量为理论用量的1.5倍。
搅拌下,取1.5 kg湿中和渣到容积为10 L三颈瓶中,在上述适宜的条件下,进行放大实验。过滤后酸浸液pH值为1.0,溶液成分如表2所列,硫酸浸出渣的XRD谱如图4所示。
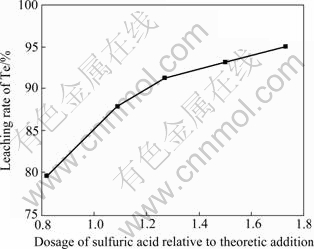
图3 硫酸用量对碲浸出率的影响
Fig.3 Effect of dosage of sulfuric acid on leaching rate of Te
表2 酸浸液成分
Table 2 Composition of acid leaching solution (g/L)

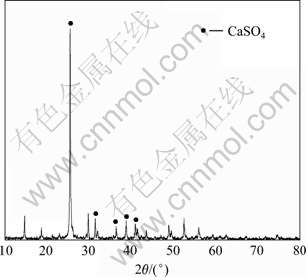
图4 硫酸浸出渣的XRD谱
Fig. 4 XRD pattern of sulfuric acid leaching residue
由表2可知,酸浸液中主要成分如下:Te为8.80 g/L,Cu为6.12 g/L,Zn为15.17 g/L,Na为9.26 g/L,根据计算碲浸出率可以达到99.99%。浸出渣的XRD实验结果(见图4)表明,浸出渣主要为CaSO4。
铜阳极泥经过回收铂钯后,用NaOH中和回收后液,Te、Cu、Zn以无定型氢氧化物形态存在,采用硫酸溶液浸出,发生以下反应。
Cu(OH)2+H2SO4=CuSO4+2H2O (1)
Zn(OH)2+H2SO4=ZnSO4+2H2O (2)
Te(OH)4+H2SO4=TeOSO4+3H2O (3)
2.2 Na2SO3和SO2还原时pH值对碲回收率和终点pH值的影响
孙召明和郑雅杰[16]的研究表明,在催化剂的作用下,SO2和Na2SO3均可有效地从含碲溶液中回收碲。
采用Na2SO3还原时,实验条件如下:硫酸浸出液300 mL,氯化钠用量为8.6 g,反应温度为75 ℃,反应时间为2 h,亚硫酸钠用量为理论用量的4倍。Na2SO3还原时,pH值对碲回收率和终点pH值的影响如图5所示,反应产物的XRD谱如图6所示。
由图5可知,碲回收率和终点pH值均随着pH值的增加而增加。在pH值为1.0时,碲的回收率为99.87%,终点pH值为5.1。由图6可知,产物中存在TeO2。
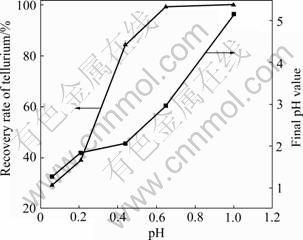
图5 Na2SO3还原pH值对碲回收率及终点pH值的影响
Fig. 5 Effect of pH value on recovery rate of Te and final pH value by Na2SO3
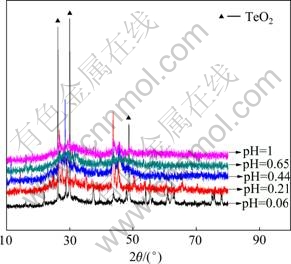
图6 Na2SO3还原产物的XRD谱
Fig. 6 XRD patterns of product by Na2SO3
采用Na2SO3还原时,Na2SO3在酸性溶液中发生如下:
SO32-+H+![]() HSO3- (4)
HSO3- (4)
HSO3-+H+![]() H2SO3 (5)
H2SO3 (5)
H2SO3![]() H2O+SO2↑ (6)
H2O+SO2↑ (6)
HSO3-+H2O![]() SO42-+2e+3H+
SO42-+2e+3H+
φΘ(SO42-/HSO3-)=-0.93 V (7)
H2SO3+H2O![]() SO42-+2e+4H+
SO42-+2e+4H+
φΘ(SO42-/H2SO3)=-1.73 V (8)
由于SO32-与H+作用生成HSO3-和H2SO3,导致溶液pH值升高,在弱酸溶液中,S元素主要以HSO3-形态存在,由式(7)和(8)可知,HSO3-的还原性较 H2SO3的弱。采用Na2SO3还原酸浸液时,反应后溶液pH值升高,并且由于HSO3-还原性较弱,因此,溶液中 Te(Ⅳ)未被还原就水解生成TeO2沉淀。
采用SO2还原时,实验条件如下:硫酸浸出液300 mL,氯化钠用量为8.6 g,反应温度为75 ℃,反应时间为2 h,二氧化硫流量为0.2 L/min。SO2还原时,pH值对碲回收率和终点pH值的影响如图7所示,反应产物的XRD实验结果如图8所示。
由图7可知,碲回收率和终点pH值均随着pH值的增加而增加。由图8可知,产物中含单质碲。
采用SO2还原,溶液中发生以下反应:
SO2+H2O![]() H2SO3 (9)
H2SO3 (9)
H2SO3![]() HSO3-+H+ (10)
HSO3-+H+ (10)
HSO3- ![]() SO32-+H+ (11)
SO32-+H+ (11)
2SO2+3H2O+TeOSO4=Te+3H2SO4 (12)
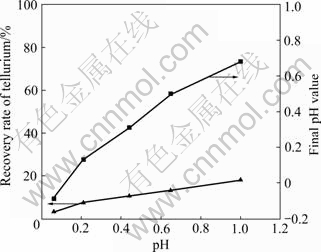
图7 SO2还原pH值对碲回收率及终点pH值的影响
Fig. 7 Effect of pH value on recovery rate of Te and final pH value by SO2
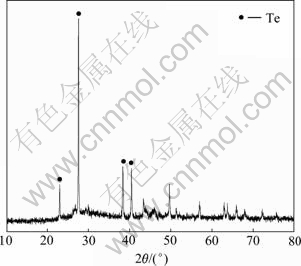
图8 SO2还原产物的XRD谱
Fig. 8 XRD pattern of product by SO2
由反应式(9)~(12)可知,SO2还原时,SO2溶于水,有H+产生,S元素主要以H2SO3形态存在。由式(8)可知,H2SO3还原性较强。采用SO2还原酸浸液时,反应后pH下降,所得产物为单质碲。
实验结果表明,Na2SO3还原时,由于pH值增加,使Te(Ⅳ)发生水解生成TeO2,没有单质碲生成;而采用SO2还原时,有单质碲产生。因此,实验选择SO2作为还原剂。
2.3 SO2还原时盐酸浓度对碲回收率的影响
SO2还原时催化剂Cl-浓度对Te(Ⅳ)还原有重要影响[16],实验中考察了Cl-浓度对碲回收率的影响。实验取300 mL上述硫酸浸出液,在反应温度为75 ℃、反应时间为2 h、二氧化硫流量为0.4 L/min的条件下,盐酸浓度对碲回收率的影响结果如图9所示。
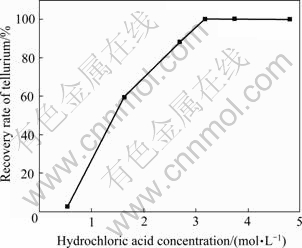
图9 盐酸浓度对碲回收率的影响
Fig. 9 Effect of hydrochloric acid concentration on recovery rate of Te
由图9可知,随着盐酸浓度的增加碲回收率增加。当盐酸浓度为0.54 mol/L时,碲回收率仅为2.31%,还原效果差。当盐酸浓度增加到3.2 mol/L时,碲回收率可达99.98%,当盐酸浓度大于3.2 mol/L时,继续增加盐酸的用量,碲回收率几乎不再增大。因此,选择适宜的盐酸浓度为3.2 mol/L。
在上述适宜实验条件下,处理7.5 L硫酸浸出液,将还原得到的湿碲粉用纯净水浆洗3次后烘干。采用ICP分析还原液的成分,结果表明碲含量为0.01 g/L,碲的回收率可以达到99.84%。采用ICP分析还原产 物,其主要成分如表3所列,其物相XRD图如图10所示,其SEM像如图11所示。
表3 碲粉的成分
Table 3 Compositions of powdered-tellurium (mass fraction, %)
![]()
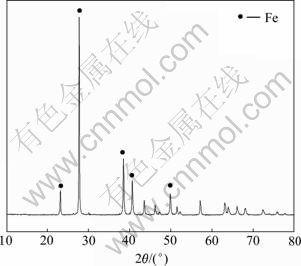
图10 碲粉的XRD谱
Fig. 10 XRD pattern of powdered-tellurium

图11 碲粉的SEM像
Fig. 11 SEM images of powdered-tellurium
由表3可知,碲粉中碲的含量可以达到98.27%,主要杂质为硒、锌和铜。图10表明产物以单质碲的形式存在。图11所示的SEM分析表明产物碲为针形。
3 结论
1) 采用硫酸浸出中和渣,在反应温度为30 ℃、反应时间为0.5 h、硫酸浓度为53.9 g/L、硫酸用量为理论用量的1.5倍的条件下,碲的浸出率为99.99%。
2) 亚硫酸钠还原酸性浸出液中Te(Ⅳ)时,所得产物XRD谱中有TeO2,说明Te(Ⅳ)发生水解产生TeO2。
3) 采用SO2还原硫酸浸出液,在温度为75 ℃、反应时间为2 h、盐酸浓度为3.2 mol/L、SO2流量为0.4 L/min的条件下,碲的回收率为99.84%。碲粉中碲含量可以达到98.27%,XRD谱分析表明还原产物以单质碲的形式存在,SEM形貌分析表明碲粉形貌为针形。
REFERENCES
[1] 周令治. 稀散金属手册[M]. 长沙: 中南工业大学出版社, 1993: 372-374.
ZHOU Ling-zhi. Handbook of scattered metals[M]. Changsha: Central South University of Technology Press, 1993: 373-374.
[2] SARGAR B M, ANUSE M A. Liquid-liquid extraction study of tellurium(Ⅳ) with N-n-octylaniline in halide medium and its separation from real samples[J]. Tatanta, 2001, 55(3): 469-478.
[3] 袁武华, 王 峰. 国内外易切削钢的研究现状和前景[J]. 钢铁研究, 2008, 36(5): 56-57.
YUAN Wu-hua, WANG Feng. Present research status and prospects on free cutting steel at home and abroad[J]. Research on Iron & Steel, 2008, 36(5): 56-57.
[4] NICOCA P, HELIO A S. Advances in organic tellurium chemistry[J]. Tetrahedron, 2005, 61(7): 1613-1679.
[5] ASSAT A, DAN O. Large blue shift of the biexciton state in tellurium doped CdSe colloidal quantum dots[J]. American Chemical Society, 2008, 8(8): 2384-2387.
[6] JEON S J, OH M, JEON H, HYUN S, LEE H J. Effects of post-annealing on thermoelectric properties of bismuth–tellurium thin films deposited by co-sputtering[J]. Microelectronic Engineering, 2011, 88(5): 541-544.
[7] WANG Ling-ling, HUANG Jia-rui, WANG Hui, PAN Ling, WEI Xian-wen. Formation of single-crystal tellurium nanowires and nanotubes via hydrothermal recrystallization and their gas sensing properties at room temperature[J]. Journal of Materials Chemistry, 2010, 20(12): 2457-2463.
[8] KHU T V, STEVE J M, BARRY L D. Stoichiometric low loss tellurium oxide thin films for photonic applications[J]. Journal of Nanoscience and Nanotechnology, 2010, 10(12): 7997-8003.
[9] 毛景文, 陈毓川, 周剑雄, 杨白川. 四川省石棉县大水沟碲矿床地质, 矿物学和地球化学[J]. 地球学报, 1995, 16(3): 276-290.
MAO Jing-wen, CHEN Yu-chuan, ZHOU Jian-xiong, YANG Bai-chuan. Geology, mineralogy, and geochemistry of the Dashuigou tellurium deposit in Shimian County, Sichuan[J]. Acta Geoscientia Sinica, 1995, 16(3): 276-290.
[10] HA Y C, SOHN H J, JEONG G J, LEE C K, RHEE K I. Electrowinning of tellurium from alkaline leach liquor of cemented Te[J]. Applied Electrochemistry, 2000, 30(3): 315-322.
[11] RHEE K, LEE C K, HA Y C, JEONG G J, KIM H S, SOHN H J. Tellurium recovery from cemented tellurium with minimum waste disposal [J]. Hydrometallurgy, 1999, 53(2): 189-201.
[12] 马玉天, 龚竹青, 陈文汨, 李宏煦, 阳征会, 黄 坚. 从硫酸溶液中还原制取金属碲粉[J]. 中国有色金属学报, 2006, 16(1): 189-194.
MA Yu-tian, GONG Zhu-qing, CHEN Wen-mi, LI Hong-xu, YANG Zheng-hui, HUANG Jian. Preparation of powdered- tellurium by reduction from sulfuric acid solution[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(1): 189-194.
[13] 郑雅杰, 孙召明. 催化还原法从含碲硫酸铜母液中回收碲的工艺研究[J]. 中南大学学报: 自然科学版, 2010, 41(6): 2109-2114.
ZHENG Ya-jie, SUN Zhao-ming. A novel technology for tellurium recovery from copper sulphate[J]. Journal of Central South University: Science and Technology, 2010, 41(6): 2109-2114.
[14] MONTIEL-SANTILLAN T, SOLORZA O, SANCHEZ H. Electrochemical research on tellurium deposition from acid sulfate medium[J]. Solid State Electrochemistry, 2002, 6(7): 433-422.
[15] 刘兴芝, 宋玉林, 武荣成, 熊 英, 朗 红, 臧树良. 碲化铜法回收碲的物理化学原理[J]. 广东有色属学报, 2002, 12(1): 55-57.
LIU Xing-zhi, SONG Yu-lin, WU Rong-cheng, XIONG Ying, LANG Hong, ZANG Shu-liang. Physicochemical principle for recovering tellurium by copper telluride method[J]. Journal of Guangdong Non-ferrous Metal, 2002, 12(1): 55-57.
[16] 孙召明, 郑雅杰. Te(Ⅳ)-H2SO4-H2O体系中卤素离子催化还原Te(Ⅳ)反应动力学[J]. 中国有色金属学报, 2010, 20(12): 2438-2444.
SUN Zhao-ming, ZHENG Ya-jie. Reaction kinetics of Te(Ⅳ) using halogen ions as catalyst in Te(Ⅳ)-H2SO4-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(12): 2438-2444.
(编辑 龙怀中)
基金项目:广东省教育部产学研重大资助项目(2009B090200053)
收稿日期:2011-07-12;修订日期:2011-10-12
通信作者:郑雅杰,教授,博士;电话:0731-88836285;E-mail: zzyyjj01@yahoo.com.cn


