文章编号:1004-0609(2012)04-1195-06
分步碳包覆合成高密度LiFePO4/C复合材料
胡国荣,刘见华,曹雁冰,彭忠东,杜 柯
(中南大学 冶金科学与工程学院,长沙 410083)
摘 要:
采用分步碳包覆法合成LiFePO4/C复合材料。首先,将原料Fe2O3、NH4H2PO4和葡萄糖经过固相反应合成Fe2P2O7/C复合材料,再将Fe2P2O7/C与前驱体Li2CO3、葡萄糖混合,通过二次碳包覆工艺合成LiFePO4/C复合材料,并考察合成温度对LiFePO4/C复合材料电化学性能的影响。采用X射线衍射、扫描电镜、差热-热重分析、电化学阻抗谱(EIS)和充放电测试对材料的性能进行表征。结果表明:以制取的Fe2P2O7/C为前驱体合成的LiFePO4/C复合材料具有较好的物理和电化学性能,材料的振实密度达1.26 g/m3,0.1C放电容量为158.3 mA·h/g,1C初次放电比容量达到140 mA·h/g。
关键词:
LiFePO4/C复合材料;Fe2P2O7;锂离子电池;正极材料;
中图分类号:TM912.9 文献标志码:A
Synthesis of high density LiFePO4/C composite by stepwise carbon-coating
HU Guo-rong, LIU Jian-hua, CAO Yan-bing, PENG Zhong-dong, DU Ke
(School of Metallurgy Science and Engineering, Central South University, Changsha 410083, China)
Abstract: LiFePO4/C composite was synthesized by stepwise carbon-coating. First, the precursor Fe2P2O7/C was obtained by solid state reaction with Fe2O3, NH4H2PO4 and glucose, then, LiFePO4/C was synthesized by mixing the precursor, Li2CO3 and glucose through stepwise carbon-coating process. The effect of synthesis temperature on the electrochemical performances of LiFePO4/C composites was studied. The product were characterized by XRD, SEM, DSC-TGA, EIS and charge-discharge test. The results show that the LiFePO4/C composites synthesized with Fe2P2O7 as the precursor have excellent physics and electrochemical performance, the tap density of product reaches 1.26 g/cm3, and it has discharge capacities of 158.3 mA·h/g at 0.1C and 140 mA·h/g at 1C.
Key words: LiFePO4/C composites; Fe2P2O7; lithium ion batteries; cathode materials
自1997年PADHI等[1]发现橄榄石型结构的LiFePO4正极材料以来,LiFePO4材料便成为近年来国内外的研究热点。LiFePO4以其原料来源广泛、热稳定性好、比能量高、循环性能好等优点,从而被认为是最具潜力的下一代锂离子电池正极材料之一[2-4]。但是,LiFePO4 的低电导率(室温下约为10-9 S/cm)和低锂离子扩散系数[5]导致其高倍率性能差,限制了其应用。目前,主要通过采用不同位置的离子掺杂和表面包覆导电相例如碳[6-9],以及通过优化材料的粒径大小和形貌来对材料进行改性,制备纳米材料,缩短锂离子固相扩散路径,提高锂离子的扩散能力[10]。但是根据文献[11]报道,仅通过单一改性很难使材料的电化学性能和物理性能同时得以提高,为解决这一问题,首先从原材料出发,以制备的改性中间相为前躯体,再以此合成磷酸铁锂复合材料。本文作者曾研究采用焦磷酸盐取代正磷酸盐来合成LiFePO4/C复合材料, 先以Fe2O3和NH4H2PO4经过固相反应合成Fe2P2O7,再将其与Li2CO3和葡萄糖混合合成LiFePO4/C复合材 料[12],以此方法合成的材料振实密度较高,但材料的电化学性能不佳,0.1C时最好容量为149 mA·h/g,且充放电极化较大,同时,合成的前躯体Fe2P2O7团聚形成块状物,需要破碎,增加了材料的制备工艺流程。因此,本文作者在研究的基础上进行改进,以廉价的Fe2O3为原料,对前躯体Fe2P2O7进行少量碳包覆,一方面使前躯体不结块,减少破碎工序,同时也限制了颗粒的长大,使产物的颗粒形貌更加均匀,材料制备工艺简单,易操作,主要考察了分步碳包覆和合成温度对材料物理和化学性能的影响。
1 实验
将Fe2O3、NH4H2PO4按比例混合均匀,以葡萄糖为碳源和还原剂,以无水乙醇作为分散剂,在行星球磨机上混合4 h,将浆料在80 ℃下烘干后于氩气气氛炉中以3 ℃/min的速度升温到700 ℃,保温10 h后随炉冷却到室温,制取前躯体Fe2P2O7/C。将前躯体Fe2P2O7/C和葡萄糖、Li2CO3按比例混合,在行星球磨机上混合3~5 h,将得到的浆料在80 ℃下烘干后于氩气气氛炉中升温到700 ℃保温10 h,随炉冷却到室温,最后制得LiFePO4/C复合材料。
采用日本Rigaku公司生产Minflex型的X射线自动衍射仪(XRD, D/max-γ A type Cu Kα1,40 kV,300 mA,10°~80°,日本生产)进行晶体结构分析;采用日本JEOL公司JSM-5600LV型扫描电子显微镜分析材料形貌。利用SDT Q600型热分析仪对材料进行热重和差热分析。采用美国PerkinElmer 生产的Model 273A Potentiostat/Galvanostat 及Model 5210 Dual Phase Lock-in Amplifier进行交流阻抗测试。
将材料制作成CR2025型扣式电池进行充放电循环测试。采用涂膜法制备电极,以N-甲基-2-吡咯烷酮(NMP)为溶剂,按质量比8:1:1分别称取活性物质、乙炔黑和PVDF,混合均匀后,涂在预处理过的铝箔上,放入真空干燥箱中在120 ℃干燥得到正极片。在充满氩气的手套箱中,以金属锂片为负极,以1 mol/L LiPF6的碳酸乙烯酸(EC)+碳酸二甲酯(DMC)+碳酸甲乙酯(EMC)(体积比1:1:1)的混合溶液作为电解液、Celgard2400多孔聚乙烯膜为隔膜,组装成扣式电池。用LAND电池测试系统对扣式电池进行电化学性能测试,充电终止电压为4.1 V ,放电终止电压为2.5 V。电化学测试都在室温下进行。
2 结果与讨论
2.1 前躯体Fe2P2O7的制备
图1所示为氩气气氛下Fe2O3和NH4H2PO4反应的差热—热重曲线。从图1可以看出,差热和热重曲线可分为4个区域:1) 从室温至187.40 ℃,在此区域内样品保持稳定的热性能,只出现少量的质量损失,其原因是样品中极少量水分的挥发;2) 在187.40~ 439.99 ℃范围内,在202.94 ℃出现了一个明显的吸热峰。同时伴随着样品质量的大量减少,其原因可能是NH4H2PO4的分解以及与Fe2O3反应所产生的氨气和水的挥发;3) 在439.99~591.69 ℃范围内,此区域NH4H2PO4与Fe2O3进一步反应的同时,Fe3+开始被还原成Fe2+,Fe2P2O7也开始生成;4) 在591.69~900 ℃,随着温度的升高,样品的质量逐渐稳定,反应趋于完全。当温度大于630 ℃时,Fe2O3和NH4H2PO4的总反应可推断为
2NH4H2PO4+Fe2O3→Fe2P2O7+4/3NH3+4H2O+1/3N2 (1)
从图1可以计算样品的质量损失约为23%,从推断的反应式进行理论计算得到质量损失为26%,二者基本吻合,所以,控制反应温度大于630℃即可得到纯相Fe2P2O7。
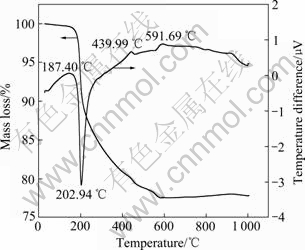
图1 氩气气氛下Fe2O3和NH4H2PO4反应的差热-热重曲线
Fig. 1 TGA-DSC curves of mixture of Fe2O3 and NH4H2PO4 under argon atmosphere
图2所示为700 ℃下Fe2O3和NH4H2PO4反应生成的Fe2P2O7的XRD谱。从图2可以看出,衍射峰尖锐,Fe2P2O7在700 ℃结晶完整。
图3所示为700 ℃下以Fe2O3和NH4H2PO4为原料合成的Fe2P2O7/C的SEM像。从图3可以看出,Fe2P2O7/C的粒度小、形貌不规则,比表面积大,有利于LiFePO4合成中固相反应的传质过程。此时前躯体含碳含量为1.2%。同时合成的Fe2P2O7/C材料没有出现团聚结块现象,因此减少了破碎工艺,使材料的合成更加简易,且与本实验室前期研究相比,该前躯体的粒度更加细小均匀。
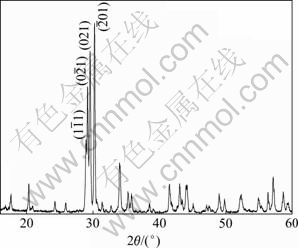
图2 700 ℃下Fe2O3和NH4H2PO4反应生成的Fe2P2O7的XRD谱
Fig. 2 XRD patterns of Fe2P2O7 synthesized with Fe2O3 and NH4H2PO4 at 700 ℃

图3 700 ℃下以Fe2O3和NH4H2PO4为原料合成的Fe2P2O7/C的SEM像
Fig. 3 SEM image of Fe2P2O7 /C synthesized with Fe2O3 and NH4H2PO4 at 700 ℃
2.2 以Fe2P2O7/C为原料制备的LiFePO4
图4所示为不同温度下合成的LiFePO4/C材料的SEM像。从图4可以看出:不同温度下合成的LiFePO4/C颗粒形貌不规则,颗粒表面比较粗糙,使得材料比表面积大、表面能高、活性较大,对材料的电化学性能有利。固相反应材料的长大阶段控制因素主要为原子和离子的扩散,根据Arrhenius 公式可知,扩散系数与T -1呈指数关系[13-14],所以,随着温度的升高,在同样的合成时间下,颗粒长大明显,相比Fe2P2O7/C而言,LiFePO4/C材料颗粒粒径较大,粒度分布范围稍广,这是由于Fe2P2O7和Li2CO3颗粒反应融合长大。650 ℃时合成的材料颗粒间絮状物较多,晶界不明显(见图4(a)),可能是温度较低,碳的石墨化程度低,使得一部分的碳处于游离状态;700 ℃合成的材料颗粒间的絮状物消失,晶界明显(见图4(b));合成温度为750 ℃时,影响粒子的扩散,材料颗粒团聚严重,对材料的性能不利,增大了Li+的传输路径。
图5所示为不同温度下合成LiFePO4/C的XRD谱。从图5可以看出,所合成材料都具有LiFePO4的特征峰,且特征峰对应整齐,说明它们都具有橄榄石结构,属于正交晶系Pnma空间群,随着合成温度的升高,各晶面衍射峰越发尖锐,晶体生长越来越完善。然而,合成温度越高晶粒的粒径也越大,对LiFePO4来说,自由迁徙的锂离子数量决定了LiFePO4的充放电容量,锂离子在进出大粒径的颗粒时,要经历较长的路径,颗粒中央的LiFePO4会因为路径远,锂离子扩散的阻力大,而不能被激活,从而影响充放电容量,因此合成温度应该适中。

图4 不同温度合成的LiFePO4/C的SEM像
Fig. 4 SEM images of LiFePO4/C synthesized at different temperatures: (a) 650 ℃; (b) 700 ℃; (c) 750℃
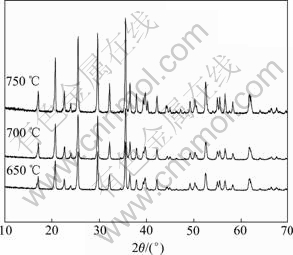
图5 不同温度下合成的LiFePO4/C的XRD谱
Fig. 5 XRD patterns of LiFePO4/C synthesized at different temperatures
图6所示为不同温度下合成的材料的电化学性能。图6(a)和6(b)所示分别为所合成的材料在0.1C和1C倍率下的充放电曲线。由图6(a)和(b)可知,在0.1C倍率充放电时,650、700和750 ℃合成材料的放电比容量分别达到149.4、158.3和155.5 mA·h/g;在1C倍率充放电时,650、700 和750 ℃合成材料的放电比容量分别可以达到131.2、140.1和133.4 mA·h/g。图6(c)所示为不同温度合成的材料在1C倍率下的循环图,图6(d)所示为700 ℃合成的LiFePO4/C在不同充放电倍率下连续循环时的充放电曲线。从图6可以看出,700 ℃下合成的材料有较好的循环和倍率性能。通过比较材料在不同倍率下放电比容量可知,700 ℃合成材料的性能优于650 ℃合成的,这是因为随着合成温度的升高,碳石墨化程度加大,有利于提高材料的电导率,减小极化,且升高温度,晶体生长更加完善,从而使材料电化学性能提高。但是随着合成温度的升高,材料颗粒的增大比较明显,颗粒尺寸的增大将增加锂离子的扩散路径,促使充放电时电极极化加大,特别是在高倍率下极化将更为严重,从而材料的充放电容量有所降低,因此,750 ℃合成材料的性能较700 ℃的有所降低。经检测,在700 ℃合成的LiFePO4/C振实密度达1.26 g/cm3,碳含量为2.58%。
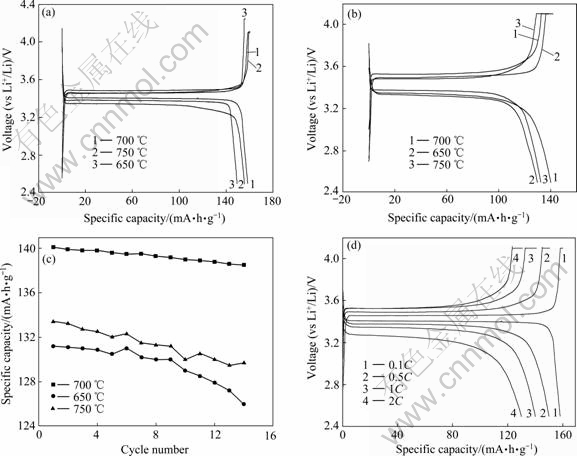
图6 不同温度下合成的LiFePO4/C的电化学性能
Fig. 6 Electrochemical performances of LiFePO4/C synthesized at different temperatures: (a) Discharge voltage profiles at 0.1C; (b) Discharge voltage profiles at 1C; (c) Cycling performance of LiFePO4/C synthesized at different temperatures and 1C; (d) Cycle capability performance of LiFePO4/C synthesized at 700 ℃ and different rates
图7所示为700 ℃以Fe2P2O7/C为前躯体分步碳包覆合成的LiFePO4/C和以Fe2P2O7为前躯体一次碳包覆合成的LiFePO4/C的电化学性能比较,曲线1为分步包覆合成的LiFePO4/C,曲线2为一次碳包覆合成的LiFePO4/C。图7(a)所示为两种材料0.1C充放电容量对比。从图7(a)可知,两次包覆合成的LiFePO4/C在0.1C倍率下容量较一次包覆的提高了10 mA·h/g,且材料的极化减小,放电平台提高。图7(b)为两种材料在1C倍率下循环性能比较,一次包覆合成的LiFePO4/C初始放电容量为120 mA·h/g,且循环衰减较快,分步两次碳包覆合成的LiFePO4/C初始放电容量为140 mA·h/g,同时容量保持较好。
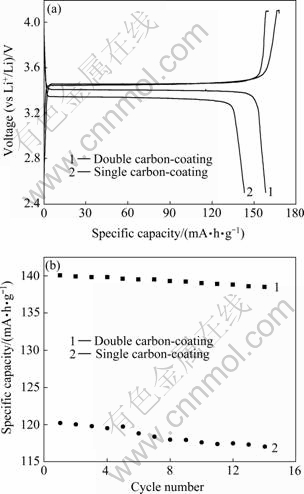
图7 700 ℃分步包覆合成的LiFePO4/C和一次碳包覆合成的LiFePO4/C的电化学性能比较
Fig.7 Electrochemical performances of LiFePO4/C synthesized with different ways at 700 ℃: (a) Discharge voltage profiles at 0.1C; (b) Cycle capability performance of LiFePO4/C at 1C
图8所示为以Fe2P2O7/C为前躯体两次碳包覆合成的LiFePO4/C和以Fe2P2O7为前躯体一次碳包覆合成的LiFePO4/C经13次循环后的交流阻抗图谱。电极材料的电化学性能主要与电子电导率和Li+传输性能有关,LiFePO4的充放电过程主要受电荷转移步骤控制,因此电荷转移阻抗上的差异也将导致电化学性能的不同[15-16]。从图8可以看出:两条曲线均包含高频区的近似半圆和低频区的直线。高中频半圆对应于电极电荷转移过程的阻抗Rct,以Fe2P2O7为前躯体一次碳包覆合成的LiFePO4/C的Rct为 315 Ω,以Fe2P2O7/C为前躯体分步两次碳包覆后合成的LiFePO4/C的Rct为180 Ω,从而可知分步包覆合成材料的Rct有一定的减小,电荷转移阻抗的减小有利于克服充放电过程中的动力学限制,使活性颗粒中锂脱嵌深度得到提高,有利于提高材料的比容量,降低LiFePO4的活性颗粒表面与其内部存在的Li+浓度差,避免了多次循环后LiFePO4的活性颗粒晶格内部发生扭曲引起的容量下降,从而改善材料的循环性能。
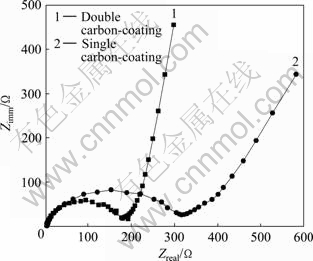
图8 LiFePO4/C在13次循环后的交流阻抗谱
Fig. 8 Nyquist graphs of LiFePO4/C electrode after 13 cycles
3 结论
1) 采用Fe2O3合成Fe2P2O7/C以其作前驱体,用分步碳包覆制备LiFePO4/C,700 ℃时,合成的材料振实密度达1.26 g/cm3,碳含量为2.58%,0.1C放电容量为158.3 mA·h/g,1C放电容量为140 mA·h/g,表现出良好的物理性能和电化学性能。
2) 对前躯体和复合材料进行碳包覆改性,不仅解决前躯体材料颗粒的团聚结块现象,使材料分布更加均匀,减少了破碎工序,使合成更加简易,且使合成材料的电化学极化减小,放电比容量和循环性能都得到了提高,同时材料保持较高的振实密度。
REFERENCES
[1] PADHI A K, NANJUNDASWAMY K S, GOODENOUGH J B. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J]. Journal of the Electrochemical Society, 1997, 144(4): 1188-1194.
[2] DONG Y Z, ZHAO Y M, CHEN Y H, HE Z F, KUANG Q. Optimized carbon-coated LiFePO4 cathode material for lithium-ion batteries[J]. Materials Chemistry and Physics, 2009, 115(1): 245-250.
[3] 傅 原. 锂离子正极材料LiFePO4[J]. 新材料产业, 2003, 10: 13-16.
FU Yuan. LiFePO4 cathode material for lithium-ion batteries, Advanced Materials Industry, 2003, 10: 13-16.
[4] 张亚利, 高立军, 吁 霁. 锂离子电池正极材料LiFePO4的研究进展[J]. 材料导报, 2007, 21(3): 303-305.
ZHANG Ya-li, GAO Li-jun, YU Ji. Research development of LiFePO4 as cathode material of Li-ion battery[J]. Materials Review, 2007, 21(3): 303-305.
[5] SUBRAMANYA HERLE P, ELLIS B, COOMBS N, NAZAR L F. Nano-network electronic conduction in iron and nickel olivine phosphates[J]. Nature Materials, 2004, 3(3): 147-152.
[6] CHUNG S Y, CHIANG Y M. Microscale measurements of the electrical conductivity of doped LiFePO4[J]. Electrochemical and Solid-State Letters, 2003, 6(12): 278-281.
[7] 倪江锋, 周恒辉, 陈继涛, 张新祥. 金属氧化物掺杂改善LiFePO4电化学性能[J]. 无机化学学报, 2005 , 21(4): 472-476.
NI Jiang-feng, ZHOU Heng-hui, CHEN Ji-tao, ZHANG Xin-xiang. Improvement of LiFePO4 electrochemical performance by doping metal oxides[J]. Chinese Journal of Inorganic Chemistry, 2005, 21(4): 472-476.
[8] 王晓琼, 李新海, 王志兴, 郭华军, 彭文杰. 锂离子电池正极材料 LiFe0.9Ni0.1PO4的合成与性能[J]. 中国有色金属学报, 2006, 16(4): 739-745.
WANG Xiao-qiong, LI Xin-hai, WANG Zhi-xing, GUO Hua-jun, PENG Wen-jie. Synthesis and performance of LiFe0.9Ni0.1PO4 as cathode material in lithium-ion battery[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(4): 739-745.
[9] 陈学军, 赵新兵, 曹高劭, 马胜林, 谢 健, 朱铁军. 一步固相合成Nb 掺杂LiFePO4/C及其电化学性能[J]. 中国有色金属学报, 2006, 16(10): 1665-1670.
CHEN Xue-jun, ZHAO Xin-bing, CAO Gao-shao, MA Sheng-lin, XIE Jian, ZHU Tie-jun. Electrochemical properties of Nb doped LiFePO4/C prepared by one step solid state synthesis[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(10): 1665-1670.
[10] FRANGER S, BENOIT C, BOURBON C, CRAS F L. Chemistry and electrochemistry of composite LiFePO4 materials for secondary lithium batteries[J]. Journal of Physics and Chemistry of Solids, 2006, 67(5/6): 1338-1342.
[11] LEE K T, CHO J. Roles of nanosize in lithium reactive nanomaterials for lithium ion batteries[J]. Nano Today, 2011, 6(1): 28-41.
[12] 肖政伟. 不同原料制备锂离子电池复合正极材料LiFePO4/C的研究[D]. 长沙: 中南大学, 2008: 31-51.
XIAO Zheng-wei. The study of preparation of LiFePO4/C composite cathode material for lithium ion batteries using different raw materials[D]. Changsha: Central South University, 2008: 31-51.
[13] LI J V, JOHNSTON S W, YAN Y, LEVI D H. Measuring temperature-dependent activation energy in thermally activated processes: A 2D Arrhenius plot method[J]. Review of Scientific Instruments, 2010, 81(3): 339-348.
[14] FABRIKANTIIYA I, HOTOP H. On the validity of the Arrhenius equation for electron attachment rate coefficients[J]. Journal of Chemical Physics, 2008, 128(12): 1243-1250.
[15] LIAO Xiao-zhen, MA Zi-feng, HE Yu-shi, ZHANG Xiao-ming, LIANG WANG,YI JIANG . Electrochemical behavior of LiFePO4/C cathode material for rechargeable lithium batteries[J]. Journal of the Electrochemical Society, 2005, A152(10): 1969-1973.
[16] 曲 涛,田彦文,翟玉春. 采用PITT 与EIS 技术测定锂离子电池正极材料LiFePO4中锂离子扩散系数[J].中国有色金属学报, 2007, 17(8): 1255-1258.
QU Tao, TIAN Yan-wen, ZHAI Yu-chun. Measurement of diffusion coefficient of lithium in LiFePO4 cathode material for Li-ion battery by PITT and EIS[J]. The Chinese Journal of Nonferrous, 2007, 17(8): 1255-1258.
(编辑 龙怀中)
基金项目:“十一五”国家科技支撑计划资助项目(2007BAE12B01-1);湖南省科技计划项目(2009GK3150);中央高校基本科研业务费专项资金资助项目(2012QNZT018)
收稿日期:2011-05-21;修订日期:2011-09-20
通信作者:曹雁冰,讲师;电话:13875868540;E-mail: cybcsu@csu.edu.cn
摘 要:采用分步碳包覆法合成LiFePO4/C复合材料。首先,将原料Fe2O3、NH4H2PO4和葡萄糖经过固相反应合成Fe2P2O7/C复合材料,再将Fe2P2O7/C与前驱体Li2CO3、葡萄糖混合,通过二次碳包覆工艺合成LiFePO4/C复合材料,并考察合成温度对LiFePO4/C复合材料电化学性能的影响。采用X射线衍射、扫描电镜、差热-热重分析、电化学阻抗谱(EIS)和充放电测试对材料的性能进行表征。结果表明:以制取的Fe2P2O7/C为前驱体合成的LiFePO4/C复合材料具有较好的物理和电化学性能,材料的振实密度达1.26 g/m3,0.1C放电容量为158.3 mA·h/g,1C初次放电比容量达到140 mA·h/g。


