文章编号:1004-0609(2007)12-1981-06
纯镁在模拟体液中的腐蚀机理
王 勇,高家诚,张 艳,周详发,伍 沙
(重庆大学 材料科学与工程学院,重庆 400045)
摘 要:
考察纯镁浸泡于模拟体液(SBF)中所发生的化学和物理过程,实验材料为扩散退火态,浸泡时间3~21 d。结果发现,镁的腐蚀速率随时间增加而降低,同时溶液pH递增;裂纹和腐蚀坑是材料损伤的主要形貌特征,而MgCl2的局部富积是形成腐蚀坑的重要原因;随着浸泡时间延长,Mg(OH)2沉积于试样表面并逐步增长,成为Ca、P在Mg表面沉积的屏障,因此抑制Mg(OH)2的形成和生长是诱导磷酸钙陶瓷在Mg表面沉积的必要条件。
关键词:
中图分类号:TG 146.22 文献标识码:A
Mechanism of pure magnesium corrosion immersed
in simulated body fluid
WANG Yong, GAO Jia-cheng, ZHANG Yan, ZHOU Xiang-fa, WU Sha
(College of Materials Science and Engineering, Chongqing University, Chongqing 400045, China)
Abstract: The chemical and physical processes of magnesium immersed in SBF were investigated. The samples were as-annealed; the immersion time was 3-21 d. The result shows that as the immersion time increases, the corrosion rate decreases while the SBF pH increases. Network-like cracks and pits are the main damages resulting from corrosion. The locally buildup of MgCl2 is the major cause of pitting. A Mg(OH)2 forms and gradually covers the sample surface. This layer acts as the barrier for the precipitation of Ca and P on the sample surface, thus it is crucial to depress the formation of Mg(OH)2 in order to have calcium phosphate bioceramics deposit on magnesium surface.
Key words: pure magnesium; simulated body fluid(SBF); corrosion; Mg(OH)2; hydroxyapatite
近来,镁及其合金得到了生物材料界的关注。尽管这类材料早在20世纪30年代就已经在临床有过应用,但它仍然被看作是一种新型的金属生物材料。其原因在于从20世纪50年代到本世纪初的50余年中没有相关的研究报道。这类材料重新得到重视的原因除了其与自然骨十分相近的力学性能以外,更重要的是期望利用其在生理环境中的腐蚀溶解来开发可降解的金属生物材料。这种可降解的金属植入体内后,可以通过腐蚀等过程而完全消失[1-3],也可以被新生组织取代[4]。但是过快的腐蚀速率仍然是普遍重视且急待解决的问题[5],这也是50余年间人们放弃镁在植入材料领域应用的主要原因。
全面认识镁在生理环境中的腐蚀行为无疑是控制腐蚀速率、开发新材料的重要基础。Witte等[4]研究了4种镁合金在动物体内的降解过程,发现镁合金的腐蚀层上有非晶态的磷酸钙沉积,而该腐蚀层与周围的骨组织直接接触。任伊宾等[6]考察了纯镁在生理盐水中的腐蚀规律,发现提高材料纯度和细化晶粒可以降低其腐蚀速率。宋光铃等[7]研究了镁在Hank’s溶液中的腐蚀行为,发现随着时间的延长,镁的腐蚀速度加快,同时溶液的pH值升高。本文作者采用浸泡实验的方法,跟踪分析了试样和SBF溶液的随时间的变化, 从而对镁在生理环境中的腐蚀过程和机理进行了较为全面的讨论。
1 实验
1.1 试样准备
实验原材料为纯度不低于99.9%的镁铸锭,经550℃、24 h均匀化退火。切割成5 mm×10 mm×25mm的长方体,表面经320~800号SiC水砂纸打磨,并在丙酮中超声清洗10 min,冷风吹干后称量。
1.2 腐蚀实验及测试分析
SBF溶液按照Kokubo等[8]介绍的程序制备,溶液成分见表1。用HCl及Tris调节溶液 pH值至7.4,该过程中溶液温度保持在(36.5±0.5) ℃。
表1 SBF溶液的成分
Table 1 Ion concentrations of SBF (mmol/L)

浸泡腐蚀实验在37 ℃进行。每个试样分别浸泡于500 mL SBF溶液中,浸泡时间为3、5、7、14及21 d。在每一个时间段分别测定试样质量、溶液pH值。试样的腐蚀速率(v,mm/d)按下式计算[9]:
![]()
用于截面观察的试样采用树脂镶嵌(BUEHLER,USA),按金相制样的程序磨制、抛光,浸蚀剂为2%硝酸酒精溶液。浸泡21 d后,将溶液中的沉淀收集起来,室温干燥7 d后进行了物相分析。
试样的表面形貌用场发射扫描电镜(FESEM,JEOL JSM 6335F)观察,其物相结构用X射线衍射仪(XRD,Bruker D5005)表征。用光学金相显微镜观察了试样浸蚀前后的截面形貌(OM,Nikon Metaphot)并使用能谱仪(EDX,Amary 1000A)测定了试样的表面成分。
2 实验结果
2.1 溶液pH值及试样腐蚀速率
图1给出了腐蚀速率随时间的变化规律。由图1可见,镁在SBF中的腐蚀速率随时间延长而下降。在第3天时,腐蚀速率为4.4 mm/d,到第5天迅速降低到3.0 mm/d;而后腐蚀速率的下降趋缓,从第7天到第21天腐蚀速率成线性减小。
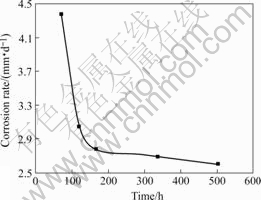
图1 腐蚀速率随浸泡时间的变化
Fig.1 Corrosion rate variation of magnesium with immersion time
图2所示为SBF溶液pH值随时间的变化。可见溶液的pH值随时间延长而升高,相应于腐蚀速率的突降,pH值从第3天到第5天的变化很小。
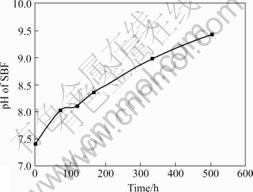
图2 SBF溶液pH值随时间的变化
Fig.2 Variation of pH of SBF with different times
2.2 腐蚀形貌与成分
图3~5所示为试样在SBF中浸泡不同时间后的表面形貌特征和典型的EDX谱。从第3天开始,试样表面能观察到分布均匀的网状裂纹和腐蚀坑(图3(a)),同时发现一些针状颗粒组成的团簇(图3(b)),成分分析表明这些针状团簇中富积着Cl离子。随着时间增长,裂纹变宽、腐蚀坑增大、增多。到第5天,试样表面的局部区域出现了疏松的沉积层(图4)。在浸泡早期,针状团簇也随时间延长而增多,其数量在第7天达到峰值,但是浸泡14 d以后,这种团簇反而消失了。疏松沉积层的面积则一直随时间延长而增加,21 d后试样表面完全被其覆盖(图5)。

图3 浸泡3 d后试样表面形貌及成分
Fig.3 Surface morphology (a) and needle-shaped deposit (b) of magnesium after immersion for 3 d
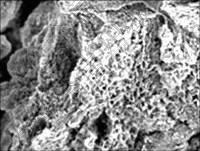
图4 浸泡5 d后表面局部区域出现的疏松沉积物
Fig.4 Porous layer appeared locally on sample surface immersed for 5 d
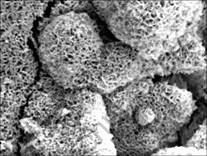
图5 浸泡21 d后试样表面覆盖的沉积物
Fig.5 Sample covered with deposit layer after immersion for 21 d
浸泡5 d后,在光学显微镜下可以观察到裂纹和腐蚀坑的截面形貌(图6)。由图6(a)可见,腐蚀坑中有沉积物聚集,但是在金相浸蚀时,这些沉积物发生溶解而消失(图6(b)),值得注意的是腐蚀坑并不是起源于晶界。表2显示了浸泡7 d和21 d后腐蚀坑中沉积物的成分,早期沉积物中有Ca、P和Cl,而后期的沉积物中则检测不到这几种元素。

图6 试样截面浸蚀前后形貌
Fig.6 Section morphologies of before (a) and after etching (b)
表2 浸泡不同时间后腐蚀坑中的沉积物成分
Table 2 Compositions of deposit in pits at different times(mass fraction, %)

表3列出了试样浸泡不同时间后的表面成分。在实验早期,大量Ca、P元素沉积于试样表面,但是经过21 d后,只有很少的Ca、P残留下来。而且,针状团簇中的Cl元素含量远高于其它区域。
表3 浸泡不同时间后试样表面成分
Table 3 Surface composition of sample at different times(mass fraction, %)
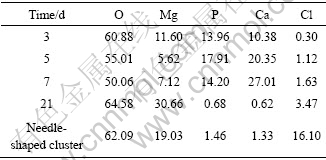
2.3 实验过程中产生的沉积物
图7所示为浸泡不同时间试样的XRD谱。浸泡3 d后,试样表面只能检测到金属镁,5 d后有Mg(OH)2出现,但浸泡7 d后Mg(OH)2的衍射峰消失,随后在14 d出现,浸泡21 d后,Mg(OH)2的衍射峰强度提高、数量增多,而金属镁的很多衍射峰则被屏蔽了。
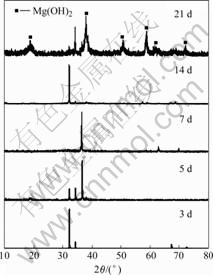
图7 浸泡不同时间后试样的XRD谱
Fig.7 XRD patterns of samples immersed in SBF for different times
由图8可见,溶液中的沉淀由Mg(OH)2和HA组成。表明HA尽管没有沉积到试样表面,但却出现在SBF溶液的游离沉淀中。
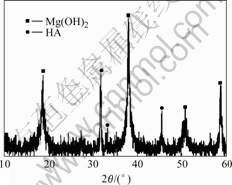
图8 21 d后溶液中游离沉淀的XRD谱
Fig.8 XRD pattern of deposit in SBF after 21 d of immersion
3 分析与讨论
3.1 腐蚀的化学过程
金属镁十分活泼,在水溶液中会发生下列反 应[10]:
2Mg→2Mg++2e(阳极反应) (1)
2H++2e→H2(阴极反应) (2)
2Mg++2H2O→2Mg2++2OH-+H2(化学反应) (3)
Mg+H++H2O→Mg2++OH-+H2(总反应) (4)
因此,镁在SBF中的溶解伴随着H2的析出。实验发现,试样一放入SBF便有气泡从表面析出,但气泡的数量随时间延长而减少,说明镁的溶解速度降低,这与图1显示的结果是一致的。
由式(4)可见,在析出氢气的同时,溶液中有OH-离子产生,因而导致pH升高(图2)。这种pH变化在试样周围尤其明显,因此Mg(OH)2会优先在试样表面沉积,并从第5天开始能够被XRD检测出来,对照图4、5、7的结果,可以断定,试样表面的疏松沉积物就是Mg(OH)2。
Mg(OH)2层结构疏松,而且在早期只出现在局部区域。文献[11-12]的作者认为,Mg(OH)2会按下式分解:
![]()
该MgO/Mg(OH)2膜对试样具有保护作用,所以腐蚀只发生在无膜的部位[11-12]。试样腐蚀速度因此下降。第5天能观察到及检测到Mg(OH)2,相应地,试样的腐蚀速率在此时显著降低(图1)。Mg(OH)2的形核与长大在抑制腐蚀的同时消耗了OH-,因此溶液pH的变化在第3天至第5天也变得平缓(图2)。但是,在本实验中,MgO的含量太少而没有被XRD检测到。
浸泡7 d后,试样表面的针状团簇达到峰值,分析表明该团簇富积大量的Cl元素,说明其中可能含有大量MgCl2。Staiger等[5]指出,Cl-既会破坏Mg(OH)2膜,也能够直接对Mg产生腐蚀,其反应机理如下:
![]()
MgCl2在水中的溶解度超过Mg(OH)2,因此其沉淀于试样表面的量很少,难以被XRD探测。又由于部分Mg(OH)2转化成MgCl2并溶解,导致浸泡7 d后Mg(OH)2的量也减少到XRD的分辨率以下,故此时在XRD谱中只有金属镁的衍射峰出现(图7)。
MgCl2在SBF中是不稳定的。在浸泡早期,其形成速率超过了溶解速率,所以在3~7 d中试样表面的针状富Cl团簇增加。随着镁的溶解,离子浓度积[Mg2+][Cl-]增大,MgCl2的形成驱动力和速率都降低,所以针状团簇减少乃至消失。事实上,Cl-是加速Mg腐蚀的重要成分[13-15]。Li等[16]将SBF中的[Cl-]从103 mmol/L降低到18 mmol/L,并用于考察Mg的耐蚀性,结果发现浸泡14 d后试样质量没有减少,而相同的试样在标准的SBF中仅仅10 d就全部溶解了。
本实验过程中,所有试样表面都能检测到Cl元素(表3),说明一直有少量MgCl2沉积于试样表面。当局部有大量Cl聚集时,就出现针状团簇,否则观察不到特殊的沉积物形态。
3.2 腐蚀的物理过程
Mg在SBF中的腐蚀是一个电化学过程,其溶解是局部进行的,损伤形态主要是裂纹和腐蚀坑。根据Song等[10]的研究,镁的腐蚀过程中尽管会出现腐蚀坑,但它与具有自催化效应的点蚀是不一样的。所以Mg的腐蚀在宏观上是均匀的,而不是只在一些特定的腐蚀坑发生加速溶解。
Mg的电极电位很低,因而其中的杂质元素较多的部位往往成为阴极而受到保护。由于试样在腐蚀前经过扩散退火,成分是均匀的,所以网状裂纹比较均匀地分布于试样表面。同时,晶界是杂质聚集的位置,其电位高于晶内,故裂纹和腐蚀坑均不易起源于晶界(图6)。
成分分析表明(表2),浸泡7 d后蚀坑中的沉积物含Cl元素,而21 d后蚀坑中的沉积物不含Cl元素,反映出Cl在局部的富积和MgCl2的高溶解度是造成腐蚀坑的重要原因。
3.3 HA的沉淀
SBF是一种过饱和溶液,溶液存放一定时间后会自发沉淀出羟基磷灰石(HA)[8]。而且HA的溶解度随pH升高而降低[17]。Mg的溶解会导致溶液pH升高(图2),尤其在试样的附近pH会高于溶液整体,这有利于HA析出。事实上,在实验的前7 d中,试样表面确实沉积了较多的Ca、P元素(表2、3)。但是由于Mg2+在很多条件下都会延迟乃至阻止HA结晶[18-20],所以Ca、P元素的沉积并没有导致HA或其它磷酸钙陶瓷在试样表面结晶。
浸泡21 d后,试样表面只剩下很少的Ca、P(表3),截面成分分析结果(表2)说明随着Mg(OH)2的形成,前期沉淀的Ca、P又重新进入溶液,HA在Mg表面析出的条件也就丧失了。可见,Mg(OH)2沉积层实际上成为了镁表面吸附Ca、P元素和析出HA的屏障。XRD分析发现(图8),尽管由于镁的溶解,SBF中必然存在大量Mg2+,但HA仍然在游离沉淀中结晶。由此可以判断,抑制Mg(OH)2层的形成是诱导HA在镁表面结晶的必要条件。
4 结论
1) 镁在SBF中的腐蚀在宏观上是均匀的,但微观上是局部进行的。其损伤形式主要是网状裂纹和腐蚀坑,这些裂纹和腐蚀坑并非起源于晶界。随着时间延长,试样腐蚀速率降低,溶液pH升高。
2) 从第5天起,试样表面能够观察到疏松的Mg(OH)2沉积层,该沉积物随时间延长而增加,到21 d时覆盖了整个试样。浸泡早期可以观察到富积Cl元素的针状团簇,这种团簇在第7天达到最多,而后消失。针状团簇是造成腐蚀坑的重要原因。
3) 浸泡早期,试样表面有较多的Ca、P元素沉积,但是21 d以后,只有很少的Ca、P残留下来。试样表面从未发现任何磷酸钙陶瓷相,21 d后溶液的游离沉淀中形成了HA。说明抑制Mg(OH)2层的形成是诱导HA在镁表面结晶的必要条件。
REFERENCES
[1] Zartner P, Cesnjevar R, Singer H, Weyand M. First successful implantation of a biodegradable metal stent into the left pulmonary artery of a preterm baby[J]. Catheterization and Cardiovascular Interventions, 2005, 66(4): 590-594.
[2] Schranz D, Zartner P, Michel-Behnke I, Akinturk H. Bioabsorbable metal stents for percutaneous treatment of critical recoarctation of the aorta in a newborn[J]. Catheterization and Cardiovascular Interventions, 2006, 67(5): 671-673.
[3] Mario C D, Griffiths H, Goktekin O, Peeters N, Verbist J, Bosiers M, Deloose K, Heublein B, Rohde R, Kasese V, Ilsley C, Erbel R. Drug-eluting absorbable magnesium stent[J]. Journal of Interventional Cardiology, 2004, 17(6): 391-395.
[4] Witte F, Kaese V, Haferkamp H, Switzer E, Meyer-Lindenberg A, Wirth C J, Windhagen H. In vivo corrosion of four magnesium alloys and the associated bone response[J]. Biomaterials, 2005, 26(17): 3557-3563.
[5] Staiger M P, Pietak A M, Huadmai J, Dias G. Magnesium and its alloys as orthopedic biomaterials: A review[J]. Biomaterials, 2006, 27(9): 1728-1734.
[6] Witte F, Fischer J, Nellesen J, Crostack H A, Kaese V, Pisch A, Beckmann F, Windhagen H. In vitro and in vivo corrosion measurements of magnesium alloys[J]. Biomaterials, 2006, 27(7): 1013-1018.
[7] 任伊宾, 黄晶晶, 杨 柯, 张炳春, 姚治铭, 王 浩. 纯镁的生物腐蚀[J], 金属学报, 2005, 41(11): 1228-1232.
Ren Y B, Huang J J, Yang K, Zhang B C, Yao Z M, Wang H. Study of bio-corrosion of pure magnesium[J]. Acta Metallurgica Sinica, 2005, 41(11): 1228-1232.
[8] 宋光铃, 宋诗哲. 镁在人体模拟溶液中的腐蚀行为[J]. 物理化学学报, 2006, 22(10): 1222-1226.
Song G L, Song S Z. Corrosion behaviour of pure magnesium in a simulated body fluid[J]. Acta Physico-Chimica Sinica, 2006, 22(10): 1222-1226.
[9] Kokubo T, Takadama H. How useful is SBF in predicting in vivo bone bioactivity?[J] Biomaterials, 2006, 27(15): 2907-2915.
[10] ASTM-G31-72. Standard Practice for Laboratory Immersion Corrosion Testing of Metals[S].
[11] Song G L, Atrens A. Understanding magnesium corrosion—A framework for improved alloy performance[J]. Advanced Engineering Materials, 2004, 5(12): 837-858.
[12] Baril G , Galicia G , Deslouis C, Pebere N, Tribollet B, Vivier V. An impedance investigation of the mechanism of pure magnesium corrosion in sodium sulfate solutions[J]. Journal of the Electrochemical Society, 2007, 154(2): C108-C113.
[13] Song G L, Atrens A, Stjohn D, Nairn J, Lit Y. The electrochemical corrosion of pure magnesium in 1 N NaCl[J]. Corrosion Science, 1997, 39(5): 855-875.
[14] Slavcheva E, Petkova G, Andreev P. Inhibition of corrosion of AZ91 magnesium alloy in ethylene glycol solution in presence of chloride anions[J]. Materials and Corrosion, 2005, 56(2): 83-87.
[15] Ambat R, Aung N N, Zhou W. Studies on the influence of chloride ion and pH on the corrosion and electrochemical behavior of AZ91D magnesium alloy[J]. Journal of Applied Electrochemistry, 2000, 30(7): 865-874.
[16] Song G L, Atrens A, Wu X L, Zhang B, Corrosion behaviour of AZ21, AZ501 And AZ91 in sodium chloride[J]. Corrosion Science, 1998, 40(10): 1769-1791.
[17] Li L C, Gao J C, Wang Y. Evaluation of cyto-toxicity and corrosion behavior of alkali-heat-treated magnesium in simulated body fluid[J]. Surface and Coatings Technology, 2004, 185(1): 92-98.
[18] Vereecke G . Calculation of the solubility diagrams in the system Ca(OH)2-H3PO4-KOH-CO2-H2O[J]. Journal of Crystal Growth, 1990, 104(4): 820-832.
[19] TenHuisen K S, Brown P W. Effects of magnesium on the formation of calcium-deficient hydroxyapatite from CaHPO4?2H2O and Ca4(PO4)2O[J]. Journal of Biomedical Materials Research, 1997, 36(3): 306-314.
[20] Abbona F, Baronnet A. A XRD and TEM study on the transformation of amorphous calcium phosphate in the presence of magnesium[J]. Journal of Crystal Growth, 1996, 165(1/2): 98-105.
[21] Barrere F, Layrolle P, van Blitterswijk C A, de Groot K. Biomimetic calcium phosphate coatings on ti6al4v: A crystal growth study of octacalcium phosphate and inhibition by Mg2+ and ![]() [J]. Bone, 1999, 25(2): 107S-111S.
[J]. Bone, 1999, 25(2): 107S-111S.
基金项目:国家自然科学基金资助项目(0670562)
收稿日期:2007-04-25;修订日期:2007-10-08
通讯作者:王 勇,副研究员,博士,电话:023-65102466;E-mail: liuzhi@cqu.edu.cn
摘 要:考察纯镁浸泡于模拟体液(SBF)中所发生的化学和物理过程,实验材料为扩散退火态,浸泡时间3~21 d。结果发现,镁的腐蚀速率随时间增加而降低,同时溶液pH递增;裂纹和腐蚀坑是材料损伤的主要形貌特征,而MgCl2的局部富积是形成腐蚀坑的重要原因;随着浸泡时间延长,Mg(OH)2沉积于试样表面并逐步增长,成为Ca、P在Mg表面沉积的屏障,因此抑制Mg(OH)2的形成和生长是诱导磷酸钙陶瓷在Mg表面沉积的必要条件。


