网络首发时间: 2019-01-28 07:00
植酸/氢氧化钙改性对3D打印纯钛多孔结构生物矿化的影响
南京航空航天大学材料科学与技术学院
摘 要:
通过激光3D打印技术制备孔隙率为65%的多孔结构纯钛试样,对试样先进行酸蚀作为表面预处理,再利用植酸与饱和氢氧化钙的混合溶液进行表面活化改性处理。采用扫描电镜(SEM)、X射线光电子能谱仪(XPS)及接触角分析仪对3D打印纯钛改性前后的表面进行表面形貌观察、表面成分分析及表面接触角测试,并将改性处理前后的各组试样浸泡在模拟体液(SBF)中进行生物矿化实验,利用SEM及能谱(EDS)分析其表面生物矿化效果。结果表明:植酸/氢氧化钙表面活化改性处理后的3D打印致密纯钛表面水接触角为21.04°,表现出较好的亲水性,即植酸/氢氧化钙改性处理可大幅提高3D打印多孔结构纯钛的表面润湿性;在植酸/氢氧化钙表面活化改性处理过程中3D打印多孔结构纯钛试样表面通过植酸螯合反应引入了Ca,P元素,可显著加快其表面羟基磷灰石的沉积速度,提高表面生物矿化能力;在浸泡模拟体液7 d后能在改性后3D打印多孔试样的多孔支架上形成羟基磷灰石包裹层。
关键词:
中图分类号: TP391.73;TG146.23
作者简介:吴小玉(1994-),女,安徽宿州人,硕士研究生,研究方向:生物医用材料,E-mail:wxy199042@163.com;;*汪涛,教授,电话:13851478319,E-mail:taowang@nuaa.edu.cn;
收稿日期:2018-12-19
基金:江苏省研究生培养创新工程项目(KYLX15-0307);江苏高校优势学科建设工程资助项目;南京航空航天大学研究生创新基金(实验室)开放基金项目(kfjj20170619)资助;
Phytic Acid/Hydroxide Hydroxide Surface Modification on Biomineralization Properties of 3D Printed Porous Titanium
Wu Xiaoyu Wang Tao Zhou Miao Huang Wenjing Huang Weixing
College of Materials Science & Technology,Nanjing University of Aeronautics & Astronautics
Abstract:
Porous titanium with a porosity of 65% was prepared by laser 3 D printing. The sample was first subjected to acid etching as a surface pretreatment,and then a surface activation modification treatment was carried out by using a mixed solution of phytic acid and saturated calcium hydroxide. The surface morphology,composition and surface contact angle of 3 D printed pure titanium were analyzed using scanning electron microscopy(SEM),X-ray photoelectron spectroscopy(XPS)and contact angle analyzer before and after surface modification. Mineralization experiments were carried out by immersed in simulated body fluids(SBF),and the surface biomineralization was analyzed by SEM and energy dispersive X-ray spectroscopy(EDS). The results showed that the contact angle of3 D printed dense titanium surface modified with phytic acid/calcium hydroxide was 21.04°,which showed better hydrophilicity,that was,phytic acid/calcium hydroxide modification treatment could greatly improve the wettability of the 3 D printed porous titanium. The phytic acid/calcium hydroxide surface modification treatment introduced Ca and P by chelation reaction on the surface of 3 D printed porous titanium,which could significantly accelerate the deposition rate of hydroxyapatite on the modified surface and improve its biomineralization ability. A hydroxyapatite coating layer could be formed on the porous stent of the modified 3 D printed porous titanium after immersing the SBF for 7 d.
Keyword:
3D printing; pure titanium; phytic acid; surface modification;
Received: 2018-12-19
钛及钛合金因具有良好的耐腐蚀性能和生物相容性被广泛用作生物医用外科植入物,尤其在是骨科和牙科领域
钙元素和磷元素为人骨组织中重要的组成元素,同时对植入体表面的矿化性能有着重要影响。钙离子的存在能使材料表面具有良好的生物活性,能够提高成骨细胞粘附、分化、骨基质矿化等能力
植酸(phytic acid,PA)分子式为C6H18P6O24,是一种纯天然无毒性的大分子化合物,存在于大多数植物种子之中,其水解产物不会对人体造成伤害,被广泛应用于食品、化工及医药等领域。植酸分子容易和Ca2+,Mg2+,Ti4+等金属离子发生强烈的螯合作用,在金属的表面形成一层保护膜
本文通过选择性激光熔化(SLM)加工多孔纯钛结构植入物,并进行酸蚀预处理,并利用植酸和饱和氢氧化钙溶液对酸蚀表面进行改性处理,探讨改性处理对多孔钛表面生物矿化能力的影响。
1 实验
1.1 实验材料
实验中3D打印使用的商业纯Ti金属粉末由西安铂力特增材制造有限公司提供,平均粒径为20~50μm,纯度为99.8%,其扫描电镜(SEM)图如图1所示;实验中所需其他试剂丙酮、无水乙醇、盐酸、硫酸、植酸、氧化钙购买自南京化学试剂有限公司。
1.2 试样制备
本文中所设计的多孔结构孔隙率为65%,微孔孔型设计为正八面体,样品的尺寸为50 mm×50 mm×10 mm,同时在同等条件下,打印致密纯钛试样用于改性处理前后接触角的测量。采用BLT-S200型激光3D打印机(西安铂力特技术有限公司),具体参数为激光光斑直径0.07 mm,激光功率200 W,每层铺粉厚度45μm,扫描速度800 mm·s-1。将3D打印成型试样切割成多个尺寸为8 mm×8 mm×3mm的实验用试样。用去离子水、丙酮、无水乙醇、去离子水依次超声清洗15 min并吹干,获得清洁试样。将清洗后的试样置于8%盐酸与34%硫酸的混合溶液中在60℃下保温70 min,进行酸蚀预处理。在室温下将70%植酸溶液溶于饱和氢氧化钙溶液中,制备植酸浓度为20%的混合溶液,酸蚀处理后的试样浸泡该混合溶液120 min,进行表面改性处理。对所获得的3种试样浸泡于37℃恒温的模拟体液(SBF,1∶1(模拟体液中离子浓度与人体体液离子浓度之比),pH=7.4)中,7 d后取出样品进行表面测试分析。
图1 纯钛粉末SEM图
Fig.1 SEM image of pure titanium powder
1.3 表征与测试
使用JC2000D7M型接触角测量仪测量试样表面与蒸馏水的静态接触角;使用PHI5000型X射线光电子能谱仪(XPS)对试样表面元素进行分析;使用JEOLS4800型扫描电镜(SEM)及能谱仪(EDS)观察试样表面形貌及分析改性后表面仿生矿化沉积物成分分析。
2 结果与讨论
2.1 表面形貌分析
图2是改性前后3D打印多孔结构纯钛的局部多孔结构及表面形貌SEM图。从图2(a,b)中可看出,3D打印多孔结构纯钛样品表面残留松散的未熔合金属粉末颗粒,微观表面不平整,存在熔坑等缺陷。从图2(c,d)中可看出,经混酸酸蚀预处理后,3D打印多孔结构钛表面上大量未熔合粉末被去除,整体仍保持完整的多孔结构,从微观尺度上来看,表面被腐蚀出不规则的微米级孔洞。从图2(e,f)中可看出,经过改性处理后的表面仍保持着微米级孔洞形貌,不同的是,在植酸/氢氧化钙改性后表面上小尺寸的孔洞形貌更多,微观形貌更加平缓。原因可能是,改性处理过程中,酸蚀处理后的试样表面在植酸/氢氧化钙混合溶液中发生点蚀,在表面大尺寸孔洞内部及周围产生形成尺寸更小的孔洞结构。
2.2 表面润湿性分析
由于多孔结构具有高通透性,难以直接对其进行接触角测试,因此为了验证改性处理对试样表面润湿性的影响,采用相同3D打印条件下的致密纯钛试样进行同等条件的改性处理,并对其进行改性前后接触角的测量。通过测量表面与纯水的静态接触角的方法来评估植酸/氢氧化钙改性前后纯钛试样表面的润湿性,获得的接触角结果如图3所示。
图3(a~c)分别表示3D打印致密纯钛试样表面、酸蚀处理及植酸/氢氧化钙改性后表面的接触角。从图3中得到,3D打印纯钛表面的水接触角为79.05°,经酸蚀处理后的试样表面水接触角为49.54°,植酸/氢氧化钙改性后试样表面水接触角为21.04°。由接触角结果可知,植酸/氢氧化钙改性后表面的润湿性得到了明显的改善,表现出较好的亲水性。这是由于植酸/氢氧化钙改性后表面生成了含有羟基、磷酸基等活性基团的植酸保护膜中,并引入了大量的钙离子,能增强表面亲水性。植酸/氢氧化钙改性处理能提高3D打印纯钛试样表面的润湿性,将宏观上的多孔结构与微观孔洞表面相结合,能大大增加植入体与周围组织的接触面积,进而结合的更牢固,并且多孔结构润湿性的改善有利于细胞沿多孔支架向内生长。
图2 改性处理前后3D打印多孔结构纯钛表面形貌SEM图
Fig.2 SEM images of 3D printed porous titanium surface morphology before and after modification treatment
(a,b)Untreated surface;(c,d)Acid etching surface;(e,f)Modified surface
图3 改性处理前后3D打印纯钛表面接触角
Fig.3 3D printed titanium surface contact angle before and after modification treatment
(a)Untreated surface;(b)Acid etching surface;(c)Modified surface
2.3 表面成分分析
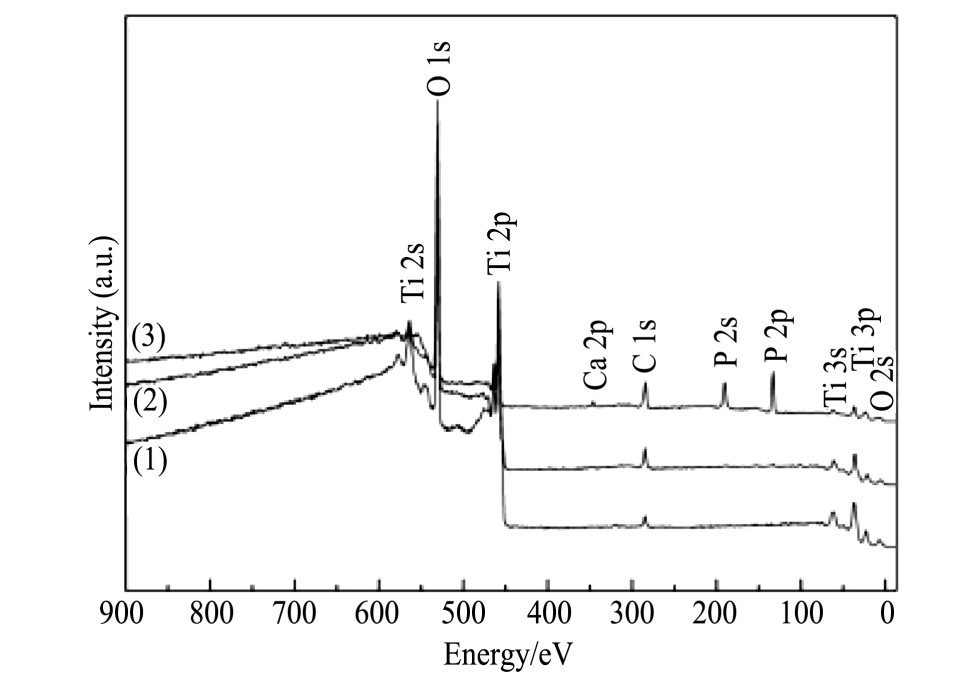
通过XPS分别对3组试样表面组成成分进行测试分析,结果如图4所示,其中图4(1~3)分别为3D打印多孔结构纯钛试样表面、酸蚀处理后的试样表面和经过植酸/氢氧化钙改性后的试样表面XPS谱图。从图4中可以看出,除了Ti,O,C元素外,植酸/氢氧化钙改性后的试样表面还出现了Ca和P元素。这是由于植酸中的基团能够与二价及二价以上的阳离子发生螯合反应,因此在植酸/氢氧化钙改性过程中,3D打印多孔结构纯钛试样表面形成了植酸钙螯合物,使表面引入钙元素,并且由于植酸本身含有大量的磷元素,因此,改性后的试样表面成功引入磷元素。
2.4 生物矿化实验
2.4.1 生物矿化情况分析
将改性前后3D打印多孔结构纯钛试样浸泡在所配制的1∶1的模拟体液中,在与人体环境相似的溶液中钙磷化合物能够在试样表面成核长大,形成类骨羟基磷灰石。图5是改性处理前后3D打印多孔结构纯钛试样经过浸泡模拟体液7 d后的局部多孔结构及表面形貌SEM图。
图4 改性处理前后3D打印多孔结构纯钛表面XPS谱图
Fig.4 XPS survey of 3D printed porous titanium surface(1)Untreated surface;(2)Acid etching surface;(3)Modi-fied surface
从图5中能看到,在矿化7 d后,未经任何处理的试样局部多孔结构支架并未发生明显的变化,微观形貌上看到表面沉积了羟基磷灰石颗粒,局部能看到钛基体;酸蚀处理后的试样多孔结构支架保留着酸蚀后的形貌,局部支架略有变粗,且表面由白色颗粒物,在微观表面上能看到表面沉积了较多的细密羟基磷灰石颗粒并由二维向三维方向生长,已经无法辨别基体形貌;而活化改性后的试样表面发生了显著地变化,羟基磷灰石表层产生细小的裂纹,是由于沉积的羟基磷灰石层较厚,由于应力不均匀导致表面裂纹产生,并且表面的羟基磷灰石颗粒也更大。从局部多孔结构图中可看到,改性处理后的试样多孔支架被羟基磷灰石层包裹,表面局部有较突出的较大的羟基磷灰石颗粒。
图6是改性前后各组试样表面的EDS能谱图,从图6中可以看到,未进行任何处理的试样表面上Ca,P元素特征峰强度较低,Ti特征峰强度比较高,说明其表面的沉积物层很薄;酸蚀后的试样表面Ti特征峰强度有所降低,而Ca,P两种元素的特征峰有所增强,说明酸蚀处理后的表面对羟基磷灰石的沉积有一定促进作用,但是效果并不是非常明显;而经过植酸/氢氧化钙改性处理后的表面上基本检测不到Ti元素,Ca,P元素特征峰的强度大大增加,说明该试样表面上形成的羟基磷灰石层具有一定厚度,能将基体完全覆盖,对羟基磷灰石的诱导作用十分明显。植酸/氢氧化钙改性后的表面能够更快地诱导羟基磷灰石的沉积一方面因为试样表面润湿性的改变,使模拟体液能够进入多孔结构内部,与试样充分接触;另一方面由于改性处理过程中,钛基体表面发生螯合反应,使表面富含钙离子,Ca2+与PO43-之间有强烈的化学作用,在浸泡模拟体液时能吸引PO43-,促进羟基磷灰石形核;而P元素在表面形成的P-O端基负电将溶液中游离的Ca2+通过离子键结合在表面,因此两者共同作用加快了植酸/氢氧化钙改性后试样表面羟基磷灰石的沉积。
图5 改性处理前后3D打印多孔结构钛浸泡SBF 7 d后SEM图
Fig.5 SEM images of 3D printed porous titanium soaked SBF for 7 d before and after modification treatment
(a,b)Untreated surface;(c,d)Acid etching surface;(e,f)Modified surface
图6 各组3D打印多孔结构钛试样浸泡SBF 7d后EDS图
Fig.6 EDS analysis of 3D printed porous titanium soaked SBF for 7 d before and after modification treatment
(a)Untreated surface;(b)Acid etching surface;(c)Modified surface
2.4.2 表面矿化物分析
在浸泡SBF溶液7 d后,对改性后的样品表面上的沉积物进行分析,结果如图7所示。
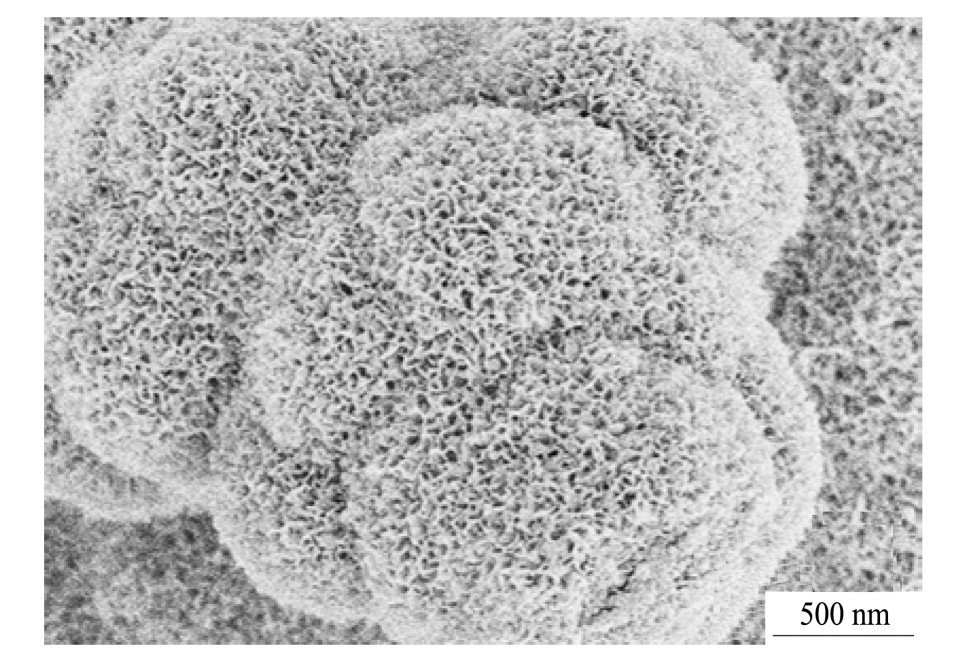
从SEM图中能看到,该沉积物为白色疏松绒球状颗粒,表面呈现无规则网络状结构,该形貌与羟基磷灰石的形态一致。通过对图6(c)中元素分析得知,该白色沉积物的主要组成元素为Ca,P,O元素,同时含有极少量的Mg是来自于模拟体液及实验过程中引入的杂质。进一步通过计算得知,沉积物的钙磷原子分数之比(Ca/P)约为1.66,与羟基磷灰石的Ca/P=1.67(原子分数比)相接近,更加证明表面沉积的球状物质为羟基磷灰石(HA)。
图7 植酸/氢氧化钙改性试样浸泡SBF 7 d后试样表面沉积物高倍SEM图
Fig.7 SEM image of surface deposits of modified surface after SBF soaking for 7 d
3 结论
1.3D打印致密纯钛表面接触角为79.05°,酸蚀预处理后其表面接触角降低至49.54°,再经植酸/氢氧化钙改性处理后表面与水的静态接触角为21.04°,说明改性处理能大大提高3D打印纯钛表面的亲水性。
2.植酸/氢氧化钙改性处理可以在3D打印多孔结构纯钛表面发生螯合反应引入Ca,P元素,加快表面羟基磷灰石的沉积,使3D打印多孔纯钛表面具有更好的生物矿化能力。
3.在生物矿化实验7 d后,改性后的3D打印多孔支架表面沉积生成Ca/P(原子分数比)约为1.66的羟基磷灰石包裹层。
参考文献