DOI:10.19476/j.ysxb.1004.0609.2019.12.16
湿法炼锌窑渣与污酸联合浸出新工艺
曾 涛,邓志敢,樊 刚,魏 昶,张 帆,甘向栋,李兴彬,刘慧杨
(昆明理工大学 冶金与能源工程学院,昆明 650093)
摘 要:
湿法炼锌过程中产生的窑渣含有大量的有价金属。锌冶炼污酸具有成分复杂、酸度高、含有大量的砷及其他重金属离子的特点。根据锌窑渣和污酸的理化性质,将二者进行联合浸出处理,考察反应时间、反应温度、液固比、H2O2加入量、窑渣粒径对锌窑渣与污酸联合浸出行为的影响。结果表明:在反应时间3 h、反应温度50 ℃、液固比(mL/g) 10:1、H2O2加入量为16 mL、窑渣粒径75~106 μm条件下进行二段逆流浸出,铜、铁、锌的浸出率均高于90%。浸出后液的酸度从172.48 g/L降至20 g/L左右,砷浓度达9 g/L左右,为后续沉砷处理提供了条件。另外,对浸出渣进行分析,可知浸出渣中主要物相为CaSO4·2H2O、SiO2和焦炭,其中银品位最高达484.7 g/t,可作为提银原料。
关键词:
文章编号:1004-0609(2019)-12-2826-10 中图分类号:TF09 文献标志码:A
在常规湿法炼锌工艺中产出的浸出渣大部分采用威尔兹法处理,渣中的Fe、Cu、Ag等高沸点金属被富集于锌窑渣中,同时锌窑渣中还含有12%~18%的焦 粉[1-2]。目前,我国每年约产出150万t锌窑渣[3]。锌窑渣硬度高、粒度细、物相及嵌布状态复杂[4],含有大量未被利用的有价金属,国内外学者均对其进行了一定的研究[5-7]。马娇等[8]采用干法磁选的方法回收了锌窑渣中大量的Fe和焦粉,但对锌窑渣中剩余的Zn、Cu等资源没有加以利用。王红军等[9-10]采用盐酸浸出的方法处理锌窑渣,在回收部分有价金属的同时引入了盐酸体系,需要进一步处理。JIANG等[11-12]采用微生物体系来浸出锌窑渣,能回收部分有价金属资源,但其微生物的浸出环境难以控制,易受外界影响。因此,锌窑渣的综合回收工艺一直未能取得突破,大多数企业对锌窑渣采用堆存处理,既占用了大量土地资源,也造成了有价金属资源的浪费,同时还会对环境造成污染。
砷具有极强的毒性和生物积累性,我国是受砷污染危害最严重的国家之一[13]。在有色冶炼过程中,大量的砷进入到烟气中,和其他一些污染物一起进入溶液,形成酸性含砷废水,也称污酸。污酸具有酸度高,砷浓度大,重金属离子种类多、含量高,成分复杂等特点[14]。对这些含砷污酸处理不当或直接排放会导致砷及重金属污染,对我国生态环境和人民生命安全造成严重的威胁。
目前常用的污酸处理方法有化学凝絮沉淀法、石灰中和法等[15-18],这些方法一般适用于处理高含砷浓度废水,但其渣量较大,易造成二次污染[19]。郑雅杰等[20]采用中和除杂-沉砷-蒸发结晶的方法处理污酸,实现了污酸中铜和砷的资源化回收。PRRASAD等[21]用纳米Fe2O3粉末吸附污酸中的As3+,取得了较好的效果,但纳米级的Fe2O3制备成本较高。本文根据湿法炼锌窑渣和含砷污酸的特点,将二者联合浸出处理,用污酸溶解锌窑渣中的复杂铁、铜化合物,回收锌窑渣中的Fe、Cu、Zn等有价金属,同时大量消耗污酸,实现锌窑渣与含砷污酸的清洁高效处理。
1 实验
1.1 实验原料
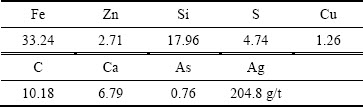
实验所用锌窑渣来自于云南某炼锌厂产出的湿法炼锌窑渣,分析其化学成分如表1所列。由表1可知,锌窑渣中Fe、Zn、Cu、Ag的含量分别是33.24%、2.71%、1.26%、204.8 g/t(质量分数),具有较高的利用价值。同时锌窑渣中还含有大量的焦炭和SiO2。
表1 锌窑渣的主要化学成分
Table 1 Main chemical composition of zinc kiln slag (mass fraction, %)
对锌窑渣进行XRD分析,其结果如图1所示。由图1可以看出,锌窑渣中主要的铁物相为FeS、Fe2O3、Fe3O4等,铜物相主要为CuS、CuFeS2和Cu5FeS4。对锌窑渣进行SEM-EDS分析,结果如图2和图3所示。
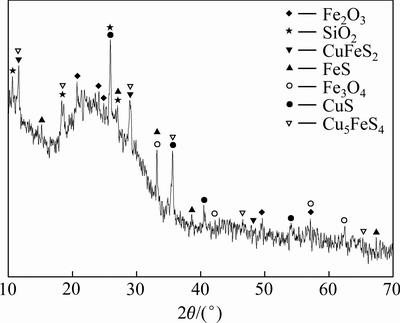
图1 锌窑渣的XRD谱
Fig. 1 XRD pattern of zinc kiln slag

图2 锌窑渣的SEM像
Fig. 2 SEM images of zinc kiln slag
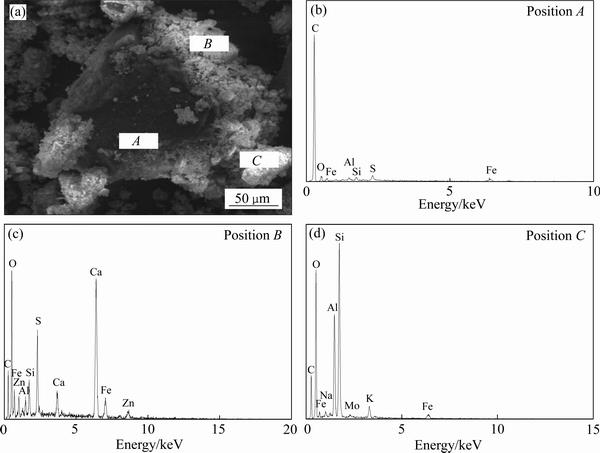
图3 锌窑渣的SEM像及EDS谱
Fig. 3 SEM image(a) and EDS spectra((b), (c), (d)) of zinc kiln slag
由图2和图3可以看出:锌窑渣为较为松散的聚集体,形貌多样且物相嵌布复杂,C、Fe、Ca、Si等都表现出极强的特征衍射峰,其中碳主要以单质块存在,大量的复杂铁、铜、硫化合物附着在碳块上。另外有部分渣相与SiO2存在着相互包裹现象。
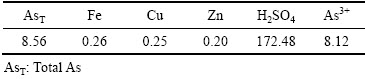
实验所用污酸为云南某厂锌冶炼制酸系统产出,其化学成分分析如表2所列。由表2可知,污酸中砷浓度很大,同时具有很高的酸度。
表2 污酸的主要化学成分
Table 2 Main chemical components of waste acid (g/L)
1.2 实验原理
在Fe-Cu-S-H2O水系中[22],Fe物相会先于Cu物相被浸出,当溶液电位较低时Cu2+不能稳定存在,体系中的低价硫也难以被氧化,如图4所示。而由图1可知,锌窑渣中的Cu大多以硫化物相的形式存在。因此,反应体系的电位需要被适当提高,氧化体系中的低价硫,进而溶解溶液中的铜硫化物,提高Cu的浸出率。
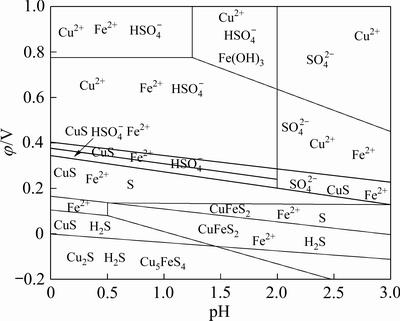
图4 Fe-Cu-S-H2O系的φ-pH优势区图
Fig. 4 φ-pH dominant area map of Fe-Cu-S-H2O system (298 K)
实验利用污酸溶解锌窑渣中的大量复杂铁、铜化合物,在消耗大量酸的同时回收锌窑渣中的有价金属。通过加入H2O2水溶液来调节溶液的氧化环境,提高溶液的氧化还原电位,氧化溶液中的低价硫,溶解锌窑渣中的铜硫物相,促进Cu的浸出。JIN等[23]推导出溶液中Fe3+、Fe2+浓度与溶液氧化还原电位的关系式如下:
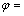 0.77+0.065lg[
0.77+0.065lg[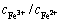 ] (1)
] (1)
由式(1)可知,溶液体系中的氧化还原电位与Fe3+和Fe2+的比值呈线性关系,在污酸浸出锌窑渣的过程中,随着H2O2的加入,反应体系中的Fe2+被大量氧化为Fe3+,使得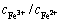 增大,提高了溶液的氧化还原电位。
增大,提高了溶液的氧化还原电位。
这一过程发生的主要化学反应为
2Fe2++ H2O2+2H+=2Fe3++2H2O (2)
2Fe3++Fe=2Fe2+ (3)
2Fe3++MeS=2Fe2++Me2++S0 (4)
CuFeS2+4Fe3+=Cu2++5Fe2++2S0 (5)
Cu5FeS4+12Fe3+=12Fe2++5Cu2++4S0 (6)
1.3 实验方法及设备
将500 mL污酸倒入三口烧瓶中,在HH-S28s型恒温水浴锅(金坛市大地自动化仪器厂生产)内水浴加热,加入定量质量分数为30%的H2O2,对污酸进行氧化。
用JE6001型电子天平(梅特勒—托利多仪器上海有限公司生产)称取定量的锌窑渣,加入经预氧化的污酸中,固定搅拌转速为200 r/min,反应开始,到达实验预设时间后。用2XZ-2型旋转式真空泵(浙江台州求精真空泵有限公司生产)对矿浆进行过滤,得到滤液和滤渣,用量筒(上海磊固仪器有限公司生产)量取滤液的体积,对浸出液进行取样分析,浸出渣经过洗涤后,置于DZF-6090型真空干燥箱烘箱(上海一恒科学仪器有限公司生产)中,在75 ℃条件下恒温12 h烘干,称重记录并分析。
1.4 分析检测与计算
采用重铬酸钾滴定法检测浸出液中的Fe2+和Fe3+浓度,采用ICP-MS法测定浸出液中H+、Zn2+、Cu2+、As的浓度,采用钨灯丝扫描电镜对锌窑渣及浸出渣进行形貌分析,借助X射线粉末衍射仪和化学分相法对其进行物相分析。利用电位计测量溶液体系的氧化还原电位。
各元素的浸出率计算公式为
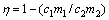 (7)
(7)
式中:η为浸出率,%;c1为浸出渣中元素含量,%;c2为锌窑渣中的元素含量,%;m1为浸出渣质量,g;m2为实验加入锌窑渣质量,g;
2 结果与讨论
2.1 污酸浸出锌窑渣实验
2.1.1 污酸预氧化实验
污酸中含有大量高毒性的As3+,加入H2O2水溶液可以将污酸中的As3+氧化为毒性较弱的As5+[24]。本文研究了H2O2的添加量对污酸中的As3+氧化的影响,其结果如图5所示。由图5可知,随着H2O2加入量的增加,污酸中As3+的浓度随之减少,从8.12 g/L减少到0.004 g/L,当H2O2加入量为每升锌污酸添加16 mL时,污酸中的As3+基本被全部氧化为As5+。本文采用被氧化后的污酸作为锌窑渣浸出实验的浸出剂。
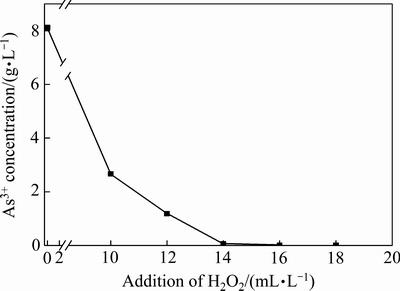
图5 H2O2加入量对As3+浓度的影响
Fig. 5 Effect of addition of H2O2 on concentration of As3+
2.1.2 反应时间对锌窑渣中金属浸出率的影响
实验中取锌窑渣50 g,锌窑渣粒径为106~150 μm,在液固比(mL/g)10:1,反应温度30 ℃,H2O2水溶液加入量为16 mL条件下进行反应。反应时间对各金属浸出率的影响如图6所示。
由图6可知,随着反应时间的增长,Zn、Fe、Cu的浸出率总体成上升趋势。反应时间从1 h增加到3 h时,Zn的浸出率由42.56%增加到48.28%,Fe的浸出率由38.59%增加到43.23%,Cu的浸出率由24.23%增加到29.56%。当反应时间超过3h后,Zn、Fe、Cu的浸出率增幅较为平缓。这是因为随着反应时间向后推进,体系中的酸被不断消耗,溶液中H+的浓度降低,反应继续进行的推动力很小。
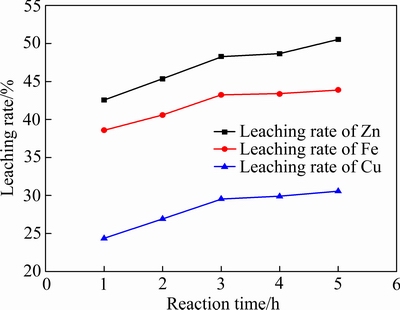
图6 反应时间对锌窑渣中金属浸出率的影响
Fig. 6 Effect of reaction time on leaching rate of metals in zinc kiln slag
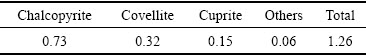
该反应体系下Zn、Fe、Cu的浸出率都不是太高,特别是Cu,反应到5 h时,Cu的浸出率也仅仅达到30.57%。对锌窑渣中的Cu物相进行分析,其结果如表3所列。结合图1(a)及表3可以看出:锌窑渣中的Cu主要以复杂难溶的硫化物相存在,在此反应体系下难以被污酸溶解,因此Cu的浸出率远低于Fe、Zn的浸出率。
表3 锌窑渣中的Cu物相组成
Table 3 Cu phase composition in zinc kiln slag (mass fraction, %)
2.1.3 反应温度对锌窑渣中金属浸出率的影响
实验中取锌窑渣50 g,锌窑渣粒径106~150 μm,在液固比(mL/g)10:1,H2O2水溶液加入量为16 mL条件下反应3 h。反应温度对各金属的浸出率的影响如图7所示。
由图7可知,温度对锌窑渣与污酸联合浸出有较大的影响。温度是分子热运动的标志,为体系中各分子之间的相互碰撞提供所需的能量。当反应体系的温度升高时,分子热运动更加剧烈,单位时间内参与反应的活性分子数量增多。因此随着温度从30 ℃逐渐升高,Zn、Fe、Cu的浸出率均逐渐增加,其中当温度升高到50 ℃时,Zn的浸出率由70.05%增加到76.93%,Fe的浸出率由71.16%增加到75.18%,Cu的浸出率从42.14%升高到47.15%;继续升高温度到70 ℃时,Zn、Fe的浸出率进一步上升,Cu的浸出率却开始下降,因为随着温度的进一步升高,H2O2的分解速度加快,溶液体系的电位也因此下降,导致锌窑渣中的Cu难以被浸出到溶液中。结合应用实际本文选择50 ℃作为浸出温度,在此条件下,H2O2的分解速度较慢,能有效地促进锌窑渣中Cu的浸出。
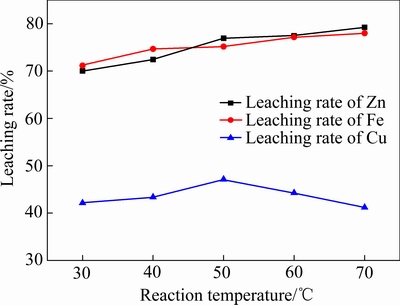
图7 反应温度对锌窑渣中金属浸出率的影响
Fig. 7 Effect of reaction temperature on leaching rate of metals in zinc kiln slag
2.1.4 液固比对锌窑渣中金属浸出率的影响
实验中取锌窑渣50 g,锌窑渣粒径为106~150 μm,在反应温度30 ℃,H2O2水溶液加入量为16 mL条件下反应3 h。液固比对各元素的浸出率的影响如图8所示。
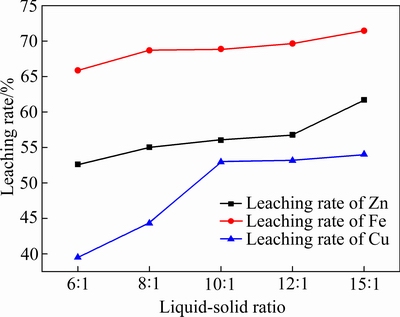
图8 液固比对锌窑渣中金属浸出率的影响
Fig. 8 Effect of liquid-solid ratio on leaching rate of metals in zinc kiln slag
由图8可知,随着液固比的增大,Zn、Fe、Cu的浸出率都有所增大。当液固比由5:1增大到10:1 时,Zn的浸出率由67.51%增大至68.88%,Fe的浸出率由52.63%增大至56.02%,Cu的浸出率由38.48%增至54.23%。这是因为当液固比较低时,虽然污酸的初始浓度相同,但其总量较少,不利于各金属元素的浸出反应,随着液固比增大,污酸的总量也随之增大,混合液黏度减小,活性分子扩散条件也得到改善,固液接触增多,浸出效率得到提高。当液固比大于10:1时,随着液固比的进一步增大,浸出液的黏度并没有大幅减小,浸出率因此增长较为缓慢。
2.1.5 H2O2加入量对锌窑渣中金属浸出率的影响
实验中取锌窑渣50 g,锌窑渣粒径为106~150 μm,在液固比(mL/g)10:1,反应温度为30 ℃条件下反应3 h。H2O2水溶液加入量对各元素的浸出率的影响如图9所示。
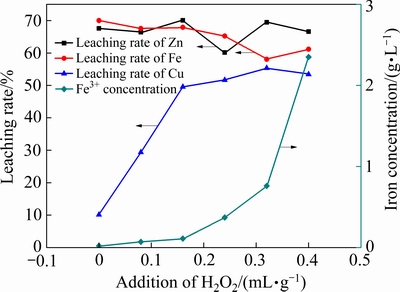
图9 H2O2加入量对锌窑渣中金属浸出率的影响
Fig. 9 Effect of addition of H2O2 on leaching rate of metals in zinc kiln slag
由图9可知,随着H2O2加入量的增加,Zn和Fe的浸出率基本保持稳定,而Cu的浸出率整体呈明显增加趋势;当H2O2加入量从0 mL增加至16 mL时,Zn和Fe的浸出率基本保持稳定,维持在60%至70%之间,Cu的浸出率从10.10%增加到55.36%。因此,H2O2的加入对Zn、Fe的浸出影响较小,对Cu浸出有较大的影响。
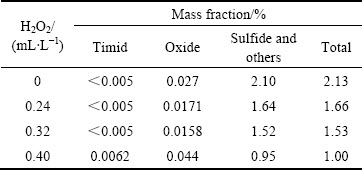
对不同H2O2加入量条件下的浸出终渣铜物相进行检测,其结果如表4所列,可知随着H2O2加入量的增加,浸出渣中的铜物相逐渐减少,与此同时溶液中的Fe3+逐渐增加,这是因为H2O2将溶液中的Fe2+氧化为Fe3+,体系中Fe3+浓度升高,GU等[25-26]的研究表明,在大量Fe2+被氧化为Fe3+后,体系电位提升,将有利于复杂铜硫化物中低价S的氧化,进而释放出Cu2+。因此,随着H2O2的增加,促进了反应(4)、(5)、(6)的进行,体系中低价S被氧化,锌窑渣中的复杂铜硫物相被溶解,Cu的浸出率得到了提高。
表4 不同H2O2加入量条件下终渣铜物相
Table 4 Final copper phase in residue under condition of H2O2 dose
2.1.6 锌窑渣粒径对锌窑渣中金属浸出率的影响
实验中取锌窑渣50 g,在液固比(mL/g)10:1,反应温度30 ℃,H2O2水溶液加入量为16 mL条件下反应3 h。锌窑渣粒径对各元素的浸出率的影响如图10所示。
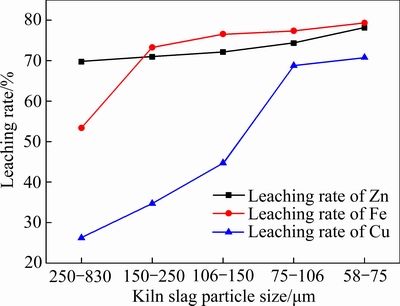
图10 锌窑渣粒径对污酸浸出锌窑渣的影响
Fig. 10 Effect of kiln slag particle size on leaching rate of metals in kiln slag
由图10可知,随着锌窑渣粒径的减小,各元素的浸出率逐渐增大,当锌窑渣粒径从250~830 μm减小到75~106 μm时,Zn的浸出率从69.74%增加至74.74%,Fe的浸出率由53.39%升至77.39%,Cu的浸出率由26.22%升至70.79%,这是因为随着锌窑渣粒径减小,其比表面积增大,液固两相间的接触增多,利于浸出反应的进行,因此浸出率也逐渐升高。其中Cu的浸出率受锌窑渣粒径影响较大,如表3可知,Cu在锌窑渣中主要以复杂硫化物相存在,在对锌窑渣进行磨矿分级时,破坏了部分含Cu物相的矿物表面结构,使得形貌嵌布复杂的难溶硫化物相得以更充分地与污酸接触参与反应。
2.2 综合实验
通过上文的条件实验确立了锌窑渣与污酸联合浸出的综合实验条件:取锌窑渣50 g,锌窑渣粒径为75~106 μm,在液固比(mL/g)10:1,反应温度50 ℃,H2O2水溶液加入量为16 mL条件下反应3 h。在此条件下进行实验,得到的各金属浸出率如表5所列。
表5 综合条件实验各金属浸出率
Table 5 Comprehensive conditions of each metal leaching rate
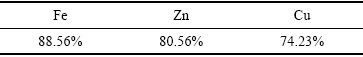
由表5可知,在综合条件下进行实验,Fe、Zn、Cu的浸出率均有所提高,Fe的浸出率达到88.56%,Zn的浸出率达到80.56%,Cu的浸出率提升至74.23%。浸出液酸度降至88.2 g/L。
2.3 二段逆流浸出工艺
为了进一步提高金属的浸出率,同时降低终酸的酸度,本文在综合条件实验的基础上进行二段逆流浸出实验,在二段浸出时使用高温高酸条件,在提高Fe、Zn、Cu的浸出率的同时富集渣中的Ag,便于后续的回收处理。
实验在一段浸出时,取锌窑渣50 g, 锌窑渣粒径为75~106 μm,在液固比(mL/g)10:1,反应温度为50 ℃,H2O2水溶液加入量为16 mL条件下反应3 h。二段浸出时改以液固比9:1,反应温度为85 ℃,不添加H2O2条件下反应3 h,得到的浸出液再返回到一段浸出。其工艺流程如图11所示,实验结果如表6~9所列。
如表6所列,在一段浸出后,溶液中的酸度降至89.16 g/L,将其返回一段浸出,进行3个循环的逆流浸出实验,其结如果如表7、8、9所列,经二段浸出反应后, Fe的总浸出率最高达到94.58%,Cu的总浸出率达到96.25%,Zn的总浸出率达到95.64%。浸出渣中的Ag富集比达到2倍,品位最高达到484.7 g/t,可作为提银原料。浸出后液中的As浓度达到9 g/L左右,全铁浓度为25 g/L左右且大多以Fe2+形式存在,Cu2+接近1.7 g/L,Zn2+浓度接近2 g/L,有价金属得到有效回收。浸出后液的酸度最低降至约20 g/L,这也表明本文所适用的污酸酸度范围大致应在20 g/L以上。
表6 一段浸出液的成分
Table 6 Composition in first stage leachate (g/L)

图12(a)所示为二段逆流浸出渣的XRD谱。由图12(a)可知,浸出渣中主要物相为CaSO4·2H2O,锌窑渣中原有的大量Fe3O4、Fe2O3、CuFeS2等已不可见,锌窑渣中的金属物相基本被溶解,因此各金属浸出率得到进一步提高,但图中还出现了CuFe2O4和CuFe2S3的衍射峰,表明锌窑渣中仍有部分铜铁硫化物未被溶解,另外锌窑渣中还出现了单质硫的衍射峰,这是由于锌窑渣中的铜铁硫化物被氧化所产生的。
对浸出渣进行SEM-EDS分析,结果如图12(b)和图13所示。由图12(b)和图13可知,渣相的表面粗糙,形貌多样,Ca、S、O表现出较强的特征衍射峰;同时还有部分的C、Si、Fe峰,结合XRD谱可知渣中主要成分应为CaSO4·2H2O。锌窑渣中的许多复杂形貌的物相已不可见,大部分在浸出环节被溶解。而锌窑渣中的碳块和SiO2并未被溶解,另外还有部分的Fe物相与碳块和SiO2存在相互包裹,因此未能被浸出到溶液中。
表7 逆流浸出实验各金属浸出率
Table 7 Metals leaching rate of countercurrent leaching experiments
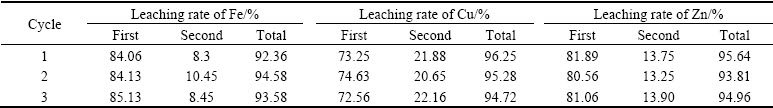
表8 二段浸出渣中的成分
Table 8 Composition of second stage leaching residue
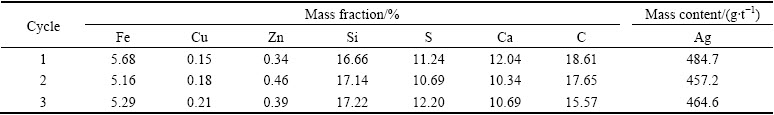
表9 逆流浸出上清液成分
Table 9 Chemical compositions of countercurrent leachate

图11 逆流浸出工艺流程示意图
Fig. 11 Schematic diagram of reflux leach process
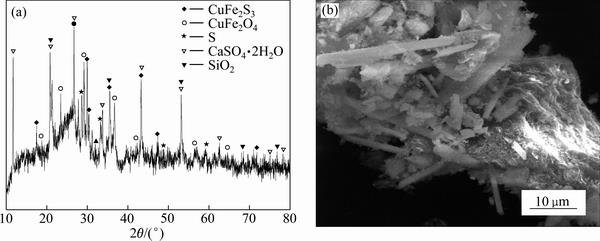
图12 二段浸出渣的XRD谱及SEM像
Fig. 12 XRD pattern(a) and SEM image(b) of second stage leaching residue
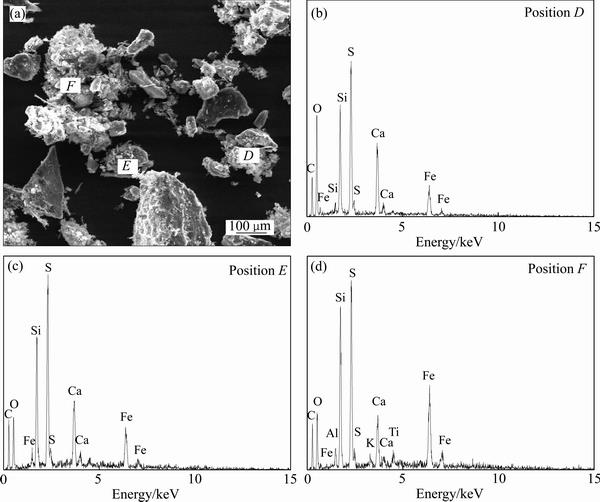
图13 二段浸出渣的SEM像和EDS谱
Fig. 13 SEM image(a) and EDS spectra((b), (c), (d)) of second stage leaching residue
2.4 浸出后液的分离与提纯
逆流浸出后液的成分如表8所列,浸出后液中的As浓度达到9 g/L左右,Fe2+浓度超过20 g/L,酸度为20 g/L左右,根据FUJITA等[27-28]的研究,已符合利用水热合成臭葱石法沉砷的条件。在90 ℃条件下通入氧气4 h,生成了稳定的臭葱石,沉砷率达95%以上。浸出后液中Cu2+达到1.7 g/L左右,利用铁粉置换法沉淀溶液中的Cu。在铁粉加入系数为1.3的条件下,铜沉淀率超过99%。Zn2+浓度近2 g/L,可利用萃取法富集回收Zn。
3 结论
1) 在锌窑渣用量50 g、反应时间3 h、H2O2水溶液加入量16 mL、液固比(mL/g)10:1、反应温度50 ℃,锌窑渣粒径75~106 μm条件下,Zn、Fe的浸出率可达80%以上,Cu的浸出率可达70%以上。进行二段逆流浸出实验,Fe的浸出率超过90%,Cu、Zn的浸出率达95%左右。有价金属得到有效回收,同时污酸被大量消耗。
2) 浸出后液中Fe2+超过20 g/L,As浓度达9 g/L左右,酸度为20 g/L左右;采用水热合成臭葱石法进行沉砷处理,沉砷率可达95%以上;Cu2+浓度为1.7 g/L左右,利用铁粉置换法回收溶液中的Cu;Zn2+近2 g/L,可采用萃取法对其进行富集。
3) 浸出渣中主要成分为CaSO4·2H2O和SiO2以及焦炭,易于后续处理。渣中Ag得到2倍的富集,其品位最高达484.7 g/t。
REFERENCES
[1] 马 娇, 焦红光, 潘兰英, 张传祥, 张宏方. 干法磁选在锌挥发窑窑渣综合利用中的应用研究[J]. 河南理工大学学报(自然科学版), 2009, 28(6): 788-791.
MA Jiao, JIAO Hong-guang, PAN Lan-ying, ZHANG Chuan-xiang, ZHANG Hong-fang. Research on recycle and reuse zinc volatile kiln slag by magnetic separation[J]. Journal of Henan Polytechnic University(Natural Science), 2009, 28(6): 788-791.
[2] BARNA R, BAE H R, MEHU J, VAN DER SLOOT H, MOSZKOWICZ P, DENOYERS C. Assessment of chemical sensitivity of Waelz slag[J]. Waste Manage, 2000, 20: 115-124.
[3] 何仕超. 湿法炼锌窑渣铁精矿综合利用研究[D]. 长沙: 中南大学, 2013: 1-6.
HE Shi-chao. Comprehensive utilization of iron concentrate separated from kiln slag in zinc hydrometallurgy[D]. Changsha: Central South University, 2013: 1-6.
[4] 李 静, 牛 皓, 彭金辉, 张世敏, 张利波, 魏 昶, 范兴祥, 黄孟阳. 锌窑渣综合回收利用研究现状及展望[J]. 矿产综合利用, 2008(6): 44-48.
LI Jing, NIU Hao, PENG Jin-hui, ZHANG Shi-min, WEI Chang, FAN Xing-xiang, HUANG Meng-yang. Present situation and prospect about comprehensive utilization of zinc kiln slag[J]. Multipurpose Utilization of Mineral Resources, 2008(6): 44-48.
[5] MATTHES J, WAIBEL P, KELLER H B. A new infrared camera-based technology for the optimization of the Waelz process for zinc recycling[J]. Minerals Engineering, 2011, 24: 944-949.
[6] 张登凯. 锌挥发窑渣综合利用研究[D]. 长沙: 中南大学, 2004: 6-51.
ZHANG Deng-kai. Study on comprehensive utilization of zinc kiln slags[D]. Changsha: Central South University, 2004: 6-51.
[7] WANG Hong-jun, LIU Zhi-yong, LIU Zhi-hong, LI Yu-hu, LI Si-wei, ZHANG Wen-hai, LI Qi-hou. Leaching of iron concentrate separated from kiln slag in zinc hydrometallurgy with hydrochloric acid and its mechanism[J]. Transaction of Nonferrous Metals Society of China, 2017, 27: 901-907.
[8] 马 娇. 锌挥发窑窑渣干法磁选的应用研究[D]. 焦作: 河南理工大学, 2010: 3-68.
MA Jiao. Application study on dry magnetic separation in volatile kiln zinc slag[D]. Jiaozuo: Journal of Henan Polytechnic University, 2010: 3-68.
[9] 王红军, 张文海, 刘志宏, 李启厚, 何仕超, 李思唯, 刘智勇. 窑渣铁精矿综合利用新工艺[J]. 中国有色金属学报, 2016, 26(3): 673-680.
WANG Hong-jun, ZHANG Wen-hai, LIU Zhi-hong, LI Qi-hou, LI Si-wei, LIU Zhi-yong. Novel process for comprehensive utilization of iron concentrate recovered from zinc kiln slag[J]. The Chinese Journal of Nonferrous Metals, 2016, 26(3): 673-680.
[10] 何仕超, 刘志宏, 刘智勇, 李玉虎, 李启厚. 湿法炼锌窑渣铁精矿的浸出热力学分析[J]. 中国有色金属学报, 2013, 23(12): 3430-3439.
HE Shi-chao, LIU Zhi-hong, LIU Zhi-yong, LI Yu-hu, LI Qi-hou. Thermodynamic analysis of leaching of iron concentrate separated from kiln slag in zinc hydrometallurgy[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(12): 3430-3439.
[11] JIANG Kai-qi, GUO Zhao-hui, XIAO Xi-yuan, WEI Xiao-yin. Effect of moderately thermophilic bacteria on metal extraction and electrochemical characteristics for zinc smelting slag in bioleaching system[J]. Transaction of Nonferrous Metals Society of China, 2012, 22: 3120-3125.
[12] ZHANG Yan-sheng, QIN Wen-qing, WANG Jun, ZHEN Shi-jie. Bioleaching of chalcopyrite by pure and mixed culture[J]. Transactions of Nonferrous Metals Society of China, 2008, 18: 1491-1496.
[13] NAN Z, WEI C, YANG L. Occurrence of arsenic in two large shallow freshwater lakes in China and a comparison to other lakes around the world[J]. Microchemical Journal, 2013, 110: 169-177.
[14] 王 勇, 赵攀峰, 郑雅杰. 含砷废酸制备亚砷酸铜及其在铜电解液净化中的应用[J]. 中南大学学报(自然科学版), 2007, 38(6): 1115-1120.
WANG Yong, ZHAO Pan-feng, ZHENG Ya-jie. Preparation of copper arsenite from waste acid containing arsenic and its application in copper electrolyte purification[J]. Journal of Central South University(Science and Technology), 2007, 38(6): 1115-1120.
[15] 郑雅杰, 罗 园, 王 勇. 采用三氧化二砷还原沉淀法制备三氧化二砷[J]. 中南大学学报(自然科学版), 2009, 40(1): 48-54.
ZHENG Ya-jie, LUO Yuan, WANG Yong. Preparation of arsenic trioxide by arsenic trioxide reduction precipitation method[J]. Journal of Central South University(Science and Technology), 2009, 40(1): 48-54.
[16] WANG Hong-jie, GONG Wen-xin, LIU Rui-ping, LIU Hui-juan, QU Jiu-hui. Treatment of high arsenic content wastewater by a combined physical-chemical process[J]. Colloids and Surface A: Physiochemical and Engineering Aspects, 2011, 379(1/3): 116-120.
[17] ZHOU Wen-ke, PENG Ying-lin, ZHENG Ya-jie, MA Yu-tian, CUI Tao. Reduction and deposition of aesenic in copper electrolyte[J]. Transaction of Nonferrous Metals Society of China, 2011, 21(12): 2772-2777.
[18] MOHAN D, PITTMAN C U Jr. Arsenic removal from water/wastewater using absorbents: A critical review[J]. Journal of Hazardous Materials, 2007, 142(1/2): 1-53.
[19] 易求实, 杜冬云, 鲍霞杰, 曹龙文, 李敦顺. 高效硫化回收技术处理高砷净化污酸的研究[J]. 硫酸工业, 2009(6): 6-10.
YI Qiu-shi, DU Dong-yun, BAO Xia-jie, CAO Long-wen, LI Dun-shun. Study on treatment of high-arsenic waste acid from cleaning section using high-efficiency sulphuration recovery technology[J]. Sulfuric Acid Industry, 2009(6): 6-10.
[20] 郑雅杰, 张胜华, 龚 昶. 含砷污酸资源化回收铜和砷的新工艺[J]. 中国有色金属学报, 2013, 23(10): 2985-2992.
ZHENG Ya-jie, ZHANG Sheng-hua, GONG Chang. Novel technique for recovery of copper and arsenic from arsenic-containing waste acid[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(10): 2985-2992.
[21] PRASAD B, GHOSH C CHAKRABORTY A, BANDYOPADHYAY N, RAY R K. Adsorption of arsenite(As3+) on nano-sized Fe2O3 waste powder from the steel industry[J]. Desalination, 2011, 274(1): 105-112.
[22] 赖绍师. 中等嗜热菌(S. thermosulfidooxidans)浸出黄铜矿研究[D]. 长沙: 中南大学, 2011: 25-29.
LAI Shao-shi. Studieson moderate thermophile (S. thermosulfidooxidans) leaching chalcopyrite[D]. Changsha: Central South University, 2011: 25-29.
[23] JIN Z M, WARREN G W, HENEIN H. An investigation of the electrochemical nature of the ferric chloride leaching of sphalerite[J]. International Journal of Mineral Processing, 1993, 37(3/4): 223-238.
[24] PETTINE M, CAMPANELLA L, MILLERO F J. Arsenite oxidation by H2O2 in aqueous solutions[J]. Geochimica Et Cosmochimica Acta, 1999, 63(18): 2727-2735.
[25] 顾帼华, 郭玉武. 细菌-矿物接触/非接触模式下黄铜矿浸出溶解行为[J]. 中南大学学报(自然科学版), 2011(8): 2167-2172.
GU Guo-hua, GUO Yu-wu. Chalcopyrite dissolution behavior under microbe-mineral contact/uncontact model[J]. Journal of Central South University(Science and Technology), 2011(8): 2167-2172.
[26] GU Guo-hua, XIONG Xian-xue, HU Ke-ting, LI Shuang-ke, WANG Chong-qing. Stepwise dissolution of chalcopyrite bioleaching by thermophile A. manzaensis and mesophile L. ferriphilum[J]. Journal of Central South University, 2015, 22(10): 3751-3759.
[27] FUJITA T,TAGUDHI R, ABUMIYA M, MATSUMOTO M, SHIBATA E, NAKAMURA T. Effect of pH on atmospheric scorodite synthesis by oxidation of ferrous ions: Physical properties and stability of the scorodite[J]. Hydrometallurgy, 2009, 96(3): 189-198.
[28] FUJITA T, TAGUDHI R, ABUMIYA M, MATSUMOTO M, SHIBATA E, NAKAMURA T. Novel atmospheric scorodite synthesis by oxidation of ferrous sulfate solution. Part Ⅰ[J]. Hydrometallurgy, 2008, 90: 2-4.
New process for combined leaching of zinc kiln slag and waste acid from zinc hydrometallurgy
ZENG Tao, DENG Zhi-gan, FAN Gang, WEI Chang, ZHANG Fan, GAN Xiang-dong, LI Xing-bin, LIU Hui-yang
(Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China)
Abstract: Large amount of valuable metals are contained in kiln slag produced in zinc hydrometallurgy. The waste acid in zinc metallurgy has the characteristics of complex composition, high acidity and large amount of arsenic and other heavy metal ions. The zinc kiln slag and waste acid were leached combined according to the physical and chemical properties. The effect of the combined leaching behavior on kiln slag and waste acid was investigated by the conditions, including reaction time, reaction temperature, solid-liquid ratio, the addition of H2O2, and particle size of kiln slag. The experimental results show that after the two stages reflux leaching, the leaching rates of copper, iron, zinc are higher than 90% for 50 g kiln slag, 3 h reaction time, 50 ℃ reaction temperature, 10:1 mL/g liquid-solid ratio, 16 mL H2O2, 75-106 μm kiln slag particle size, respectively. The acidity of leach solution decreases from 172.48 g/L to about 20 g/L and the arsenic concentration reaches about 9 g/L, which provide conditions for subsequent arsenic treatment. The main phases of residue are CaSO4·2H2O, SiO2 and coke according to the analysis of leaching residue. The silver grade is up to 484.7 g/t, which can be used as raw material for extracting silver.
Key words: zinc kiln slag; waste acid; combined leaching; zinc hydrometallurgy
Foundation item: Projects(51804146, 51564030, 51664030, 51664029, 51664038) supported by the National Natural Science Foundation of China; Project(2018YFC1900402) supported by National Key Research and Development Program of China
Received date: 2018-11-12; Accepted date: 2019-06-24
Corresponding author: DENG Zhi-gan; Tel: +86-15925127947; E-mail: dengzhigan83@163.com
(编辑 王 超)
基金项目:国家自然科学基金资助项目(51804146,51564030,51664030,51664029,51664038);国家重点研发计划固废资源化专项(2018YFC1900402)
收稿日期:2018-11-12;修订日期:2019-06-24
通信作者:邓志敢,讲师,博士;电话:15925127947;E-mail:dengzhigan83@163.com
摘 要:湿法炼锌过程中产生的窑渣含有大量的有价金属。锌冶炼污酸具有成分复杂、酸度高、含有大量的砷及其他重金属离子的特点。根据锌窑渣和污酸的理化性质,将二者进行联合浸出处理,考察反应时间、反应温度、液固比、H2O2加入量、窑渣粒径对锌窑渣与污酸联合浸出行为的影响。结果表明:在反应时间3 h、反应温度50 ℃、液固比(mL/g) 10:1、H2O2加入量为16 mL、窑渣粒径75~106 μm条件下进行二段逆流浸出,铜、铁、锌的浸出率均高于90%。浸出后液的酸度从172.48 g/L降至20 g/L左右,砷浓度达9 g/L左右,为后续沉砷处理提供了条件。另外,对浸出渣进行分析,可知浸出渣中主要物相为CaSO4·2H2O、SiO2和焦炭,其中银品位最高达484.7 g/t,可作为提银原料。
[1] 马 娇, 焦红光, 潘兰英, 张传祥, 张宏方. 干法磁选在锌挥发窑窑渣综合利用中的应用研究[J]. 河南理工大学学报(自然科学版), 2009, 28(6): 788-791.
[3] 何仕超. 湿法炼锌窑渣铁精矿综合利用研究[D]. 长沙: 中南大学, 2013: 1-6.
[4] 李 静, 牛 皓, 彭金辉, 张世敏, 张利波, 魏 昶, 范兴祥, 黄孟阳. 锌窑渣综合回收利用研究现状及展望[J]. 矿产综合利用, 2008(6): 44-48.
[6] 张登凯. 锌挥发窑渣综合利用研究[D]. 长沙: 中南大学, 2004: 6-51.
[8] 马 娇. 锌挥发窑窑渣干法磁选的应用研究[D]. 焦作: 河南理工大学, 2010: 3-68.
[9] 王红军, 张文海, 刘志宏, 李启厚, 何仕超, 李思唯, 刘智勇. 窑渣铁精矿综合利用新工艺[J]. 中国有色金属学报, 2016, 26(3): 673-680.
[10] 何仕超, 刘志宏, 刘智勇, 李玉虎, 李启厚. 湿法炼锌窑渣铁精矿的浸出热力学分析[J]. 中国有色金属学报, 2013, 23(12): 3430-3439.
[14] 王 勇, 赵攀峰, 郑雅杰. 含砷废酸制备亚砷酸铜及其在铜电解液净化中的应用[J]. 中南大学学报(自然科学版), 2007, 38(6): 1115-1120.
[15] 郑雅杰, 罗 园, 王 勇. 采用三氧化二砷还原沉淀法制备三氧化二砷[J]. 中南大学学报(自然科学版), 2009, 40(1): 48-54.
[19] 易求实, 杜冬云, 鲍霞杰, 曹龙文, 李敦顺. 高效硫化回收技术处理高砷净化污酸的研究[J]. 硫酸工业, 2009(6): 6-10.
[20] 郑雅杰, 张胜华, 龚 昶. 含砷污酸资源化回收铜和砷的新工艺[J]. 中国有色金属学报, 2013, 23(10): 2985-2992.
[22] 赖绍师. 中等嗜热菌(S. thermosulfidooxidans)浸出黄铜矿研究[D]. 长沙: 中南大学, 2011: 25-29.
[25] 顾帼华, 郭玉武. 细菌-矿物接触/非接触模式下黄铜矿浸出溶解行为[J]. 中南大学学报(自然科学版), 2011(8): 2167-2172.


