锰胁迫下商陆生理响应的FTIR分析
薛生国,王钧,刘恒,雷杰,刘丰豪
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘要:以新发现的锰耐性植物商陆为实验材料,研究在不同Mn2+浓度下(0.005,0.2,0.5,1.0,2.0,5.0和10.0 mmol/L)商陆不同组织器官的傅里叶红外光谱(FTIR)图谱变化。研究结果表明:茎组织在3 420和2 926 cm-1处峰高先上升后下降,反映糖类和氨基酸等有机物在低Mn2+条件下往往作为渗透性调节物质出现, 其含量升高;但随着Mn2+浓度的升高, 其合成和运输受限, 有机物含量逐渐下降;根组织在2 926 cm-1处峰先减弱后增强, 说明商陆分泌的有机酸不断螯合Mn2+, 造成羧酸O—H减少;随着Mn2+浓度的升高, 其羧酸螯合力变弱;叶组织在1 640 cm-1处的显著吸收峰可能与商陆叶中氨基酸、多肽和蛋白质类物质含量升高有关,或与根部输送的羧酸盐过多有关,且与根部此处峰值的下降趋势相吻合;商陆根、茎、叶在1 060 cm-1处和最高浓度下峰值的变化主要表现在膜脂过氧化,这可能与商陆的锰耐性有关。
关键词:
中图分类号:O657.3 文献标志码:A 文章编号:1672-7207(2011)07-1852-06
Physiological response of Phytolacca acinosa to
manganese stress by FTIR spectroscopy
XUE Sheng-guo, WANG Jun, LIU Heng, LEI Jie, LIU Feng-hao
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: A technique based on Fourier transform infrared (FTIR) spectrometry was used to explore the physiological changes in chemical composition of Phytolacca acinosa in a wide range of Mn2+ concentration (0.005, 0.2, 0.5, 1.0, 2.0, 5.0, 10.0 mmol/L). The results show that the absorption bands at 3 420 and 2 926 cm-1 of stem tissues increase firstly and then decrease, indicating the exudation and transporting situation of organic substances which serves as organic osmotic contents to enhance manganese tolerance during low treatments. Meanwhile, the bands at 2 926 cm-1(roots) and 1 640 cm-1(leaves) have different tendencies in accordance with Mn2+ treatments, which shows that the capability to chelate Mn decreases under higher manganese concentration. In addition, the changes of the bands at 1 060 cm-1 differ from each other, suggesting that under the conditions of Mn2+ concentration, the ex-oxidation of membrane lipid increases. It is practical to apply FTIR to compare the chemical differences of the tolerate plants during metal treatments.
Key words: FTIR; Phytolacca acinosa roxb.; manganese stress; chemical composition; tolerance
重金属具有不可降解性和持久性,通过食物链积累在动植物体内,对生物和人体健康构成严重威胁。随着人们环保意识的增强,锰在冶金、陶瓷、玻璃、电池、防腐材料、汽油防爆剂和农药等方面广泛使用以及对锰矿开采引起的土壤、地表水和地下水的Mn2+污染日益得到关注[1-3]。具有超富集特性的耐性植物清除土壤和水体环境中的金属和类金属污染-植物修复技术(Phytoremediation)具有潜在的高效、廉价及其环境友好性,通过种植收割这类植物可有效地治理环境中的重金属污染[4]。植物对重金属的耐性可通过金属排斥(Metal exclusion)和金属积累(Metal accumulation)这2条途径进行。金属排斥是指重金属被植物吸收后又排出体外,或者重金属在植物体内的运输受到阻碍;金属积累是指重金属在植物体内以不具有生物活性的解毒形态存在[5]。超积累植物是一种极端的金属积累型植物,因其超寻常的重金属积累能力而被广泛应用于污染环境修复研究[6-10]。研究不同Mn2+处理条件下商陆不同组织器官化学组成上的差异将有助于揭示其Mn2+耐性机理。红外光谱中反映的是植物中混合成分的叠加,各种化学成分只要质和量相对稳定,样品的处理方法按统一要求进行,则其红外光谱是相对稳定的。任立民等[11]利用傅里叶变换红外光谱(FTIR)研究垂序商陆对锰毒生理响应。在此,本文作者利用FTIR对商陆不同组织器官的化学组成进行研究,以期为Mn2+污染环境修复和Mn2+耐性机理研究提供参考。
1 材料与方法
1.1 试验方法
将商陆种子播于湿沙,萌芽后依次在0.25 Hoagland营养液和0.50 Hoagland营养液预培养15 d,选择生长一致的商陆幼苗移至外壁不透光的塑料容器。Mn2+浓度设定为7种,分别为0.005,0.2,0.5,1.0,2.0,5.0和10.0 mmol/L。Mn以MnCl2的形式加入,每个实验重复3次。每4 d换1次营养液,保持连续通气。植物在35 d后收获,用去离子水洗净,称质量,分别取根、茎、叶3部分于105 ℃杀青30 min,然后于75 ℃烘箱中干燥48 h,用不锈钢粉碎机粉碎,过75 μm筛。
1.2 傅里叶红外光谱分析
按照所给定的测试条件(光谱范围 为500~4 000 cm-1,分辨率为4 cm-1,扫描累加次数为32次),采用美国Nicolet公司制造的Nexus 670型傅里叶变换红外光谱仪对商陆根、茎和叶的粉末样品进行测定。应用OMNI采样器直接测定红外光谱,并采用OMNIVE. S.P 5.1同步智能软件对图谱进行分析。
2 结果与讨论
2.1 根的FTIR分析
不同Mn2+浓度下商陆根系的傅里叶红外光谱见图1,商陆根系的特征峰见图2。从图1可见:3 420 cm-1处附近的峰是分子间氢键O—H自由羟基的伸缩振动峰,主要来自于纤维素、半纤维素、多糖等碳水化合物[12];随着Mn2+浓度的升高,吸收峰移向低频3 390 cm-1,同时峰形变窄。从图2可见:在Mn2+浓度低于1.0 mmol/L时,随着Mn2+浓度的升高,吸光度先上升后下降,说明低浓度Mn2+促进了商陆根部碳水化合物的分泌;同时,随着Mn2+浓度的升高,根外表皮细胞壁的羟基吸附结合Mn2+形成稳定的化合物,使细胞表面的氢键减少;当Mn2+浓度大于2.0 mmol/L时,峰值再次出现上升的变化趋势,说明高浓度Mn2+可能破坏了根外表皮细胞壁的羟基吸附结合Mn2+的机制,导致根外表皮细胞壁的羟基无法吸附结合Mn2+,引起峰值升高。

图1 不同Mn2+浓度条件下商陆根系的傅里叶红外光谱图
Fig.1 Absorption FTIR spectra in roots of P. acinosa in different Mn2+ concentrations
2 926 cm-1左右的吸收峰是饱和C—H键的伸缩振动吸收峰,主要来自于细胞壁中蛋白质、纤维素和果胶等组织成分(图1)。当Mn2+浓度小于1.0 mmol/L时,随着Mn2+浓度的增加,吸光度先升后降(图2);商陆的根部由于耐性机制不断分泌有机酸螯合Mn2+,但是,前期Mn2+处理浓度较低,螯合Mn2+的有机酸消耗速率小于根部的有机酸分泌速率,导致羧酸频带上升;随着Mn2+浓度的增加,螯合Mn2+的有机酸消耗速率大于根部的有机酸产生速率,羧酸频带又开始下降;当Mn2+浓度大于1.0 mmol/L时,随着Mn2+毒害的进一步加重,其羧酸螯合力变弱,因而其频带 上升。

图2 不同Mn2+浓度下商陆根系的特征峰变化图
Fig.2 Band height changes in roots of P. acinosa in different Mn2+ concentrations
1 735~1 720 cm-1处的峰为脂肪族酮类化合物中羰基的C=O伸缩振动峰。在1 735 cm-1附近,随着Mn2+浓度的升高,前期峰值降低,但最高浓度处理下,开始出现显著吸收峰,峰值达到最大(图2)。这可能是因为初期商陆膜质过氧化,使脂类物质减少,但含脂肪族酮类化合物中羰基的产物也逐渐增多,因而后期开始升高。
1 380 cm-1附近的吸收带是含油脂化合物(各种膜和胞壁)的组织中甲基的吸收带。在Mn2+浓度为0.2 mmol/L时,峰值小幅度上升,可能是由于低浓度Mn2+促进了商陆根部含油脂化合物的分泌。但是,在Mn2+浓度大于0.2 mmol/L时,随着Mn2+浓度的进一步增大,其峰值表现先减小后增大, 峰形也出现多向短波位移(见图1),这也说明随着Mn2+浓度的升高,细胞壁通过降低果胶甲基化程度,使CEC(阳离子交换能力)增强,进而吸收更多的Mn2+,即通过细胞壁中积累Mn2+来增强抗逆性,但高浓度的Mn2+已对商陆产生了胁迫,甲基化程度又开始升高。
1 060 cm-1附近吸收峰为碳水化合物(醇、醚基、酯基或酚)的C—O基团的伸缩振动峰(图1)[12]。当Mn2+浓度小于0.5 mmol/L时,随着Mn2+浓度的升高,吸光度先升后降,说明低浓度Mn2+促进该类物质的合成,也可能是由于化学吸附羟基与Mn2+作用,导致C—O峰值增加;当Mn2+浓度升高时,糖类运输通道受到一定影响,致使部分糖类物质无法运输到根部;当Mn2+浓度大于0.5 mmol/L时,膜过氧化机制对峰值变化起主导作用;随着Mn2+浓度的升高,膜过氧化程度加深,脂肪族酮类化合物过氧化产物在根部积累,引起峰值升高;而在Mn2+浓度为10.0 mmol/L时,高浓度的Mn2+破坏了此机制,造成脂肪族酮类化合物过氧化产物减少,峰值下降[13-15]。
2.2 茎的FTIR分析
不同Mn2+浓度下商径根的傅里叶红外光谱和特征峰分别见图3和图4。从图3可见:当Mn2+浓度小于1.0 mmol/L时,3 420 cm-1附近吸收峰的峰值无明显变化,说明商陆茎中碳水化合物成分没有明显变化,这也表明当Mn2+浓度大于1.0 mmol/L时,在外部Mn2+的胁迫下,商陆茎中的生理过程受影响程度较小,也表现出商陆对Mn2+的耐性特征。而随着Mn2+浓度的升高,该峰的吸光度先升后降。这说明后期Mn2+浓度的升高,促进了有机物的分泌和运输,通过渗透作用来增强茎对Mn2+的抗逆性,但在Mn2+浓度为10.0 mmol/L时,Mn2+的毒性加剧,茎细胞的细胞壁的羟基吸附结合Mn2+,使细胞表面的氢键减少,引起峰值下降。
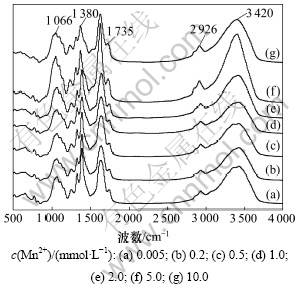
图3 不同Mn2+浓度下商陆茎的傅里叶红外光谱图
Fig.3 Absorption FTIR spectra in stems of P. acinosa. in different Mn2+ concentrations

图4 不同Mn2+浓度下商陆茎的特征峰变化图
Fig.4 Band height changes in stems of P. acinosa in different Mn2+ concentrations
由图3可以看出:2 926 cm-1附近吸收峰峰形未发生明显位移,肩峰变化不大。随着Mn2+浓度的增加,吸光度前期变化不大,当Mn2+浓度为2.0 mmol/L时,有轻微升高与下降(图4)。这说明当Mn2+浓度低于2.0 mmol/L时,低浓度Mn2+对商陆茎的运输功能影响不大,在5.0 mmol/L时,反而促进商陆产生碳水化合物等物质增强其Mn2+耐性;但当Mn2+浓度为10.0 mmol/L时,已影响碳水化合物等的合成和运输。
由图4可以看出:随着Mn2+浓度的升高,前期 1 735~1 720 cm-1处的吸收峰峰值无明显变化,但在Mn2+浓度为5.0 mmol/L时,出现显著吸收峰,峰值达到最大;而当Mn2+浓度为10.0 mmol/L时,峰值下降。这可能是因为在一定Mn2+浓度的刺激下会产生脂肪族酮类化合物等物质,通过渗透调节来增强抗逆性,但随着Mn2+毒的加剧,脂肪族酮类化合物等物质合成减少,峰值下降。
随着Mn2+浓度的升高,1 380 cm-1附近吸收峰的峰值先下降后上升,在当Mn2+浓度为10.0 mmol/L时,峰值再次出现下降(图4)。这可能是因为随着Mn2+浓度的升高,细胞壁通过降低果胶甲基化程度,使CEC(阳离子交换能力)增强,进而吸收更多的Mn2+,即通过细胞壁中累积Mn2+来增强抗逆性,但高浓度的Mn2+已对商陆产生了胁迫,甲基化程度又开始升高,关于在Mn2+浓度为10.0 mmol/L处峰值下降的原因有待进一步研究。
由图3看出:随着Mn2+浓度的升高,1 060 cm-1处的最大吸收带由对照的1 060 cm-1位移到1 052 cm-1附近,但峰形变化不大,肩峰变化不明显;当Mn2+浓度小于1.0 mmol/L时,随着Mn2+浓度的升高,吸光度变化不大;但当Mn2+浓度为5.0 mmol/L时,出现显著吸收峰,峰值达到最大;而当Mn2+浓度为10.0 mmol/L时,峰值下降;当Mn2+浓度为2.0~5.0 mmol/L时,膜过氧化机制对峰值变化起主导作用,随着Mn2+浓度的升高,膜过氧化程度加深,脂肪族酮类化合物过氧化产物在根部积累,引起峰值升高。而在Mn2+浓度为10.0 mmol/L时,高浓度的Mn2+可能破坏了此机制,造成脂肪族酮类化合物过氧化产物减少,引起峰值下降[13-15]。
2.3 叶的FTIR分析
Mn2+浓度不同时商陆叶的红外光谱和特征峰分别见图5和图6。从图5可见:当Mn2+浓度低于1.0 mmol/L时,随着Mn2+浓度的升高,3 420 cm-1附近吸收峰的峰值下降,说明叶片表皮细胞壁的羟基吸附结合Mn2+,使细胞表面的氢键减少(图6);而当Mn2+浓度达到2.0 mmol/L时,吸光度上升,说明后期Mn2+浓度的升高,促进了有机物的分泌和运输,通过渗透作用来增强茎对Mn2+的抗逆性,同时高浓度的Mn2+阻碍了这些有机物的合成和运输。
2 926 cm-1处吸收峰为羧酸O—H与甲基C—H键的伸缩振动重叠,主要来自于维生素和各种膜及细胞壁的组织成分等[12](图5),这与运输功能有关。该处峰的峰值随着Mn2+浓度增加先升高后下降(图6),表明说明前期商陆分泌的有机酸不断螯合Mn 2+,造成羧酸O—H 的减少,随着Mn2+毒害的加重,其羧酸螯合力变弱。
在低外源Mn条件下,1 650~1 620 cm-1处的峰值在处理前期下降,说明随着Mn2+浓度的升高,蛋白二级结构中,肽键间氢键的结合力随着Mn2+浓度的升高而变弱(图6)。而在Mn2+浓度为2.0 mmol/L时,出现显著吸收峰,可能是由于不断增加的Mn2+诱导富脯氨酸蛋白、病害相关蛋白和富甘氨酸蛋白等一些蛋白合成,Didierjean等[16]还认为这些重金属胁迫诱导蛋白可能具有保护植物细胞免受重金属毒害的作用,出现的显著吸收峰可能与商陆叶中氨基酸、多肽和蛋白质类物质含量升高有关。当Mn2+浓度为5.0和10.0 mmol/L时,吸光度下降,可能是高浓度的Mn2+毒破坏了重金属胁迫诱导蛋白合成机制所致。

图5 不同Mn2+浓度下商陆叶的傅里叶红外光谱图
Fig.5 Absorption FTIR spectra in leaves of P. acinosa in different Mn2+ concentrations
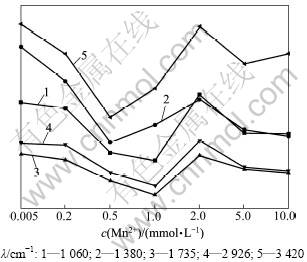
图6 不同Mn2+浓度下商陆叶的特征峰变化图
Fig.6 Band height changes in leaves of P. acinosa in different Mn2+ concentrations
随着Mn2+浓度的升高,1 380 cm-1附近的峰值表现先降后升的趋势,但在Mn2+浓度为2.0 mmol/L时,又出现轻微下降。这说明随着Mn2+浓度的增大,细胞壁通过降低果胶甲基化程度,进而吸收更多的Mn2+,即通过细胞壁中积累Mn2+来增强抗逆性,但高浓度的Mn2+对商陆产生了胁迫,甲基化程度又开始升高;当Mn2+浓度为2.0 mmol/L时,又出现轻微下降的原因可能是高浓度的Mn2+抑制了细胞内含油脂化合物产生。
从图5可见:在Mn2+浓度小于1.0 mmol/L时,随着Mn2+浓度的升高,1 060 cm-1附近吸收峰的峰值下降,说明当Mn2+浓度升高时,该类物质的运输受到影响,峰值降低;在Mn2+浓度大于1.0 mmol/L时峰值上升,可能是膜过氧化程度加深,脂肪族酮类化合物过氧化产物在叶部积累,引起峰值升高;而在Mn2+浓度为5.0和10.0 mmol/L时,高浓度的Mn2+破坏了此机制,造成脂肪族酮类化合物过氧化产物减少,峰值下降[13-15]。
3 结论
(1) 糖类和氨基酸等有机化合物在低Mn2+处理条件下往往作为渗透性调节物质出现,其含量升高,随着Mn2+毒害的加重,其合成和运输都会受限,含量必然下降,这在输导组织中表现明显。当Mn2+浓度为0.2 mmol/L时,根在2 926 cm-1处的峰值先减弱后增强, 说明商陆分泌的有机酸不断螯合Mn2+,造成羧酸O—H减少;随着Mn2+毒害的加重,其羧酸螯合能力变弱;当Mn2+浓度为2.0 mmol/L时,叶在1 640 cm-1处的显著吸收峰可能与商陆叶中氨基酸、多肽和蛋白质类物质含量升高有关,或与根部输送的羧酸盐过多有关,且与根部此处峰值的下降趋势吻合。
(2) 商陆对Mn2+毒的耐性存在一个临界值,当超过此临界值时,植物同样会受到毒害,主要表现是膜脂过氧化。根、茎、叶在1 060 cm-1处峰值的变化均证明了这一点。
(3) 商陆根、茎、叶组织中糖类、氨基酸和有机酸等物质含量随Mn2+浓度升高而变化较大,而茎组织各物质含量变化不大,表明当Mn2+浓度小于2.0 mmol/L的外部Mn2+胁迫下,商陆茎组织中的生理过程受影响较小,有机物的合成和运输基本没有受到影响,也表明商陆具有较强的Mn2+耐性特征。
参考文献:
[1] 蔡固平, 葛晓霞, 曾光明. 黄兴镇硫酸锰企业污染调查与评价[J]. 中国环境监测, 2003, 19(4): 56-59.
CAI Gu-ping, GE Xiao-xia, ZENG Guang-ming. Investigation and evaluation of the pollution of manganese sulphate in Huangxing Town[J]. Environmental Monitoring in China, 2003, 19(4): 56-59.
[2] Aydinalp C, Marinova S. Distribution and forms of heavy metals in some agricultural soils[J]. Polish Journal of Environmental Studies, 2003, 12(5): 629-633.
[3] 汪福顺, 刘丛强, 梁小兵, 等. 贵州阿哈湖沉积物-水界面微生物活动及其对微生物元素再迁移富集的影响[J]. 科学通报, 2003, 48(19): 2073-2078.
WANG Fu-shun, LIU Cong-qiang, LIANG Xiao-bing, et al. Microbiological activity across the sediment-water interface of Lake Aha and its influence upon translocation and accumulation of trace elements[J]. Chinese Science Bulletin, 2003, 48(19): 2073-2078.
[4] Myrna E W. Phytoremeditaion on the brink of commercialization[J]. Environment Science and Technology, 1997, 31(4): 182-186.
[5] Baker A J M, Brooks R R. Terrestrial higher plants which hyperaccumulate metallic elements: A review of their distribution, ecology and phytochemistry[J]. Biorecovery, 1989, 1(2): 81-96.
[6] 薛生国, 陈英旭, 林琦, 等. 中国首次发现的锰超积累植物: 商陆[J]. 生态学报, 2003, 23(5): 935-937.
XUE Sheng-guo, CHEN Ying-xu, LIN Qi, et al. Phytolacca acinosa Roxb. (Phytolaccaceae): A new manganese hyperaccumulator plant from Southern China[J]. Acta Ecological Sinica, 2003, 23(5): 935-937.
[7] XUE Sheng-guo, CHEN Ying-xu, Reeves R D, et al. Manganese uptake and accumulation by the hyperaccumulator plant Phytolacca americana Roxb. (Phytolaccaceae)[J]. Environmental Pollution, 2004, 131(3): 393-399.
[8] XUE Sheng-guo, CHEN Ying-xu, Baker A J M, et al. Manganese uptake and accumulation by two populations of Phytolacca acinosa Roxb. (Phytolaccaceae)[J]. Water Air and Soil Pollution, 2005, 160(1/3): 3-14.
[9] XU Xiang-hua, SHI Ji-yan, CHEN Ying-xu, et al. An investigation of cellular distribution of manganese in hyperaccumlator plant Phytolacca acinosa Roxb. using SRXRF analysis[J]. Journal of Environmental Sciences-China, 2006, 18(4): 746-751.
[10] 薛生国, 叶晟, 周菲, 等. 锰超富集植物垂序商陆的认定[J]. 生态学报, 2008, 28(12): 6344-7347.
XUE Sheng-guo, YE Sheng, ZHOU Fei, et al. Phytolacca americana L.(Phytolaccaceae), Pokewood: A manganese hyperaccumulator plant[J]. Acta Ecologica Sinica, 2008, 28(12): 6344-6347.
[11] 任立民, 成则丰, 刘鹏, 等. 美洲商陆对锰毒生理响应的FTIR研究[J]. 光谱学与光谱分析, 2008, 28(3): 582-585.
REN Li-min, CHENG Ze-feng, LIU Peng, et al. Studies on the physiological response of Phytolacca americana to manganese toxicity by FTIR spectroscopy[J]. Spectroscopy and Spectral Analysis, 2008, 28(3): 582-585.
[12] 陆婉珍, 袁洪福, 徐广通, 等. 现代近红外光谱分析技术[M]. 北京: 中国石化出版社, 2000: 19-26.
LU Wan-zhen, YUAN Hong-fu, XU Guang-tong, et al. NIR spectra analysis[M]. Beijing: China Petrochemical Press, 2000: 19-26.
[13] 迟光宇, 刘新会, 刘素红, 等. Cu污染与小麦特征光谱相关关系研究[J]. 光谱学与光谱分析, 2006, 26(7): 1272-1276.
CHI Guang-yu, LIU Xin-hui, LIU Su-hong, et al. Studies of relationships between Cu pollution and spectral characteristics of TritiZnm aestivum L[J]. Spectroscopy and Spectral Analysis, 2006, 26(7): 1272-1276.
[14] 陈思宁, 刘新会, 侯娟, 等. 重金属锌胁迫的白菜叶片光谱响应研究[J]. 光谱学与光谱分析, 2007, 27(9): 1797-1810.
CHEN Si-ning, LIU Xin-hui, HOU Juan, et al. Study on the spectrum response of Brassica campestris L leaf to the zinc pollution[J]. Spectroscopy and Spectral Analysis, 2007, 27(9): 1797-1810.
[15] 张晓斌, 刘鹏, 李丹婷, 等. 铬诱导植物根细胞壁化学成分变化的FTIR表征[J]. 光谱学与光谱分析, 2008, 28(5): 1067-1070.
ZHANG Xiao-bin, LIU Peng, LI Dan-ting, et al. FTIR Spectroscopic characterization of chromium-induced changes in root cell wall of plants[J]. Spectroscopy and Spectral Analysis, 2008, 28(5): 1067-1070.
[16] Didierjean L, Frendo P, Nasser W, et al. Heavy metal responsive genes in maize: Identification and comparison of their expression upon various forms of abiotic stress[J]. Planta, 1996, 199(1): 1-8.
收稿日期:2010-10-15;修回日期:2010-12-28
基金项目:国家公益性(环保)行业科研项目(200909065,201109056);国家自然科学基金资助项目(40771181);中国博士后科学基金资助项目(20080430565);中国博士后科学基金特别资助项目(200801119)
通信作者:薛生国(1970-),男,河南焦作人,博士,副教授,从事污染环境修复与金属矿山废弃地生态恢复技术研究;电话:13787148441;E-mail: sgxue70@yahoo.com.cn


