文章编号:1004-0609(2016)-08-1811-06
LiF-MgF2-BaF2-KCl熔盐Mg2+在钨电极上的电化学还原机理
杨少华,赖晓晖,王 君,王浩然
(江西理工大学 冶金与化学工程学院,赣州 341000)
摘 要:
采用循环伏安法、计时电流法、计时电位法研究以MgO为原料、LiF-MgF2-BaF2-KCl为电解质体系、温度为1173 K时镁离子在钨电极上的电化学还原过程。结果表明:镁离子在钨电极上的电化学还原是一步转移两个电子的过程,电极反应为Mg2++2e→Mg;镁在钨电极析出过程中出现成核极化现象,析出过程是受扩散控制的不可逆反应;1173 K时,Mg2+在熔盐中的扩散系数D为1.28×10-5 cm2/s。
关键词:
中图分类号:TF822 文献标志码:A
金属镁的生产主要有热还原法和氯化镁电解 法[1]。热还原法能耗大、热效率低、环境污染严重[2-4];氯化镁电解法生产流程复杂,氯化镁脱水工艺较难控制,无水氯化镁的生产成本几乎占镁电解生产成本的一半[5-6]。多年来,国内外学者试图以廉价的氧化镁为原料,直接用于电解生产金属镁[7-10],由于氧化镁在熔盐中的溶解度比较小,电解过程中频繁发生阳极效应,电流效率不高等原因,使氧化镁电解法制备金属镁的工艺并没有太大的突破[10-11]。
镁离子在阴极析出的电化学还原过程直接影响到镁熔盐电解过程中的电流效率、生产能耗等主要经济技术指标,因此,对镁电解阴极过程的研究显得尤为重要。刘江宁等[12]研究温度973 K的NaCl-KCl- MgCl2熔盐中镁在铂电极上的阴极行为,认为镁先与Pt电极形成合金,然后才以纯镁的形式析出,镁析出过程是包含两个电子的受扩散过程控制的准可逆反应;陈野等[13]在998 K温度的MgCl2 -KCl-NaCl-CaCl2熔盐体系中研究了电解镁机理,认为镁离子转移两个电子在阴极上放电析出,在电子转移步骤之前存在一前置转化步骤MgCl+→Mg2++C1-,并认为随着CaCl2含量的增加,镁离子的析出电位逐渐负移;石忠宁等[14]研究1053 K温度下KF-1%MgF2(质量分数)熔盐中Mg2+的电化学沉积行为,认为Mg2+的还原是一步两电子反应,其还原过程受扩散控制。
本文作者以MgO为原料,以 LiF- MgF2-BaF2-KCl 为电解质系体系,采用电化学暂态技术,研究镁离子在钨电极上的电化学还原过程,以期能在此基础上解析氧化镁熔盐电解机理。
1 实验
1.1 实验试剂及装置
实验采用MgO为原料,13%LiF-36%MgF2-44% BaF2-7%KCl(摩尔分数)为电解质的熔盐体系。其中MgO、LiF、MgF2、BaF2和KCl均为分析纯试剂。
实验测试电极为三电极体系。工作电极为钨丝(d 1.0 mm,纯度99.99%),参比电极为铂丝(d 0.5 mm,纯度99.95%),辅助电极为钨棒(d 10 mm,纯度99.99%);三电极体系使用前,均用去离子水和丙酮清洗并烘干。
实验采用程序升温控制仪控制电阻加热炉温度,以三电极体系为测试电极,以AUTOLAB P30型电化学工作站进行测试,实验数据由计算机自动采集并进行存储。
1.2 实验过程及方法
实验前将熔盐组分按比例混合均匀,经低温真空干燥,并在573 K烘干2 h后装入高纯石墨坩埚,放入电阻炉内缓慢升温至1173 K并恒温30 min,然后对熔盐体系预电解30 min,以去除熔盐中杂质对实验测试的影响。
本文作者采用循环伏安法、计时电位法和计时电流法,研究以MgO为原料,13%LiF-36%MgF2- 44%BaF2-7%KCl为电解质体系,温度为1173 K时,镁离子在钨电极上的电化学还原过程。
2 结果与讨论
2.1 循环伏安法
在温度为1173 K下的LiF-MgF2-BaF2-KCl电解质体系中,相关化合物相的理论分解电动势如表1所列[15]。
表1 部分相关化合物的分解电势
Table 1 Decomposition potential of some related compounds
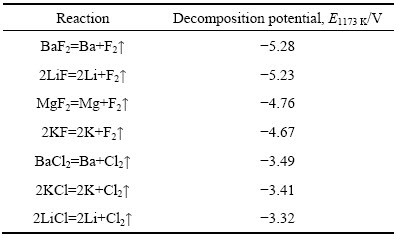
从理论分解电动势判断,LiCl的分解电动势最正,但由于Li+亲近F-,体系中易形成电位更负的K(LiFx)结构,又因镁的析出电位比钾的析出电位负,因此,单独对该电解质体系电解时,金属钾先在阴极上析出;当加入MgO后,体系中会形成含镁络合阴离子,这种阴离子放电电位更正,会在阴极沉积出金属镁。
为了更好地研究Mg2+在熔盐体系中的还原机理,首先对13%LiF-36%MgF2-44%BaF2-7%KCl(质量分数)电解质体系进行空白曲线测定,其结果如图1所示。
从图1可以看出,当阴极电位扫描至-1.2 V时,电流迅速增加,此时金属钾开始在电极上析出,与回扫过程中出现的氧化峰相对应。在-1.2~0 V电势范围内没有出现氧化还原峰,说明在此电势范围内熔盐体系电化学性能稳定,研究MgO在电解质中的还原过程可在-1.2~0 V的电势范围进行。
在13%LiF-36%MgF2-44%BaF2-7%KCl电解质体系中加入原料MgO,在1173 K温度下,对熔盐进行循环伏安扫描,研究镁在钨电极上的电化学还原过程,结果如图2所示。
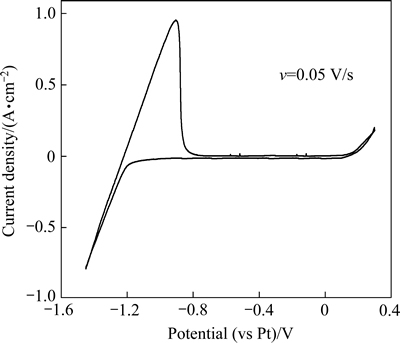
图1 1173 K时13%LiF-36%MgF2-44%BaF2-7%KCl电解质体系的循环伏安曲线
Fig. 1 Cyclic voltammetry curves of 13%LiF-36%MgF2- 44%BaF2-7%KCl molten salt system at 1173 K
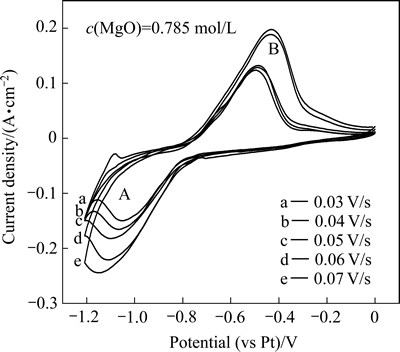
图2 1173 K时LiF-MgF2-BaF2-KCl-MgO熔盐体系不同扫描速率的循环伏安曲线
Fig. 2 Cyclic voltammograms of LiF-MgF2-BaF2-KCl-MgO molten salt system with different scan rate of magnesium ion at 1173 K
从图2可以看出,随着电位向负方向扫描,曲线只出现一个还原峰A,电位在-1.1 V(相对Pt参比电极,下同)左右,与电位作反向扫描时出现的阳极溶解峰B相对应,表明Mg2+的阴极还原是一步得电子过程。随着扫描速率的不断增加,阴极还原峰电位负移动,同时,峰值电流密度增大。
根据Randles-Seveik方程[16]:
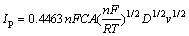 (1)
(1)
对图2中每组数据的还原峰电流Ip与对应的扫描速率v的平方根作关系曲线,其结果如图3所示。
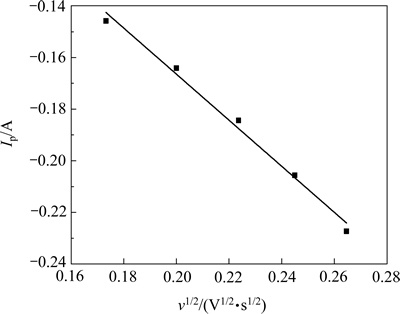
图3 1173 K时还原峰值电流与扫描速率平方根的关系
Fig. 3 Relationship between reduction peak current and square root of scan rate at 1173 K
从图3可以看出,Ip与v1/2呈良好的线性关系,符合Randles-Sevick方程,且Ip随着v1/2 的增大而增大,表明Mg2+在钨阴极上的电化学过程是受扩散控制的不可逆反应[16]。
根据Heyrovsky-Ilkovic方程[17]:
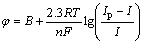 (2)
(2)
对扫描速率为0.05 V/s的循环伏安曲线上还原峰A进行处理,作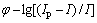 关系图,其结果如图4所示。
关系图,其结果如图4所示。
从图4可以看出,φ与lg[(Ip-I)/I]之间呈线性关系,其中斜率K=2.3RT/(nF)为0.139,可求得还原峰A对应电化学反应的电子转移数约为2。说明此处发生的是两个电子转移反应,电极反应为Mg2++2e→Mg。
2.2 计时电流法
以13%LiF-36%MgF2-44%BaF2-7%KCl为电解质,MgO为原料,在1173 K温度下,根据循环伏安曲线(见图2),在镁析出的电势范围内,测量了镁在钨电极上的计时电流曲线,其结果如图5所示。
从图5可以看出,曲线中电流首先迅速增加,再衰减之后出现缓慢上升,表明镁在析出过程中存在成核极化现象。在电极双电子层急剧充电衰减后,由于镁的形核和生长使感应电流开始增加;电流持续增长达到最大值后,由于扩散层厚度的增加使感应电流开始衰减;经过一段时间后,镁在电极表面的扩散和析出趋于平衡,电流相应地也趋于一恒定值。计时电流曲线表现出了经典的三维形核过程。
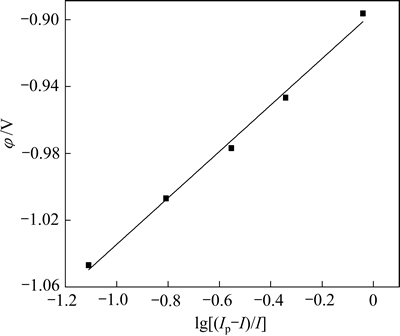
图4 1173 K时φ与lg[(Ip-I) / I]的关系曲线
Fig. 4 Relationship between φ and lg[(Ip-I) / I] at 1173 K
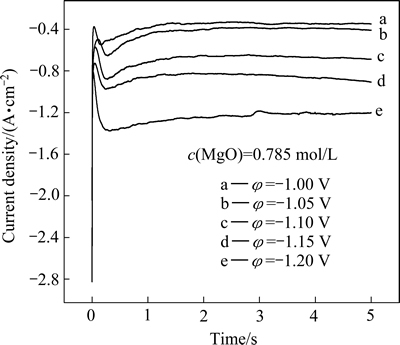
图5 1173 K时不同恒电位条件下镁在钨电极上的计时电流
Fig. 5 Chronoamperometry of magnesium on tungsten electrode under different constant potentials at 1173 K
采用Cottrel方程[18]计算离子扩散系数:
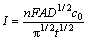 (3)
(3)
式中:I为电流,A;n为电子转移数;F为法拉第常数,96458 C/mol;A为研究电极有效面积(钨丝浸入熔盐部分的表面积),cm2;D为扩散系数,cm2/s;c0为熔盐中氧化镁的浓度,mol/mL;t为电解时间,s。
根据图5,作曲线中上升部分电流I与t-1/2的关系图,结果如图6所示。
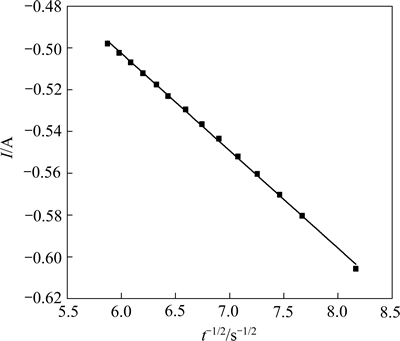
图6 1173 K时I与t-1/2的关系
Fig. 6 Relationship between I and t-1/2 at 1173 K
从图6可以看出,I和t-1/2呈良好的线性关系,通过直线斜率(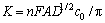 ),可以计算出Mg2+在熔盐中的扩散系数D=2.94×10-6 cm2/s。
),可以计算出Mg2+在熔盐中的扩散系数D=2.94×10-6 cm2/s。
2.3 计时电位法
为了进一步研究Mg2+的电化学还原过程,在电解温度为1173 K时,以13%LiF-36%MgF2-44%BaF2- 7%KCl为电解质,MgO为原料的熔盐体系中,测量镁在钨电极上的计时电位曲线,结果如图7所示。
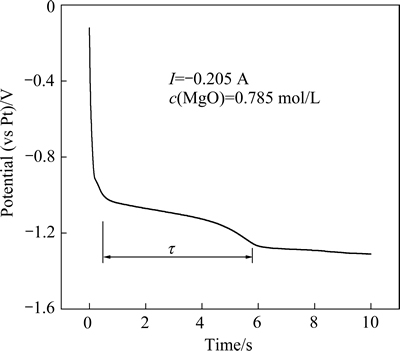
图7 1173 K时Mg2+在钨电极上的计时电位曲线
Fig. 7 Chronopotentiometry of Mg2+ on tungsten electrode at 1173 K
从图7可以看出,计时电位曲线中出现两个平台,电位约为-1.10 V和-1.27 V,分别与图2和图1循环伏安曲线中原料与电解质内Mg2+和K+的析出峰电位相对应。进一步说明了Mg2+在钨电极上是一步转移两个电子直接还原成金属镁的过程。
从计时电位曲线中,可得到镁还原析出的过渡时间τ,根据式(4)[19]:
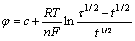 (4)
(4)
作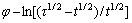 关系图,结果如图8所示。
关系图,结果如图8所示。
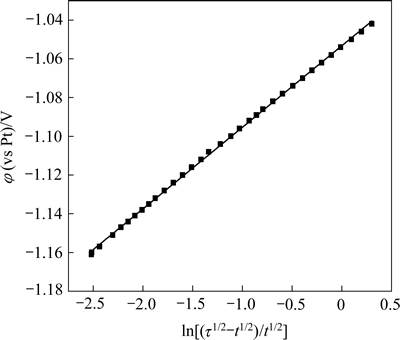
图8 1173 K时φ与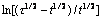 的关系
的关系
Fig. 8 Relationship between φ and 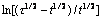 at 1173 K
at 1173 K
从图8可以看出,φ与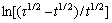 呈良好的线性关系,由直线斜率
呈良好的线性关系,由直线斜率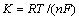 为0.042,求得转移电子数n=2.4,n≈2,即镁在钨电极上的析出过程为一步得到两个电子的反应,与循环伏安法研究所得结果相一致。
为0.042,求得转移电子数n=2.4,n≈2,即镁在钨电极上的析出过程为一步得到两个电子的反应,与循环伏安法研究所得结果相一致。
根据Sand方程[20]:
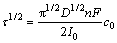 (5)
(5)
式中:τ为镁沉积过度时间,s;D为扩散系数,cm2/s;n为电子转移数;F为法拉第常数,96458 C/mol;c0为熔盐中氧化镁的浓度,mol/mL;I0为阴极上施加的工作电流强度,A。
根据图7中的数据,可求得1173 K时,Mg2+在熔盐中的扩散系数D为1.28×10-5 cm2/s,与计时电流法计算出的扩散系数相差不大。
3 结论
1) 在电解温度为1173 K时,以 LiF- MgF2-BaF2- KCl为电解质,MgO为原料的熔盐体系中,Mg2+在钨电极上的电化学还原是一步转移两个电子的过程,电极反应为Mg2++2e→Mg。
2) 镁在钨电极析出过程中出现成核极化现象,其析出过程是受扩散控制的不可逆反应,1173 K时,Mg2+在熔盐中的扩散系数D为1.28×10-5 cm2/s。
REFERENCES
[1] 杨重愚. 轻金属冶金学[M]. 北京: 冶金工业出版社, 2011: 228-229.
YANG Chong-yu. Metallurgy of lightweight metals[M]. Beijing: Metallurgical Industry Press, 2011: 228-229.
[2] 高 峰, 聂祚仁, 王志宏, 左铁镛. 中国皮江法炼镁的资源消耗和环境影响分析[J]. 中国有色金属学报, 2006, 16(8): 1456-1461.
GAO Feng, NIE Zuo-ren, WANG Zhi-hong, ZUO Tie-yong. Resource depletion and environmental impact analysis of magnesium produced using pidgeon process in China[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(8): 1456-1461.
[3] 冯乃祥, 王耀武. 一种以菱镁石和白云石混合矿物为原料的真空热还原法炼镁技术[J]. 中国有色金属学报, 2011, 21(10): 2678-2686.
FENG Nai-xiang, WANG Yao-wu. A method of producing magnesium by vacuum thermal reduction using magnesite and dolomite as materials[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(10): 2678-2686.
[4] 刘红湘, 戴永年, 田 阳, 曲 涛, 郁青春. 中国皮江法炼镁工业环保问题的探讨[J]. 轻金属, 2010(11): 43-48.
LIU Hong-xiang, DAI Yong-nian, TIAN Yang, QU Tao, YU Qing-chun. The environmental issue of the magnesium produced in China using the Pidgeon process[J]. Light Metal, 2010(11): 43-48.
[5] 王龙蛟, 罗洪杰, 王耀武, 冯乃祥. 熔盐电解法制镁工艺研究进展[J]. 中国有色冶金, 2014, 43(5): 48-52.
WANG Long-jiao, LUO Hong-jie, WANG Yao-wu, FENG Nai-xiang. Study progress of preparation of magnesium with molten salt electrolysis method[J]. China Nonferrous Metallurgy, 2014, 43(5): 48-52.
[6] 刘积灵, 张玉坤. 无水氯化镁的制备技术及发展趋势[J]. 无机盐工业, 2007, 39(8): 10-12.
LIU Ji-ling, ZHANG Yu-kun. Preparation techniques and development trend of anhydrous magnesium chloride[J]. Inorganic Chemical Industry, 2007, 39(8): 10-12.
[7] SHARMA R A. A new electrolytic magnesium production process[J]. JOM—Journal of the Minerals Metals & Materials Society, 1996(10): 39-43.
[8] YANG Shao-hua, YANG Feng-li, LIAO Chun-fa, LI Ming-zhou, WANG Xu. Electrodeposition of magnesium-yttrium alloys by molten salt electrolysis[J]. Journal of Rare Earths, 2010, 28(S1): 385-388.
[9] 梁 蓓, 梁义田. 利用氧化镁电解生产金属镁[J]. 轻金属, 2007(6): 50-51.
LIANG Bei, LI Yi-tian. Producing metal Mg with magnesia[J]. Light Metal, 2007(6): 50-51.
[10] 杨少华, 班允刚, 郭玉华, 邱竹贤. 以氧化镁为原料生产铝镁合金的研究[J]. 东北大学学报(自然科学版), 2007, 28(6): 839-842.
YANG Shao-hua, BAN Yun-gang, GUO Yu-Hua, QIU Zhu-xian. Preparation of aluminum-magnesium alloys from magnesium oxide[J]. Journal of Northeastern University (Natural Science), 2007, 28(6): 839-842.
[11] 徐 徽, 刘卫平, 董 瑞, 杨喜云, 石西昌, 赵 娜. 氧化镁在熔盐中溶解度的研究[J]. 有色金属(冶炼部分), 2011(1): 20-22.
XU Hui, LIU Wei-ping, DONG Rui, YANG Xi-yun, SHI Xi-chang, ZHAO Na. Study on Solubility of MgO in Melt Salt[J]. Nonferrous Metals (Extractive Metallurgy), 2011(1): 20-22.
[12] 刘江宁, 孙 泽, 晋心文, 李 冰, 宋兴福, 于建国. KCl-NaCl-MgCl2熔盐中镁在铂电极上的阴极还原[J]. 有色金属(冶炼部分), 2007(6): 35-38.
LIU Jiang-ning, SUN Zi, JIN Xin-wen, LI Bing, SONG Xing-fu, YU Jian-guo. The cathodic reduction of magnesium in KCl-NaCl-MgCl2 melts on platinum electrode[J]. Nonferrous Metals (Extractive Metallurgy), 2007(6): 35-38.
[13] 陈 野, 叶 克. MgCl2-KCl-NaCl-CaCl2熔盐电解镁机理[J]. 应用化学, 2008, 25(12): 1409-1412.
CHEN Ye, YE Ke. Mechanism of electrolysis of magnesium chloride in MgCl2-KCl-NaCl-CaCl2 molten salt[J]. Chinese Journal of Applied Chemistry, 2008, 25(12): 1409-1412.
[14] SHI Zhong-ning, LI Min, LI Lan-lan, GAO Bing-liang, HU Xian-wei, WANG Zhao-wen. Electrochemical behaviors of Mg2+ and B3+ deposition in fluoride molten salts[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(7): 1655-1659.
[15] 张明杰, 王兆文. 熔盐电化学原理与应用[M]. 北京: 化学工业出版社, 2006: 231-238.
ZHANG Ming-jie, WANG Zhao-wen. Principle and application of electrochemistry of fused salts[M]. Beijing: Chemical Industry Press, 2006: 231-238.
[16] BARDE A J, FAULKNER L R. Electrochemical fundamentals and applications[M]. 2nd ed. New York: John Wiley and Sons INC, 2003: 225-227.
[17] BARDE A J, FAULKNER L R. Electrochemical methods, fundamentals and applications[M]. Beijing: Chemical Industry Press, 2005: 159.
[18] 保罗·蒙克. 电分析化学基础[M]. 朱俊杰, 罗 鲲, 潘宏程, 译. 北京: 化学工业出版社, 2012: 100-101.
MONCK P M S. Fundamentals of electroanalytical chemistry[M]. ZHU Jun-jie, LUO Kun, PAN Hong-cheng, transl. Beijing: Chemical Industry Press, 2012: 100-101.
[19] GREEF R, PEAT R, PLETCHER L M. Instrumental methods in electrochemistry[M]. London: Ellis Hrwood, 1990: 316-317.
[20] MCDONALD D D. Transient techniques in electrochemistry[M]. New York: Plenum Press, 1977: 365-367.
Electrochemical reduction mechanism of Mg2+ on tungsten electrode in LiF-MgF2-BaF2-KCl molten salt
YANG Shao-hua, LAI Xiao-hui, WANG Jun, WANG Hao-ran
(School of Metallurgical and Chemical Engineering,
Jiangxi University of Science and Technology, Ganzhou 341000, China)
Abstract: The electrochemical reduction mechanism of Mg2+ on the tungsten electrode at 1173 K was studied through the methods of cyclic voltammetry, chronopotentiometry and chronoamperometry using MgO and LiF-MgF2-BaF2-KCl as raw material and molten salt. The results show that the electrochemical reduction of Mg2+on the tungsten electrode is a two-electron transition process by one step. The electrode reaction is Mg2++2e→Mg. During depositing process, the nuclear polarization phenomenon is observed. The depositing process of Mg is an irreversible reaction controlled by diffusion, and the diffusion coefficient of Mg2+ in the molten salt is 1.28×10-5 cm2/s at 1173 K.
Key words: magnesium oxide; molten salt; electrochemical reduction; diffusion control
Foundation item: Project(51164013) supported by the National Natural Science Foundation of China
Received date: 2015-09-18; Accepted date: 2016-01-13
Corresponding author: YANG Shao-hua; Tel: +86-15970085173; E-mail: xizi527i@163.com
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51164013)
收稿日期:2015-09-18;修订日期:2016-01-13
通信作者:杨少华,副教授,博士;电话:15970085173;E-mail: xizi527@163.com
摘 要:采用循环伏安法、计时电流法、计时电位法研究以MgO为原料、LiF-MgF2-BaF2-KCl为电解质体系、温度为1173 K时镁离子在钨电极上的电化学还原过程。结果表明:镁离子在钨电极上的电化学还原是一步转移两个电子的过程,电极反应为Mg2++2e→Mg;镁在钨电极析出过程中出现成核极化现象,析出过程是受扩散控制的不可逆反应;1173 K时,Mg2+在熔盐中的扩散系数D为1.28×10-5 cm2/s。
[1] 杨重愚. 轻金属冶金学[M]. 北京: 冶金工业出版社, 2011: 228-229.
[2] 高 峰, 聂祚仁, 王志宏, 左铁镛. 中国皮江法炼镁的资源消耗和环境影响分析[J]. 中国有色金属学报, 2006, 16(8): 1456-1461.
[3] 冯乃祥, 王耀武. 一种以菱镁石和白云石混合矿物为原料的真空热还原法炼镁技术[J]. 中国有色金属学报, 2011, 21(10): 2678-2686.
[4] 刘红湘, 戴永年, 田 阳, 曲 涛, 郁青春. 中国皮江法炼镁工业环保问题的探讨[J]. 轻金属, 2010(11): 43-48.
[5] 王龙蛟, 罗洪杰, 王耀武, 冯乃祥. 熔盐电解法制镁工艺研究进展[J]. 中国有色冶金, 2014, 43(5): 48-52.
[6] 刘积灵, 张玉坤. 无水氯化镁的制备技术及发展趋势[J]. 无机盐工业, 2007, 39(8): 10-12.
[9] 梁 蓓, 梁义田. 利用氧化镁电解生产金属镁[J]. 轻金属, 2007(6): 50-51.
LIANG Bei, LI Yi-tian. Producing metal Mg with magnesia[J]. Light Metal, 2007(6): 50-51.
[10] 杨少华, 班允刚, 郭玉华, 邱竹贤. 以氧化镁为原料生产铝镁合金的研究[J]. 东北大学学报(自然科学版), 2007, 28(6): 839-842.
[11] 徐 徽, 刘卫平, 董 瑞, 杨喜云, 石西昌, 赵 娜. 氧化镁在熔盐中溶解度的研究[J]. 有色金属(冶炼部分), 2011(1): 20-22.
[12] 刘江宁, 孙 泽, 晋心文, 李 冰, 宋兴福, 于建国. KCl-NaCl-MgCl2熔盐中镁在铂电极上的阴极还原[J]. 有色金属(冶炼部分), 2007(6): 35-38.
[13] 陈 野, 叶 克. MgCl2-KCl-NaCl-CaCl2熔盐电解镁机理[J]. 应用化学, 2008, 25(12): 1409-1412.
[15] 张明杰, 王兆文. 熔盐电化学原理与应用[M]. 北京: 化学工业出版社, 2006: 231-238.
[18] 保罗·蒙克. 电分析化学基础[M]. 朱俊杰, 罗 鲲, 潘宏程, 译. 北京: 化学工业出版社, 2012: 100-101.


