酪氨酸-钐(Ⅲ)配合物与鲱鱼精DNA的作用方式
赵娜1,王兴明1,张艳1,胡亚敏1,丁立生2
(1. 西南科技大学 材料科学与工程学院,四川 绵阳,621010;
2. 中国科学院 成都生物研究所,四川 成都,610041)
摘 要:
摘 要:采用UV光谱法、荧光光谱法,在pH=7.40的生理环境中用摩尔比法确定了Sm(Ⅲ)与Tyr(酪氨酸)结合的物质的量比n(Sm(Ⅲ))?n(Tyr)=1?3,Sm(Ⅲ)(Tyr)3配合物与hs(鲱鱼精)DNA结合的物质的量比n(Sm(Ⅲ)(Tyr)3)? n(DNA)=3?1。用双倒数法确定了结合常数![]() =9.97×104 L/mol和
=9.97×104 L/mol和![]() =7.56×103 L/mol。化学热力学研究显示配合物Sm(Ⅲ)(Tyr)3与hsDNA的结合过程为焓驱动;结合Scatchard法和黏度法,确定了配合物Sm(Ⅲ)(Tyr)3与hsDNA之间的作用方式为沟渠作用和嵌插作用。
=7.56×103 L/mol。化学热力学研究显示配合物Sm(Ⅲ)(Tyr)3与hsDNA的结合过程为焓驱动;结合Scatchard法和黏度法,确定了配合物Sm(Ⅲ)(Tyr)3与hsDNA之间的作用方式为沟渠作用和嵌插作用。
关键词:
中图分类号:O629.74 文献标志码:A 文章编号:1672-7207(2010)03-0876-07
Binding mode between Tyr-Sm(Ⅲ) complex and herring sperm DNA
ZHAO Na1, WANG Xing-ming1, ZHANG Yan1, HU Ya-min1, DING Li-sheng2
(1. School of Materials Science and Engineering, Southwest University of Science and Technology,
Mianyang 621010, China;
2. Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, China)
Abstract: With the methods of UV spectra, fluorescence spectra in physiological pH environment (pH=7.40), the binding ratio of n(Sm(Ⅲ))?n(Tyr)=1?3 and n(Sm(Ⅲ)(Tyr)3)?n(DNA)=3?1 were confirmed by molar ratio method. The binding constants of ![]() =9.97×104 L/mol and
=9.97×104 L/mol and ![]() =7.56×103 L/mol were confirmed by double reciprocal method. Thermodynamic function computation demonstrates that
=7.56×103 L/mol were confirmed by double reciprocal method. Thermodynamic function computation demonstrates that ![]() is the primary driving power of the interaction of Sm(Ⅲ)(Tyr)3 and DNA. Combined with Scatchard method and viscosity method, the results suggest that the interaction mode between Sm(Ⅲ)(Tyr)3 complex and herring sperm DNA are groove binding and intercalation binding.
is the primary driving power of the interaction of Sm(Ⅲ)(Tyr)3 and DNA. Combined with Scatchard method and viscosity method, the results suggest that the interaction mode between Sm(Ⅲ)(Tyr)3 complex and herring sperm DNA are groove binding and intercalation binding.
Key words: tyrosine; samarium(Ⅲ); herring sperm DNA; complex; binding mode
氨基酸是人体内本身具有的不可缺少的生物物质,是人体内生物大分子蛋白质的基本组成单元,对人和动物的生长发育及其新陈代谢都有着重要的意义。其中酪氨酸一般在医药中作为甲状腺功能亢进药物,在许多合成反应中用作合成多肽类激素、抗生素和L-多巴等药物的主要原料,是一种重要的生化试剂。近年来,发现稀土在医药方面具有广阔的应用前景,它们具有特殊的电子结构,一旦稀土金属元素与配体配位不仅会降低稀土元素的毒性,还可以表现出其特殊的生理活性。例如,配合物与DNA的某些亲核基团(如磷酸氧位点或碱基氮、氧位点)直接螯合,引起癌细胞的DNA损伤,起到抗癌抑癌的作用[1]。同时,以氨基酸与稀土金属形成的配合物作为抗癌药物可能产生协同效应,从而提高药物与人体的生物相容性和抗癌活性。目前,欧阳泽英等[2]采用了紫外光谱法、荧光光谱法和黏度法研究了二(2-苯并咪唑亚甲基)胺合镝配合物与DNA的作用,认为它是以静电和部分插入模式与DNA作用。曹惠平等[3]通过紫外光谱法、荧光光谱法和凝胶成像法研究了酚氧桥联型双核Eu(Ⅲ)配合物与DNA的作用,指出了它们之间存在插入作用。杨立荣等[4]仅采用荧光光谱和黏度法研究了3种铕(Ⅲ)-牛磺酸席夫碱配合物与DNA的作用模式,认为它们与DNA之间均存在插入作用。吴惠霞等[5]通过紫外光谱和循环伏安2种方法研究了氨基酸-铈配合物与小牛胸腺DNA的作用,指出它们之间存在静电作用,但该文献未包含结合比和热力学函数等参数的计算。另外,目前研究较多的是氨基酸-铜配合物与DNA的作用,而对氨基酸-稀土金属配合物与DNA的作用研究较少。迄今为止,关于酪氨酸-钐配合物与DNA作用的研究尚未见报道,为此,本文作者除通过紫外光谱法、荧光光谱法综合黏度法和Scatchard法对酪氨酸-钐(Ⅲ)稀土配合物与鲱鱼精DNA的作用进行较全面、系统的研究,还采用了摩尔比法、双倒数法等测定计算热力学函数和结合常数等相关作用信息。酪氨酸-钐(Ⅲ)稀土配合物与鲱鱼精DNA之间不仅存在沟渠作用,还存在嵌插作用。同时,舍弃了原有毒性较强的EB探针,采用相对环保型的AO作为探针,可望对了解抗癌药物的抗癌机理及设计开发新型抗癌药物提供有价值的信息[6]。
1 实验
1.1 仪器与试剂
仪器为:UNICO UV-2102 PCS型紫外可见分光光度计(尤尼科上海仪器有限公司);RF-540 荧光光谱仪(日本岛津);Nicolet 380型智力傅里叶变换红外光谱仪(美国热电尼高力公司);Vario EL CUBE 型元素分析仪(德国元素分析系统公司);pHS-2C型酸度计(成都方舟科技开发公司);乌式贝德黏度计(上海市青浦县前明玻璃仪器厂);HH-601超级恒温水浴(金坛金南仪器厂)。
试剂为:hsDNA(A.R,Sigma公司产品);酪氨酸(Tyr,A.R,成都科龙化工试剂厂);三氧化二钐( Sm2O3,A.R,北方方正稀土研究所有限公司产品);吖啶橙(AO,A.R,成都科龙化工试剂厂);乙二胺四乙酸钠(EDTA,A.R,广东光华化学厂有限公司);其他试剂,均为分析纯;水,为二次重蒸水。
1.2 实验方法
1.2.1 配制Sm(Ⅲ)Cl3溶液
用浓盐酸将Sm(Ⅲ)2O3溶解,小火蒸发掉水和过量的盐酸至白色粉末状,加Tris-HCl缓冲溶液配制成一定浓度的Sm(Ⅲ)Cl3溶液。
1.2.2 光谱法测定
各种溶液均用pH=7.40的Tris-HCl缓冲溶液配制,摇匀,放置5 min。在1 cm比色皿中加入3.00 mL 待测溶液,以Tris-HCl缓冲溶液空白为参比,用指定溶液进行滴定,扫描吸收光谱或荧光强度。激发和发射光谱扫描狭缝宽度均为5 nm,波长λex=441 nm。
1.2.3 黏度法
用pH=7.40的Tris-HCl缓冲溶液配制DNA和不同浓度的Sm(Ⅲ)(Tyr)3-DNA溶液,放置24 h,在25 ℃恒温水浴槽中用乌式贝德黏度计测定黏度。
2 结果与讨论
2.1 酪氨酸-钐(Ⅲ)配合物的合成
将三氯化钐与酪氨酸(先逐滴加入少量浓盐酸使酪氨酸完全溶解)以物质的量比为1?3的配比溶解在85 mL乙醇溶液中,在80 ℃水浴上加热并不断搅拌,调pH=3~5,在水浴中反应14 h,溶液变为淡黄色,浓缩液体至10 mL左右,静置结晶,用无水乙醚洗涤数次,干燥后,得到晶体酪氨酸-钐(Ⅲ)的配合物(Sm(Ⅲ)(Tyr)3·Cl3·H2O)[7]。IR(KBr压片):配合物羧基的对称和反对称伸缩振动位置(νs(COO-)=1 490 cm-1,νas(COO-)=1 600 cm-1)与相应单纯的氨基酸比较有较明显的变化,并且羧基的反对称振动峰发生分裂,说明氨基酸以羧基的氧原子与金属配位;?(νas(COO-)- νs(COO-))=110 cm-1,说明羧酸根可能以双齿形式配 位[8]。在3 440 cm-1处的峰为N—H伸缩振动峰;3 130 cm-1处的峰为O—H的伸缩振动吸收,由于酪氨酸分子间由氢键连接形成多聚体,氢键的缔合导致羟基的伸缩振动峰发生了向低频方向的位移,并形成宽阔的独特图形的吸收峰[9];1 070 cm-1和1 140 cm-1处的峰为C—N的伸缩振动峰。元素成分分析结果如下:对于实验值,C 41.03%,H 4.66%,N 5.15%,Sm 17.57%;对于理论值,C 39.19%,H 4.35%,N 5.08%,Sm 18.18%。
2.2 光谱法研究Sm(Ⅲ)-Tyr与DNA的作用方式
2.2.1 Sm(Ⅲ)对Tyr荧光光谱的影响及其结合比
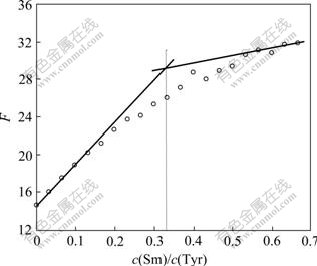
Sm(Ⅲ)对Tyr荧光光谱的影响见图1。由图1可知:固定Tyr的浓度,随着Sm(Ⅲ)浓度增加,Tyr在波长为519 nm处的荧光值逐渐升高,表明Sm与Tyr之间发生了相互作用[10],可能形成了配合物。因此,固定Tyr的浓度,改变Sm(Ⅲ)的浓度,在519 nm处测定荧光值,结果如图2所示,实验测得Sm(Ⅲ)与Tyr结合的Sm与Tyr物质的量比F为1?3。

c(Tyr)= 0.6 mmol/L; c(Sm(Ⅲ))=6.0 mmol/L
1—0 μL; 2—40 μL; 3—80 μL; 4—120 μL; 5—160 μL;
6—200 μL
图1 Sm(Ⅲ)对Tyr荧光光谱的影响
Fig.1 Influence of Sm(Ⅲ) to fluorescence spectra of Tyr
c(Tyr)=0.6 mmol/L; c(Sm(Ⅲ))=6.0 mmol/L
图2 Sm(Ⅲ)-Tyr的物质的量比F与c(Sm)/c(Tyr)的
关系(519 nm)
Fig.2 Relationship between molar ratio F and c(Sm)/c(Tyr) (519 nm)
2.2.2 DNA对Sm(Ⅲ)(Tyr)3紫外吸收光谱的影响及其结合比
DNA对Sm(Ⅲ)(Tyr)3紫外吸收光谱的影响见图3。由图3可知:固定Sm(Ⅲ)(Tyr)3的浓度,随着DNA浓度增加,Sm(Ⅲ)(Tyr)3在223 nm和277 nm处有明显的增色效应,表明Sm(Ⅲ)(Tyr)3配合物与DNA分子之间相互作用[10-11]可能生成了复合物;同时,出现吸收峰蓝移,其原因可能是DNA与配合物的吸收峰发生叠加(DNA的2个主要吸收峰在210 nm和260 nm左右),导致配合物吸收峰蓝移。增色效应和减色效应的产生可能是由于配合物与DNA结合之后,溶液中配合物聚集体以及配合物分子之间的氢键被破坏,导致配合物吸收强度发生改变。
固定Sm(Ⅲ)(Tyr)3的浓度,改变DNA的浓度,在277 nm处测定吸收强度,结果如图4所示。由图4可见:实验测得Sm(Ⅲ)(Tyr)3与DNA的物质的量比n(Sm(Ⅲ)(Tyr)3)? n(DNA)=3?1。根据Beer定律A=εbc,计算得到Sm(Ⅲ)(Tyr)3-DNA的表观摩尔吸光系数ε=2.70×105 L/(mol·cm)。
c(Sm(Tyr)3) = 6 μmol/L; c(DNA)= 6 μmol/L
1—0 μL; 2—40 μL; 3—80 μL; 4—120 μL; 5—160 μL;
6—200 μL
图3 DNA对Sm(Tyr)3紫外吸收光谱的影响
Fig.3 Influence of DNA on UV-vis absorption spectra of Sm(Tyr)3 (pH 7.40)

c(Sm(Tyr)3) = 6 μmol/L; c(DNA)= 6 μmol/L
图4 DNA与Sm(Tyr)3的物质的量比(277 nm)
Fig.4 Molar ratio plots of DNA and Sm(Tyr)3 (277 nm)
2.3 双倒数法测定结合常数和热力学函数
采用化学热力学方法分析Sm(Ⅲ)(Tyr)3与DNA的相互作用,可以更深刻地理解它们的作用情况。分别在298.15 K和人体温度310.15 K下测定DNA与Sm(Ⅲ)(Tyr)3配合物的作用。双倒数公式为[12]:

对298.15 K和310.15 K时277 nm的相对吸收强度按式(1)进行数据处理,作双倒数图(图5),所得直线截距和斜率求出Sm(Ⅲ)(Tyr)3配合物的结合常数分别为![]() = 9.97×104 L/mol,
= 9.97×104 L/mol,![]() =7.65×103 L/mol。根据热力学方程:
=7.65×103 L/mol。根据热力学方程:
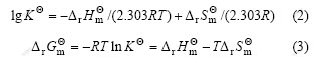
可计算298.15 K时反应的![]() ,
,![]() 和
和![]() 。计算求得Sm(Ⅲ)(Tyr)3与DNA相互作用的
。计算求得Sm(Ⅲ)(Tyr)3与DNA相互作用的![]() = -1.64×105 J/mol,
= -1.64×105 J/mol,![]() = -4.54×102 J/(mol·K),
= -4.54×102 J/(mol·K),![]() =-2.86×104 J/mol。
=-2.86×104 J/mol。
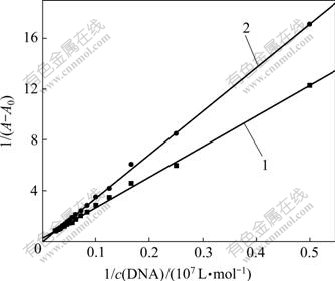
1—298.15 K; 2—310.15 K
c(Sm(Tyr)3) = 6.00 μmol/L
图5 pH=7.40时1/(A-A0)与1/c(DNA)的关系
Fig.5 Relationship between 1/(A-A0) and 1/c(DNA) at
pH 7.40
因此判定Sm(Ⅲ)(Tyr)3配合物与DNA之间可以相互作用,这种作用为焓驱动。
2.4 以吖啶橙为探针研究Sm(Ⅲ)(Tyr)3与DNA的作用方式
2.4.1 吖啶橙(AO)对DNA-Sm(Ⅲ)(Tyr)3体系荧光光谱的影响
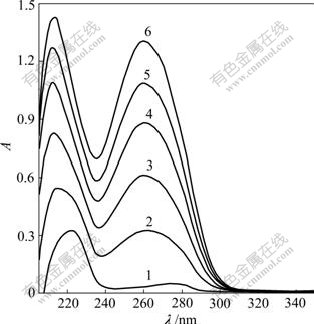
AO为一共轭平面稠环分子,能专一性地嵌插于DNA双螺旋的碱基对之间而用作核酸的光谱探 针。AO对DNA-Sm(Tyr)3荧光光谱的影响见图6。由图6可见:向DNA-Sm(Ⅲ)(Tyr)3体系中逐渐滴加AO溶液,随着AO体积增加,DNA-Sm(Ⅲ)(Tyr)3体系在519 nm处的荧光强度逐渐增强。这是AO嵌插于DNA的结果[13]。
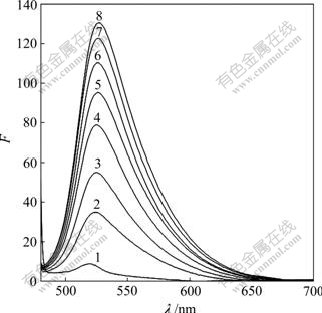
c(DNA-Sm(Tyr)3) = 1.00×10-7 mol/L;
c(AO)= 3 μmol/L
1—0 μL; 2—20 μL; 3—40 μL; 4—60 μL; 5—80 μL;
6—100 μL; 7—120 μL; 8—140 μL
图6 AO对DNA-Sm(Tyr)3荧光光谱的影响(pH=7.40)
Fig.6 Influence of AO on fluorescence spectra of DNA-Sm(Tyr)3(pH=7.40)
2.4.2 配合物Sm(Ⅲ)(Tyr)3对DNA-AO体系荧光光谱的影响
Sm(Ⅲ)(Tyr)3对DNA-AO荧光光谱的影响见图7。可见:向DNA-AO体系中逐渐滴加配合物溶液,随着配合物体积的增加,DNA-AO体系在526 nm处的荧光强度逐渐减弱,说明Sm(Ⅲ)(Tyr)3的加入破坏了原来DNA-AO体系平衡,Sm(Ⅲ)(Tyr)3与AO存在一定的竞争作用,争夺DNA上的结合位点,将AO从DNA上挤出来,导致荧光强度降低。这说明配合物Sm(Ⅲ)(Tyr)3与DNA之间存在嵌插作用。
2.5 Scatchard法研究Sm(Ⅲ)(Tyr)3与DNA的作用 方式
AO可以作为研究Sm(Ⅲ)(Tyr)3与DNA作用方式的荧光探针。在DNA-Sm(Ⅲ)(Tyr)3体系中滴加AO,引起荧光强度变化。因此,利用Sm(Ⅲ)(Tyr)3存在AO与DNA作用的Scatchard图可判别配合物与DNA的作用方式。AO与DNA作用的特点可用Scatchard方程阐述:r/c2=K(n-r)(式中:r为每个核苷酸结合AO的分子数;c2为AO游离浓度;n为r最大值;K为单个位点固有的结合常数)。

c(DNA-AO)= 6.00×10-7 mol/L;
c(Sm(Tyr)3) = 5.40×10-5 mol/L
1—0 μL; 2—20 μL; 3—40 μL; 4—60 μL; 5—80 μL;
6—100 μL; 7—120 μL; 8—140 μL; 9—160 μL; 10—180 μL; 11—200 μL
图7 Sm(Tyr)3对DNA-AO荧光光谱的影响(pH 7.40)
Fig.7 Influence of Sm(Tyr)3 on fluorescence spectra of DNA-AO (pH 7.40)
当NaCl是否存在时,Sm(Ⅲ)(Tyr)3配合物与AO-DNA体系相互作用的Scatchard图如图8和图9所示。由图8和图9可以看出:AO与DNA作用的Scatchard图中各直线均出现拐点,这表明在Sm(Ⅲ)(Tyr)3配合物的存在下,AO与DNA的结合分2个阶段:在AO体积较小的初始阶段,DNA的一部分结合位点已被配合物占据,AO则采用非竞争方式占据DNA上剩余的位点,与DNA形成化合物,即在图中斜率绝对值较大的那部分直线;随着AO体积的增大,AO与DNA的结合达到饱和,由于Sm(Ⅲ)(Tyr)3 配合物与DNA的结能力远小于AO与DNA的结合能力,结合在DNA上的配合物分子将被多余的AO分子采用竞争方式从DNA分子上挤出来,同时,结合在DNA上的AO与游离的AO分子发生相互作用,削弱了AO与DNA之间的结合,导致AO-DNA化合物稳定性降低,n增大,即图中斜率绝对值较小的那部分直线[14]。
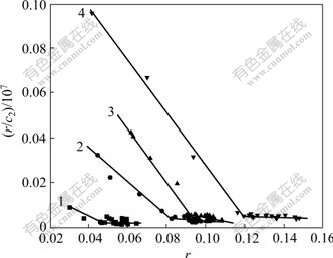
c(DNA)=1.00×10-6 mol/L; c(AO)=3.00×10-5 mol/L
(10 μL/次); Rt = c(Sm(Tyr)3)/c(DNA);
1—Rt=0; 2—Rt=0.15; 3—Rt=0.30; 4—Rt=0.45
图8 Sm(Tyr)3配合物与AO-DNA体系相互作用的Scatchard图(无NaCl)
Fig.8 Scatchard plots of AO-DNA in different concentrations of Sm(Tyr)3(without NaCl)

c(DNA)=1.00×10-6 mol/L; c(AO)=3.00×10-5 mol/L
(10 μL/次); Rt = c(Sm(Tyr)3)/c(DNA);
1—Rt=0; 2—Rt=0.15; 3—Rt=0.30; 4—Rt=0.45
图9 Sm(Tyr)3配合物与AO-DNA体系相互作用的Scatchard图(有NaCl)
Fig.9 Scatchard plots of AO-DNA in different concentrations of Sm(Tyr)3(with NaCl)
另外,溶液中有无NaCl 2种情况的对比结果显示:存在NaCl的n基本都大于不存在NaCl的n,说明Sm(Ⅲ)(Tyr)3与DNA之间存在沟渠作用,即Sm(Ⅲ)(Tyr)3配合物与DNA沟区中的碱基对之间存在范德华力和氢键作用[15]。
2.6 黏度法研究配合物与DNA的作用方式
在缺少高精度晶体结构数据和核磁数据的情况下,黏度法作为对DNA长度变化比较敏感的流体力学方法是检测溶液状态下配合物与DNA作用模式的重要手段。含有平面芳香稠环的小分子以插入方式与DNA作用时,DNA相邻碱基对的距离变大,以容纳插入配体,并导致DNA双螺旋长度增加,从而增大溶液的黏度;当药物分子以静电、沟渠结合等非插入方式与DNA作用时,DNA溶液黏度无明显变化;当药物分子以部分插入模式与DNA作用时,则可能使DNA碱基对的相对位置发生变化,导致双螺旋发生扭结,使DNA黏度降低[6, 16]。不同浓度的Sm(Ⅲ)(Tyr)3对DNA黏度的影响见图10。可见:Sm(Ⅲ)(Tyr)3与hsDNA作用后黏度有所增加,进一步证实在本实验条件下,Sm(Ⅲ)(Tyr)3与hsDNA之间存在嵌插作用[17-18]。
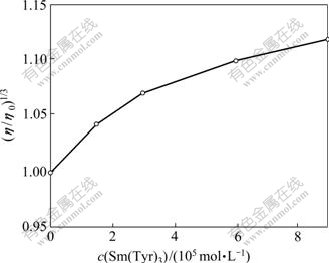
c(DNA)=1.00×10-5 mol/L
图10 不同浓度的Sm(Ⅲ)(Tyr)3对DNA黏度的影响
Fig.10 Influence of different concentrations of Sm(Ⅲ)(Tyr)3 on DNA viscosity
3 结论
(1) 通过摩尔比法,测得在生理pH=7.40 时 Sm(Ⅲ)(Tyr)3与DNA形成物质的量比为3?1的复合物,表观摩尔吸光系数为ε= 2.70×105 L/(mol·cm)。
(2) 由热力学实验测定和计算得到Sm(Ⅲ)(Tyr)3与鲱鱼精DNA相互作用的结合常数为![]() = 9.97×104 L/mol,
= 9.97×104 L/mol,![]() = -1.64×105 J/mol,
= -1.64×105 J/mol,![]() = -4.54×102 J/(mol·K),
= -4.54×102 J/(mol·K),![]() = -2.86×104 J/mol,配合物Sm(Ⅲ)(Tyr)3与鲱鱼精DNA之间的作用为焓所驱动。
= -2.86×104 J/mol,配合物Sm(Ⅲ)(Tyr)3与鲱鱼精DNA之间的作用为焓所驱动。
(3) Sm(Ⅲ)(Tyr)3与DNA主要是以嵌插方式和沟渠方式相互作用。沟渠作用是由于配合物通过DNA分子中的大沟及小沟与碱基发生范德华力和氢键作用。嵌插作用是由于酪氨酸的分子结构中的羟基与苯环共平面,这可能是Sm(Ⅲ)(Tyr)3可以与DNA发生嵌插作用的内部结构原因。
致谢:
本文得到了西南科技大学分析测试中心的支持,在此表示衷心感谢!
参考文献:
[1] 尹荔松, 朱 剑, 闻立时, 等. 稀土掺杂纳米TiO2光催化降解氯胺磷[J]. 中南大学学报: 自然科学版, 2009, 40(1): 140-144.
YIN Li-song, ZHU Jian, WEN Li-shi, et al. Photocatalytic degradation of chloramine phosphorus with RE doped TiO2[J]. Journal of Central South University: Science and Technology, 2009, 40(1): 140-144.
[2] 欧阳泽英, 肖小明, 张金艳, 等. 二(2-苯并咪唑亚甲基)胺合镝配合物的合成及其与DNA作用的光谱研究[J]. 光谱实验室, 2009, 26(1): 67-70.
OUYANG Ze-ying, XIAO Xiao-ming, ZHANG Jin-yan, et al. Synthesis and spectrum study of compound Dysprosium(Ⅲ)- Bis(2-Benzimidazolylmethyl)Amine and its interaction with DNA[J]. Chinese Journal of Spectroscopy Laboratory, 2009, 26(1): 67-70.
[3] 曹惠平, 高飞. 酚氧桥联型双核Eu(Ⅲ)配合物的合成、表征及与DNA作用研究[J]. 化学研究与应用, 2009, 21(7): 1019-1023.
CAO Hui-ping, GAO Fei. Synthesis and characterization of a new phenolate-bridged binuclear Eu(Ⅲ) complex, and interaction between the complex and DNA[J]. Chemical Research and Application, 2009, 21(7): 1019-1023.
[4] 杨立荣, 邵彩云, 毕彩丰, 等. 铕(Ⅲ)牛磺酸席夫碱配合物的合成、表征及其与DNA的作用模式[J]. 应用化学, 2009, 26(8): 913-917.
YANG Li-rong, SHAO Cai-yun, BI Cai-feng, et al. Synthesis, characterization and interaction mode of complexes of Europium(Ⅲ) and taurine schiff base with DNA[J]. Chinese Journal of Applied Chemistry, 2009, 26(8): 913-917.
[5] 吴惠霞, 吴霞琴, 沈鹤柏, 等. 铈(Ⅲ)-氨基酸二元配合物与DNA的相互作用[J]. 稀土, 1999, 20(6): 1-3.
WU Hui-xia, WU Xia-qin, SHEN He-bai, et al. Study on the interaction between Ce-amino acid complexes and DNA using cyclic voltammetry and UV spectrometry[J]. Chinese Rare Earths, 1999, 20(6): 1-3.
[6] Zhang G W, Guo J B, Pan J H, et al. Spectroscopic studies on the interaction of morin–Eu(III) complex with calf thymus DNA[J]. Biochem Biophys Methods, 2009(923): 114-119.
[7] Yang Y T, Su Q D, Zhao H Z, et al. Photoacoustic spectra of complexes of tryptophan with Sm(Ⅲ), Tb(Ⅲ) and Dy(Ⅲ)[J]. Spectrochimica Acta Part A, 1998, 54(4): 645-649.
[8] 中本一雄. 无机和配合物的拉曼红外光谱[M]. 黄德如, 汪仁庆, 译. 北京: 化学工业出版社, 1986: 235.
Kazuo Nakamoto. The IR and Raman spectrum of inorganic and coordination compounds[M]. HANG De-ru, WANG Ren-qing, trans. Beijing: Chemical Industry Press, 1986: 235.
[9] 邓芹英, 刘岚, 邓慧敏. 波谱分析教程[M]. 北京: 科学出版社, 2005: 38.
DENG Qin-ying, LIU Lan, DENG Hui-min, et al. Spectrum analysis textbook[M]. Beijing: Science Press, 2005: 38.
[10] 陈凤英, 何水样, 刘峰, 等. 配合物[RE2(H2L)2(HL)2- (2,6-H2PDA)(H2O)2]?2H2O的合成、晶体结构及其与DNA作用方式初探[J]. 化学学报, 2009, 67(6): 555-563.
CHEN Feng-ying, HE Shui-Yang, LIU Feng, et al. Synthesis, crystal structure and preliminary DNA-binding studies of [RE2(H2L)2(HL)2(2,6-H2PDA)(H2O)2]·2H2O[J]. Acta Chimica Sinica, 2009, 67(6): 555-563.
[11] 杨昌英, 刘义, 曾芳, 等. 两种荧光探针法研究三种非甾体抗炎药与DNA的相互作用[J]. 化学学报, 2007, 65(18): 2076-2080.
YANG Chang-ying, LIU Yi, ZENG Fang, et al. Interaction of three kinds of non-steroidal anti-inflammatory drugs with DNA investigated by two fluorescence probes[J]. Acta Chimica Sinica, 2007, 65(18): 2076-2080.
[12] Nafisi S, Saboury A A, Keramat N, et al. Stability and structural features of DNA intercalation with ethidium bromide, acridine orange and methylene blue[J]. J Mole Structure, 2007(827): 35-43.
[13] Tarita B, Claudia C, Fernando S, et al. The two modes of binding of Ru(phen)2dppz2+ to DNA: Thermodynamic evidence and kinetic studies[J]. Journal of Inorganic Biochemistry, 2007, 3(101): 461-469.
[14] 周庆华, 杨频. 1,3-双(2-苯并咪唑基)-2-氧杂丙烷与锌配合物的合成、晶体结构及其与DNA作用方式的研究[J]. 化学学报, 2006, 64(8): 793-798.
ZHOU Qing-hua, YANG Pin. Synthesis, crystal structure and DNA binding studies of Zn(Ⅱ) complex with 1,3- bis(benzimidazol-2-yl)-2-oxapropane[J]. Acta Chimica Sinica, 2006, 64(8): 793-798.
[15] 黎泓波, 王兴明, 阮开敏, 等. Sm(Ⅲ)(BCB)3与DNA的相互作用机理[J]. 中南大学学报: 自然科学版, 2008, 39(2): 239-245.
LI Hong-bo, WANG Xing-ming, RUAN Kai-min, et al. Mechanism of interaction between Sm(Ⅲ)(BCB)3 and DNA[J]. Journal of Central South University: Science and Technology, 2008, 39(2): 239-245.
[16] 古琴, 任祥祥, 乐学义. TATP-铜(Ⅱ)-L-丝氨酸(L-精氨酸)配合物与DNA的相互作用[J]. 物理化学学报, 2008, 24(6): 1068-1072.
GU Qin, REN Xiang-xiang, LE Xue-yi. Interaction of 1,4,8,9- Tetraazatriphenylene-Copper(Ⅱ)-L-Serinate (L-Argininate) complexes with DNA[J]. Acta Physchim Sinica, 2008, 24(6): 1068-1072.
[17] 张尊听, 高润莉, 庄素凯. 双黄酮的合成及其与DNA的作用[J]. 药学学报, 2009, 44(8): 873-878.
ZHANG Zun-ting, GAO Run-li, ZHUANG Su-kai. Synthesis of biflavones and their interaction with DNA[J]. Acta Pharmaceutica Sinica, 2009, 44(8): 873-878.
[18] 咸会朵, 刘建风, 赵国良. 十一烯酸邻菲咯啉铜髤配合物的合成、表征、晶体结构及与DNA作用[J]. 无机化学学报, 2009, 25(11): 2066-2069.
XIAN Hui-duo, LIU Jian-feng, ZHAO Guo-liang. Synthesis, characterization, crystal structure and interaction with DNA of copper(Ⅱ) complex with undecylenic acid and 1,10-phenan- throline[J]. Chinese J Inorg Chem, 2009, 25(11): 2066-2069.
收稿日期:2009-10-12;修回日期:2010-01-18
基金项目:国家自然科学基金资助项目(30572254);西南科技大学研究生创新基金资助项目(09ycjj14)
通信作者:王兴明(1955-),男,四川广汉人,教授,从事生物无机化学研究;电话:13547133962;E-mail: xmwang_xkd@yahoo.cn
(编辑 任楚威)
[1] 尹荔松, 朱 剑, 闻立时, 等. 稀土掺杂纳米TiO2光催化降解氯胺磷[J]. 中南大学学报: 自然科学版, 2009, 40(1): 140-144.
[2] 欧阳泽英, 肖小明, 张金艳, 等. 二(2-苯并咪唑亚甲基)胺合镝配合物的合成及其与DNA作用的光谱研究[J]. 光谱实验室, 2009, 26(1): 67-70.
[3] 曹惠平, 高飞. 酚氧桥联型双核Eu(Ⅲ)配合物的合成、表征及与DNA作用研究[J]. 化学研究与应用, 2009, 21(7): 1019-1023.
[4] 杨立荣, 邵彩云, 毕彩丰, 等. 铕(Ⅲ)牛磺酸席夫碱配合物的合成、表征及其与DNA的作用模式[J]. 应用化学, 2009, 26(8): 913-917.
[15] 黎泓波, 王兴明, 阮开敏, 等. Sm(Ⅲ)(BCB)3与DNA的相互作用机理[J]. 中南大学学报: 自然科学版, 2008, 39(2): 239-245.


