文章编号: 1004-0609(2006)10-1799-07
尖晶石LiMn2O4和LiCoO2与电解液的相容性
尹笃林, 范长岭, 徐仲榆
(湖南大学 新型炭材料研究所, 长沙 410082)
摘 要:
研究锂离子电池正极活性材料尖晶石LiMn2O4和LiCoO2与6种电解液充、 放电时的相容性。 用X射线衍射检测自制的LiCoO2试样和尖晶石LiMn2O4试样的结构; 用粉末微电极循环伏安法测定6种电解液在导电剂乙炔黑表面的氧化电位; 将制得的尖晶石LiMn2O4试样和LiCoO2试样在上述电解液中进行恒电流充放电实验。 结果表明: 充电至高电位3.3~4.3V(vs Li/Li+)时, 如果正极活性材料表面与电解液发生不可逆反应并在其上覆盖一薄层电子不可导的钝化膜, 则将导致活性材料的充、 放电效率降低, 放电容量减少, 即正极活性材料与电解液的相容性差; 反之, 则相容性好; 尖晶石LiMn2O4与上述6种电解液的相容性都很好, 普适性强; LiCoO2与上述6种电解液的相容性差别较大, 呈选择性。
关键词: 尖晶石LiMn2O4; LiCoO2; 锂离子电池; 相容性
中图分类号: TM912.9 文献标识码: A
Compatibilities of electrolytes with spinel LiMn2O4 and LiCoO2
YIN Du-lin, FAN Chang-ling, XU Zhong-yu
(Institute of New Carbon Materials, Hunan University, Changsha 410082, China)
Abstract: The compatibilities of six kinds of electrolytes with positive electrode active materials spinel LiMn2O4 and LiCoO2 were studied. The structures and properties of the spinel LiMn2O4 and LiCoO2 prepared were detected by XRD. The oxidation potentials of the above electrolytes on the surface of the conductive reagent, acetylene black were determined by microelectrode cyclic voltammetry experiments. The galvanostatic charge-discharge experiments of the spinel LiMn2O4 and LiCoO2 were carried out in the electrolytes. The results show that if the irreversible oxidation occurs on the interface between the positive electrode active material and the electrolyte, and a thin electron-nonconductive passivated film covers on it, both the charge-discharge efficiency and the discharge capacity of the positive electrode active material will decrease. This means that the compatibility of the electrolyte with the positive electrode active material is bad, conversely the compatibility is good. The compatibilities of the above electrolytes with the spinel LiMn2O4 are all very good. The adaptability of spinel LiMn2O4 to electrolytes is excellent, while the compatibilities of the above electrolytes with LiCoO2 are quite different. The adaptability of sample LiCoO2 to electrolytes is selective.
Key words: spinel LiMn2O4; LiCoO2; lithium ion batteries; compatibilities
锂离子电池(LIB)的电化学性能和价格主要取决于电极活性材料与电解液, 因此高性能、 廉价的正、 负极活性材料和电解液的开发一直是LIB研究的重点。 近年来, 国内石墨类负极材料的电化学性能已经取得了很大的成功[1]。 相对而言, LIB正极材料的研究进展缓慢, 已成为提高LIB性能价格比的制约因素, 例如采用LiCoO2作为正极材料时, 其比容量(~140mA·h/g)远小于石墨类负极材料的比容量(>300mA·h/g), 而且价格相差悬殊, 因此正极活性材料的研究受到越来越多的重视。 目前世界上各大电池厂所采用的正极材料仍然为LiCoO2和尖晶石LiMn2O4(包括掺杂的), 至于LiFePO4还正在开发中。
有关正、 负极活性材料的研究大多集中在制备方法对材料结构和电化学性能的影响方面, 极少涉及到正、 负极活性材料与电解液的相容性, 而这方面的研究对组装电化学性能优良的LIB至关重要。 研究石墨类负极活性材料与电解液的相容性方面已有少量报道[2-9], 但有关正极活性材料与电解液相容性方面的研究尚无报道。 因此本文作者选择了工业上常用的正极活性材料尖晶石LiMn2O4和LiCoO2在6种不同组分的电解液中进行了与电解液相容性方面的研究。
1 实验
将自制的尖晶石LiMn2O4试样和LiCoO2试样进行X射线衍射分析, 并将所得结果与德国Merck公司生产的尖晶石LiMn2O4和LiCoO2的相应图谱进行对比。 实验采用德国Siemens公司生产的D5000型X射线衍射仪, 辐射源为Cu Kα(单色器λ=0.15406nm), 工作电压35kV, 工作电流50mA, 扫描范围为10°~80°, 采用步进扫描, 步长0.03°, 步进时间0.5s。
LIB中常用的有机溶剂体系多为环状碳酸酯(如EC和PC)与线型碳酸酯(如DEC、 DMC和DME)按一定的比例混合组成。 常用的溶质为LiClO4和LiPF6。 LiBF4常用于提高LIB低温性能[10], 较少使用。 实验中所用各种溶剂和溶质的规格和生产厂家见表1, 其物理性能参看文献[11]。
表1 实验所用试剂的级别和生产厂家
Table 1 Grade and manufacturer of reagents used
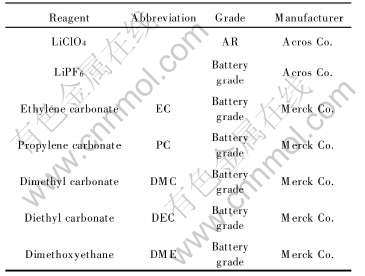
配制电解液时, 先将LiClO4·3H2O和无水LiPF6在真空干燥箱中干燥24h, 与3组溶剂[EC+DEC(1∶1), EC+DMC(1∶1)和PC+DME(1∶1)]在充满高纯氩气的手套箱中分别配制1mol/L LiClO4/EC+DEC(1∶1)、 1mol/L LiClO4/EC+DMC(1∶1)、 1mol/L LiClO4/PC+DME(1∶1)、 1mol/L LiPF6/EC+DEC(1∶1)、 1mol/L LiPF6/EC+DMC (1∶1)和1mol/L LiPF6/PC+DME(1∶1)等6种电解液。
使用DDS-12A型电导仪在20℃测定6种电解液的电导率, 测量误差〈2%。
Jang等[12, 13]认为电解液在正极表面的氧化反应主要发生在导电剂乙炔黑的表面部分, 为此采用粉末微电极循环伏安法测定了上述6种电解液在乙炔黑表面的氧化电位。 实验采用两电极体系。 将乙炔黑粉末从粉末微电极玻璃管下端压入, 使其与铂微盘电极紧密接触, 即成为粉末微电极—工作电极。 辅助电极是将锂片压在1mm粗铜丝弯成的圆环上制成的。 将工作电极和辅助电极浸入电解池的待测电解液中, 工作电极置于辅助电极的上方。 采用8511A型微电极恒电位仪(延边永恒电化学仪器厂)进行扫描, 扫描速度为1mV/s, 扫描范围为3~5V。
用恒电流充、 放电实验法检验尖晶石LiMn2O4试样、 LiCoO2试样与6种电解液的相容性时, 采用三电极体系。 将正极活性物质(尖晶石LiMn2O4或LiCoO2)、 导电剂(乙炔黑)及粘结剂(PTFE)按质量比为85∶10∶5进行充分混合, 再用辊压法制成薄膜, 然后将其碾压在铝网上即成工作电极。 辅助电极和参比电极均为锂片, 电解池的槽体为PTFE材料, 隔膜采用聚丙烯微孔膜(Celgard 2400), 在充有高纯氩气的手套箱内装配成实验模拟电池。 采用美国Arbin公司生产的BT2000型电池测试系统进行实验。 其充、 放电制度为: 充、 放电电流密度15mA/g, 充放电范围为3.30~4.30V(vs Li/Li+)[14, 15]。
2 结果与讨论
2.1 尖晶石LiMn2O4和LiCoO2试样的结构
将自制尖晶石LiMn2O4的X射线衍射谱(图1(a))与用作参照标准的Merck公司生产的尖晶石LiMn2O4样品的X射线衍射谱(图1(b))进行对比, 可以看出两个图谱中所有特征峰的峰位和相对强度都相同, 据此可以认定两种LiMn2O4具有相
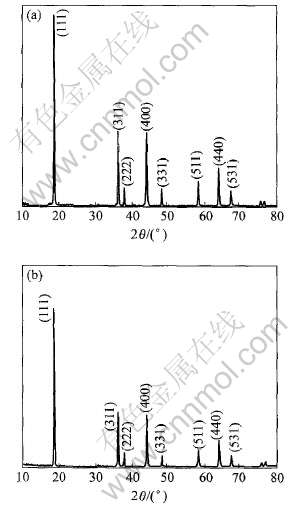
图1 自制LiMn2O4试样(a)与Merck公司LiMn2O4样品(b)的X射线衍射谱
Fig.1 XRD patterns of LiMn2O4 samples self-made (a) and made in Merck company(b)
同的结构。
将自制LiCoO2试样的X射线衍射谱(图2(a))与用作参照标准的Merck公司生产的LiCoO2样品的X射线衍射谱(图2(b))进行对比, 可以看出两个图谱中所有特征峰的峰位和相对强度都相同, 据此可以认定两种LiCoO2具有相同的结构。
2.2 电解液的电导率
表2列出了实验中所用6种不同组分电解液在20℃时的电导率。
从表2可以看出, 同一锂盐的电解液其电导率与溶剂组成的关系为: PC+DME >EC+DMC>EC+DEC; 溶剂组成相同的电解液以LiPF6作溶质时的电导率略高于以LiClO4作溶质时的电导率。 其原因是由于在有机非质子溶剂中, 正、 负离子间的相互作用程度不同(LiClO4>LiPF6), 离子间缔合作用越强, 相同电解液浓度下载流子的数目愈
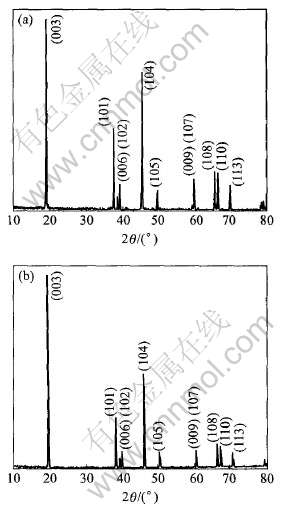
图2 自制LiCoO2试样(a)与德国Merck公司LiCoO2样品(b)的X射线衍射谱
Fig.2 XRD patterns of LiCoO2 samples self-made(a) and made in Merck company(b)
表2 不同组成的6种电解液在20℃时的电导率
Table 2 Conductivities of six different electrolytes with 1mol/L concentration at 20℃
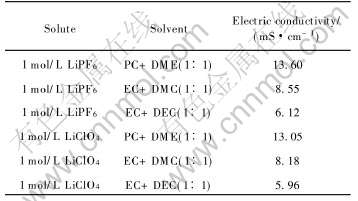
少, 电解液的电导率愈低。
2.3 电解液的氧化电位
图3所示为使用粉末微电极循环伏安法测得的6种不同电解液在导电剂乙炔黑表面的氧化情况。 表3列出了相应电解液体系在乙炔黑表面的氧化电位。
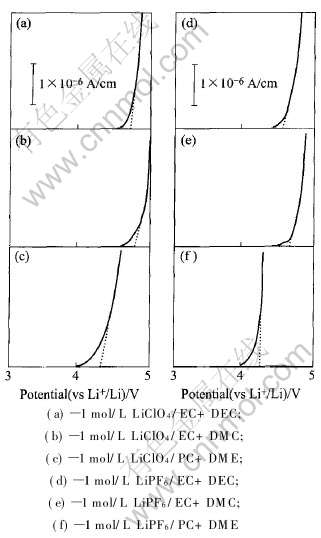
图3 6种电解液在导电剂乙炔黑表面的氧化曲线
Fig.3 Oxidation curves of six different electrolytes on surfaces of conductive reagent acetylene black
表3 6种不同电解液在乙炔黑表面的氧化电位
Table 3 Oxidation potential in six different kinds of electrolytes on surface of acetylene black
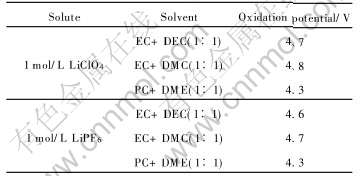
可以看出, EC+DMC溶剂体系的抗氧化性能最好, PC+DME体系的抗氧化性能最差。 溶质的种类也影响抗氧化性, 相同溶剂体系的电解液, 以LiClO4作溶质时的抗氧化性能优于LiPF6作溶质时的抗氧化性能。
2.4 尖晶石LiMn2O4试样和LiCoO2试样在6种不同组分电解液中的恒电流充、 放电性能
图4所示为尖晶石LiMn2O4试样在6种不同组分电解液中的恒电流充、 放电曲线。 可以看出, 在所有的电解液中, 从第一循环到第三循环都有2个电位平台: 3.95V(vs Li+/Li)左右和4.15V(vs Li+/Li)左右, 前者对应于锂离子在八面体16c位置上的脱嵌, 后者对应于锂离子在四面体8a位置上的脱嵌。 充、 放电容量和循环效率如表4所示。
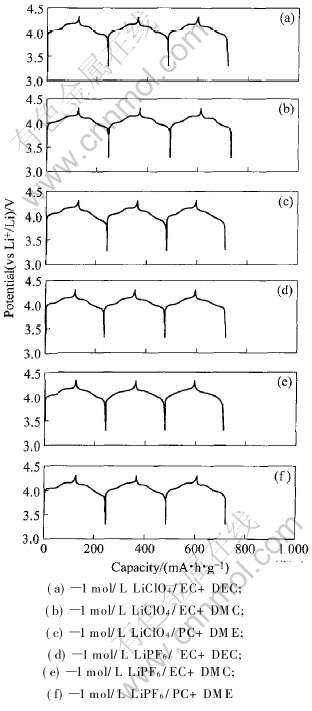
图4 LiMn2O4试样在6种不同组分电解液中的恒电流充、 放电曲线
Fig.4 Galvanostatic charge-discharge curves of LiMn2O4 sample in six different electrolytes
表4 LiMn2O4在6种电解液中的恒电流充、 放电实验数据
Table 4 Charge-discharge experimental data of LiMn2O4 sample in six different kinds of electrolytes
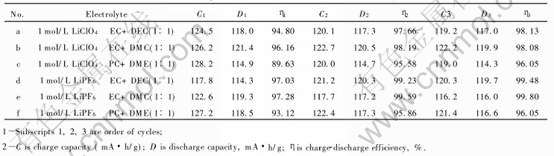
从表4可以看出, 尖晶石LiMn2O4试样在6种不同组分的电解液中进行恒电流充、 放电时, 其特点如下: 1) 进行首次充、 放电时, 充、 放电效率η1都很高(93.12%~97.28%); 2) 进行第三循环充、 放电时放电容量D3的差别很小(116.0~119.9mA·h/g), 充、 放电效率η3差别也很小(96.05%~99.80%), 而且都很高; 3) 随着循环的增加, 充、 放电效率也在不断增加并逐步趋向于100%。
上述事实表明: 1) 在实验所选择的充、 放电电位范围3.3~4.3V(vs Li+/Li)内未发生过充或过放电致使尖晶石LiMn2O4试样结构遭到破坏的现象; 2) 在最高充电电位为4.3V的情况下, 上述6种不同组分的电解液也未在导电剂乙炔黑的表面因氧化而大量分解; 3) 6种不同组分电解液电导率的大小(5.96~13.9mS/cm)与LiMn2O4试样的第三循环放电容量D3和充、 放电效率η3无关; 4) 在进行首次充电时6种不同组分的电解液与尖晶石LiMn2O4试样表面并未发生激烈的不可逆氧化反应, 因此尖晶石LiMn2O4试样与在上述6种电解液的相容性都很好、 普适性很强。
图5所示为LiCoO2试样在6种不同组分电解液中的恒电流充、 放电曲线。 可以看出, 在所有的电解液中进行恒电流充、 放电时, 从第一循环到第三循环都有一个4V(vs Li+/Li)左右的电位平台。 充、 放电容量和循环效率如表5所示。
从表5可以看出, 与尖晶石LiMn2O4试样相比, LiCoO2试样在6种不同组分的电解液中进行恒电流充、 放电时有明显的差异: 第三循环的放电容量D3的差别较大(131.3~155.7mA·h/g), 充、 放电效率η3的差别也较大(93.69%~98.98%)。
显然, 在本实验中所选择的充、 放电电位3.3~4.3(vs Li+/Li)范围内, LiCoO2试样的结构不可
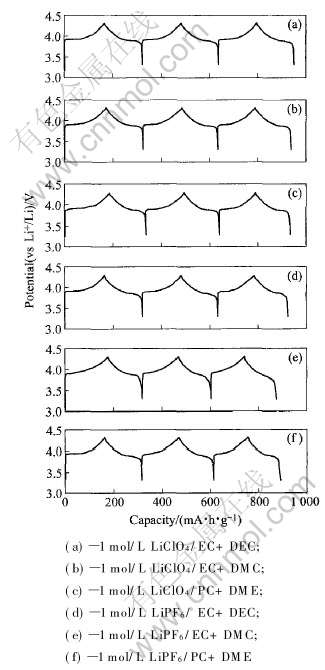
图5 LiCoO2试样在6种不同组分电解液中的恒电流充、 放电曲线
Fig.5 Galvanostatic charge-discharge curves of LiCoO2 sample in six different electrolytes
表5 LiCoO2在6种不同电解液中的恒电流充、 放电实验数据
Table 5 Charge-discharge experimental data of LiCoO2 sample in six different kinds of electrolytes
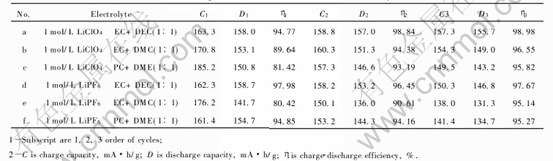
能遭到破坏。 上述6种不同组分的电解液也不可能在导电剂乙炔黑的表面因氧化而分解, 电解液电导率的差异与第三循环放电容量D3和充、 放电效率η3的差异也无对应关系, 因此第三循环的放电容量D3和充、 放电效率η3的降低只可能是因为在进行恒电流充、 放电时, 电解液与LiCoO2试样表面发生了不可逆氧化反应。
从表5可知, LiCoO2试样在1mol/L LiPF6/EC+DMC(1∶1)电解液中进行首次充、 放电时, 充、 放电效率η1仅为80.42%, 不可逆容量已接近20%。 而在第二、 三循环中充、 放电效率η2和η3逐步增至90.61%和95.14%, 不可逆容量逐步减少至10%和5%左右。 上述事实表明不可逆氧化反应所得产物必然是一种覆盖在LiCoO2试样表面的钝化膜, 这种钝化膜电子不可导, 但锂离子可以通过, 因此当循环继续进行时, 由于钝化膜的不断完善, 不可逆反应逐步减弱, 充、 放电效率不断提高。 与此同时, 锂离子对LiCoO2进行脱出和嵌入的阻力也在逐渐增加, 充、 放电容量也在逐渐减少。
LiCoO2试样在1mol/L LiClO4/EC+DEC(1∶1)电解液中进行充、 放电时, 各循环的充、 放电效率都很高: η1=94.77%, η2=98.84%, η3=98.98%, 这说明在各循环中电解液与LiCoO2试样表面没有产生不可逆氧化反应, 试样表面并未覆盖一层对锂离子进行脱出和嵌入时产生阻力的钝化膜, 因此各循环的放电容量几乎保持不变: D1=158.0mA·h/g, D2=157.0mA·h/g, D3=155.7mA·h/g。
综上所述, 可见LiCoO2试样与尖晶石LiMn2O4试样迥然不同, 在上述6种不同组分的电解液中, 充、 放电性能差别较大, 也即LiCoO2试样与电解液的相容性呈选择性。 上述6种不同组分的电解液中, 溶剂组分相同的电解液, 使用LiClO4作溶质时电解液的抗氧化性优于LiPF6作溶质时电解液的抗氧化性; 而对同一种溶质而言, 又以EC+DEC溶剂组分在LiCoO2表面的抗氧化性为最好。
3 结论
1) 如果正极在进行首次充电(在高电位)时正极活性材料表面与电解液发生不可逆的氧化反应, 并在其表面覆盖一薄层电子不可导的钝化膜, 则因钝化膜的生成不仅增大了不可逆容量, 降低了充、 放电效率, 而且在某种程度上阻碍了锂离子对正极活性材料的脱出和嵌入, 从而降低了放电容量。 反之, 如果正极在进行首次充电(在高电位)时正极活性材料表面与电解液不发生不可逆的氧化反应, 则因无不可逆容量, 充、 放电效率将很高。 前一种情况属于正极活性材料与电解液相容性差的情况, 后一种情况属于正极活性材料与电解液相容性好的情况。
2) 尖晶石LiMn2O4对上述6种常用电解液的相容性都很好、 普适性很强, 但LiCoO2对各种常用电解液的相容性差别较大、 选择性很强。
3) 对LiCoO2而言, 在上述6种常用电解液中以1mol/L LiClO4/ EC+DEC(1∶1)电解液在LiCoO2表面的抗氧化性为最强, 因此1mol/L LiClO4/EC+DEC(1∶1) 与LiCoO2试样的相容性最好。
4) LiCoO2试样在1mol/L LiPF6/EC+DMC(1∶1)电解液中进行充、 放电后, 在其表面所形成钝化膜的化学组成还有待于进一步确定。
REFERENCES
[1]时志强, 樊丽萍, 王成扬. 商业化的锂离子电池石墨负极材料的研究进展[J]. 炭素, 2006(1): 3-6.
SHI Zhi-qiang, FAN Li-ping, WANG Cheng-yang. Research progress on the graphite cathode material of the commercial lithium ion battery [J]. Carbon, 2006(1): 3-6.
[2]徐仲榆, 郑洪河. 锂离子蓄电池碳负极/电解液的相容性研究进展(Ⅰ): 碳电极界面化学与碳负极/电解液的相容性[J]. 电源技术, 2000, 24(3): 171-177.
XU Zhong-yu, ZHENG Hong-he. Research progress on the compatibility of electrolytes with carbon negative electrode in lithium ion batteries(Ⅰ): Surface chemistry of carbon electrode and the compatibility of electrolytes with carbon negative electrode[J]. Chinese Journal of Power Sources, 2000, 24(3): 171-177.
[3]徐仲榆, 郑洪河. 锂离子蓄电池碳负极/电解液的相容性研究进展(Ⅱ): 电解液组成与碳负极/电解液的相容性[J]. 电源技术, 2000, 24(5): 295-301.
XU Zhong-yu, ZHENG Hong-he. Research progress on the compatibility of electrolytes with carbon negative electrode in lithium ion batteries(Ⅱ): The relation between electrolyte composition and the compatibility of electrolytes with carbon negative electrode[J]. Chinese Journal of Power Sources, 2000, 24(5): 295-301.
[4]苏玉长, 徐仲榆. 高温热处理石油焦在不同电解液中的嵌锂特性[J]. 电池, 2001, 31(4): 157-160.
SU Yu-chang, XU Zhong-yu. The lithium intercalation characteristics of high temperature treated petroleum coke in different electrolytes [J]. Battery Bimonthly, 2001, 31(4): 157-160.
[5]徐仲榆, 朱鹏, 彭丽华, 等. 石油沥青基中间相炭微球用作锂离子电池负极材料时与电解液的相容性[J]. 炭素技术, 2002(1): 1-7.
XU Zhong-yu, ZHU Peng, PENG Li-hua, et al. Compatibility of electrolytes with petroleum pitch-based mesocarbon microbeads used as the negative electrode material in lithium ion batteries [J]. Carbon Techniques, 2002(1): 1-7.
[6]徐仲榆, 尹笃林, 涂健, 等. 煤焦油沥青基中间相碳微球与电解液的相容性[J]. 电池, 2002, 32(6): 315-319.
XU Zhong-yu, YIN Du-lin, TU Jian, et al. The compatibility of electrolytes with coal tar pitch-based mesocarbon microbeads[J]. Battery Bimonthly, 2002, 32(6): 315-319.
[7]XU Zhong-yu, YIN Du-lin. The compatibility of electrolytes with heat-treated soft carbon used as the negative electrode materials in lithium ion batteries[A]. Proceedings of International Conference on Carbon[C]. Beijing, 2002: 2-31.
[8]徐仲榆, 范长岭, 尹笃林. 锂离子电池中电解液与石墨类负极活性材料的相容性[J]. 新型炭材料, 2004, 19(4): 241-248.
XU Zhong-yu, FAN Chang-ling, YIN Du-lin. The compatibility of electrolytes with graphitic negative electrode active material in lithium ion batteries [J]. New Carbon Materials, 2004, 19(4): 241-248.
[9]YIN Du-lin, FAN Chang-ling, XU Zhong-yu. Two kinds of interfacial reactions occurring at the interfaces of graphite particles during the charge-discharge process in lithium ion batteries[A]. The 2nd International Symposium on Interfacial Materials & The 2nd China-Australia Materials Science Symposium-Progress in New Energy Materials[C]. Shenyang: Instutute of Metal Reserch, Cinese Academy of Scierces, 2005: 12-13.
[10]Zhang S S, Xu K, Jow T R. A new approach toward improved low temperature performance of Li-ion battery[J]. Electrochem Commun, 2002(4): 928-932.
[11]吴宇平, 戴晓兵, 马军旗, 等. 锂离子电池—应用与实践[M]. 北京: 化学工业出版社, 2004: 222-229.
WU Yu-ping, DAI Xiao-bing, MA Jun-qi, et al. Lithium ion Batteries—Applications and Practices[M]. Beijing: Chemical Industry Press, 2004: 222-229.
[12]Jang D H, Oh S M. Effects of carbon additives on spinel dissolution and capacity losses in 4V Li/LixMn2O4 rechargeable cells[J]. Electrochimica Acta, 1998, 43: 1023-1029.
[13]Jang D H, Shin Y J, Oh S M. Dissolution of spinel oxides and capacity losses in 4V Li/LixMn2O4 cells[J]. J Electrochem Soc, 1996, 143: 2201-2211.
[14]王要武. 尖晶石型锂锰氧材料作为锂离子二次电池正极材料的研究[D]. 长沙: 湖南大学, 1999.
WANG Yao-wu. The Research on Using Spinel LiMn2O4 as the Positive Electrode Materials for Lithium Ion Secondary Batteries[D]. Changsha: Hunan University, 1999.
[15]郑洪河. 锂离子二次电池中电解液与正、 负电极材料的兼容性[D]. 长沙: 湖南大学, 2001.
ZHENG Hong-he. The Compatibility Between the Electrolyte and the Positive and Negative Electrode Materials for Lithium Ion Batteries[D]. Changsha: Hunan University, 2001.
(编辑龙怀中)
基金项目: 湖南省科技厅重点资助项目(00GK1006)
收稿日期: 2006-03-16; 修订日期: 2006-08-24
通讯作者: 徐仲榆, 教授; 电话: 0731-8822967; E-mail: zyxincmhnu@yahoo.com.cn
[1]时志强, 樊丽萍, 王成扬. 商业化的锂离子电池石墨负极材料的研究进展[J]. 炭素, 2006(1): 3-6.
[2]徐仲榆, 郑洪河. 锂离子蓄电池碳负极/电解液的相容性研究进展(Ⅰ): 碳电极界面化学与碳负极/电解液的相容性[J]. 电源技术, 2000, 24(3): 171-177.
[3]徐仲榆, 郑洪河. 锂离子蓄电池碳负极/电解液的相容性研究进展(Ⅱ): 电解液组成与碳负极/电解液的相容性[J]. 电源技术, 2000, 24(5): 295-301.
[4]苏玉长, 徐仲榆. 高温热处理石油焦在不同电解液中的嵌锂特性[J]. 电池, 2001, 31(4): 157-160.
[5]徐仲榆, 朱鹏, 彭丽华, 等. 石油沥青基中间相炭微球用作锂离子电池负极材料时与电解液的相容性[J]. 炭素技术, 2002(1): 1-7.
[6]徐仲榆, 尹笃林, 涂健, 等. 煤焦油沥青基中间相碳微球与电解液的相容性[J]. 电池, 2002, 32(6): 315-319.
[8]徐仲榆, 范长岭, 尹笃林. 锂离子电池中电解液与石墨类负极活性材料的相容性[J]. 新型炭材料, 2004, 19(4): 241-248.
[11]吴宇平, 戴晓兵, 马军旗, 等. 锂离子电池—应用与实践[M]. 北京: 化学工业出版社, 2004: 222-229.


