磷脂胆碱聚乳酸自组装胶束的结构与性能
仇 植1,陈元维1, 2,李速明2,罗祥林1, 3
(1. 四川大学 高分子科学与工程学院,四川 成都,610065;
2. 法国国家科学研究中心5247实验室,蒙彼利埃第一大学,蒙彼利埃 34060;
3. 四川大学 高分子国家重点实验室,四川 成都,610065)
摘 要:
摘 要:用与天然磷脂结构和相对分子质量类似的磷脂胆碱聚乳酸(Phosphorylcholine-containing poly(L-lactide), PLLA-PC)制备自组装胶束,采用透射电镜和激光共聚焦显微镜进行观察。研究结果表明:胶束为外壳亲水内核疏水的实心球;表面张力法测得临界胶束质量浓度(Critical micelle concentration, CMC)为23 mg/L,显著低于天然磷脂胆碱质量浓度;当氯化钠质量分数低于0.9%时,CMC无明显变化,表明胶束在生理盐水中较稳定;胶束被稀释时,动态光散射测得胶束粒径和粒径分布均逐渐变小,表明体系是动态体系;在37 ℃恒温条件下放置15 h,胶束数量、粒径和分布均变小,表明胶束可随时间降解;PLLA-PC胶束生物相容性好,可降解,可望成为新型的控释药物载体。
关键词:
中图分类号:TQ423.3;R318.08 文献标志码:A 文章编号:1672-7207(2009)06-1552-05
Structure and stability of micelles formed by self-assembling of biodegradable phosphorylcholine-containing poly(L-lactide)
QIU Zhi1, CHEN Yuan-wei1, 2, LI Su-ming2, LUO Xiang-lin1, 3
(1. School of Polymer Science and Engineering, Sichuan University, Chengdu 610065, China;
2. CNRS 5247, University Montpellier I, Montpellier 34060, France;
3. National Key Lab of Polymer, Sichuan University, Chengdu 610065, China)
Abstract: Self-assembled micelles were prepared from phosphorylcholine-containing poly (L-lactide)(PLLA-PC) with similar molecular structure and molecular mass to natural phospholipids. The global structure with hydrophilic shell and hydrophobic core is confirmed by transmission electron microscope (TEM) and confocal laser scanning microscope (CLSM). The results show that critical micelle concentration (CMC) is detected to be 23 mg/L with surface tension method, which is much lower than that of natural phospholipids. It remains constant while NaCl concentration varies within 0.9% (mass fraction), indicating the stability of micelles in physiological saline. The results of dynamic light scattering (DLS) show that the diameter and distribution of micelles decrease gradually with dilution, suggesting a dynamic system. Moreover, the number, particle size and distribution of micelles diminish after 15 d at 37 ℃, indicating that the micelles can degrade over time. With good biocompatibility and biodegradability PLLA-PC micelle might be a novel alternative for controlled drug release.
Key words: self-assembled micelles; phosphorylcholine-containing poly(L-lactide); degradation; structure; property
磷脂能够进行自组装,常用作药物释放载体,但天然卵磷脂分子中含有不饱和的脂肪酸链段,很容 易水解和氧化,生成过氧化物、醛和有机酸等产物[1]。为此,常用的方法是通过氢化使不饱和脂肪酸碳链变为饱和[2]。另外,在合成或天然获取的甘油磷脂胆碱中,引入饱和脂肪酸链段,生成的磷脂既稳定又具有很好的生物相容性[3-5]。但是,饱和碳链在人体中不易水解,只能通过脂肪酸氧化途径代谢后才能被清除。以甘油磷脂胆碱(G-glycero-phosphorylcholine, GPC)开环L-丙交酯制备的甘油磷脂酰胆碱聚乳酸(Phosphorylcholine-containing poly(L-lactide), PLLA- PC)是一种新型聚合物,也是两亲性分子,其结构与天然磷脂胆碱的结构极其相似,具有良好的抗蛋白吸附和血小板黏附性能[6],可完全生物降解且降解产物无毒。目前,关于PLLA-PC的自组装行为在国内外均未见报道。Salvage等[7]以2-甲基丙烯酰羟乙基磷脂酰胆碱(MPC)和2-甲基丙烯酰乙基二乙基胺(DPA)为原料合成了MPC-DPA共聚物;Hsiue等[8]以苯甲醇为引发剂使MPC和丙交酯(D,L-lactide)共聚得到含磷脂胆碱的聚乳酸。这2种聚合物均为含亲水的磷脂胆碱基团和疏水的脂肪链的两亲性共聚物,可自组装形成纳米微粒,据此预测PLLA-PC可能具有类似的自组装行为。本文作者合成了与天然磷脂胆碱相对分子质量相近的PLLA-PC,研究自组装形成胶束以及胶束的结构和性能,为其用作药物控释材料提供数据。
1 实 验
1.1 试 剂
试剂为:甘油磷脂胆碱,从新鲜鸡蛋中分离提取;L-丙交酯,抚顺市天元生物材料有限公司生产,用无水甲苯重结晶;中性氧化铝,分析纯,粒度为38~75 μm;辛酸亚锡、奈尔红(Nile red),Sigma-Aldrich公司生产。其他试剂均为市售,分析纯。
1.2 共聚物PLLA-PC合成和胶束的制备
PLLA-PC的合成按文献[9]所述的方法进行。
胶束的制备:称取一定量的PLLA-PC于圆底烧瓶中,用四氢呋喃溶解得到1 g/L溶液。旋转蒸发得到一层薄膜。真空干燥后,加入去离子水,超声处理30 min后再搅拌1 h,最后,将所得溶液用过滤器过滤(滤膜直径为0.45 μm)。
1.3 表 征
核磁共振氢谱H1 NMR在Bruker核磁共振波谱仪上于室温测定。以CDCl3为溶剂,四甲基硅烷为内标,频率为300 MHz。采用体积排除色谱仪SEC测定相对分子质量,色谱仪为Waters410,THF为流动相,流速为1.0 mL/min,以聚苯乙烯为标样。 每次进样时注入20 μL 1.0%(质量分数)样品溶液。
采用JEM-100CX透射电子显微镜TEM观察胶束形态,加速电压为80 kV。测试前,用磷钨酸PTA染胶束溶液并滴加在铜丝网上,放在滤纸上在空气中干燥。采用激光共聚焦显微镜CLSM(德国莱卡公司TCS SP5)观察胶束内核结构,激发波长为549 nm。按照胶束制备方法准备样品,在旋转蒸发前把疏水荧光染料奈尔红溶解在PLLA-PC共聚物的THF溶液中。动态光散射DLS(Brookhaven BI-200和Brookhaven BI-9000 AT数字自动校正仪)测定胶束粒径及粒径 分布,氩激光波长为514.5 nm,激发功率为200 mW,测试温度为25 ℃或37 ℃,散射角为90?。选用自动校正功能中的CONTN方法获得粒径分布。
用Kruss K100张力计测定不同浓度的胶束溶液的表面张力。
2 结果与讨论
2.1 PLLA-PC共聚物的表征
以结构和相对分子质量与天然磷脂接近的PLLA-PC为研究对象,PLLA-PC的分子结构如图1所示,其中,平均每条链的乳酸单元与磷脂胆碱的物质的量比n(LLA)?n(PC)=5?1(H1 NMR谱图中δ=1.55 处聚乳酸侧甲基特征峰的峰面积与δ=3.25处甘油磷酰胆碱-N+(CH3)3的特征单峰峰面积的积分值之比),SEC测得的数均相对分子质量Mn=621,重均相对分子质量Mw=2 108。

图1 PLLA-PC分子结构
Fig.1 Molecular structure of PLLA-PC
2.2 PLLA-PC胶束的结构与性质
2.2.1 胶束的形态结构
胶束的制备通常可采用相分离法或成膜水化法。前者适用于疏水链段较长的聚合物,而后者适用于疏水链段较短的聚合物[10]。本研究采用成膜水化法制备胶束,以TEM和CLSM表征其形态结构。
图2(a)所示为胶束经磷钨酸负染色后的TEM图。从图2(a)可见:胶束呈球形,直径为30~60 nm。为进一步确认胶束的内部结构,用疏水荧光染料奈尔红染色胶束做激光共聚焦观察,结果如图2(b)所示。从图2(b)可以观察到大量的圆形小球,呈橙红色,且颜色分布较均匀,与断层扫描观察结果一致,表明胶束内部为疏水实心结构而非囊泡。

(a) TEM;(b) CLSM
图2 PLLA-PC胶束(质量浓度为0.9 g/L)的TEM和CLSM照片
Fig.2 TEM (a) and CLSM (b) images of micelles PLLA-PC with mass concentration of 0.9 g/L
已有研究证实,磷脂分子在水溶液中既可形成外壳亲水内核疏水的胶束,也可形成封闭的双层膜结构即囊泡,这取决于疏水链的结构。当疏水链为双链时,疏水链为因静电作用相互排斥的极性头提供足够空间,有利于双层膜结构的形成。而当疏水链为单链时,由于受空间的局限,只能形成胶束。据此推测PLLA-PC分子可能为单链或不等长双链结构。导致这种结构的原因可能是合成PLLA-PC时甘油磷脂胆碱上与磷脂胆碱邻近的羟基比另一个羟基具有更大的空间位阻[11]。
2.2.2 临界胶束浓度CMC
表面张力法是测定临界胶束质量浓度的常用方法。随着水溶液中聚合物质量浓度增大,表面张力逐步降低。当质量浓度增加到某一值时,如果继续增大,表面张力不再改变或改变很小[12],这时的质量浓度即为临界胶束质量浓度(Critical micelle concentration, CMC)。25 ℃时PLLA-PC水溶液的表面张力与质量浓度关系如图3所示。图3表明:PLLA-PC的临界胶束质量浓度为23 mg/L。该值是天然磷脂胆碱临界胶束质量浓度(约为1.0 g/L[13])的1/50。因此,合成的PLLA-PC较天然磷脂胆碱有更强的表面活性。
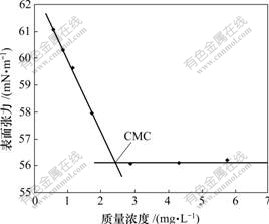
图3 25 ℃时PLLA-PC(n(LLA)?n(PC)=5?1)水溶液的表面张力-质量浓度关系
Fig.3 Relationship between surface tension and concentration of PLLA-PC (n(LLA)?n(PC)=5?1) solutions at 25 ℃
通常,极性基团在疏水链末端的表面活性剂比极性基团在疏水链中间的表面活性剂有更强的表面活 性[12],据此,可以再次推测PLLA-PC具有单链或不等长双链结构。
2.2.3 电解质对CMC的影响
以氯化钠作为电解质,研究结果表明,当氯化钠质量分数由0提高到0.09 %和0.45 %时,PLLA-PC的CMC分别为23,24和22 mg/L,基本保持不变。当氯化钠浓度进一步提高到0.9 %(生理盐水浓度)时,CMC仍然为23 mg/L。表明PLLA-PC在0.9%以内的氯化钠溶液中形成胶束能力几乎不受影响。这一性质对经脉注射有重要意义。
通常情况下,人们认为电解质的引入会影响离子型表面活性剂的表面活性(CMC)。实际上,Huang等[14]研究表明,影响程度不仅取决于电解质的种类,而且取决于电解质的浓度。当氯化钠溶液离子强度低于0.5 mol/L时,磷脂酰胆碱形成胶束的临界相变温度变化不大,与本文的结果一致。
2.2.4 稀释对粒径及粒径分布的影响
DLS检测PLLA-PC在水溶液中形成颗粒粒径及粒径分布,结果如图4所示。可见,当PLLA-PC质量浓度为190 mg/L时,粒径分布在71.5~271.3 nm,平均粒径为153.3 nm,集中分布在159.1 nm。用去离子水稀释至原浓度的1/3,粒径分布范围变窄(75.0~217.3 nm),平均粒径变小(126.6 nm),集中分布在142.0 nm。进一步稀释溶液至原浓度的1/4,粒径分布范围进一步变窄(100.6~149.6 nm),平均粒径进一步减小(105.0 nm)。这种动态变化证明这些微粒确为胶束而非固体粒子。进一步将胶束浓度稀释至原质量浓度的1/7即27 mg/L时,DLS检测到的微粒数极少。这一结果与表面张力法检测到的临界胶束浓度一致。

质量浓度/(mg?L-1): (a) 190; (b) 63; (c) 47
图4 不同浓度胶束的粒径及粒径分布的关系曲线
Fig.4 Curves of size and size distribution of micelles at different concentrations
2.2.5 胶束的降解性
在37 ℃时质量浓度为170 mg/L PLLA-PC胶束的粒径及粒径分布如图5所示。可见:到第7 d时,平均粒径由初始的153.0 nm减小到113.0 nm,粒径分布由最初的71.0~271.0 nm变为99.0~133.0 nm;至第15 d时,代表胶束数量的ACR(Average count rate)由初始的16 000 个/s降至10 200 个/s,减少了36%,平均粒径进一步减小为106.7 nm,粒径分布集中在104.0~108.0 nm,分布范围进一步缩小。在其他浓度和相同的温度条件下也得到类似的结果。由此可以看出,PLLA-PC胶束可随时间降解。其原因是聚乳酸分子的酯键因水解作用可以断裂,相对分子质量下降,使得胶束粒径变小;同时,由于高聚合的多分散性,PLLA-PC相对分子质量较小的分子降解更迅速,降解后成为可溶于水的小分子[15]。PLLA-PC的可降解性可能成为控制药物释放的一种手段,即通过药物载体的降解实现药物释放。
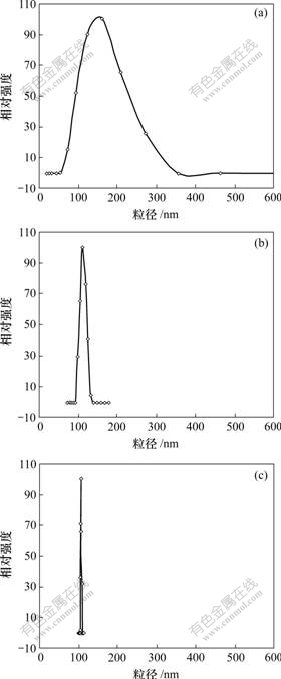
时间/d: (a) 0; (b) 7; (c) 15
图5 浓度为170 mg/L的胶束在37 ℃放置不同时间后的粒径及粒径分布
Fig.5 Size and size distribution of micelles with same concentration of 170 mg/L holding for different days at 37 ℃
3 结 论
a. 结构和相对分子质量与天然磷脂类似的磷脂胆碱聚乳酸PLLA-PC能够形成胶束,该胶束结构为外壳亲水内核疏水实心球体。
b. 该胶束临界质量浓度为23 mg/L,显著低于天然磷脂胆碱的临界胶束质量浓度,并且具有较好的稳定性,几乎不受电解质的影响(w(NaCl)<0.9%)。
c. PLLA-PC胶束可降解,可望成为一种新型的控释药物载体。
参考文献:
[1] Crommelin D J A, Grit M, Talsma H, et al. Liposomes as carries for durgs and antigens: approaches to preserve their long term stability[J]. Drug Development and Industrial Pharmacy, 1994, 20(4): 547-553.
[2] 黄国文, 赵俊廷, 谷克仁. 大豆粉末磷脂的氢化[J]. 中国油脂, 2003, 28(2): 51-54.
HUANG Guo-wen, ZHAO Jun-ting, GU Ke-ren. Hydrogenation of soybean powder lecithin[J]. China Oils, 2003, 28(2): 51-54.
[3] Oishi T, Yoshikawa M, Yamasaki H, et al. Synthesis and polymerization of novel methacrylate having glycerophosphorylcholine[J]. Polymer Bulletin, 2002, 47(5): 415-420.
[4] Gadras C, Santaella C, Vierling P. Improved stability of highly ?uorinated phospholipid-based vesicles in the presence of bile salts[J]. Journal of Controlled Release, 1999, 57(1): 29-34.
[5] Tiera M J, Qiu X P, Bechaouch S. Synthesis and characterization of phosphorylcholine substituted chitosans soluble in physiological pH conditions[J]. Biomacromolecules, 2006, 7(11): 3151-3156.
[6] Iwasaki Y, Tojo Y, Kurosaki T, et al. Reduced adhesion of blood cells to biodegradable polymers by introducing phosphorylcholine moieties[J]. Journal of Biomedical Materials Research, 2003, 65A: 164-169.
[7] Salvage J P, Rose S F, Phillips G J, et al. Novel biocompatible phosphorylcholine-based self-assembled nanoparticles for drug delivery[J]. Journal of Controlled Release, 2005, 104(2): 259-270.
[8] Hsiue G H, Lo C L, Cheng C H, et al. Preparation and characterization of poly(2-methacryloyloxyethyl phosphorylcholine)- block-poly(D,L-lactide) polymer nan particles[J]. Journal of Polymer Science (Part A): Polymer Chemistry, 2007, 45(4): 688-698.
[9] 王立坚, 罗 娟, 罗祥林, 等. 含生物功能基团磷脂胆碱的聚乳酸的合成反应[J]. 高分子材料科学与工程, 2007, 23(6): 60-63.
WANG Li-jian, LUO Juan, LUO Xiang-lin, et al. L-Lactide ring-opening polymerization by L-glycerophosphorylcholine to get polylactide containing bionic functional group[J]. Polymer Materials Science and Engingeering, 2007, 23(6): 60-63.
[10] Gaucher G, Dufresne M H, Sant V P. Block copolymer micelles: preparation, characterization and application in drug delivery[J]. Journal of Controlled Release, 2005, 109(1/3): 169-188.
[11] Cantor C R, Schimmel P R. Biophysical chemistry[M]. San Francisco: Wh Freeman & Co, 1980.
[12] 章莉娟, 郑 忠. 胶体与界面化学[M]. 广州: 华南理工大学出版社, 2006: 170-173.
ZHANG Li-juan, ZHEN Zhong. Colloid and interface chemistry[M]. Guangzhou: South China University of Technology Press, 2006: 170-173.
[13] 李鸿瑞, 娄安境. 磷脂酸胆碱的CMC测定与研究[J]. 山东师范大学报: 自然科学版, 1990, 5(1): 37-39.
LI Hong-rui, Lou An-jin. The determination of the critical micelle concentration (CMC) of phosphatidylcholine[J]. Journal of Shangdong Normal University: Natural Sciences Edition, 1990, 5(1): 37-39.
[14] Huang X Y, George M. The effect of salt identity and concentration on liquid-liquid phase separation in aqueous micellar solution of C8-lecithin[J]. Journal of Chemical Physics, 1990, 92(3): 1956-1962.
[15] Hakkarainen M, Karlsson S, Albertsson A C. Rapid (bio) degradation of polylactide by mixed culture of compost microorganisms: Low molecular weight products and matrix changes[J]. Polymer, 2000, 41(7): 2331-2338.
收稿日期:2009-01-11;修回日期:2009-04-14
基金项目:国家自然科学基金资助项目(50473052);国际科技合作项目(2006DFA53470)
通信作者:罗祥林(1962-),女,四川自贡人,教授,博士生导师,从事生物材料的研究;电话:028-85466166;E-mail: luoxl_scu@126.com


