固溶处理对AP65镁合金阳极放电活性的影响
王乃光,王日初,彭超群,冯艳,石凯,金和喜
(中南大学 材料科学与工程学院,湖南,长沙 410083)
摘 要:
制备AP65镁合金阳极材料,采用扫描电镜(SEM)结合能谱分析(ESA)研究不同状态下试样的显微组织和腐蚀形貌,采用X线衍射仪(XRD)分析不同状态下试样的相结构,采用动电位极化扫描法、恒电流氧化法和交流阻抗法研究不同状态下试样在3.5% NaCl溶液中的电化学行为。研究结果表明:铸态试样在晶界处存在不连续分布的第二相Mg17Al12,该第二相能增强试样的耐蚀性,但导致试样局部腐蚀严重且放电活性较弱;经400 ℃固溶24 h后第二相溶解,试样的耐蚀性减小,腐蚀相对铸态试样均匀且放电活性增强。
关键词:
镁阳极;AP65合金;电化学活性;耐蚀性;恒电流测试;交流阻抗;
中图分类号:TG146.1+5 文献标志码:A 文章编号:1672-7207(2012)06-2120-05
Effect of solid solution treatment on discharge activity of AP65 magnesium alloy anode
WANG Nai-guang, WANG Ri-chu, PENG Chao-qun, FENG Yan, SHI Kai, JIN He-xi
(School of Materials Science and Engineering, Central South University, Changsha 410083, China)
Abstract: AP65 magnesium alloy anode was prepared by melting and casting. The microstructures and corrosion morphologies of the specimens under different conditions were investigated by scanning electronic microscopy (SEM) and emission spectrum analysis (ESA), the phase structures of the specimens under different conditions were analyzed by X-ray diffraction (XRD), and the electrochemical behavior of the specimens under different conditions in 3.5% NaCl solution was studied by potentiodynamic polarization, galvanostatic oxidation test and electrochemical impedance spectroscopy. The results show that the second phase Mg17Al12 distributing discontinuously along the grain boundaries of the as-cast specimen can enhance the corrosion resistance but accelerate the local corrosion or reduce the discharge activity of AP65 anode. After solid solution treatment at 400 ℃ for 24 h, the second phase dissolves into the magnesium matrix and the corrosion resistance decreases but the corrosion develops uniformly on the specimen surface, leading to an improvement of the activity of AP65 anode.
Key words: magnesium anode; AP65 alloy; electrochemical activity; corrosion resistance; galvanostatic test; electrochemical impedance spectroscopy
镁合金阳极材料的海水激活动力电池具有电化学活性高、电压范围广、能量密度大、未被激活时储存时间长[1-2]等特点,广泛应用于海底声音测试装置、潜水艇、警告浮标、球状电池、空间飞行器和紧急救生设备等领域[3]。海水电池依靠金属阳极(如镁合金阳极)在海水中的溶解提供阳极放电电流,该电流通过外接电路对外做功,然后在阴极上发生还原反应。海水电池最突出的特点是不需要携带电解质,可以在放电时利用天然海水作为电解液,在运输过程中绝对安全[4]。但镁合金阳极材料存在加工难、自腐蚀速率大、激活时间长且电流效率低等缺点[5-6],目前,解决此类问题的方法是改善热处理制度和添加适量的合金元素。AP65是镁合金阳极中的一种,其名义成分为Mg-6%Al-5%Pb(质量分数)。Al影响镁阳极的放电活性,其效果取决于Al的含量和第二相的分布[7-8]。适量的Pb可以增强镁阳极的放电活性[9]。Udhayan等[10]研究AP65阳极在高氯酸镁溶液中的电化学行为,发现其电极反应过程受活化控制。研究结果表明[11]:Al和Pb对Mg基体的活化存在协同效应,在NaCl溶液中放电时溶解的Pb2+以氧化物的形式在Mg电极表面沉积,该过程有利于溶解的Al3+沉积。Al3+以Al(OH)3的形式沉积在Mg电极表面,以Al(OH)3·2Mg(OH)2的形式剥离腐蚀产物膜,对电极起到活化作用。目前,国内外关于不同状态下AP65阳极在NaCl溶液中电化学行为的报道较少,为此,本文作者研究铸态和固溶态AP65阳极在3.5% NaCl溶液中的电化学行为,以比较不同状态下AP65阳极的放电性能并分析固溶处理对AP65阳极放电活性的影响。
1 实验
采用感应熔炼法制备AP65镁合金阳极材料,将Mg,Al和Pb等以纯度为99.99%的金属放入高纯石墨坩埚,于750 ℃熔炼,充氩气保护。金属熔体在氩气保护下于铁模浇铸。所得试样于400 ℃固溶24 h,水淬。采用原子吸收光谱分析AP65阳极的化学成分(质量分数),见表1。 采用Quanta-200扫描电镜结合能谱分析研究经打磨、抛光后各试样的显微组织。采用D/Max2500衍射仪分析铸态和固溶态AP65阳极的相结构,其扫描速度为1.2 (°)/min,扫描范围为10°~80°,采用Cu靶,工作电压为47 V,工作电流为250 mA。
表1 AP65阳极的化学成分(质量分数)
Table 1 Chemical composition of AP65 anode %

采用动电位极化扫描法、恒电流氧化法和交流阻抗法测定AP65阳极的电化学行为。将试样用同型号SiC砂纸打磨去除表面氧化层,保留其经打磨的工作面并使其成10 mm×10 mm(长×宽)的矩形。然后,用铜导线捆绑样品,非工作面用环氧树脂密封。电化学仪器为IM6ex,采用三电极体系进行测量。工作电极为AP65阳极,辅助电极为铂电极,参比电极为饱和甘汞电极。实验温度为25 ℃,电解液为3.5%(质量分数)的NaCl中性溶液,该电解液接近海水成分。动电位极化扫描测试的扫描速度为2 mV/s,电压范围为开路电位±0.8 V;恒电流氧化测试的电流密度为180 mA/cm2,放电时间为600 s;交流阻抗测试的工作电位为开路电位,频率范围为100 kHz至0.05 Hz,电压振幅为5 mV。各电化学测试在试样浸入溶液后立即 进行。
采用原子吸收光谱测定各试样经恒电流氧化测试后溶解的Mg2+和合金元素离子的浓度。采用Quanta-200扫描电镜观察各试样经恒电流氧化测试后的腐蚀表面形貌(含腐蚀产物和不含腐蚀产物)及试样在3.5% NaCl溶液中浸泡48 h后的腐蚀截面。采用200 g/L CrO3+10 g/L AgNO3溶液清除各试样的腐蚀产物,并将清除腐蚀产物的试样在无水乙醇中超声波清洗5 min,干燥并观察各试样的腐蚀形貌。
2 结果与分析
2.1 固溶处理对AP65阳极显微组织和相结构的影响
图1所示为不同状态下AP65阳极的XRD图谱。从图1(a)可知:铸态试样由α-Mg基体和第二相Mg17Al12组成,固溶态试样则主要含α-Mg基体(图1(b))。图2所示为AP65阳极铸态试样的背散射像及合金元素的面分布。从图2(a)所示的背散射像可以看出:铸态试样中第二相Mg17Al12主要在晶界处不连续分布,晶内第二相较少。由图2(b) 所示Mg的面分布可知:Mg主要分布在晶内,晶界处Mg含量较少。结合表2的能谱分析,位于晶界的A处Mg含量为61% (质量分数,下同),晶内B处为93.71%。从图2(c) 所示Al的面分布可以看出:Al主要在晶界处偏聚,晶内 Al含量较少。结合表2可知:位于晶界A处Al含量为35.29%,靠近晶界C处为10.25%,晶内B处为2.70%。图2(d)所示为Pb的面分布,从中可以看出Pb相对于Al分布较均匀。结合表2可知各处Pb的含量偏差较小。
图3所示为AP65阳极固溶态试样的背散射像及合金元素的面分布。从图3(a)所示的背散射像可以看出:固溶态试样主要为含α-Mg基体的单相组织,表明铸态试样经400 ℃固溶24 h后第二相已溶入基体。根据图3(b)~(d) 所示各合金元素的面分布可知:经固溶处理后各合金元素相对铸态试样分布较均匀。结合表2的能谱分析,图3(a)中D处各合金元素的含量接近于AP65的名义成分。
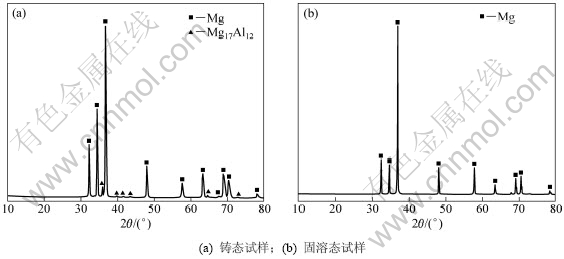
图1 不同状态下AP65阳极的XRD图谱
Fig.1 XRD patterns of AP65 anodes under different conditions

图2 AP65阳极铸态试样的背散射像及合金元素的面分布图
Fig.2 BSE (Backscattered electron) images of as-cast specimen of AP65 anode and elemental mappings of alloying elements
2.2 固溶处理对AP65阳极极化曲线和恒电流氧化过程中的电位-时间曲线的影响
图4(a)所示为不同状态下AP65阳极的极化曲线。各试样的阳极支和阴极支不对称,阳极支电流密度随电位增加的速率高于阴极支。一般来说,阴极支的电流主要受析氢控制,阳极支的电流主要受金属的阳极溶解控制[12]。在动电位极化扫描过程中,各试样均没有发生钝化。根据极化曲线计算出各试样的腐蚀电位和腐蚀电流密度,见表3。从表3可以看出:固溶态试样的腐蚀电位为-1.428 V,高于铸态试样(-1.598 V)。固溶态试样的腐蚀电流密度为0.531 mA/cm2,大于铸态试样的电流密度(0.225 mA/cm2)。镁合金阳极中普遍存在电偶腐蚀,第二相比镁基体具有更高的电极电位而充当阴极[5],其分布和数量对电化学腐蚀行为有很大影响;当第二相的数量较少时,主要作为阴极相与镁基体形成腐蚀电偶加速镁基体的腐蚀;当第二相的数量较多时,则主要作为腐蚀屏障抑制镁基体的腐蚀[13]。结合图1所示的XRD图谱和图2所示的显微组织可知:铸态试样晶界处存在不连续分布的第二相Mg17Al12。该第二相相对镁基体为弱阴极相,加速镁基体腐蚀的效果较差[8]。AP65阳极铸态试样的腐蚀电流密度比固溶态的小,表明铸态试样中第二相Mg17Al12能抑制基体的腐蚀。根据图4(a),在同一阴极电位下(横线所示),铸态试样的阴极电流密度比固溶态的小,表明第二相Mg17Al12能抑制阴极反应过程中氢气的析出。

图3 AP65阳极固溶态试样的背散射像及合金元素的面分布图
Fig.3 BSE (Backscattered electron) images of solid solution treated specimen of AP65 anode and elemental mappings of alloying elements
表2 图1和图2中经能谱分析所得各区域的化学成分 (质量分数)
Table 2 Chemical compositions of different areas in Figs.1-2 obtained by ESA %
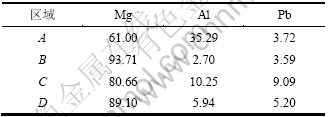
图4(b) 所示为不同状态下AP65阳极在恒电流氧化过程中的电位-时间曲线。该恒电流曲线在试样处于阳极极化的条件下测得, 电流密度为180 mA/cm2。在恒电流氧化过程中,黑色腐蚀产物不断从试样表面剥落。根据电位-时间曲线可计算出试样的平均电位,见表3。一般来说,平均电位能反映镁阳极的放电活性,平均电位越负,则放电活性越强。从图4(b)可以看出,铸态试样的电位-时间曲线存在波动起伏且平均电位较正(-1.516 V),固溶态试样则放电平稳且平均电位较负(-1.683 V)。因此,固溶态试样相比铸态具有较强的放电活性。图4(c) 所示为不同状态下AP65阳极经恒电流氧化后单位面积的试样表面溶解的Mg2+浓度,固溶态试样的Mg2+浓度为72.4 mg/(cm2·L-1),大于铸态试样的Mg2+浓度(51.3 mg/(cm2·L-1),表明经固溶处理后AP65在放电过程中镁基体的阳极溶解速度加快。图4(d)所示为不同状态下AP65阳极经恒电流氧化后单位面积的试样表面溶解的Al3+和Pb2+浓度,固溶态试样溶解的Al3+浓度大于铸态试样的浓度,而Pb2+浓度则小于铸态试样浓度。根据文献[11],AP65阳极在NaCl溶液中放电时溶解的Pb2+以氧化物的形式在Mg基体表面沉积,该过程有利于溶解的Al3+的沉积。Al3+以Al(OH)3的形式沉积在Mg基体表面,以Al(OH)3·2Mg(OH)2的形式剥离腐蚀产物膜,对基体起到活化作用。一般来说,镁阳极的电化学活性取决于试样的成分和结构。铸态试样中合金元素分布不均匀且第二相Mg17Al12能抑制基体的腐蚀,因此,其电化学活性较弱。经固溶处理后第二相溶解且合金元素扩散均匀(见图3),在放电过程中溶解的Al3+浓度增大,有利于腐蚀产物膜的剥落,因此,其电化学活性较强,在恒电流氧化过程中平均电位较负且Mg基体的溶解速度加快。
表3 不同状态下AP65阳极的腐蚀电位(Ecorr)、腐蚀电流密度(icorr)和平均电位(Emean)
Table 3 Corrosion potentials (Ecorr), corrosion current densities(icorr) and mean potentials (Emean) of AP65 anodes under different conditions

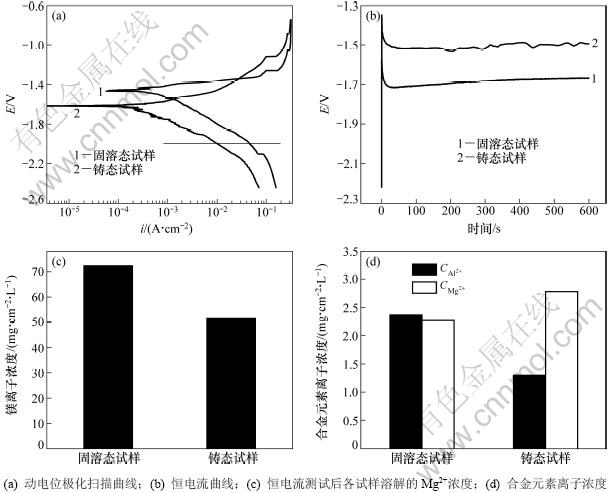
图4 不同状态下AP65阳极的动电位极化扫描曲线、恒电流曲线、恒电流测试后各试样溶解的Mg2+离子浓度和合金元素离子浓度
Fig.4 Potentiodynamic polarization curves,potential-time curves, concentration of dissolved Mg2+ ions and
alloying elements ions of AP65 anodes under different conditions after galvanostatic tests
2.3 固溶处理对AP65阳极电化学阻抗谱的影响
图5所示为不同状态下AP65阳极的电化学阻抗谱(其中:Z′为阻抗实部;Z″为阻抗虚部)。该阻抗谱在试样的开路电位下测得,能反映出试样在自腐蚀状态下的电化学反应机理。根据图5(a)所示的Nyquist图可知:铸态试样在整个频率范围内仅存在1个容抗弧,该容抗弧与双电层电容Cdl和电荷转移电阻Rt有关,表明影响铸态试样电极表面反应的状态变量为电极电位E[14]。固溶态试样除了在高频区存在1个与双电层电容Cdl和电荷转移电阻Rt有关的容抗弧外,在低频区也存在1个半径较小的容抗弧,该容抗弧与沉积在试样表面的腐蚀产物膜有关,其电容和电阻分别用Cf和Rf表示。因此,影响固溶态试样电极表面反应的状态变量为电极电位和沉积在表面的腐蚀产物膜[15]。该腐蚀产物膜主要成分为Mg(OH)2,当溶解的Mg2+浓度超过某一极限值时,将以Mg(OH)2的形式在试样表面沉积[14]。根据电化学阻抗谱原理[15],当电极表面反应仅受电极电位影响时,法拉第导纳YF可表示为:
YF=1/Rt (1)
式中:YF为法拉第导纳;Rt为电荷转移电阻。当电极表面反应除了受电极电位影响外,还受沉积在表面的腐蚀产物膜影响时,法拉第导纳YF可表示为:
YF=1/Rt+(?IF/?θ)( ?θ′/?E)/[jω-?θ′/?θ] (2)
式中:IF为法拉第电流密度;θ为腐蚀产物膜在试样表面的覆盖率;E为电极电位;ω为频率;![]() ;θ′=dθ/dt;t为时间。
;θ′=dθ/dt;t为时间。
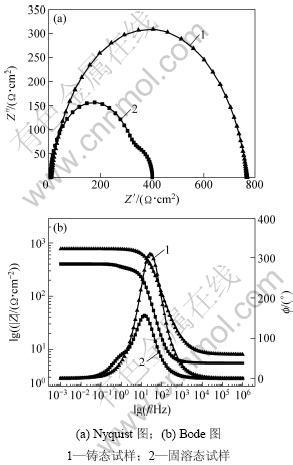
图5 不同状态下AP65阳极的电化学阻抗谱
Fig.5 EIS of AP65 anodes under different conditions
在电极反应过程中,法拉第电流密度IF随腐蚀产物膜覆盖率的增大而减小,因此,?IF/?θ<0。随电极电位的正移溶解到溶液中的Mg2+浓度增大,加速Mg(OH)2膜在试样表面沉积,因此,?θ′/?E>0。故在式(2)中(?IF/?θ)( ?θ′/?E)<0,表明在低频区将出现1个容抗弧[14],与实验结果相符。根据图5(b)所示的Bode图可知:铸态试样的阻抗模在整个频率范围内都大于固溶态的阻抗模,表明铸态试样与固溶态相比具有较强的耐蚀性。根据电化学阻抗谱拟合出各试样的电化学元件参数见表4,并作出各试样的等效电路图,见图6。在等效电路图中,Rs为试样表面与鲁金毛细管之间的溶液电阻。由于弥散效应的存在,采用常相位角元件CPEdl代替双电层电容Cdl,该元件与电荷转移电阻Rt并联。从表4可以看出:固溶态试样的电荷转移电阻为325 Ω·cm2,比铸态试样(760 Ω·cm2)的小,表明固溶态试样与铸态相比具有较强的电化学活性。因此,固溶态试样在NaCl溶液中浸泡时相比铸态试样有更多的Mg2+溶解到溶液中,当Mg2+的浓度超过某一极限值时,将以Mg(OH)2的形式在试样表面沉 积[15],导致固溶态试样的Nyquist图在低频区出现容抗弧[14]。
2.4 固溶处理对AP65阳极腐蚀形貌的影响
图7所示为不同状态下AP65阳极经恒电流氧化测试后腐蚀表面形貌的二次电子像。从图7(a)和(b)可以看出:各试样经恒电流氧化后表面都覆盖一层腐蚀产物,该腐蚀产物较疏松且存在泥土状裂纹,在大电流密度放电过程中容易从试样表面剥落,对基体起不到保护作用。图7(c)所示为铸态试样经恒电流氧化后清除腐蚀产物的表面形貌,可以看出铸态试样腐蚀表面凹凸不平且部分第二相在放电过程中脱落。根据图7(d)所示放大的二次电子像可知:铸态试样在恒电流氧化过程中基体的腐蚀从第二相周围开始。图7(e)所示为固溶态试样经恒电流测试后清除腐蚀产物的表面形貌,从中可以看出固溶态试样腐蚀表面相比铸态试样较平坦,属于活性区的均匀腐蚀。图8所示为各试样浸泡48 h后腐蚀截面的低倍背散射像。从图8(a)可以看出:铸态试样腐蚀截面存在较大的凹坑,局部腐蚀严重。固溶态试样则腐蚀均匀(见8(b))。铸态试样尽管腐蚀速率小于固溶态,但由于第二相的存在,导致局部腐蚀严重且活性较差,不适合用于大功率海水电池阳极材料。而固溶态试样由于成分均匀,在恒电流氧化过程中试样均匀溶解,且活性较强,适合用于大功率海水电池阳极材料。
表4 根据电化学阻抗谱拟合出的不同状态下AP65阳极的电化学参数
Table 4 Electrochemical parameters obtained by fitting analysis of EIS of AP65 anodes under different conditions

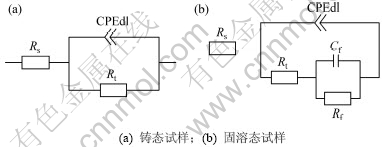
图6 不同状态下AP65阳极的等效电路图
Fig.6 Equivalent circuits for EIS of AP65 anodes under different conditions
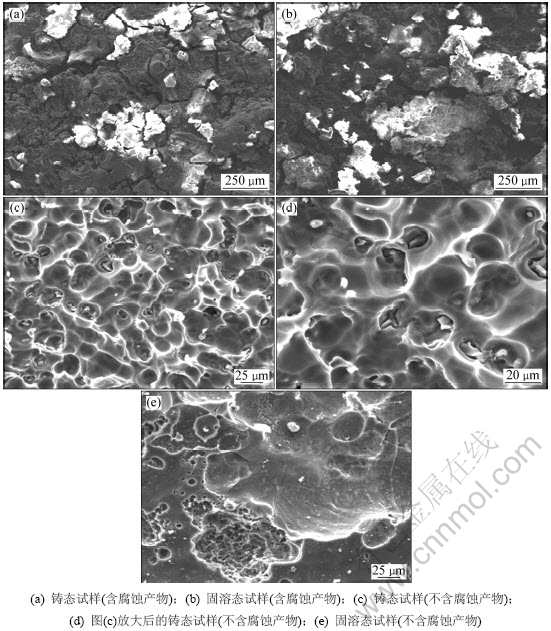
图7 不同状态下AP65阳极经恒电流测试后腐蚀表面形貌的二次电子像
Fig.7 SE (Secondary electron) corrosion morphologies of AP65 anodes under different conditions after galvanostatic tests

图8 不同状态下AP65阳极在3.5% NaCl 溶液中浸泡48 h后腐蚀截面的背散射像
Fig.8 BSE (Backscattered electron) cross-section images of AP65 anodes immersed in 3.5% NaCl solution for 48 h
3 结论
(1) AP65阳极铸态试样合金元素分布不均匀且在晶界处存在不连续分布的第二相Mg17Al12,该第二相能增强试样的耐蚀性,但导致试样局部腐蚀严重且放电活性较弱,不适合用作大功率海水电池阳极材料。
(2) AP65阳极固溶态试样为单相组织且合金元素分布较均匀,其耐蚀性比铸态试样的小但腐蚀相对铸态试样均匀且放电活性较强,在180 mA/cm2放电电流密度下平均电位为-1.683 V,适用于大功率海水电池阳极材料。
参考文献:
[1] Medeiros M G, Dow E G. Magnesium-solution phase catholyte seawater electrochemical system[J]. Journal of Power Sources, 1999, 80(1/2): 78-82.
[2] Renuka R. Influence of allotropic modifications of sulphur on the cell voltage in Mg-CuI(S) seawater activated battery[J]. Materials Chemistry and Physics, 1999, 59(1): 42-48.
[3] Renuka R. AgCl and Ag2S as additives to CuI in Mg-CuI seawater activated batteries[J]. Journal of Applied Electrochemistry, 1997, 27(12): 1394-1397.
[4] Kim J G, Joo J H, Koo S J. Development of high-driving potential and high-efficiency Mg-based sacrificial anodes for cathodic protection[J]. Journal of Materials Science Letters, 2000, 19(6): 477-479.
[5] 王乃光, 王日初, 余琨, 等. 合金化和热处理对镁合金阳极材料组织及性能的影响[J]. 中国有色金属学报, 2009, 19(1): 38-43.
WANG Nai-guang, WANG Ri-chu, YU Kun, et al. Effect of alloying and heat treatment on electrochemical behavior of Mg anode[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(1): 38-43.
[6] Flamini D O, Saidman S B, Bessone J B. Aluminium activation produced by gallium[J]. Corrosion Science, 2006, 48(6): 1413-1425.
[7] GU Xue-nan, ZHENG Yu-feng, CHENG Yan, et al. In vitro corrosion and biocompatibility of binary magnesium alloys[J]. Biomaterials, 2009, 30(4): 484-498.
[8] ZHAO Ming-chun, LIU Ming, SONG Guang-ling, et al. Influence of the β-phase morphology on the corrosion of the Mg alloy AZ91[J]. Corrosion Science, 2008, 50(7): 1939-1953.
[9] Candan S, Unal M, Turkmen M, et al. Improvement of mechanical and corrosion properties of magnesium alloy by lead addition[J]. Material Science and Engineering A, 2009, 501(1/2): 115-118.
[10] Udhayan R, Bhatt D P. On the corrosion behavior of magnesium and its alloys using electrochemical techniques[J]. Journal of Power Sources, 1996, 63(1): 103-107.
[11] WANG Nai-guang, WANG Ri-chu, PENG Chao-qun, et al. Influence of aluminium and lead on activation of magnesium as anode[J]. Trans Nonferrous Met Soc China, 2010, 20(8), 1403-1411.
[12] Tamar Y, Mandler D. Corrosion inhibition of magnesium by combined zirconia silica sol-gel films[J]. Electrochimica Acta, 2008, 53(16): 5118-5127.
[13] SONG Guang-ling, Andrej A, Matthew D. Influence of microstructure on the corrosion of diecast AZ91D[J]. Corrosion Science, 1998, 41(2): 249-273.
[14] 曹楚南. 腐蚀电化学原理[M]. 北京: 化学工业出版社, 2008: 150-160.
CAO Chu-nan. Principles of electrochemistry of corrosion[M]. Beijing: Chemical Industry Press, 2008: 179-187.
[15] ZHAO Ming-chun, LIU Ming, SONG Guang-ling, et al. Influence of pH and chloride ion concentration on the corrosion of Mg alloy ZE41[J]. Corrosion Science, 2008, 50: 3168-3178.
(编辑 陈灿华)
收稿日期:2011-07-15;修回日期:2011-08-22
基金项目:民口配套国家攻关项目(JPPT-115-168)
通信作者:王日初(1965-),男,广东和平人,博士,教授,从事海水激活动力电池研究;电话:0731-88836638;E-mail:wrc910103@163.com
摘要:采用熔炼铸造法制备AP65镁合金阳极材料,采用扫描电镜(SEM)结合能谱分析(ESA)研究不同状态下试样的显微组织和腐蚀形貌,采用X线衍射仪(XRD)分析不同状态下试样的相结构,采用动电位极化扫描法、恒电流氧化法和交流阻抗法研究不同状态下试样在3.5% NaCl溶液中的电化学行为。研究结果表明:铸态试样在晶界处存在不连续分布的第二相Mg17Al12,该第二相能增强试样的耐蚀性,但导致试样局部腐蚀严重且放电活性较弱;经400 ℃固溶24 h后第二相溶解,试样的耐蚀性减小,腐蚀相对铸态试样均匀且放电活性增强。


