DO对短程反硝化过程中N2O产量的影响
巩有奎,王淑莹,王莎莎,王赛,彭永臻
(北京工业大学 环境与能源工程学院,北京,100022)
摘 要:
器,考察不同溶解氧(DO)条件下NO2-反硝化过程中N2O产生及释放过程。研究结果表明:控制曝气量为0.3 L/min,进水NO2--N质量浓度为40 mg/L,体系DO质量浓度分别为0,0.1,0.3,0.5和0.7 mg/L时,反硝化过程N2O释放量分别为0.41,0.60,2.62,4.98,6.83 mg/L;随DO质量浓度的增加,反硝化速率明显降低;当DO质量浓度由0 mg/L增至0.7 mg/L时,每克混合液悬浮固体(MLSS)的NO2-反硝化速率由14.9 mg/(L·h)降至10.2 mg/(L·h),每克MLSS的N2O产生速率由0.2 mg/(L·h)增至 1.9 mg/(L·h)。其原因为:高DO质量浓度对氧化亚氮还原酶具有较强的毒性,抑制了N2O的进一步还原过程;高NO2-的存在导致抑制了氧化亚氮还原酶的活性。降低A/O和A2/O等生物脱氮过程中缺氧反应器内部DO质量浓度,保证严格缺氧条件,是减少短程生物反硝化过程中N2O产量的关键因素。
关键词:
中图分类号:X703 文献标志码:A 文章编号:1672-7207(2012)01-0395-06
Effect of DO on N2O emission during nitrite denitrification process
GONG You-kui, WANG Shu-ying, WANG Sha-sha, WANG Sai, PENG Yong-zhen
(College of Environmental and Energy Engineering, Beijing University of Technology, Beijing 100022, China)
Abstract: The effect of DO (Dissolved oxygen) on the kinetics of nitrite denitrification, as well as the corresponding N2O accumulation and emission were investigated using 2.4 L sequencing batch reactor. The results show that NaNO2 is added at the initial of the test to the final NO2--N mass concentration of 40 mg/L. The aeration rate is controlled at 0.3 L/min and the ratio of N2 to O2 is adjusted so that the DO can be controlled at 0, 0.1, 0.3, 0.5 and 0.7 mg/L and the N2O emission is 0.41, 0.60, 2.62, 4.98, 6.83 mg/L, respectively. The denitrification rate decreases with the increase of DO mass concentration. The nitrite reduction rate per gram of mixed liquor suspended solid (MLSS) decreases from 14.9 to 10.2 mg/(L·h), while the N2O emission rate per gram of MLSS increases from 0.2 to 1.9 mg/(L·h). The reason may be that higher DO mass concentration inhibits the activity of N2O reductase thus results in higher N2O production as to higher N2O emission. Besides, higher nitrite presence inhibits the activity of nitrous oxide reduction enzymes which is responsible for N2O reduction. To reduce DO mass concentration in anoxic tanks during nitrogen removal process may be the efficient way to reduce N2O emission during nitrite denitrification process.
Key words: dissolved oxygen; nitrous oxide; nitrite; inhibition
N2O是3种最重要的大气温室气体(CO2,CH4和N2O)之一,其增温潜势是CO2的320倍,在大气中存留时间为114 a,对全球温室效应的贡献占5%~6%。联合国环境规划署和世界气象组织共同设立的“政府间气候变化委员会”(IPCC)已将其列为影响自然生态系统、威胁人类生存基础的重大问题[1-2]。初步估计污水处理厂运行过程中每年排放的N2O量为(0.13~ 3.00)×1012 kg,占全球N2O总排放量的21.5%~ 25.0%[3]。鉴于此,2006年IPCC将污水处理厂出水中N2O的含量标准由1.0%减至0.5%[4]。与传统脱氮过程相比,短程硝化反硝化过程具有如下优点[5]:(1) 硝化阶段能够减少25%的曝气量;(2) 反硝化阶段能够减少40%的碳源投加量;(3) 具有较高的反硝化速率。但是通过研究发现,短程生物脱氮过程中产生的N2O产量是全程生物脱氮过程的1.4倍[6]。Zeng[7]研究亚硝酸型同步脱氮除磷工艺过程中发现:N2O是该脱氮过程中的主要气态终产物。在前置反硝化生物脱氮工艺(A/O,A2/O)中,好氧硝化液的内循环和沉淀池污泥回流都有可能将DO(Dissolved oxygen)携带进入缺氧区,从而导致缺氧区内存在少量DO。以往的研究多集中在考察DO对反硝化过程动力学的研究,但是,对低氧条件下短程反硝化过程中氧化亚氮的产生及释放尚未见报道。在此,本文作者利用SBR反应器,考察低氧条件下以NO2-作为电子受体的反硝化过程及其N2O产量,以便为探索短程生物脱氮过程中N2O释放规律提供依据。
1 材料及方法
1.1 实验用水水质及种泥
试验用水取自北京某大学SBR中试反应器反硝化结束后出水,出水COD<50 mg/L, NOx--N质量浓度小于1 mg/L。试验用接种污泥取自中试反应器,试验期间中试反应器脱氮效率达96%以上。在试验过程中,通过投加NaNO2控制初始NO2--N质量浓度为40 mg/L。试验过程中投加乙醇作为碳源,初始碳氮比(即COD与总氮的质量浓度比)>5,同时,在曝气反硝化过程中以蠕动泵连续加入乙醇稀释液,以保证系统脱氮过程中充足的碳源。
1.2 试验装置及运行
试验装置如图1所示。试验所用SBR反应器有效容积2.4 L。反应器底部利用机械搅拌器搅拌,采用黏砂块作为微孔曝气头。在反应过程中,采用N2+O2的曝气方式,总曝气量利用转子流量计控制在0.3 L/min,通过调节曝气中N2与O2的体积比控制系统内部DO质量浓度。反应过程水温控制在(25.0±1.0) ℃。
1.3 测试方法
反应器均采用密闭方式运行,反应阶段产生的气体经干燥器干燥去除水分后,间隔10 min收集至气体采样袋,利用湿式流量计测定气体体积,以气相色谱仪测定所收集气体中N2O质量浓度。同时,在密闭条件下,取污泥混合液并测定溶解态N2O浓度。
1.4 分析方法
1.4.1 DO,pH和ORP测定
分别使用Multi340i 型(WTW公司)便携式多功能DO和pH测定仪测定。COD的含量采用COD快速测定仪测定;NH4+-N的含量采用纳氏试剂分光光度法测定;NO3--N的含量采用麝香草酚分光光度法测定;NO2--N的含量采用N-(1-萘基)-乙二胺光度法测定;MLSS的含量采用滤纸称重法测定;水样经过0.45 μm滤纸过滤后测定以上各参数。
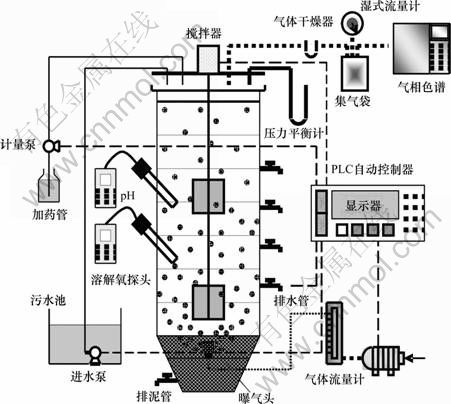
图1 试验装置图
Fig.1 Schematic diagram of experimental system
1.4.2 N2O测定方法
(1) 气态N2O测定。采用6890N型(Agilent公司)气相色谱仪,HP-Plot/分子筛(长度×内径×膜厚为30 m×0.53 mm×25 μm)毛细管色谱柱测定。N2O色谱条件为:进样口温度110 ℃;炉温180 ℃;ECD检测器300 ℃。
(2) 溶解性N2O测定。溶解于活性污泥混合液中的N2O采用上部空间法测定。在密闭条件下,将活性污泥混合液经泥水分离后,加入 0.5 mL质量浓度为 1 000 mg/L的HgCl2 溶液抑制残余微生物的活性。于水样上部加入N2,30 ℃下利用恒温摇床振荡0.5 h 后,测定上部气体中的N2O浓度,根据亨利定律计算溶解性N2O质量浓度[8]。
2 试验结果
2.1 不同DO质量浓度下NO2--N质量浓度变化
图2所示为不同DO条件下反硝化过程中NO2--N质量浓度的变化过程。在初始NO2--N质量浓度为40 mg/L、DO质量浓度为0 mg/L时,亚硝态氮在40 min内降至0;DO增加,反硝化速率显著降低,当DO质量浓度增至0.7 mg/L时,反硝化时间延长至80 min。反硝化初始通过投加乙醇作为反硝化碳源,初始碳氮比大于5,同时,为保证整个反硝化过程中有足够的碳源,在整个反应过程中,利用蠕动泵不断泵入稀释后乙醇,碳氮比始终大于3,保证充足碳源。因此,碳源不是导致NO2--N还原速率下降的原因。
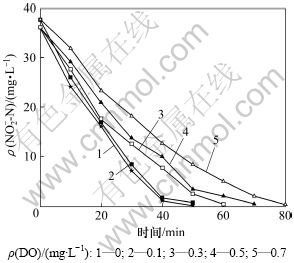
图2 不同DO下反硝化过程中NO2-变化
Fig.2 Variation of NO2--N at different DO concentrations during denitrification process
反硝化细菌能够分别以 O2和NO3--N/NO2--N作为电子受体进行有氧和无氧呼吸。当反应体系内共存上述电子受体时,反硝化菌优先利用O2进行好氧呼吸,从而阻碍NO3--N/NO2--N的还原。反硝化过程是包含硝酸盐还原酶(NaR)、亚硝酸盐还原酶(NiR)、一氧化氮还原酶(NOR)和氧化亚氮还原酶(N2OR)在内的生化还原过程。与NO3-/NO2-(+0.42 mV)相比,O2具有更高的氧化还原电动势(+0.82 mV),其捕获电子的能力更强[9];因此,DO的存在导致了系统NO2-反硝化速率的下降。
2.2 不同DO含量下短程反硝化过程中N2O的产量
整个反硝化过程中利用鼓风曝气,控制曝气量为0.3 L/min,通过调节N2和O2的体积比调节整个反硝化过程中的DO质量浓度。反硝化过程中产生的N2O包括两部分。(1) 一部分逸出处理系统,释放于大气,此部分为 N2O-N释放量;(2) 剩余部分溶解于活性污泥混合液中,即溶解性N2O-N。
图3所示为不同DO条件下反硝化过程中氧化亚氮的释放情况。从图3可见:当DO质量浓度为0 mg/L,反硝化过程N2O产量为0.41 mg/L;随DO质量浓度增加,系统N2O产量迅速增加;当DO质量浓度增加至0.7 mg/L时,系统N2O产量达6.83 mg/L。无论采取何种溶解氧质量浓度,N2O释放过程均表现为同样的特点。N2O释放量在初始10 min内迅速增加,随后N2O释放速率逐渐降低,直至趋于稳定。这是由于反硝化初始阶段,NO2-大量加入,反硝化速率较大,与氧化亚氮还原酶相比,氧化亚氮还原酶的合成速率较低,因此,作为反硝化过程的中间产物,部分N2O积累并被吹脱出。除此之外,大量NO2-的加入也抑制了氧化亚氮还原酶的活性,从而导致N2O大量释放。
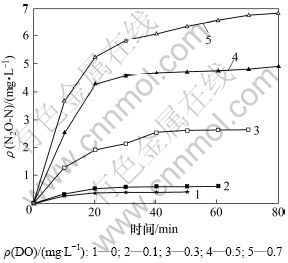
图3 不同DO浓度下N2O的释放情况
Fig.3 Variation of N2O emission at different DO concentrations
图4所示为不同DO质量浓度下短程反硝化过程中溶解态N2O的变化。为考察系统内部溶解性N2O,NO2-投加后1 min后即取样并检测水体中溶解态N2O。实验结果如图4所示。作为反硝化过程的中间产物,溶解态N2O迅速增加。从图4可见:DO质量浓度为0 mg/L时,其溶解态N2O质量浓度最大为0.03 mg/L;DO质量浓度增加,反硝化过程中积累的溶解态N2O迅速增加,DO质量浓度增加至0.7 mg/L,其溶解态N2O可达0.24 mg/L。对比图2反硝化过程NO2-的变化可见:系统溶解态N2O与NO2-的质量浓度变化具有明显的正相关性。
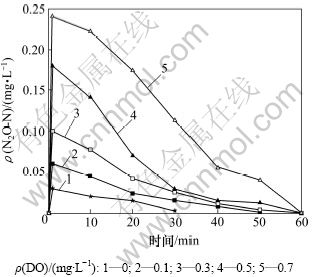
图4 不同DO浓度下溶解态N2O的变化
Fig.4 Variation of dissolved N2O at different DO concentrations
3 讨论
在缺氧条件下,N2OR的合成滞后于NaR的合成。在反硝化过程的初期,N2OR缺乏,反硝化过程中产生的N2O不能及时被还原为N2,从而导致系统N2O积累并逸出[10]。本研究中,NO2-加入后均伴随有溶解态N2O的迅速积累,该部分积累的N2O在曝气过程中被吹脱出来,从而导致反硝化初期N2O释放量迅速增加。因此,反硝化初期氧化亚氮还原酶的缺失可能是导致反硝化初始阶段N2O大量释放的主要原因。
Otte等[11]研究表明:在反硝化阶段,各种还原酶对电子的竞争能力不同,其中以氧化亚氮还原酶的电子竞争力最弱;当NO2-存在并积累时,多种NOx-还原酶之间存在电子竞争,氧化亚氮还原酶对电子的亲和力较弱,从而引起系统N2O积累。本试验中利用蠕动泵连续投加乙醇作为反硝化碳源,但是,DO和NO2-的存在仍然导致N2O还原酶在竞争电子过程中处于劣势,从而导致N2O积累及释放。
Alinsafi等[12]研究不同碳氮比下反硝化过程N2O的产生过程中也发现,反硝化过程中脉冲投加NO2-均伴随有N2O大量增加,说明N2O的释放和系统NO2-质量浓度具有明显的正相关性,反硝化过程中NO2-积累,导致氧化亚氮还原酶的活性降低,从而引起N2O的释放。研究表明[7]:即使1 mg/L NO2-也会对N2O的还原具有明显的抑制作用。NO2-对N2OR还原酶活性的抑制作用导致溶解态N2O积累并在接下来的曝气过程中被吹脱出。
作为反硝化过程的中间产物,NO2--N反硝化速率能够表征N2O的产生过程。NO2-还原速率增加,系统内部N2O产生速率增加。NO2-和N2O还原速率之间的不平衡可能导致系统N2O的积累并逸出。图5所示为不同DO条件下系统NO2-还原速率及N2O释放速率。由图5可见:当DO质量浓度由0 mg/L增加至0.7 mg/L,每克混合液悬浮固体(MLSS)还原NO2-的还原速率由14.9 mg/h降至10.2 mg/h,表明N2O产生速率降低;与此相悖,每克MLSS的N2O释放速率由0.2 mg/h增加至 1.9 mg/h。其原因为:(1) 高DO质量浓度对氧化亚氮还原酶具有较强的毒性,抑制了N2O的进一步还原过程;(2) 高NO2-的存在抑制了氧化亚氮还原酶的活性,N2O产量明显增加。表明在本实验中,N2O释放速率的增加并不是由于较高NO2-还原速率所导致的,而是由于亚硝态氮的积累导致了N2O还原酶在电子竞争过程中处于劣势,同时,NO2-的大量存在也抑制了氧化亚氮还原酶的活性,导致了系统N2O释放量增加。
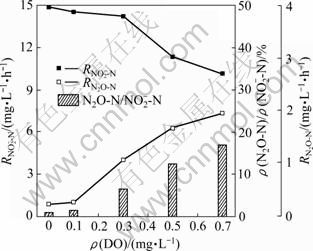
图5 不同DO条件下系统NO2--N还原速率、N2O溢出速率及N2O产量百分比
Fig.5 Reduction rate of NO2--N, emission rate of N2O and percentage of N2O to NO2--N
N2O还原至N2,从而减少脱氮过程中N2O的逸出[6, 13]。与文献[6, 13]中的研究结果不同,本试验反硝化阶段始终采用曝气手段以改变系统DO质量浓度,这在一定程度上降低了溶解态N2O的缺氧停留时间,曝气吹脱作用导致系统缺氧反硝化过程中有少量N2O溢出。尽管如此,在保证同样的曝气量下,DO质量浓度的变化仍然导致系统溶解态N2O及N2O释放量的变化。DO质量浓度为0 mg/L,其N2O产量仅占进水氮负荷的1%;当DO质量浓度增加至0.7 mg/L时,反硝化气态产物中N2O占17%。其原因可能是当O2存在时,反硝化菌优先利用O2作为电子受体,造成反硝化作用不彻底;另一方面,可能是O2对N2OR的活性具有抑制和毒害作用,从而导致反硝化过程中N2O积累。Otte等[14]在对A. faecalis研究过程中发现,氧气对N2OR的抑制要远大于其对亚硝态氮还原酶的抑制,因此,微氧环境的存在将导致N2O产量增加。利用A. Faecalis作为模型微生物的研究表明,DO对反硝化酶尤其是N2O的产生具有较大的影响。Hwang 等[15]研究也发现:DO对反硝化过程及过程中N2O产量具有明显的影响。在DO含量在10%~15%范围内,NO3-还原速率明显降低,同时反硝化过程中有大量NO2-积累。研究还发现:DO的存在降低了反硝化速率,而N2O产量有所增加。
在A/O和A2/O等生物脱氮过程中,好氧-缺氧条件的交替变化使得缺氧反硝化过程中的微生物长期处于低氧条件下运行,导致系统反硝化过程中N2OR的活性受到抑制,系统反硝化过程中产生N2O积累。Kampschreur等[16]研究发现:N2O不仅产生于硝化过程中,缺氧反应器中产生的N2O在接下来的曝气过程中也会被吹脱出来。除此之外,N2O的溶解度较高 (N 2O的亨利常数为2.47×10-7 mol/(L·Pa),O2的亨利常数为1.28×10-8 mol/(L·Pa)),其吹脱过程较慢。Sommer等[17]指出:污水处理厂在冬季,溶解在水体中的N2O质量浓度是曝气出脱出的5倍。因此,溶解态N 2O排至水体,将会导致接纳水体N2O质量浓度增加。因此,降低缺氧池中DO质量浓度,防止低氧条件下亚硝酸盐的积累及O2对N2OR的抑制作用,以保证缺氧反硝化阶段的顺利进行,能够有效降低生物脱氮过程中N2O释放量。
4 结论
(1) 短程反硝化过程中,DO质量浓度的增加会导致系统N2O产量大量增加。当DO质量浓度为0.7 mg/L时,短程反硝化过程中N2O释放比例占总进水氮负荷的17.1%,远大于缺氧条件。其原因是:高DO质量浓度的存在导致氧化亚氮还原酶在电子竞争过程中处于劣势;另一方面,DO对N2OR具有明显的毒性,高DO质量浓度下,N2OR活性受到较大抑制。
(2) 短程反硝化过程中,大量NO2-的存在对N2OR活性的抑制也是导致系统N2O释放量增加的重要 原因。
(3) 短程反硝化脱氮过程中较高NO2-积累量和DO的存在导致反硝化过程中溶解态N2O大量积累,从而在后续好氧曝气过程中被吹脱出,导致脱氮过程中N2O释放量迅速增加。保证严格低氧甚至缺氧条件是降低短程脱氮过程中N 2O释放量的重要途径。
参考文献:
[1] IPCC. Climate change 1995: The science of climate change[M]. Cambridge: Cambridge University Press, 1996: 21-24.
[2] Peter C, Patrick C, Robert H. Nitrous oxide emission from municipal wastewater treatment[J]. Environ Sci Technol, 1995, 29: 2352-2356.
[3] Khalil M A K, Rasmussen R A. The global sources of nitrous oxide[J]. Journal of Geophysical Research, 1992, 97(D13): 14651-14660.
[4] Intergovermental Panel on Climate Change. 2006 IPCC guidelines for national greenhouse gas inventories[EB/OL]. [2006]. http://www.IPCC-nggip.iges.or.jp/.
[5] Peng Y Z, Zhu G B. Biological nitrogen removal with nitrification and denitrification via nitrite pathway[J]. Appl Microbiol Biotechnol, 2006, 73(1): 15-26.
[6] 巩有奎, 王赛, 彭永臻, 等. 生活污水不同生物脱氮过程中N2O产量及控制[J]. 化工学报, 2010, 61(5): 1286-1292.
GONG You-kui, WANG Sai, PENG Yong-zhen, et al. Formation of N2O in various biological nitrogen removal processes for treatment of domestic sewage[J]. Chemical Industry and Engineering (China), 2010, 61(5): 1286-1292.
[7] Zeng R J. A novel wastewater treatment process: Simultaneous nitrification-denitrification and phosphorus removal[J]. Wat Sci Technol, 2004, 50(10): 163-170.
[8] Noda N, Kaneko N, Mikami M, et al. Effects of SRT and DO on N2O reductase activity in an anoxic-oxic activated sludge system[J]. Wat Sci Technol, 2003, 48(11/12): 363-370.
[9] Lansing M P, John P H, Donald A K. Microbiology[M]. 5th ed. Columbus, USA: McGraw-Hill Companies Inc, 2001: 486-492.
[10] Letey J, Valoras N, Focht D, et al. Nitrous oxide production and reduction during denitrification as affected by redox potential[J]. Soil Sci Soc Am J, 1981, 45: 727-730.
[11] Otte S, Seviour R J, Kuenen J G, et al. Nitrous oxide production by Alcaligenes faecalis during feast and famine regimes[J]. War Res, 2000, 34(7): 2080-2088.
[12] Alinsafi A, Adouani N, Beline F, et al. Nitrite effect on nitrous oxide emission from denitrification activated sludge[J]. Process Biochemistry, 2008, 43: 683-689.
[13] Yang Q, Liu X H, Peng C Y, et al. N2O production during nitrogen removal via nitrite from domestic wastewater: Main sources and control method[J]. Environ Sci Technol, 2009, 43(24): 9400-9406.
[14] Otte S, Grobben N G, Robertson L A, et al. Nitrous oxide production by Alcaligenes faecalis under transient and dynamic aerobic and anaerobic conditions[J]. Appl Environ Microbiol, 1996, 62(7): 2421-2426.
[15] Hwang S, Hanaki K. Effect of oxygen concentration and moisture content of refuse on nitrification, denitrification and nitrous oxide production[J]. Bioresouce Technology, 2000, 71: 159-165.
[16] Kampschreur M J, Tan N C G, Picioreanu C, et al. Effect of dynamic process conditions on nitrogen oxides emission from a nitrifying culture[J]. Environ Sci Technol, 2008, 42(2): 429-435.
[17] Sommer J, Ciplak A, Sümer E, et al. Quantification of emitted and retained N2O in a municipal wastewater treatment plant with activated sludge and nitrification-denitrification units[J]. Agrobiological Research, 1998, 51(1): 59-73.
(编辑 杨幼平)
收稿日期:2011-01-17;修回日期:2011-03-24
基金项目:城市水资源与水环境国家重点实验室开放基金资助项目(QAK201006);北京市属高等学校人才强教计划高层次人才资助项目(PHR20090502);北京工业大学第9届研究生科技基金重点资助项目(ykj-2011-5374)
通信作者:王淑莹(1953-),女,黑龙江肇源人,教授,博士生导师,从事污水深度脱氮处理理论及应用;电话:010-67392627;E-mail: wsy@bjut.edu.cn
摘要:利用SBR反应器,考察不同溶解氧(DO)条件下NO2-反硝化过程中N2O产生及释放过程。研究结果表明:控制曝气量为0.3 L/min,进水NO2--N质量浓度为40 mg/L,体系DO质量浓度分别为0,0.1,0.3,0.5和0.7 mg/L时,反硝化过程N2O释放量分别为0.41,0.60,2.62,4.98,6.83 mg/L;随DO质量浓度的增加,反硝化速率明显降低;当DO质量浓度由0 mg/L增至0.7 mg/L时,每克混合液悬浮固体(MLSS)的NO2-反硝化速率由14.9 mg/(L·h)降至10.2 mg/(L·h),每克MLSS的N2O产生速率由0.2 mg/(L·h)增至 1.9 mg/(L·h)。其原因为:高DO质量浓度对氧化亚氮还原酶具有较强的毒性,抑制了N2O的进一步还原过程;高NO2-的存在导致抑制了氧化亚氮还原酶的活性。降低A/O和A2/O等生物脱氮过程中缺氧反应器内部DO质量浓度,保证严格缺氧条件,是减少短程生物反硝化过程中N2O产量的关键因素。


