文章编号:1004-0609(2014)06-1486-08
Mg(In)固溶体的微观结构与储氢性能
钟海长1,王 辉2
(1. 厦门理工学院 材料科学与工程学院,厦门 361024;
2. 华南理工大学 材料科学与工程学院,广州 510640)
摘 要:
采用烧结-球磨方法制备了不同成分的Mg(In)固溶体合金。利用X射线衍射分析合金的相组成和吸/脱氢过程的相转变,并用Rietveld方法精确测定Mg(In)固溶体的晶格常数;通过SEM观察样品的微观形貌及其相分布;吸/脱氢性能采用Sievert方法进行测试,并用差热分析准确测定合金的脱氢温度。结果表明:In固溶到Mg晶格中使Mg的晶格常数减小;Mg(In)固溶体氢化分解成MgH2和金属间化合物MgxIny,脱氢后可逆地回到Mg(In)固溶体。Mg(In)固溶体吸/脱氢可逆相变与界面合金化有效降低了合金的脱氢反应焓,从而降低了合金脱氢温度,并提高了合金的吸/脱氢动力学性能。与纯Mg相比,Mg(In)固溶体的吸/脱氢平台压提高,吸/脱氢滞后减小。
关键词:
Mg(In)固溶体;可逆相变;界面合金化;微观结构;储氢性能;
中图分类号:TG139.7 文献标志码:A
Microstructure and hydrogen storage properties of Mg(In) solid solution
ZHONG Hai-chang1, WANG Hui2
(1. School of Materials Science and Engineering, Xiamen University of Technology, Xiamen 361024, China;
2. School of Materials Science and Engineering, South China University of Technology, Guangzhou 510640, China)
Abstract: Mg(In) solid solutions with different compositions were prepared by sintering and ball milling method. X-ray diffraction was used to analyze the phases and phase transition of the alloys during the hydriding and dehydriding process. Lattice constants of Mg(In) solid solution were accurately calculated by Rietveld method. Morphology and phase distribution of the samples were observed by SEM. The hydrogen absorption and desorption performances of the alloys were measured by Sievert method, and dehydriding temperatures were determined by DSC tests. The results show that the lattice constants of Mg are reduced by dissolving of In, and that Mg(In) solid solutions were hydrogenated to MgH2 and intermetallic compounds MgxIny, which reversibly return to Mg(In) solid solution after dehydrogenation. The reversible hydriding and dehydriding phase transitions of Mg(In) solid solutions and interfacial alloying effectively reduce the dehydriding enthalpy, thus lowering the dehydriding temperature and improving the hydriding and dehydriding kinetics of the Mg(In) solid solutions. The plateau pressure of Mg(In) solid solutions is improved and the hydriding and dehydriding lag is reduced compared with those of pure Mg.
Key words: Mg(In) solid solution; reversible phase transition; interfacial alloying; microstructure; hydrogen storage property
镁作为储氢材料具有高的质量储氢密度(7.6%,质量分数)和体积储氢密度(1.4 kg/L),并且价格低廉,被认为是对燃料电池汽车供氢的理想储氢介质[1]。众多研究者针对改善镁的吸放动力学性能和降低镁氢化物热力学稳定性开展了大量的研究工作,并取得了重要进展[2]。归纳起来改善镁储氢性能的方法主要有合金化[3-4]、纳米化[5]、添加高效催化剂[6]、调整吸/脱氢反应路径[7]、与其他储氢材料复合[8],以及制备方法改进[9-11]。目前,在改善动力学性能方面取得了较大的突破,但MgH2的热力学稳定性依然过高。研究表明纳米化,如采用气相沉积制备Mg/MgH2纳米线、球磨制备Mg/MgH2纳米颗粒、纳米限域和其他物理/化学方法制备具有纳米结构的Mg/MgH2,可降低氢化物热力学稳定性,从而降低脱氢反应焓[5, 12-13]。合金化是调节合金吸/脱氢反应焓的传统方法,如Mg和Ni合金化生成金属间化合物Mg2Ni,其吸/脱氢反应焓显著降低至64.5 kJ/mol[3, 14]。但Mg-Ni合金化完全改变了Mg的晶体结构,导致合金的储氢量显著降低为3.6%。Mg17Al12、Al3Mg2和Mg2Cu等合金也存在类似的问题[15]。调整Mg的吸/脱氢反应路径同样可以显著降低吸/脱氢反应焓,如添加Si使MgH2脱氢生成Mg2Si,对应的脱氢反应焓为36.4 kJ/mol。然而化合物Mg2Si过于稳定,难以氢化分解成Mg和Si,导致体系的可逆性差、可逆储氢量损失严重[7]。Mg和LiBH4等储氢材料复合,体系的脱氢反应焓降低,但体系的可逆性同样有待提高[16]。
最近,通过添加合金元素形成镁的固溶体调节吸/脱氢反应焓受到了广泛的关注[4, 17-18]。该方法在保持镁晶体结构不变的基础上,添加合金元素对合金的成分和微观结构进行调控,实现了降低反应焓的同时保持了较高的储氢量。遗憾的是多数镁的固溶体在氢化过程中发生歧化反应,如Mg12YNi过饱和固溶体合金氢化分解成MgH2、Mg2NiH4和YH2-3,导致镁的固溶体结构不可逆[17]。因此,探索可逆的镁基固溶体储氢材料体系,研究其吸/脱氢反应机理及其对储氢性能的影响具有非常重要的理论和实际意义。为此,本文作者在Mg(In)固溶体可逆体系基础上,进一步研究了In对Mg微观结构的影响和不同成分Mg(In)固溶体的储氢性能。
1 实验
将Mg(99.8%,质量分数)和In(99.99%,质量分数)粉按摩尔比98:2、95:5和90:10配置合金样品,分别记作Mg0.98In0.02、Mg0.95In0.05和Mg0.9In0.1。将称量好的样品先在行星式球磨机(南京大学制造,QM-3SP2)上进行混粉,然后将混合均匀的粉末压成坯样在氩气保护下进行预烧结处理,烧结坯样破碎后再在行星式球磨机上进行球磨。不锈钢磨球与样品的质量比为20:1,球磨转速设定为200 r/min,正转和反转交替进行。用于对比的纯Mg采用相同的球磨工艺进行球磨。X射线衍射分析在Philips X’Pert X射线衍射仪上进行,X射线光源为铜靶Cu Kα (λ=1.54060  )。样品测试前,先用高纯Si(>99.999%)对衍射仪的光路系统进行零点校正。晶格常数采用Rietveld方法用Rietan2000程序进行计算[19]。样品的微观形貌、相分布及成分利用Zeiss Supera40场发射扫描电镜观察分析。储氢性能采用Sievert方法在美国先进材料公司生产的储氢性能测试仪(AMC)上进行测试,性能测试前样品先进行了活化处理。脱氢温度利用差示扫描量热法(DSC/TG,NETZSCH STA 449 C)进行测量。
)。样品测试前,先用高纯Si(>99.999%)对衍射仪的光路系统进行零点校正。晶格常数采用Rietveld方法用Rietan2000程序进行计算[19]。样品的微观形貌、相分布及成分利用Zeiss Supera40场发射扫描电镜观察分析。储氢性能采用Sievert方法在美国先进材料公司生产的储氢性能测试仪(AMC)上进行测试,性能测试前样品先进行了活化处理。脱氢温度利用差示扫描量热法(DSC/TG,NETZSCH STA 449 C)进行测量。
2 结果与讨论
2.1 Mg(In)固溶体的微观结构和吸/脱氢过程的相转变
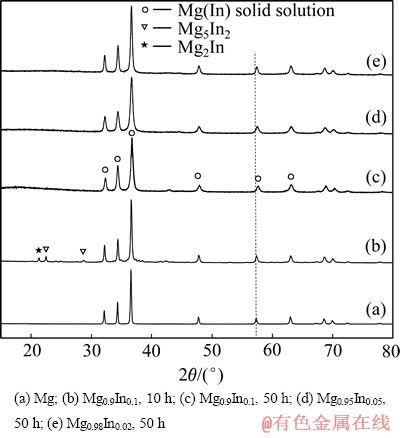
图1 球磨后Mg-In合金和Mg的XRD谱
Fig. 1 XRD patterns of ball milled Mg-In alloys and Mg
图1所示为球磨不同时间的Mg-In合金和纯Mg的XRD谱。其中,图1(b)所示为Mg0.9In0.1球磨10 h后的XRD谱,物相分析结果表明,样品由Mg、Mg5In2和Mg2In三相组成,说明球磨过程中In与Mg反应生成了金属间化合物。将球磨时间继续延长至50 h,如图1(c)所示,金属间化合物Mg5In2和Mg2In的衍射峰均完全消失,只剩下Mg的衍射峰,说明延长球磨时间可使金属间化合物Mg5In2和Mg2In分解,并与Mg反应形成Mg(In)固溶体。球磨过程中Mg和In先形成Mg-In金属间化合物,然后与Mg反应生成Mg(In)固溶体的形成机制,可能与In的熔点低和质软导致In难于分散有关。图1(d)和图1(e)所示分别是球磨50 h后Mg0.95In0.05和Mg0.98In0.02的XRD谱,两者均只有Mg的衍射峰。因此,Mg0.9In0.1、Mg0.95In0.05和Mg0.98In0.02球磨50 h后均生成了单相的Mg(In)固溶体。另外,从图1中虚线所标示位置(Mg的衍射峰)的对比可以发现,Mg0.98In0.02、Mg0.95In0.05和Mg0.9In0.1与纯Mg(见图1(a))相比,衍射峰向高角度漂移,并且随着In含量增加,衍射峰向高角度漂移量增大。2θ增大,说明晶格常数减小,即In固溶到Mg晶格后生成Mg(In)固溶体的晶格常数减小。
为了进一步分析In原子固溶对Mg微观结构的影响,采用Rietveld全谱拟合方法对球磨50 h后Mg0.98In0.02、Mg0.95In0.05和Mg0.9In0.1合金的XRD谱进行拟合。样品中掺入高纯Si(99.999%)作为内标,以准确计算Mg(In)固溶体的晶格常数。Rietveld拟合过程中Si的晶格常数固定为其常温下的值0.543054 nm,先对衍射仪系统的零点漂移进行修正,然后将系统零点漂移固定,对Mg(In)固溶体的XRD谱进行进一步拟合,从而精确计算出Mg(In)固溶体的晶格常数。图2所示为Mg0.9In0.1固溶体合金添加Si作为内标进行Rietveld拟合的图形化结果输出。由图2可以看到,理论计算谱(— Cal)与实验谱(+ Obs)相当吻合,说明各项拟合参数的理论值与实际值非常接近。评价拟合结果优劣程度的可靠性因子(Rwp)和优度因子(S)分别为13.0%和1.9,也说明拟合结果的可靠性较高。表1所列为Rietveld全谱拟合求得不同成分Mg(In)固溶体和纯Mg的晶格常数及拟合结果的评价因子。从表1可以看到,Mg0.98In0.02、Mg0.95In0.05和Mg0.9In0.1固溶体的晶格常数均小于纯Mg的,并且随着In含量增加,Mg(In)固溶体的晶格常数减小,这一结果与图1中不同固溶度Mg(In)固溶体的衍射峰向高角度漂移量不同的结果相一致。非常有趣的是,虽然In原子半径(0.166
nm)比Mg原子半径(0.160 nm)大,但In原子部分替代Mg原子形成Mg(In)固溶体后的晶格常数反而减小。导致这一奇异结果的原因可能是Mg和In原子的电负性差别比较大,分别为1.23和1.7。因此,当In原子部分替代晶体点阵中的Mg原子后,近临原子间相互作用的吸引力增强,从而导致Mg(In)固溶体的晶胞发生收缩。

图2 Mg0.9In0.1球磨50 h后添加Si作为内标的Rietveld拟合结果
Fig. 2 Rietveld refinement results of Mg0.9In0.1 milled for 50 h and adding Si as interior label
表1 Reitveld拟合得到不同In含量Mg(In)固溶体和Mg的晶格常数及拟合因子
Table 1 Lattice constants of Mg(In) solid solutions with different In contents and Mg achieved by Rietveld refinement and refinement factors


图3 Mg0.9In0.1固溶体合金氢化和脱氢后的XRD谱
Fig. 3 XRD patterns of hydrogenated (a) and dehydrogenated (b) Mg0.9In0.1 solid solution alloy
图3所示为Mg0.9In0.1固溶体合金吸氢状态和脱氢后的XRD谱。从图3(a)可以看到Mg0.9In0.1氢化后由β″、Mg2In和MgH2三相所组成,说明Mg0.9In0.1固溶体合金氢化过程中发生了分解。需要指出的是,图3(a)所示为Mg0.9In0.1固溶体合金在615 K氢化后缓冷至室温的XRD谱。原位X射线衍射表明,高于573 K进行氢化时,Mg(In)固溶体将分解成MgH2和高温相β[4]。因此,可以推断图3(a)中的β″和Mg2In应当是由高温的β相在降温过程中分解形成的,即Mg0.9In0.1固溶体合金在615 K氢化应当是直接分解为MgH2和β相。图3(b)所示为在615 K充分脱氢后Mg0.9In0.1合金的XRD谱。对比图3(a)中氢化状态下的XRD谱可以发现,伴随着MgH2的分解,β″和Mg2In也全部消失,只剩下Mg的衍射峰,表明脱氢后的Mg0.9In0.1合金重新回到了固溶体。In含量较低的Mg0.98In0.02和Mg0.95In0.05固溶体合金氢化过程的相转变与Mg0.9In0.1的相同,脱氢后同样可逆地回到固溶体。因此,Mg(In)固溶体合金的氢化反应是完全可逆的。

图4 不同状态下Mg0.9In0.1合金的微观形貌、相分布和EDS分析结果
Fig. 4 Microstructure and phase distribution of Mg0.9In0.1 alloy at different states and EDS analysis results
图4所示为Mg0.9In0.1合金不同状态下的微观形貌、相分布和能谱分析结果。图4(a)所示为球磨50 h后的背散射像,只有一种相衬度。据此可推断In已经固溶到Mg晶格中形成了Mg(In)固溶体,这与前面的XRD谱分析结果一致。微区成分分析结果(见图4(b))显示,球磨后合金中Mg和In的摩尔分数分别为84.68%和15.32%,考虑到不同原子序数对能谱分析结果的影响,可以认为球磨后合金的成分与初始成分基本一致。从图4(a)还可以看到,烧结-球磨方法制备的Mg(In) 固溶体合金粉末颗粒形状并不规则,颗粒尺寸分布也不均匀,多数为几微米的量级,也有部分颗粒超过10 μm。将球磨样品(见图4(a))与经过吸/脱氢循环后的样品(见图4(c)和(d))进行对比可以发现,图4(a)中的大颗粒实际上是由许多小颗粒组成,即球磨过程中粉末样品发生了粘连。图4(c)所示为Mg0.9In0.1合金吸氢状态下的背散射电子像,灰色基体为MgH2,箭头所标示的亮白色分散镶嵌在MgH2基体中的颗粒则是由高温相β分解形成的金属间化合物MgxIny(即XRD谱分析中的Mg2In和β″)。金属间化合物MgxIny的分布不均匀,且出现明显的团簇现象,这与Mg(In)固溶体的氢化分解过程有关[4]。图4(d)所示的Mg0.9In0.1合金脱氢后的背散射电子像与吸氢前的相似,只有一种相衬度,进一步证实了Mg0.9In0.1合金脱氢后可逆地回到了固溶体。
根据上述XRD和SEM分析结果,Mg(In)固溶体合金的可逆吸/脱氢反应可表示为

2.2 Mg(In)固溶体的储氢性能
图5所示为MgH2和不同In含量Mg(In)固溶体氢化后加热分解的DSC曲线。纯MgH2和氢化后的Mg0.95In0.05及Mg0.9In0.1固溶体合金以5 K/min的加热速率进行加热,发生热分解的峰值温度分别为702、670和660 K。与纯MgH2相比,Mg0.9In0.1固溶体合金的脱氢温度降低了42 K。从图5中的DSC分析结果还可以看到,Mg(In)固溶体的脱氢温度随其固溶度的增加而减小,这说明不同In含量对降低MgH2脱氢温度的作用效果不同。
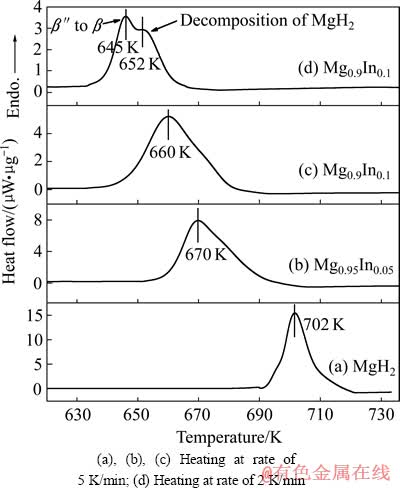
图5 纯MgH2、Mg0.95In0.05和Mg0.9In0.1热分解脱氢的DSC曲线
Fig. 5 DSC curves of thermal dehydrogenation of pure MgH2, Mg0.95In0.05 and Mg0.9In0.1
图5(d)所示为氢化后的Mg0.9In0.1固溶体合金以2 K/min的加热速率进行加热脱氢的DSC曲线。曲线中有两个部分重叠的吸热峰,对应的峰值温度分别为645 和652 K。根据Mg(In)固溶体脱氢过程的原位X射线衍射结果,并结合Mg-In二元相图,可以推断645 K的吸热峰是低温相β″转变为高温相β的吸热反应;652 K的吸热峰则是MgH2与高温相β反应生成Mg(In)固溶体并释放氢气的脱氢反应。由于加热速度快,两个反应发生重叠,因而图5(b)和(c)所示曲线中只呈现一个宽化的吸热峰。图5(b)中Mg0.95In0.05合金脱氢结束温度与图5(a)中纯MgH2起始脱氢温度相接近,可能是由于样品颗粒较大,颗粒内部MgH2受In的影响小,保持了较高的热稳定性。据此推断细化粉末样品并改善β相的均匀性将有利于提高合金的脱氢性能。
另外,从图5中的DSC分析结果还可以大致看出Mg0.95In0.05及Mg0.9In0.1合金中MgH2分解对应的吸热峰的面积小于纯MgH2吸热分解的峰面积,说明合金中MgH2分解所需的反应热降低。从Mg-In二元相图可知,Mg(In)固溶体相区与β相区相邻,所以β相容易与Mg反应转变为Mg(In)固溶体。而MgH2分解正好为β相转变为Mg(In)固溶体提供Mg。因此,高温相β相形成后,MgH2与β相之间的界面合金化速度加快,从而加速了MgH2分解,并可逆地转变为Mg(In)固溶体,促使MgH2的脱氢温度降低。
图6所示为Mg0.9In0.1固溶体合金和纯Mg不同温度下的等温吸/脱氢循环PCI曲线。由图6可以看到纯Mg在596 K进行脱氢时,需要在接近真空的条件下才开始缓慢分解释放出氢气,然后脱氢压力逐渐升高至接近其平台压。这说明纯MgH2开始分解需要克服比较高的形核能垒,但MgH2的热分解一旦被激活,脱氢反应就可以比较容易进行。有研究者认为,Mg在纯净的MgH2表面形核困难,然而当Mg在MgH2的表面形核完成后,由于MgH2转变成Mg引起的晶胞体积变化产生的应力作用在近邻的MgH2晶格上,将可以促进MgH2分解[20]。因此,纯MgH2的PCI曲线中有一个比较大的滞后。另外,随着脱氢温度的升高,Mg的吸/脱氢滞后减小,表明高温下MgH2的热分解反应容易被激活,即脱氢动力学性能提高。这可能与高温下氢原子的扩散速率提高有关。不同于纯Mg,Mg0.9In0.1固溶体合金在脱氢测试过程中,随着环境氢压的减小,在高于其平台压就有少量的氢气放出,表现为图6中Mg0.9In0.1固溶体合金的脱氢PCI曲线在平台区之上有明显的斜率。可能是由于受到高温相β的影响,与β相接触界面上MgH2的稳定性降低,使其在高于平衡压下便发生分解放出氢气。图6中Mg0.9In0.1固溶体合金的PCI曲线没有明显的滞后,表明合金具有良好的动力学性能。如前所述,β相转变为Mg(In)固溶体将消耗MgH2分解产生的Mg。从化学反应平衡的角度来看生成物的消耗将有利于反应向正向进行。因此,β相与Mg反应生成Mg(In)固溶体无疑促进了MgH2分解。其次,合金中大量的相界面、晶界和各种缺陷为H的扩散提供通道也促进了动力学性能的改善[21]。

图6 Mg0.9In0.1固溶体合金和纯Mg在不同温度下的PCI曲线
Fig. 6 PCI curves of Mg0.9In0.1 solid solution alloy and pure Mg at different temperatures
将Mg0.9In0.1固溶体合金和纯Mg在相同温度615 K的PCI进行对比发现,Mg0.9In0.1固溶体合金的吸/脱氢平台压比纯Mg的高。氢化物的脱氢平台压与其热力学稳定性相关,由可逆稳定性原理可知,氢化物热力学稳定性越高,平台压越低。Mg0.9In0.1固溶体合金的吸/脱氢平台压提高,说明合金中MgH2的热力学稳定性降低。氢化物的脱氢热力学性质通常用吸/脱氢反应焓来表征。为了确定Mg0.9In0.1固溶体合金的吸/脱氢热力学性质的变化,利用vant’ Hoff方程(式(2))计算合金的脱氢反应焓变(ΔH)和熵变(ΔS)。
 (2)
(2)
式中:p0为标准大气压;R为摩尔气体常数;T为热力学温度;peq为平衡压,通常取PCI曲线平台中点对应的压力值作为氢化物的脱氢平衡压。本研究中选取Mg0.9In0.1固溶体合金脱氢平台中点对应的压力值作为平衡压,利用vant’ Hoff 方程计算出其脱氢反应焓变(ΔH)和熵变(ΔS)分别为(65.2±0.8) kJ/mol和(121.8±1.7) J/(K·mol)。用同样的方法计算纯Mg、Mg0.98In0.02和Mg0.95In0.05固溶体合金的脱氢反应焓变和熵变列于表2中。从表2可见,本实验中得到纯Mg的脱氢反应焓变和熵变分别为(77.9±0.3) kJ/mol和(138.9±0.6) J/(K·mol),大于文献[13]中报道的(74.06±0.42) kJ/mol和(133.4±0.7) J/(K·mol),误差主要来源于对平衡压的判断和温度的准确测定。文献中Mg的颗粒尺寸为7~8 nm左右,具有较好的动力学性能,脱氢反应容易达到平衡。而本研究中普通球磨后Mg的颗粒尺寸为毫米级,其动力学性能较差。因此脱氢达到平衡所需时间更长,特别是在较低的温度下难于达到真实的平衡,从而导致计算所用的平衡压小于真实的平衡压,造成反应焓偏高。此外,Mg的颗粒尺寸较大,受动力学性能的影响,导致Mg难于完全氢化生成MgH2,使所测纯Mg的储氢量明显小于其理论储氢量。
表2 不同In 含量Mg(In)固溶体和纯Mg的脱氢反应焓及熵变
Table 2 Dehydriding enthalpy and entropy change of Mg(In) solid solutions with different In contents and pure Mg

表2中Mg0.98In0.02、Mg0.95In0.05和Mg0.9In0.1固溶体合金的脱氢反应焓均小于纯Mg的脱氢反应焓,并且随着In含量增加,固溶体合金的脱氢反应焓呈明显减小趋势,与DSC测试中脱氢反应热减小的结果相对应。XRD谱分析已表明,Mg(In)固溶体氢化分解成MgH2和β相,而脱氢过程则是MgH2和β相反应生成Mg(In)固溶体并释放氢气。MgH2与β相界面发生合金化,如MgH2-Fe体系中Fe合金化导致Mg—H键减 弱[22],降低了MgH2的热力学稳定性。因此,Mg(In)固溶体合金脱氢反应焓的降低可归因于β相参与下的Mg(In)固溶体吸/脱氢可逆相变和界面合金化作用。需要指出的是,合金脱氢反应焓变减小的同时熵变也减小。根据脱氢温度T=DH/DS,脱氢反应熵变化(DS)减小将部分抵消了反应焓变化(DH)减小对降低脱氢温度的作用效果[9, 13]。所以,图5中DSC所测得的Mg0.95In0.05和Mg0.9In0.1固溶体合金的脱氢温度均高于其理论脱氢温度。合金脱氢反应熵变(DS)的减小,可能是由于固溶体合金氢化生成的亚稳态过渡相β是一种无序固溶体相,其结构熵较高。另外,氢原子的存在使β相与MgH2之间的界面熵增加。这两方面的原因使MgH2-β体系的熵增加,从而导致脱氢反应熵变减小。
3 结论
1) Mg和In的混合粉末球磨过程中先形成金属间化合物MgxIny,随后金属间化合物 MgxIny发生分解,最终与剩余的Mg反应生成Mg(In)固溶体。In固溶到Mg晶格中形成固溶体的晶格常数减小。
2) Mg(In)固溶体在高温下氢化分解成MgH2和高温相β,脱氢后可逆地回到Mg(In)固溶体。高温相β降温过程中转变为金属间化合物MgxIny。但β相更有利于促进MgH2分解生成Mg(In)固溶体。
3) β相参与下的Mg(In)固溶体吸/脱氢可逆相变及界面合金化能有效降低MgH2的脱氢反应焓,从而降低MgH2的脱氢温度,提高脱氢平台压。同时β相还能加速MgH2分解,显著地提高脱氢动力学性能,减小合金的吸/脱氢滞后。并且In含量越高,越有利Mg(In)固溶体脱氢反应焓降低,且动力学性能提高越明显。
REFERENCES
[1] SCHLAPBACH L,  A. Hydrogen-storage materials for mobile applications[J]. Nature, 2001, 414: 353-358.
A. Hydrogen-storage materials for mobile applications[J]. Nature, 2001, 414: 353-358.
[2] CHEN P, ZHU M. Recent progress in hydrogen storage[J]. Mater Today, 2008, 11: 36-43.
[3] LIANG G, BOILY S, HUOT J, van NESTE A, SCHULZ R. Mechanical alloying and hydrogen absorption properties of the Mg-Ni system[J]. J Alloys Compd, 1998, 267: 1-2.
[4] ZHONG H C, WANG H, LIU J W, SUN D L, ZHU M. Altered desorption enthalpy of MgH2 by the reversible formation of Mg(In) solid solution[J]. Scripta Mater, 2011, 65: 285-287.
[5] LI W Y, LI C S, MA H, CHEN J. Magnesium nanowires: Enhanced kinetics for hydrogen absorption and desorption[J]. J Am Chem Soc, 2007, 129: 6710-6711.
[6] FAN X L,XIAO X Z,CHEN L X,WANG X H,LI S Q,GE H W, WANG Q D.High catalytic efficiency of amorphous TiB2 and NbB2 nanoparticles for hydrogen storage using the 2LiBH4-MgH2 system[J]. J Mater Chem A, 2013, 1: 11368-11375.
[7] VAJO J J, MERTENS F, AHN C C, BOWMAN T R, FULTZ B. Altering hydrogen storage properties by hydride destabilization through alloy formation: LiH and MgH2 destabilized with Si[J]. J Phys Chem B, 2004, 108: 13977-13983.
[8] KOU H Q, XIAO X Z, CHEN L X, LI S Q, WANG Q D. Formation mechanism of MgB2 in 2LiBH4+MgH2 system for reversible hydrogen storage[J]. Trans Nonferrous Met Soc China, 2011, 21: 1040-1046.
[9] ZHONG H C, WANG H, OUYANG L Z, ZHU M. Microstructure and hydrogen storage properties of Mg-Sn nanocomposite by mechanical milling[J]. J Alloys Compd, 2011, 59: 4268-4272.
[10] PHETSINORATH S, ZOU J X, ZENG X Q, SUN H Q, DING W J. Preparation and hydrogen storage properties of ultrafine pure Mg and Mg-Ti particles[J]. Transactions of Nonferrous Metals Society of China, 2012, 22: 1849-1854.
[11] 张羊换, 张国芳, 李 霞, 侯忠辉, 任慧平, 赵栋梁. 快淬 Mg2Ni 型合金的结构及贮氢动力学[J]. 中南大学学报: 自然科学版, 2012, 43(6): 2101-2107.
ZHANG Yang-huan, ZHANG Guo-fang, LI Xia, HOU Zhong-hui, REN Hui-ping, ZHAO Dong-liang. Structure and hydrogen storage kinetics of as-spun Mg2Ni-type alloys[J]. Journal of Central South University: Science and Technology, 2012, 43(6): 2101-2107.
[12] JEON K J, MOON H R, RUMINSKI A M,JIANG B, KISIELOWSKI C, BARDHAN R, URHAN J J. Air-stable magnesium nanocomposites provide rapid and high-capacity hydrogen storage without using heavy-metal catalysts[J]. Nature Mater, 2011, 10: 286-290.
[13] PASKEVICIUS M, SHEPPARD D A, BUCKLEY C E. Thermodynamic changes in mechanochemically synthesized magnesium hydride nanoparticles[J]. J Am Chem Soc, 2010, 132: 5077-5083.
[14] REILLY J J, WISWALL R H. Reaction of hydrogen with alloys of magnesium and nickel and the formation of Mg2NiH4[J]. Inorg Chem, 1968, 7: 2254-2256.
[15] CRIVELLO J C, NOBUKI T, KUJI T. Improvement of Mg-Al alloys for hydrogen storage applications[J]. Int J Hydro Energy, 2009, 34: 1937-1943.
[16] PINKERTON F E, MEYER M S, MEISNER G P, BALOGH M P, VAJO J J. Phase boundaries and reversibility of LiBH4/MgH2 hydrogen storage material[J]. J Phys Chem C, 2007, 111: 12881-12885.
[17] SI T Z, LIU Y F, ZHANG Q A. Hydrogen storage properties of the supersaturated Mg12YNi solid solution[J]. J Alloys Compd, 2010, 507: 489-493.
[18] ZHOU C S, ZAK FANG Z G, LU J, ZHANG X Y. Thermodynamic and kinetic destabilization of magnesium hydride using Mg-In solid solution alloys[J]. J Am Chem Soc, 2013, 135(30): 10982-10985.
[19] IZUMI F, IKEDA T. A Rietveld-analysis program RIETAN-98 and its applications to zeolites[J]. Mater Sci Forum, 2000, 198: 321-324.
[20] PASQUINI L, CALLINI E, PISCOPIELLO E, MONTONE A, VITTORI ANTISARI M, BONETTI E. Metal-hydride transformation kinetics in Mg nanoparticles[J]. Appl Phys Lett, 2009, 94: 041918-041921.
[21] 彭书科, 肖学章, 杭州明, 吴 凡, 李长旭, 李寿权, 陈立新. Mg+10%Ni2P储氢材料的相结构和吸/脱氢性能[J]. 稀有金属材料与工程, 2011, 40: 1387-1391.
PENG Shu-ke, XIAO Xue-zhang, HANG Zhou-ming, WU Fan, LI Chang-xu, LI Shou-quan, CHEN Li-xin. Phase-structure and hydrogen storage behaviors of Mg+10%Ni2P composite prepared by reactive ball-milling[J]. Rare Metal Materials and Engineering, 2011, 40: 1387-1391.
[22] 周惦武, 张 健, 彭 平, 刘金水. 球磨条件下Fe 合金化改善MgH2体系性能的机理[J]. 中国有色金属学报, 2008, 18(12): 2233-2244.
ZHOU Dian-wu, ZHANG Jian, PENG Ping, LIU Jin-shui. Mechanism of improved properties of MgH2 systems with ball milling and iron addition[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(12): 2233-2244.
(编辑 陈卫萍)
基金项目:福建省教育厅教育科研A类项目(JA13244); 清洁能源材料广东省普通高校重点实验室开放基金项目(KLB11003)
收稿日期:2013-10-20;修订日期:2014-02-23
通信作者:钟海长,讲师,博士;电话:0592-6291326;E-mail: Haichangchung@gmail.com
摘 要:采用烧结-球磨方法制备了不同成分的Mg(In)固溶体合金。利用X射线衍射分析合金的相组成和吸/脱氢过程的相转变,并用Rietveld方法精确测定Mg(In)固溶体的晶格常数;通过SEM观察样品的微观形貌及其相分布;吸/脱氢性能采用Sievert方法进行测试,并用差热分析准确测定合金的脱氢温度。结果表明:In固溶到Mg晶格中使Mg的晶格常数减小;Mg(In)固溶体氢化分解成MgH2和金属间化合物MgxIny,脱氢后可逆地回到Mg(In)固溶体。Mg(In)固溶体吸/脱氢可逆相变与界面合金化有效降低了合金的脱氢反应焓,从而降低了合金脱氢温度,并提高了合金的吸/脱氢动力学性能。与纯Mg相比,Mg(In)固溶体的吸/脱氢平台压提高,吸/脱氢滞后减小。


