网络首发时间: 2017-09-20 10:03
碱熔-水浸法从钼精矿焙烧烟灰中回收铼和钼
河南科技大学材料科学与工程学院
河南科技大学河南省耐磨材料工程技术研究中心
河南科技大学河南省高温结构与功能材料重点实验室
摘 要:
针对目前采用的沉淀法和直接浸出法从钼精矿焙烧烟灰中回收铼和钼回收率较低的问题, 提出通过添加硝酸钠和碳酸钠碱熔实现铼和钼物相的转化, 然后采用水浸法回收铼和钼。考察了硝酸钠与烟灰质量比、碳酸钠与烟灰质量比、碱熔时间和碱熔温度对碱熔过程中铼和钼转化率的影响;采用差热分析-热重法 (DTA-TG) 和X射线衍射 (XRD) 分析了钼的反应过程和相变行为;探讨了双氧水浓度、浸出温度、浸出时间和液固比对水浸过程中铼和钼浸出率的影响。结果表明, 合适的碱熔条件为硝酸钠和碳酸钠加入量均为烟灰质量的60%, 碱熔时间3 h、碱熔温度500℃, 铼和钼的转化率分别达到93. 5%和96. 3%;随着碱熔温度的提高, 产物中钼的物相由Na2Mo2O7向Na2MoO4转变, 在500℃时Na2MoO4峰最强, 继续提高碱熔温度时, Na2MoO4峰减弱, SiO2变得活跃并与氧化钙和氧化钠结合生成硅酸盐;合适的浸出条件是双氧水浓度10%、浸出温度70℃、浸出时间2 h、液固比5∶1, 铼和钼的浸出率分别达到93. 2%和95. 3%。
关键词:
中图分类号: TF841
作者简介:刘伟 (1981-) , 男, 河北石家庄人, 博士, 副教授, 研究方向:稀有金属资源综合利用及功能材料开发;电话:13608463235;E-mail:liuweimse@163.com;
收稿日期:2017-08-06
基金:国家自然科学基金项目 (U1404511);河南省重点科技攻关项目 (132102210250) 资助;
Recovery of Rhenium and Molybdenum from Dust of Roasted Molybdenum Concentrate by Oxidized Alkali Fusion Followed by Water Leaching
Liu Wei Ding Liuliang Li Jiwen Wei Shizhong
School of Materials Science & Engineering, Henan University of Science & Technology
Henan Engineering Research Center for Wear of Material, Henan University of Science & Technology
Henan Key Laboratory of High-Temperature Structural and Functional Materials, Henan University of Science & Technology
Abstract:
In view of low extraction rates of rhenium and molybdenum by precipitation and direct leaching from dust of roasted molybdenum concentrate, a novel process of oxidized alkali fusion with sodium nitrate and sodium carbonate followed by water leaching was proposed. The effects of ratios of sodium nitrate and sodium carbonate to dust of roasted molybdenum concentrate, alkali fusion time and alkali fusion temperature on the transformation rates of rhenium and molybdenum were investigated. The differential thermal analysis-thermogratimetry (DTA-TG) and X-ray diffraction (XRD) analysis were adopted to analyze the reaction procedure and reveal phase transformation behavior of molybdenum. Meanwhile, the influences of different process parameters (such as concentration of hydrogen peroxide, leaching temperature, leaching time and liquid-solid ratio) on leaching efficiency were studied. The results showed that the preferable transformation rates of rhenium and molybdenum were 93. 5% and 96. 3%, respectively, when ratios of sodium nitrate and sodium carbonate to dust of roasted molybdenum concentrate were 60%, alkali fusion time was 3 h and alkali fusion temperature was 500 ℃. Specifically, with the increase of alkali fusion temperature, the phase of molybdenum transformed from Na2Mo2O7 to Na2MoO4, and the XRD peaks of Na2MoO4 were the most significant at 500 ℃. However, further increase of temperature weakened the XRD peaks of Na2MoO4, activated silica, calcium oxide and sodium oxide to form silicates. The leaching rates of rhenium and molybdenum were93. 2% and 95. 3%, respectively, when the concentration of hydrogen peroxide was 10%, leaching temperature was 70 ℃, leaching time was 2 h and liquid-solid ratio was 5∶ 1.
Keyword:
molybdenum; rhenium; fume ash; oxidized alkali fusion; water leaching;
Received: 2017-08-06
铼和钼是高温难熔金属, 是高温应用技术领域重要的合金元素[1,2,3], 广泛应用于国防、航空航天、核能以及电子工业等现代高科技领域[4,5,6,7]。铼还具有很强的催化活性, 主要被用于石油化工行业的Pt/Re重整催化剂[4,8,9,10]。然而铼属于稀散金属, 在地壳中含量低且分散, 地壳丰度约为1.0×10-9。美国地调局数据[11]显示, 目前铼已探明的储量约2500 t, 基础储量约11000 t, 而我国的铼资源储量较低, 仅237 t。铼无独立矿床, 因和钼性质相近而多伴生于钼矿中, 在钼精矿焙烧时, 挥发的氧化铼、氧化钼和随尾气带出的钼精矿在烟道中降温, 经旋风收尘和布袋收尘时被收集, 所以烟灰中含有丰富的钼和可回收的铼资源。目前钼冶炼企业对钼精矿焙烧烟灰的主要处理方法是作为原料再次焙烧, 并未对铼进行有效回收, 但就目前我国铼资源现状而言, 探索从烟灰中提取铼的工艺条件, 实现废渣的资源化利用, 对我国的可持续发展和环境保护具有重要意义。
目前铼资源主要从镍基合金废料、报废的涡轮叶片和含铼废催化剂中回收[11], 所以这方面的铼回收工艺研究较多。烟灰中铼含量相对较低且成分复杂, 从而对铼的高效回收带来困难, 使得从烟灰中提铼的研究较少, 陈来成等[12]通过氧化干馏和水吸收提取铼, 然后调节p H使铼转化为高铼酸铵得以回收, 铼的回收率在85%以上, 但干馏法在实际生产中应用较少。李卫昌[13]以双氧水氧化浸出法直接提取烟灰中的铼, 确定了铼的最佳浸出工艺, 牛春林等[14]在氧化浸出的基础上进行了钼铼分离和铼的氯化钾沉淀富集研究, 但铼的综合回收率只有69%。关于钼在高温下的物相转变和机制分析, Wang等[15]对辉钼精矿氧化焙烧, 分析了钼在纯氧条件下的相变过程和产物形貌。Gan等[16]以低品位钼精矿为原料, 分别添加Ca (OH) 2, CaO和CaCO3钙化焙烧, 研究了钼在钙盐中的焙烧热力学和相变规律。牟文宁等[17]在低品位钼精矿中加入碳酸钠焙烧, 探讨了钼在钠盐中的转化历程和钼酸钠的生成规律。本文拟以布袋收尘灰为原料, 通过加入硝酸钠和碳酸钠氧化碱熔, 使铼和钼转化成可溶于水的铼酸盐和钼酸盐, 然后再通过水浸法溶出铼和钼, 实现与大部分杂质元素的分离, 最后采用离子交换法富集和分离溶液中的铼和钼。在此, 主要考察烟灰的碱熔过程和碱熔渣的水浸过程, 探讨碱熔过程中钼的物相变化和各因素对铼、钼转化率的影响, 以及浸出过程各因素对铼和钼浸出率的影响, 为铼的高效回收提供理论依据和技术支持。
1实验
1.1原料
实验所用原料来自洛阳某钼冶炼企业, 系钼精矿焙烧时的布袋收尘灰 (以下称烟灰) 。烟灰经105℃烘箱保温24 h, 冷却后过0.074 mm网筛, 保存于干燥的容器中, 以备后续实验研究。
1.2设备和分析仪器
主要设备:SXL-1400C型马弗炉, FA2004N型电子天平, 101-A-2型恒温干燥箱, DF-101S型集热式恒温加热磁力搅拌器, SHZ-D (Ⅲ) 型循环水式真空泵。
分析仪器:X射线荧光光谱仪 (XRF) , HCT-4微机差热分析仪 (DTA-TG) , TESCANVEGA3扫描电子显微镜 (SEM) , EDAX Octane SSD型X射线扫描电镜能谱仪 (EDS) , Brux-D8X射线衍射分析仪 (XRD) , 安捷伦Cary 60 UV-Vis紫外-可见分光光度计。
1.3原理
烟灰辅加碳酸钠和硝酸钠在高温下碱熔时, 硝酸钠分解生成的活性氧将烟灰中各金属由低价态氧化成高价态, 碳酸钠起到助熔和反应剂的作用, 促进铼钼化合物的晶型转变, 使铼和钼最终分别转化为高铼酸钠和钼酸钠。碱熔生成的高铼酸钠和钼酸钠都易溶于水, 而其他大部分杂质元素则不溶, 浸出液经过滤实现铼钼与其他杂质元素的分离, 后续结合使用萃取法和离子交换法即可实现铼和钼的回收。
1.4方法
碱熔方法:称取10.00 g过筛后的烟灰于陶瓷坩埚中, 加入一定量的硝酸钠和碳酸钠并混匀, 放入马弗炉中加热, 达到设定的温度后保温一定时间, 然后取出冷却, 研磨并过0.074 mm网筛, 通过XRD表征碱熔渣的物相组成, 然后取适量碱熔渣于盛有蒸馏水的烧杯中, 通过恒温加热磁力搅拌器在固定条件下 (温度70℃、液固比10/1、时间2 h、转速600 r·min-1) 浸出, 趁热过滤并洗涤, 滤饼烘干后测定其中铼和钼的含量, 并与烟灰中铼和钼的含量作对比, 计算铼和钼的转化率, 并以此来表征各因素对碱熔效果的影响。铼和钼的转化率计算公式如下:
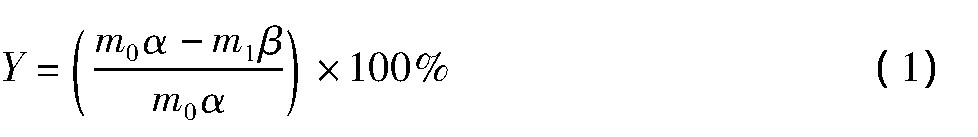
式中:Y为铼和钼的转化率;m0为用于碱熔的烟灰质量;α为烟灰中铼和钼的含量;m1为滤渣的质量;β为滤渣中铼和钼的含量。
浸出方法:在最佳碱熔工艺参数下碱熔出一批渣样, 研磨并过0.074 mm网筛。每次称取10.00 g碱熔渣, 按照设定的液固比加入到盛有一定浓度双氧水的烧杯中, 然后放于预先设置好温度的磁力搅拌水浴锅中恒温浸出, 一定时间后取出并趁热过滤, 滤饼烘干后测定其中铼和钼的含量, 并计算铼和钼的浸出率, 计算公式如下:
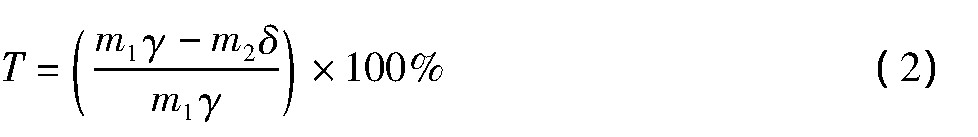
式中:T为铼和钼的浸出率;m1为碱熔渣的质量;γ为碱熔渣中铼和钼的含量;m2为浸出渣的质量;δ为浸出渣中铼和钼的含量。
分析方法[18,19,20]:铼和钼含量的测定均采用分光光度法。在铼测定时, 先用盐酸氯化四苯胂 (C24H20As Cl·HCl·x H2O, 97%) 和三氯甲烷萃取分离铼, 然后在盐酸体系下, 高价铼经氯化亚锡还原后与硫氰酸钾显黄色络合物, 最大吸收波长430nm;钼测定采用硫酸体系, 高价钼经硫脲还原后与硫氰酸铵显橙红色络合物, 最大吸收波长460 nm。
XRD分析:采用Brux-D8 X射线衍射仪Cu Kα辐射对样品进行衍射分析, λ=0.154056 nm, 电压40 k V, 电流40 m A, 试样步进时间0.2 s, 步长0.02°, 2θ测量取10°~90°。
2结果与讨论
2.1烟灰的表征
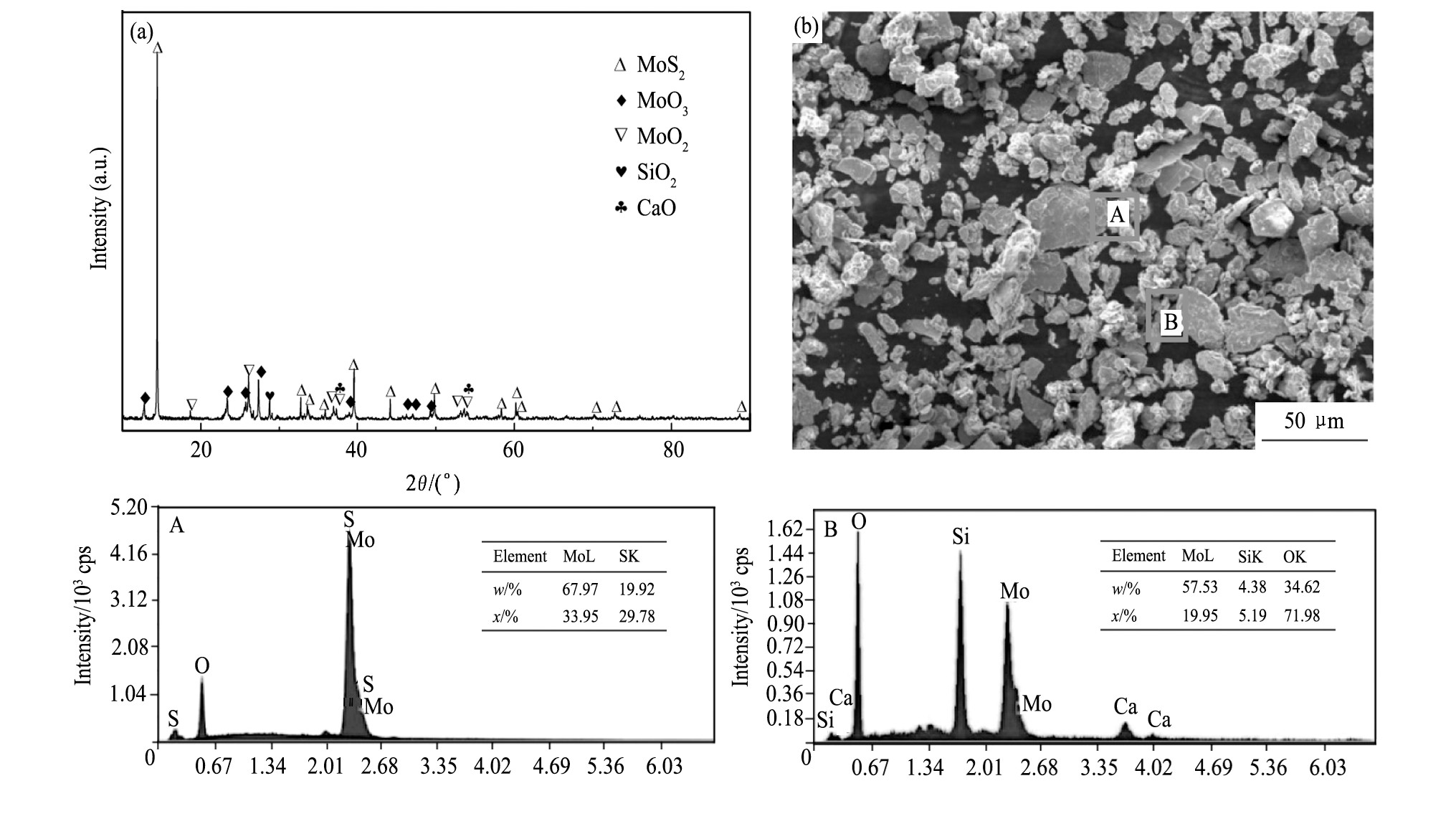
分别采用XRF, XRD和SEM对烟灰的成分、物相和形貌进行分析。表1是烟灰的XRF分析结果, 钼和硫的质量百分含量分别为43.35%和16.83%。图1是烟灰的XRD谱、SEM像和能谱 (EDS) 分析结果, 从图1 (a) 可以看出烟灰的主要物相是钼的硫化物MoS2、氧化物MoO2和MoO3, 其次是石英SiO2和石灰CaO, 所以要想实现较高的转化率首先需要氧化处理。从图1 (b) 可以看到烟灰的颗粒粒径在10~50μm之间, 大体分为两类, 一类是粒径较大的灰色硫化钼颗粒, 主要是随尾气带出的钼精矿, 表面伴有少量的氧化钼, 另一类是粒径较小的灰白色颗粒, 能谱显示为钼、硅、钙的氧化物。
表1 烟灰的XRF分析结果Table 1 XRF results of molybdenum fume ash (%, mass fraction) 下载原图
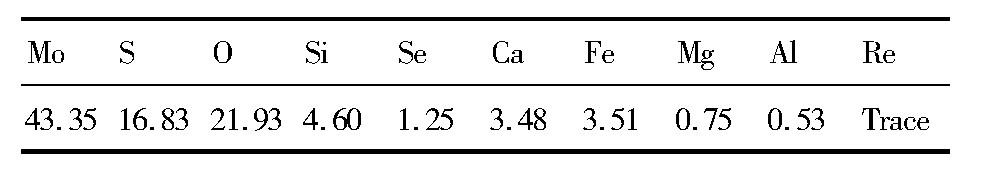
表1 烟灰的XRF分析结果Table 1 XRF results of molybdenum fume ash (%, mass fraction)
图1 烟灰的XRD谱、SEM像和EDS (区域A, B) 分析结果Fig.1 XRD pattern (a) , SEM micrograph (b) of molybdenum fume ash and EDS results of Zone A and B
2.2氧化碱熔工艺的研究
2.2.1硝酸钠与烟灰质量比的影响
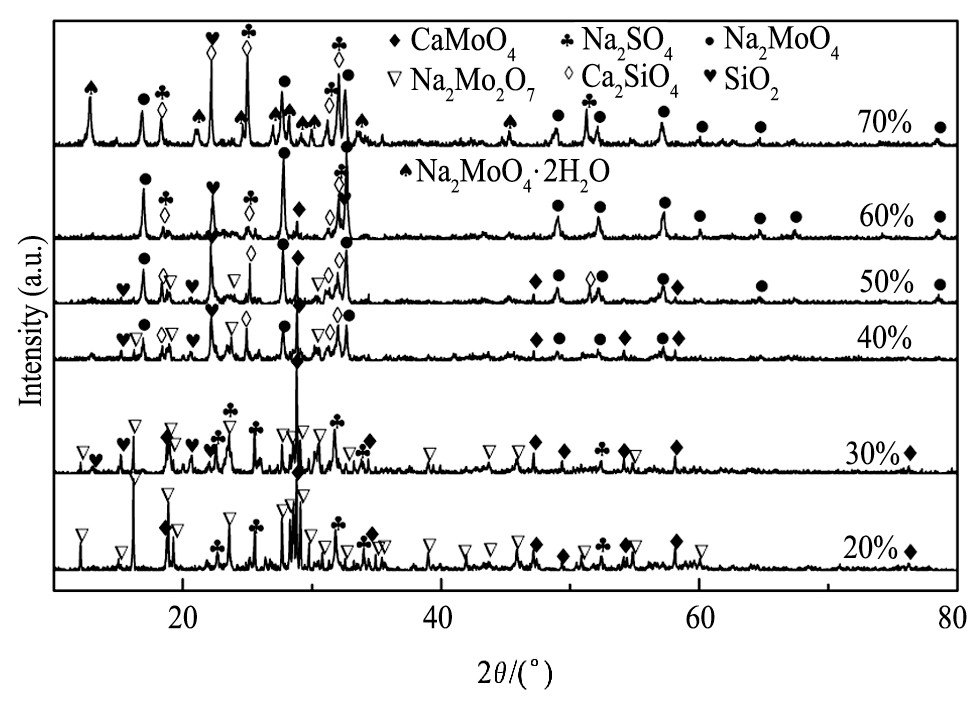
在10.00 g烟灰中分别加入烟灰质量20%, 30%, 40%, 50%, 60%, 70%的硝酸钠, 在碱熔温度700℃, 碱熔时间3 h, 碳酸钠与烟灰质量比为50%的条件下碱熔, 碱熔渣的XRD谱如图2所示。由图2可知, 当硝酸钠加入量较少时钼的生成物主要为Na2Mo2O7, Na2MoO4较少, 其余为SiO2, CaMoO4和Na2SO4, Na2SO4是相对过量的碳酸钠和烟灰碱熔放出的SO2反应的生成物, CaMoO4的生成说明MoO3相较碳酸钠更倾向于同CaO结合。随着硝酸钠加入量的增加, 生成物由Na2Mo2O7向Na2MoO4转变, Na2Mo2O7逐渐减少直至消失, 相应的Na2MoO4逐渐增加, CaMoO4的量也逐渐减少并生成新相Ca2SiO4。当硝酸钠加入量为60%时, 碱熔渣中物相Na2MoO4的峰较其他加入量时最强, 而且Na2SO4峰明显增强, 固硫效果显著, 其他物相为SiO2和Ca2SiO4, 其中Na2SO4为硝酸钠的分解物Na2O和SO2结合的产物, 说明此时硝酸钠已足量。继续增加硝酸钠用量时, Na2MoO4峰减弱, 并有部分Na2MoO4·2H2O生成, 其形成应归因于过量盐类在冷却时吸附空气中的水分[21]。
图2 不同硝酸钠与烟灰质量比碱熔渣的XRD谱Fig.2XRD patterns of alkali fusion slag with different ratios of Na NO3to molybdenum fume ash
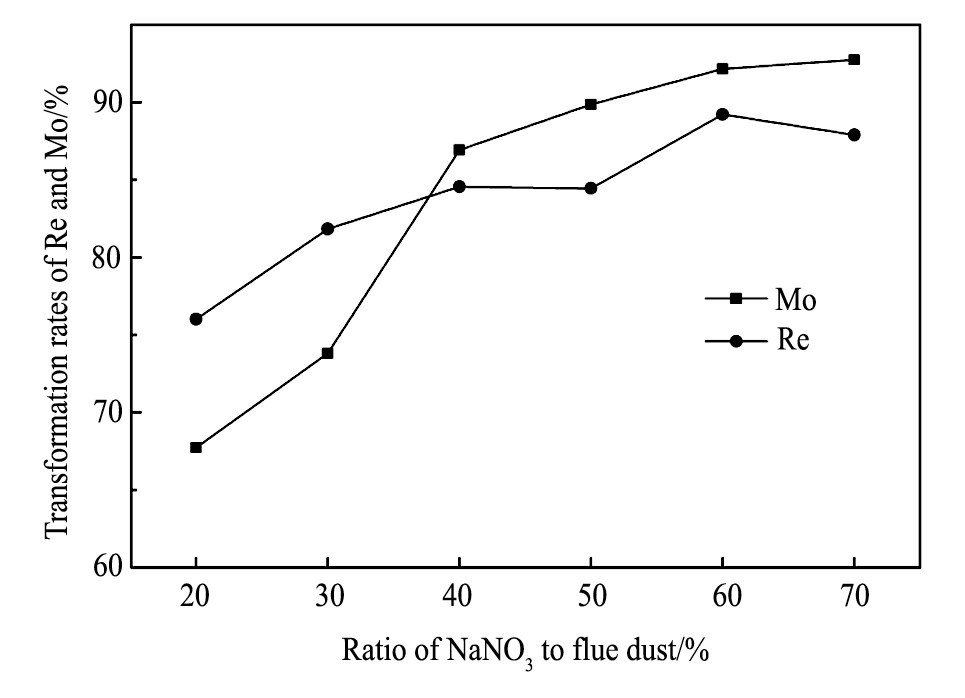
图3是铼、钼转化率和硝酸钠与烟灰质量比的关系图。由图3可知, 随着硝酸钠加入量的增加, 铼和钼的转化率呈现增大趋势, 当硝酸钠加入量是烟灰质量的60%时, 铼和钼的转化率分别达到89.2%和92.1%, 继续增大加入量, 钼的转化率增大不明显, 而铼的转化率则有所降低。这是因为随着硝酸钠加入量的增加, 分解出的氧气量增加, 提高了对烟灰中硫化物的氧化能力[15,22], 但同时也加大了气体对烟灰的搅动力度, 使得沸点低的Re2O7随气体挥发, 造成铼的损失。综上, 硝酸钠加入量为烟灰质量的60%为宜。
2.2.2碳酸钠与烟灰质量比的影响
分别称取10.00 g烟灰, 依次加入烟灰质量20%, 30%, 40%, 50%, 60%, 70%的碳酸钠, 在碱熔温度700℃, 碱熔时间3 h, 硝酸钠与烟灰质量比为60%的条件下碱熔, 碱熔渣的XRD谱如图4所示。从图4可以看出, 当碳酸钠加入量为烟灰质量的20%时, 碱熔渣的主要物相为Na2Mo2O7, CaMoO4和Na2SO4, 因为碳酸钠的不足使得硝酸钠相对过量, 烟灰中的硫化钼全部被氧化生成MoO3, 一部分MoO3同碳酸钠结合生成Na2Mo2O7, 另一部分则与CaO反应生成CaMoO4, 过量的硝酸钠分解产生的Na2O, O2与SO2生成了Na2SO4。随着碳酸钠加入量的增加, Na2Mo2O7逐渐向Na2MoO4转变, 当碳酸钠加入量为40%时, Na2MoO4峰明显强于Na2Mo2O7, 并有新相Ca2SiO4生成。当碳酸钠加入量为60%时, Na2Mo2O7峰和CaMoO4峰基本消失, 除少量的SO2和Ca2SiO4峰外, 其余全部为Na2MoO4和Na2SO4峰, 继续增加到70%时, Na2MoO4峰有所减弱, Ca2SiO4和Na2SO4峰增强, 并生成一部分Na2MoO4·2H2O, 此处Na2SO4峰的增强是叠加了过量的碳酸钠结合SO2的产物。
图3 铼、钼转化率和硝酸钠与烟灰质量比的关系Fig.3Relationship between ratio of Na NO3to molybdenum fume ash and transformation rates of Re and Mo
图4 不同碳酸钠与烟灰质量比碱熔渣的XRD谱Fig.4XRD patterns of alkali fusion slag with different ratios of Na2CO3to molybdenum fume ash
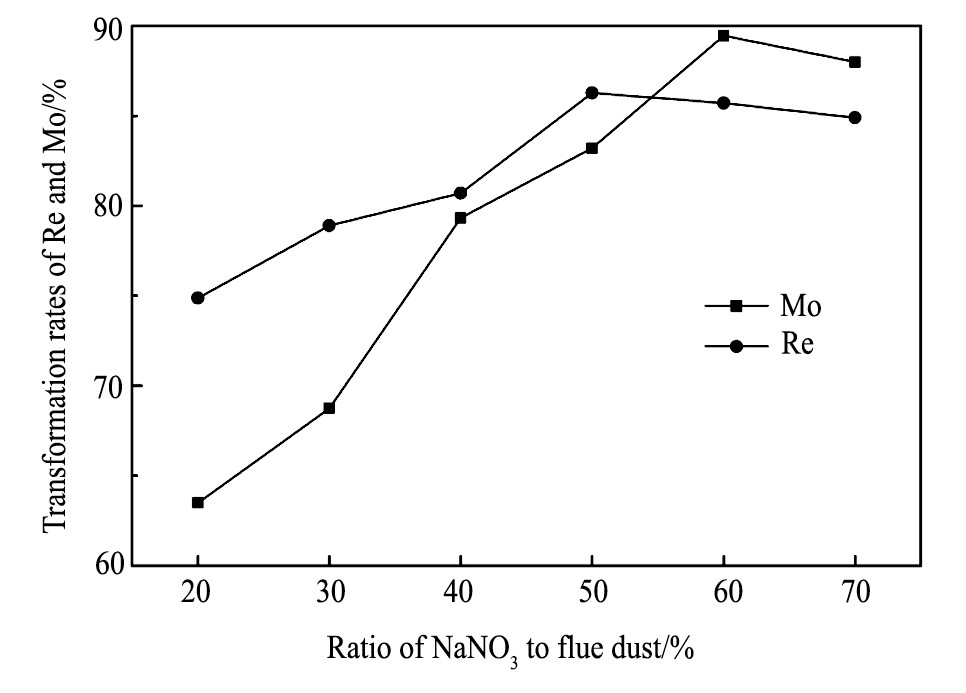
图5是铼、钼转化率和碳酸钠与烟灰质量比的关系图。由图5可知, 随着碳酸钠加入量的增加, 铼和钼的转化率先增大后降低。当碳酸钠加入量较少时, 从图5可以看出碱熔渣中的钼主要以Na2Mo2O7形式存在, 而Na2Mo2O7在水中的溶解度较Na2MoO4低, 从而导致得出的钼转化率较低。当增加碳酸钠加入量时, 钼逐渐向易溶于水的Na2MoO4形式转变, 相应的钼的转化率也逐步增大, 并在60%碳酸钠加入量时达到最大值89.4%, 随后略有降低。铼的转化率在碳酸钠加入量为50%时达到最大值86.2%, 之后缓慢降低, 60%加入量时为85.7%, 但考虑到碳酸钠加入量为50%时钼的转化率只有83.2%, 所以选取60%加入量为宜。加大碳酸钠加入量, 烟灰和碳酸钠接触面积增加, 可以使氧化生成的氧化物与之结合的几率增大[17], 促进铼和钼的转化, 但过量的碳酸钠会增加碱熔渣的量, 进而加大水浸和过滤的处理量, 造成铼和钼的损失, 从而影响铼和钼的转化率。综合以上因素, 碳酸钠加入量选择烟灰质量的60%。
2.2.3碱熔时间的影响
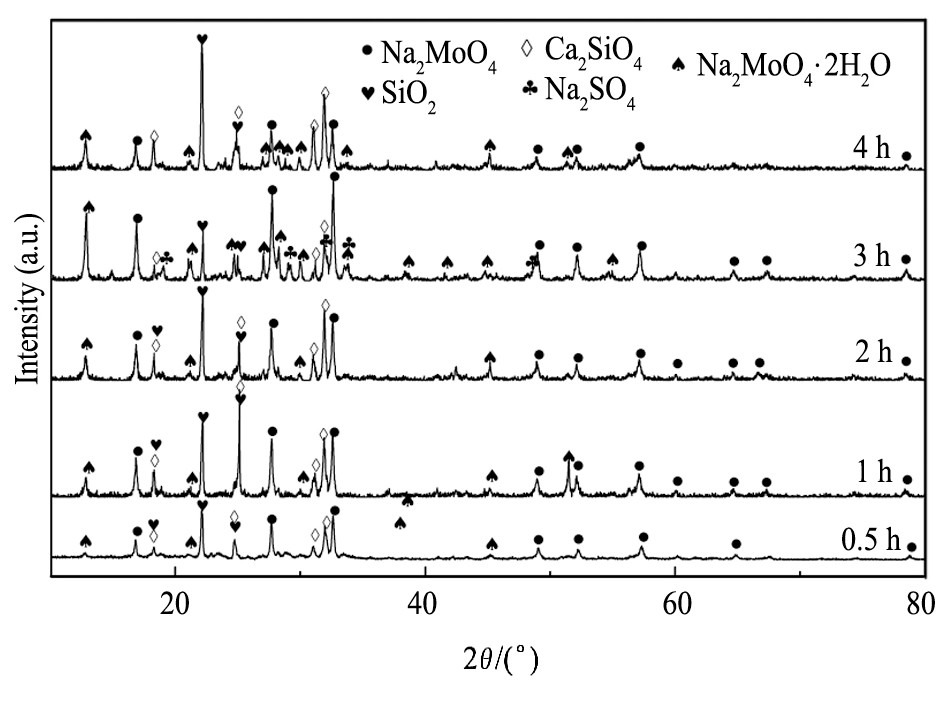
在10.00 g烟灰中分别加入烟灰质量的60%硝酸钠和60%碳酸钠, 在碱熔温度700℃下碱熔, 依次在碱熔0.5, 1.0, 2.0, 3.0, 4.0 h后取出, 碱熔渣的XRD谱如图6所示。总体来看, 碱熔时间对钼的物相变化影响不大, 不同碱熔时间下的物相均为Na2MoO4, SO2, Ca2Si O4和Na2MoO4·2H2O, 其中3 h时出现了较明显的Na2SO4峰。从钼的主要物相来看, Na2MoO4峰随着时间的延长逐步增强, 0.5 h时由于反应时间过短Na2MoO4峰较弱, 1.0 h时明显增强, 说明MoO3和Na2CO3的反应迅速, 在碱熔3 h时Na2MoO4峰达到最强, 并有Na2SO4相生成, 起到了固硫的效果。继续延长碱熔时间时, Na2MoO4的峰大幅减弱, 并生成大量Ca2Si O4相, 说明过长的碱熔时间加大了钼氧化物的挥发损失和促进了硅酸盐的生成。
图5 铼、钼转化率和碳酸钠与烟灰质量比的关系Fig.5Relationship between ratio of Na2CO3to molybdenum fume ash and transformation rates of Re and Mo
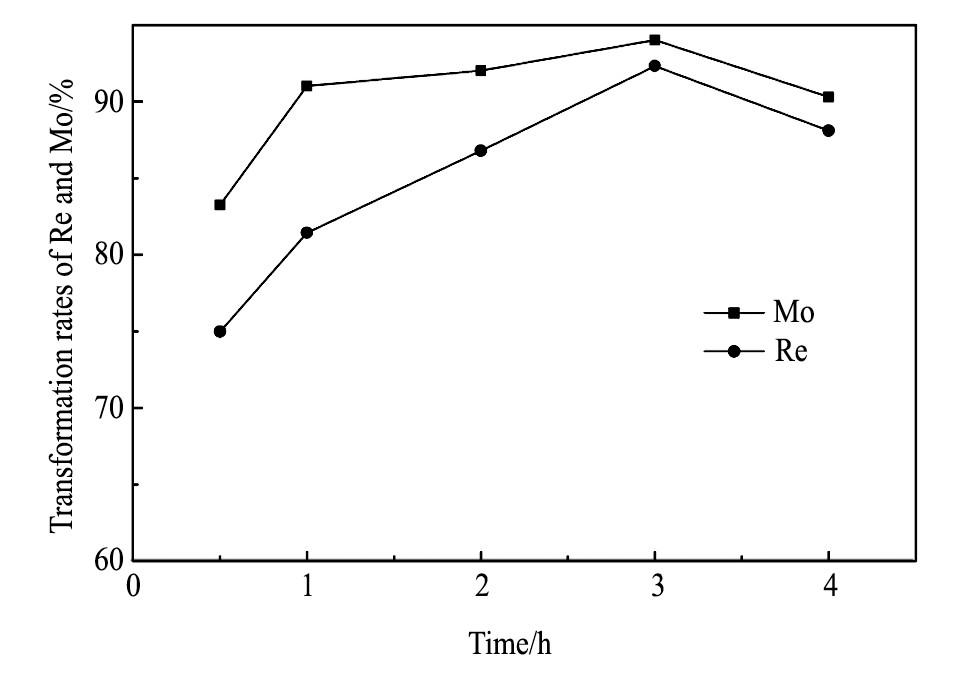
图7为碱熔时间和铼、钼转化率的关系图。从图7可以看到, 随着碱熔时间的不断延长, 钼的转化率总体变化不大, 而铼的转化率呈现先明显增大而后降低的趋势。在碱熔0.5 h时, 铼和钼的转化率分别达到75.0%和83.3%, 可见铼和钼的氧化以及结合碳酸钠的反应很快, 在碱熔3.0 h时铼和钼的转化率均达到最大值, 分别为92.3%和94.0%, 之后有所降低。因为随着时间的延长, 铼和钼的氧化更为充分, 但继续延长碱熔时间会增大物料的挥发损失, 以及生成钼酸钙等不溶的钼酸盐[23], 使得铼和钼的转化率不同程度的降低。另外, 从铼和钼转化率的差别可以推测, 钼优先于铼被氧化, 进而转化为钼酸钠。综上, 适宜的碱熔时间为3.0 h。
图6 不同碱熔时间碱熔渣的XRD谱Fig.6 XRD patterns of alkali fusion slag at different time
图7 铼、钼转化率和碱熔时间的关系Fig.7 Relationship between alkali fusion time and transforma-tion rates of Re and Mo
2.2.4碱熔温度的影响及碱熔过程钼的反应机制
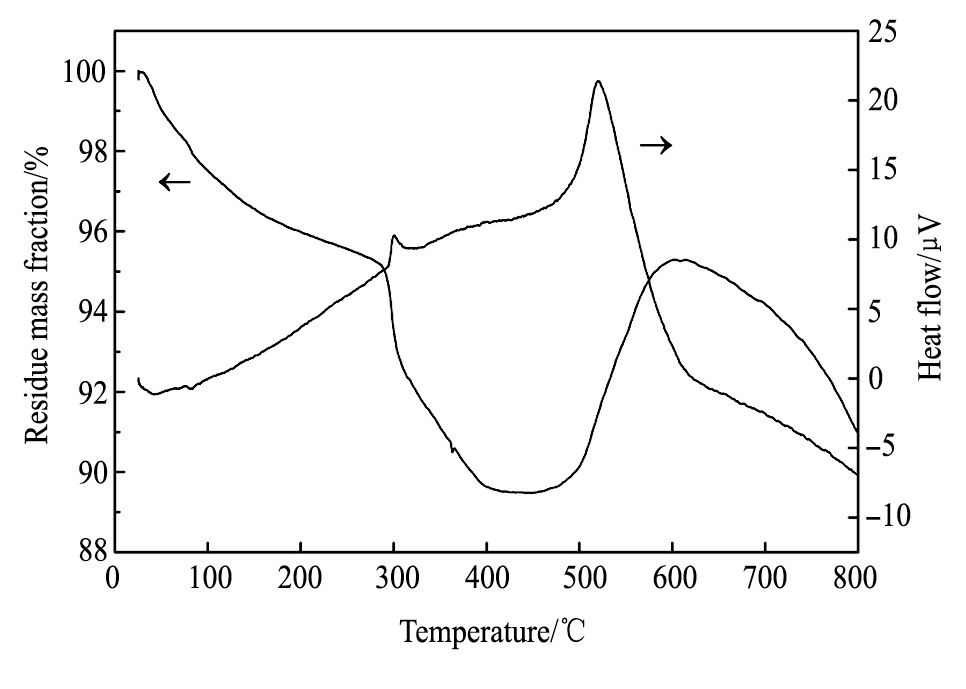
图8是在烟灰中加入其质量60%的硝酸钠和60%的碳酸钠后的DTA-TG曲线, 空气气氛, 初始质量7.8 mg, 升温速率10℃·min-1。从TG曲线可以看到在加热过程中, 400℃之前是一个明显的质量损耗过程, 500℃后质量开始增加, 600℃后再次逐渐减少。DTA曲线上在40和100℃左右出现较小的吸热峰, 在300和520℃左右出现放热峰。
图8 硝酸钠和碳酸钠碱熔烟灰的DTA-TG曲线Fig.8DTA-TG curves of molybdenum fume ash added with Na NO3and Na2CO3
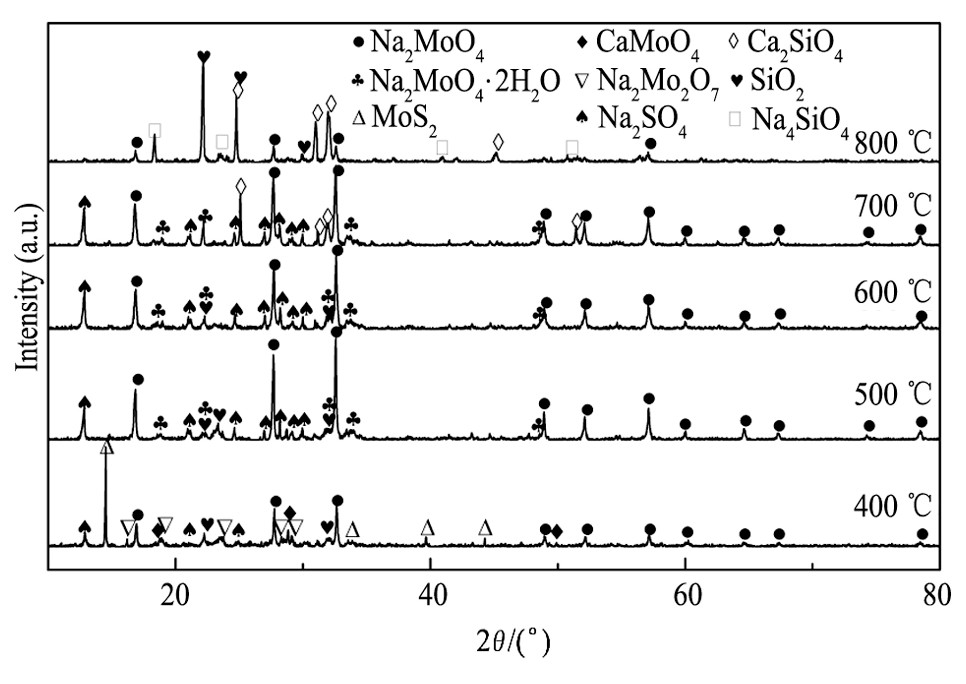
为了考察碱熔温度的影响并分析碱熔过程中的反应机制, 结合DTA-TG曲线分别选择在400, 500, 600, 700和800℃下碱熔实验, 固定条件:硝酸钠和碳酸钠与烟灰的质量比均为60%、碱熔时间3.0 h, 各温度下碱熔渣的XRD谱如图9所示。可见, 在400℃时, 碱熔渣物相为MoS2, Na2MoO4和SiO2, 以及少量的Na2Mo2O7和CaMoO4, 表明此温度下烟灰中的MoO3和碳酸钠已经反应, 但MoS2的峰说明部分钼精矿还没被氧化, CaMoO4的存在说明在此温度下MoO3更倾向于同CaO优先反应[23]。500℃时, 主要物相是Na2MoO4, Na2MoO4·2H2O, Na2SO4和少量的SiO2, 所有的硫化物已被充分氧化并与碳酸钠反应剧烈, 使得Na2MoO4峰大幅增强, 这也证实了DTA曲线图上520℃左右出现的放热峰, 同时Na2SO4峰的出现说明此温度下碳酸钠已和有害气体SO2结合, 而且此反应的吉布斯自由能随着温度的升高而增大[17]。另外, 溶解度小的Na2Mo2O7和难溶于水的CaMoO4峰消失, 这将更有利于钼的浸出, 增大钼的转化率。600℃时, 主要物相和500℃相同, 只是Na2MoO4峰开始减弱, Na2MoO4·2H2O峰有所增强。700℃时, 主要物相为Na2MoO4, Na2MoO4·2H2O, Na2SO4和Ca2Si O4, Na2MoO4峰进一步减弱, SiO2峰消失, 并生成新相Ca2SiO4, 表明在此温度下Si O2倾向于同CaO反应。800℃时, 主要物相为Na2MoO4, Ca2Si O4, Si O2以及少量的Na4Si O4, 相比于700℃, Na2MoO4峰大幅减弱, 说明此温度下钼的挥发损失比较大, 这在一定程度上使得SiO2峰出现以及Ca2SiO4峰进一步增强, 新相Na4SiO4的生成表明此温度下Si O2和硝酸钠分解物Na2O开始反应。总的来说, 随着温度的提高, Na2MoO4峰逐渐减弱, Ca2Si O4峰逐渐增强。可以得出, 温度较低时硫化钼未充分氧化, 且一部分氧化钼与氧化钙反应生成了不溶的钼酸钙, 导致钼的转化率较低, 而温度较高时会造成钼的挥发损失, 使得Na2MoO4的生成量减少, 进而影响钼的转化率。
图9 不同温度碱熔渣的XRD谱Fig.9 XRD patterns of alkali fusion slag at different temperatures
通过以上的分析, 可以得出碱熔过程主要发生的反应如下:
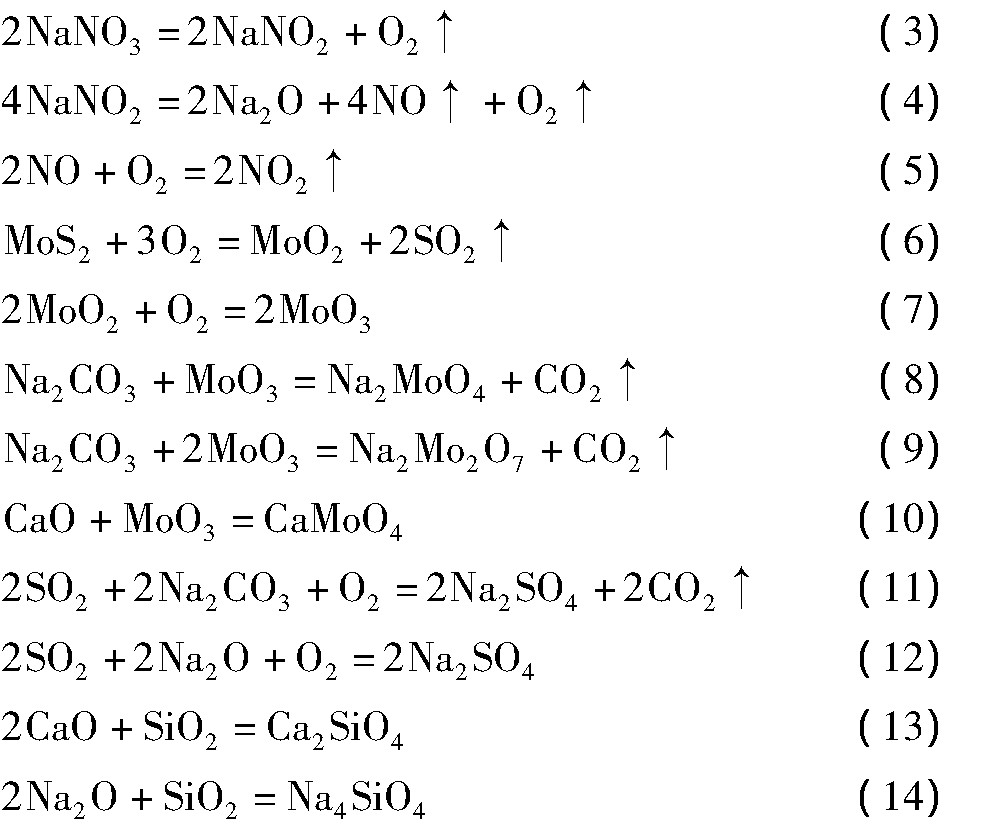
可见, DTA曲线上40和100℃左右的吸热峰为浮选油和水分挥发的吸收热, 300℃左右的放热峰为硝酸钠分解产物的化合反应 (5) , 520℃左右的放热峰为MoO2的氧化反应 (7) 和Na2MoO4的生成反应 (8) 。TG曲线上300℃前主要是物料中的水分和浮选油的挥发损失, 300~400℃间质量快速减少系硝酸钠的分解反应 (3) 和 (4) 以及MoO3和碳酸钠化合反应 (8) 和 (9) 放出二氧化碳所致, 400~500℃间因为温度较低, 主要发生了反应 (6) 和 (7) , 因为反应 (6) 和 (7) 的质量变化为一增一减且反应缓慢, 使得总体质量变化不明显。当继续升高温度, 反应 (7) , (8) 和 (11) , (12) 剧烈进行, 质量快速增加, 而且由于差热分析的热滞后现象[24], TG曲线会向高温方向移动, 在500℃时上述四反应已经进行。600℃以后, 伴随着物料不断的挥发损失, 质量逐渐降低。另外需要说明的是, 由于铼含量太低, 本部分并未提及铼的反应机制和相变行为, 但依据铼和钼的相似性, 可以作为参考。
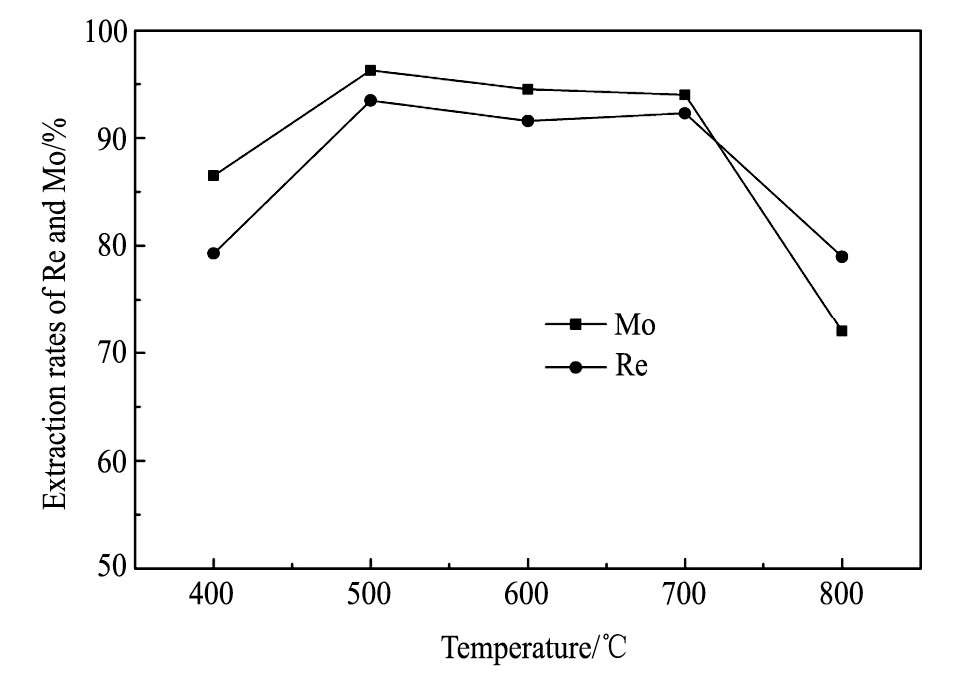
图10是铼、钼转化率和碱熔温度的关系图。由图10可知, 铼和钼的转化率随着温度的升高变化明显, 当温度较低时, 由于硫化物的氧化速率较慢, 成为钼酸钠和高铼酸钠生成反应的控制步骤, 造成铼和钼的转化率较低。当温度升高到500℃时, 铼和钼的转化率快速增大, 分别达到93.5%和96.3%。之后继续提高温度时, 铼和钼的转化率变化不大, 但当温度大于700℃以后, 转化率却快速下降。这是因为随着温度的升高, 硫化物转化为氧化物的速率大大提高, 进而加快了钼酸钠和高铼酸钠的生成反应速率, 但是继续提高温度时, 会因形成共熔物加重烧结现象[25], 进而阻碍转化反应, 再加上表层氧化钼和氧化铼的挥发损失, 造成铼和钼转化率的降低。综上, 合适的碱熔温度为500℃。
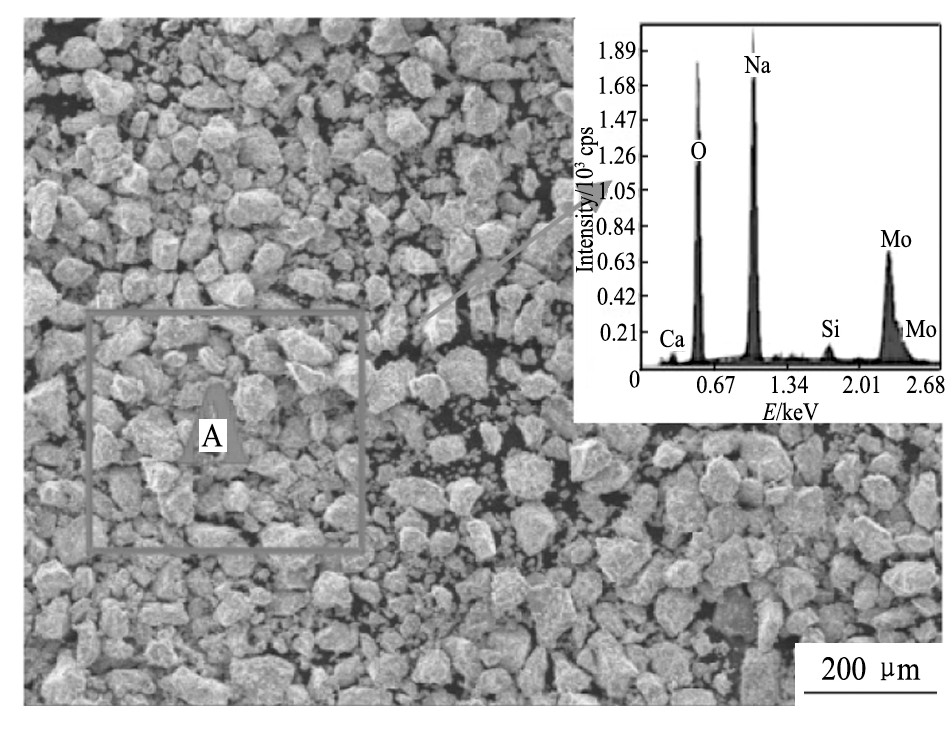
综合以上的结果和分析, 可以得出最佳的碱熔工艺参数是硝酸钠和碳酸钠加入量均为烟灰质量的60%、碱熔温度500℃、碱熔时间3 h, 在此条件下, 铼和钼的转化率分别达到93.5%和96.3%。图11是最佳碱熔工艺参数下的碱熔渣的SEM像和EDS分析结果, 可以看到碱熔渣颗粒均匀, 主要成分为Mo, Na和O。
2.3水浸工艺的研究
2.3.1双氧水浓度的影响
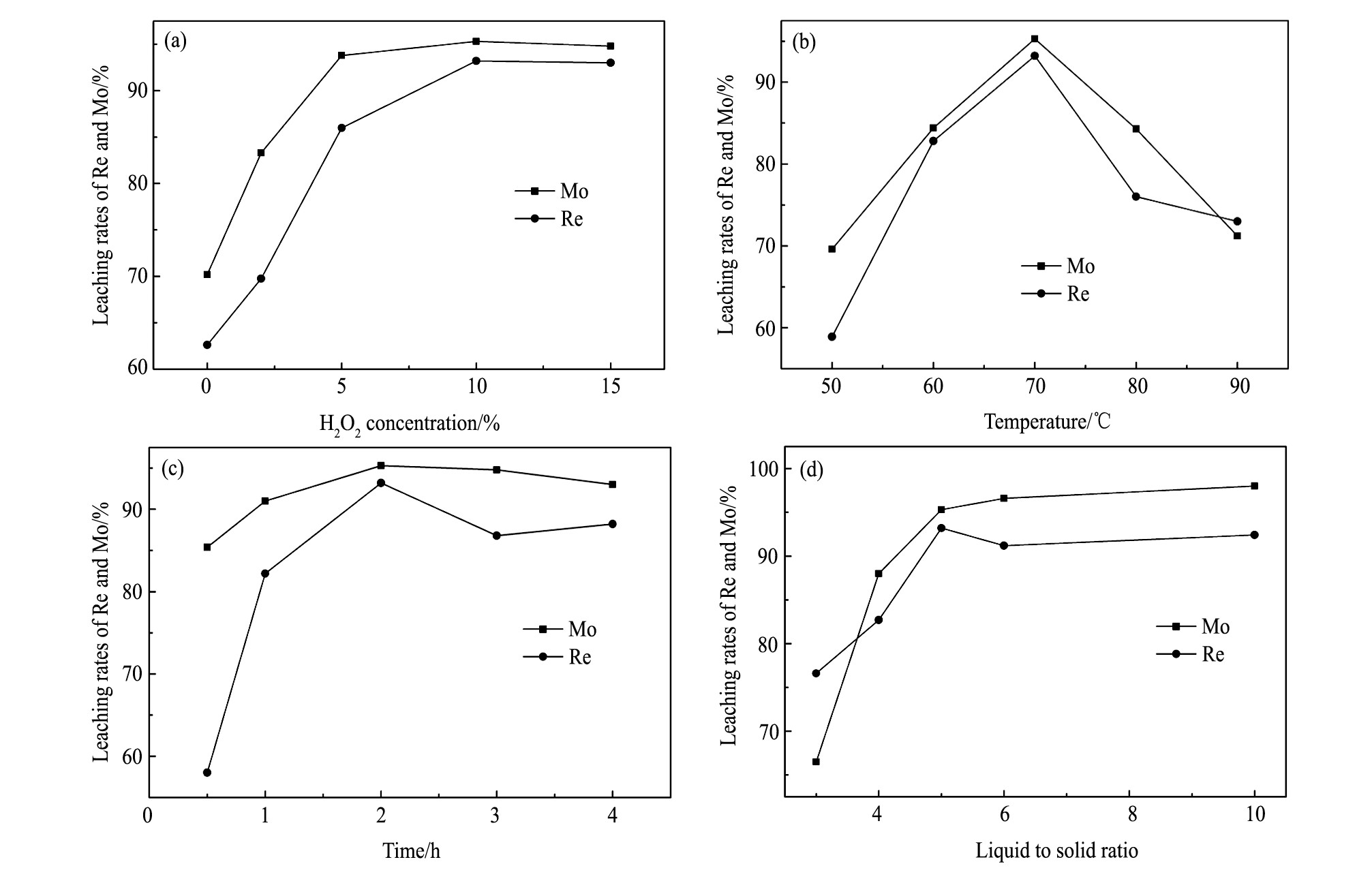
图12 (a) 是浸出温度70℃, 时间2 h, 液固比5/1的条件下双氧水浓度与铼、钼浸出率的关系图。由图12 (a) 可知, 随着双氧水浓度的提高, 铼和钼的浸出率先是不同程度的增大, 而后趋于窄幅波动, 铼和钼的浸出率在10%双氧水浓度时分别达到最大值93.2%和95.3%。因为双氧水具有强氧化性, 其分解的羟基自由基得电子能力很强, 可以将铼和钼的硫化物以及低价的氧化物氧化成可溶的铼酸和钼酸, 而且双氧水提供了弱酸性条件, 增大了钼酸和钼酸钠的溶解度[26], 但是在双氧水足量后继续加大其用量已无意义, 而且会造成浪费。综上, 实验选取10%双氧水浓度。
图1 0 铼、钼转化率和碱熔温度的关系Fig.10Relationship between alkali fusion temperature and transformation rates of Re and Mo
图1 1 碱熔渣的SEM像和EDS分析结果Fig.11 SEM image and EDS result of alkali fusion slag
2.3.2浸出温度的影响
图12 (b) 是双氧水浓度10%, 浸出时间2 h, 液固比5/1的条件下浸出温度与铼、钼浸出率的关系图。由图12 (b) 可知, 随着温度的升高, 铼和钼的浸出率先增大后降低, 并在70℃时达到最大值, 分别为93.2%和95.3%。因为浸出过程是高铼酸钠和钼酸钠溶于水的过程, 并无固体产物生成, 所以在充分搅拌下浸出过程受化学反应控制[27], 提高温度可以增强溶液中分子的活性, 增大液固反应的反应速率, 进而提高浸出率, 但是浸出温度如果过高, 会加速双氧水分解失效, 导致实际双氧水浓度降低。所以, 适宜的浸出温度为70℃。
2.3.3浸出时间的影响
图12 (c) 是双氧水浓度10%, 浸出温度70℃, 液固比5/1的条件下浸出时间与铼、钼浸出率的关系图。由图12 (c) 可知, 随着时间的延长, 铼的浸出率快速上升, 由0.5 h的58.0%到2 h的93.2%, 之后有所降低。相比于铼, 钼的浸出率波动不大, 在0.5 h时已达到85.4%, 这应该是因为碱熔渣中残留的MoS2起到了良好的催化作用, 促进了双氧水的分解, 加速了钼的氧化浸出。综上, 适当延长浸出时间可以使碱熔物料的浸出更为充分, 提高铼和钼的浸出率, 但是时间太长时, 不但增加能耗, 还会使浸出渣变细, 从而加大铼和钼在过滤时的损失, 综上, 适宜的浸出时间为2 h。
图1 2 铼、钼浸出率与双氧水浓度、浸出温度、浸出时间和液固比的关系Fig.12Relationships between H2O2concentration (a) , leaching temperature (b) , leaching time (c) , and liquid-solid ratio (d) and leaching rates of Re and Mo
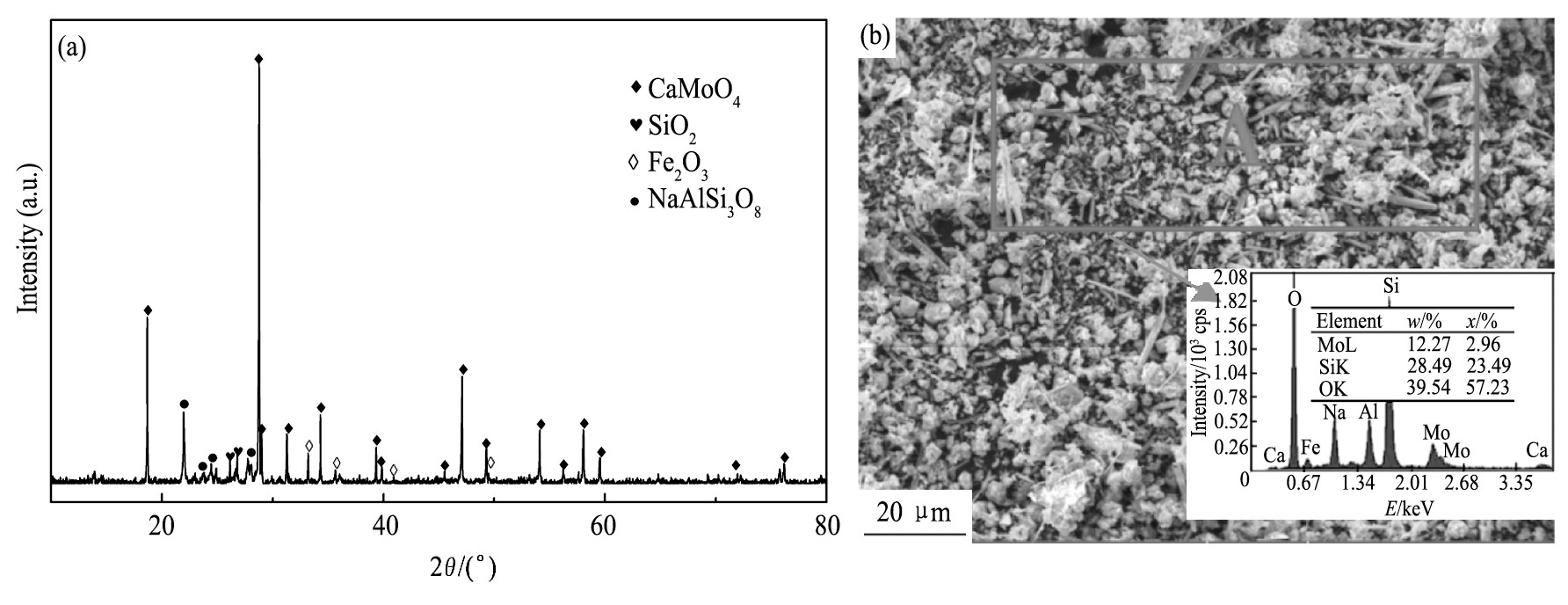
图1 3 浸出渣的XRD谱 (a) 、SEM像和EDS分析结果 (b) Fig.13 XRD pattern (a) , SEM image and EDS result (b) of leaching residue
2.3.4浸出液固比的影响
图12 (d) 是双氧水浓度10%、浸出温度70℃、时间2 h的条件下液固比与铼、钼浸出率的关系图。由图12 (d) 可知, 铼和钼的浸出率先是随着液固比的增大而增大, 之后呈现高位震荡。液固比较小时, 碱熔渣与液体接触面积小, 造成浸出反应不充分, 再加上钼酸的溶解度较低, 使得铼和钼的浸出率较低。当液固比增大到一定程度后, 能溶解的铼和钼已基本浸出完全, 继续增大液固比已没有意义, 而且会加大过滤处理量[13], 不利于铼和钼的回收。所以合适的液固比为5∶1。
2.3.5浸出渣的表征
图13是在最佳水浸工艺参数下浸出所得浸出渣的XRD谱、SEM像和EDS分析结果。从中可以看出, 浸出渣的主要物相为CaMoO4, Fe2O3, SiO2 (石英) 和NaAlSi3O6 (钠长石) , 浸出渣颗粒粒径范围较大, 主要包括长条状的石英和块状的钠长石。
3结论
1.烟灰中含有MoO2和MoO3, 以及少量的石英SiO2和石灰CaO, 但含量最多的是钼的硫化物MoS2, 所以要想实现铼和钼高的转化率, 需要氧化碱熔。
2.合适的碱熔条件为硝酸钠和碳酸钠加入量均为烟灰质量的60%, 碱熔时间3 h、碱熔温度500℃, 铼和钼的转化率分别达到93.5%和96.3%。
3.碱熔温度较低时MoS2未充分氧化, 且一部分氧化钼与氧化钙反应生成了不溶的钼酸钙, 而温度较高时会加大钼的挥发损失, 造成Na2MoO4的生成量减少。
4.合适的水浸工艺参数是双氧水浓度10%、浸出温度70℃、浸出时间2 h、液固比5∶1, 铼和钼的浸出率分别达到93.2%和95.3%。
参考文献