Li-Fe-Si-H2O体系的热力学分析
张有新,曹才放,刘旭恒,赵中伟
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘 要:根据已有热力学数据,绘制25℃时Li-Fe-Si-H2O体系各溶解组分的lgc-pH图、Li-Fe-Si-H2O体系主要物种的优势区图和强碱性区域Li-Fe-Si-H2O体系各沉淀的优势区图。利用这些平衡图对液相制备硅酸铁锂的工艺条件进行热力学分析。研究结果表明:控制溶液的碱度是制备磷酸铁锂前驱体Li2H2SiO4·Fe(OH)2的关键因素,若要利用Li+,Fe2+和![]() 在液相形成Li2H2SiO4·Fe(OH)2,则要维持溶液较高的碱度,使得Li+能与
在液相形成Li2H2SiO4·Fe(OH)2,则要维持溶液较高的碱度,使得Li+能与![]() 生成Li2H2SiO4沉淀,并且抑制FeH2SiO4的生成,使Fe2+以Fe(OH)2的形式沉淀;溶液体系的碱性越强,Li2H2SiO4·Fe(OH)2的优势区域越宽,更有利于Li2H2SiO4·Fe(OH)2的合成;采用液相法制备硅酸铁锂时,由于pH值大于15,体系的碱度较高,溶液中Fe2+极容易被氧化,故制备过程难以实现;而利用固相法制备硅酸铁锂,其保护性气氛容易控制,工艺简单,流程短,便于实现。
生成Li2H2SiO4沉淀,并且抑制FeH2SiO4的生成,使Fe2+以Fe(OH)2的形式沉淀;溶液体系的碱性越强,Li2H2SiO4·Fe(OH)2的优势区域越宽,更有利于Li2H2SiO4·Fe(OH)2的合成;采用液相法制备硅酸铁锂时,由于pH值大于15,体系的碱度较高,溶液中Fe2+极容易被氧化,故制备过程难以实现;而利用固相法制备硅酸铁锂,其保护性气氛容易控制,工艺简单,流程短,便于实现。
关键词:
Li-Fe-Si-H2O体系;硅酸铁锂;热力学;Li2H2SiO4·Fe(OH)2;
中图分类号:TQ021.2 文献标志码:A 文章编号:1672-7207(2010)02-0428-06
Thermodynamic analysis of Li-Fe-Si-H2O system
ZHANG You-xin, CAO Cai-fang, LIU Xu-heng, ZHAO Zhong-wei
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: Based on thermodynamic data, lgc-pH diagrams of various species and predominance diagram of main compositions and various precipitations in alkalescence region were presented in Li-Fe-Si-H2O system at 25℃. The thermodynamic equilibrium diagram of Li-Fe-Si-H2O system was used to investigate the process conditions of preparing Li2FeSiO4 by liquid phase method. The results show that controlling alkalinity of solution is the key factor of preparing the precursor of Li2H2SiO4·Fe(OH)2; the precursor of Li2H2SiO4·Fe(OH)2 can be prepared by controlling the concentration of ![]() , Fe2+ and Li+ in alkalescence system. Under this condition, Li+ can react with
, Fe2+ and Li+ in alkalescence system. Under this condition, Li+ can react with ![]() to form Li2H2SiO4 precipitation and the formation of FeH2SiO4 can be restrained, and Fe2+ is deposited in the form of Fe(OH)2. The stronger the alkaline of system, the wider the predominance diagram of Li2H2SiO4·Fe(OH)2, which is beneficial to the synthesis of Li2H2SiO4·Fe(OH)2 precursor. When the pH value is more than 15, Fe2+ in the Li2FeSiO4 solution is very easily oxidized with liquid phase method, and it is difficult to achieve the preparing process. But it is easy to prepare Li2FeSiO4 with solid state method, and is easy to control its protective atmosphere.
to form Li2H2SiO4 precipitation and the formation of FeH2SiO4 can be restrained, and Fe2+ is deposited in the form of Fe(OH)2. The stronger the alkaline of system, the wider the predominance diagram of Li2H2SiO4·Fe(OH)2, which is beneficial to the synthesis of Li2H2SiO4·Fe(OH)2 precursor. When the pH value is more than 15, Fe2+ in the Li2FeSiO4 solution is very easily oxidized with liquid phase method, and it is difficult to achieve the preparing process. But it is easy to prepare Li2FeSiO4 with solid state method, and is easy to control its protective atmosphere.
Key words: Li-Fe-Si-H2O system; Li2FeSiO4; thermodynamics; Li2H2SiO4·Fe(OH)2
橄榄石型LiFePO4正极材料具有原料丰富、价廉、无毒、环境友好、理论比容量高(170 mA·h/g),与其他锂离子电池正极材料相比,它的工作电压适中(Li/Li+为3.45 V),充放电电压变化平缓,循环性能、高温性能和安全性能优良等优点[1-6],顺应了锂离子电池的发展,成为近年来研究和开发的热点。由于Li2FeSiO4 的成功开发与应用,人们开始对Li-Fe-Si-O系进行研究。Fe-Si-O系在自然界大量存在,具有成本低、无毒、环境友好等特点。目前,对Li2FeSiO4研究的相关报道较少,主要制备方法是高温固相法[7]、水热法[8]、溶胶凝胶-高温固相合成[9-10]。高温固相合成具有工艺简单、容易实现工业化等优点,但是,产品粒度大、粒度分布较宽,需要长时间高温处理。采用液相合成法,反应物可以实现均一混合,合成产物的粒度小、粒度和形貌可控、粒度分布窄,可以在低温下完成反应。本文作者对锂、铁、硅等在水溶液中的化学特性进行热力学分析, 绘制Li-Fe-Si-H2O体系溶解组分的lgc-pH图(25 ℃时)、Li-Fe-Si-H2O体系主要物种的优势区图(25 ℃时)以及强碱性区域Li-Fe-Si-H2O体系各沉淀的优势区图(25 ℃),并对合成Li2FeSiO4的可行性进行简单分析,以期为进一步研究Li2FeSiO4提供一定的理论指导。
1 溶解组分lgc-pH图的绘制
在水溶液中,正硅酸根![]() 不能稳定存在,而是结合H+以
不能稳定存在,而是结合H+以![]() ,
,![]() 和H4SiO4(aq)形态存 在[11-12],故在水溶液中直接合成Li2FeSiO4沉淀比较困难,得到的产物通常是其前驱物。Li2FeSiO4·nH2O为复杂硅酸盐,根据温元凯等[13]计算复杂含氧酸盐生成自由能的主体思想,复杂硅酸盐可以看作是酸性氧化物、碱性氧化物和水的复合物,碱性最强的氧化物优先结合酸性最强的氧化物而形成含氧酸盐,然后,与酸性稍弱的氧化物复合,有时与水复合成氢氧化物或水合分子。因此,当Li2FeSiO4·nH2O中n取2时,分子式可变换为Li2H2SiO4·Fe(OH)2形式。此时,硅酸铁锂就可以看作是Li2H2SiO4和Fe(OH)2的复合物;同理,正硅酸亚铁Fe2SiO4·2H2O可以看作是FeH2SiO4和Fe(OH)2的复合物,Li2H2SiO4可看作是Li2O,SiO2和H2O的复合物,FeH2SiO4则可看作是FeO,SiO2和H2O的复合物,具体的替代组合过程如图1所示。
和H4SiO4(aq)形态存 在[11-12],故在水溶液中直接合成Li2FeSiO4沉淀比较困难,得到的产物通常是其前驱物。Li2FeSiO4·nH2O为复杂硅酸盐,根据温元凯等[13]计算复杂含氧酸盐生成自由能的主体思想,复杂硅酸盐可以看作是酸性氧化物、碱性氧化物和水的复合物,碱性最强的氧化物优先结合酸性最强的氧化物而形成含氧酸盐,然后,与酸性稍弱的氧化物复合,有时与水复合成氢氧化物或水合分子。因此,当Li2FeSiO4·nH2O中n取2时,分子式可变换为Li2H2SiO4·Fe(OH)2形式。此时,硅酸铁锂就可以看作是Li2H2SiO4和Fe(OH)2的复合物;同理,正硅酸亚铁Fe2SiO4·2H2O可以看作是FeH2SiO4和Fe(OH)2的复合物,Li2H2SiO4可看作是Li2O,SiO2和H2O的复合物,FeH2SiO4则可看作是FeO,SiO2和H2O的复合物,具体的替代组合过程如图1所示。
Li2H2SiO4·Fe(OH)2,FeH2SiO4·Fe(OH)2,Li2H2SiO4和FeH2SiO4的生成自由能的生成自由能分别满足式(1)~(4):

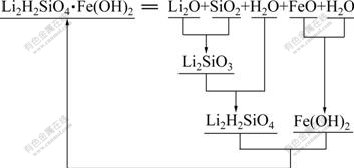
图1 复杂硅酸盐Li2H2SiO4·Fe(OH)2的生成方式
Fig.1 Formation reaction of complicate silicate Li2H2SiO4·Fe(OH)2
其中:![]() ,
,![]() ,
,![]() 和
和![]() 为复合能或水合能。根据温元凯等[13-14]的计算经验,与酸性氧化物和碱性氧化物的化合能相比,复盐的复合能或水合盐的水合能较小,可忽略不计,故
为复合能或水合能。根据温元凯等[13-14]的计算经验,与酸性氧化物和碱性氧化物的化合能相比,复盐的复合能或水合盐的水合能较小,可忽略不计,故![]() ,
,![]() ,
,![]() 和
和![]() 均可取作0。Li2SiO3,FeSiO3和H2O等物质的
均可取作0。Li2SiO3,FeSiO3和H2O等物质的![]() 可从有关数据手册中查到,本文所选取的
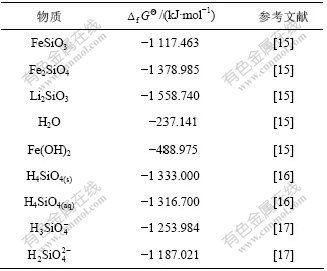
可从有关数据手册中查到,本文所选取的![]() 数据见表1。
数据见表1。
表1 Li-Fe-Si-H2O体系部分物种的热力学数据
Table 1 Thermodynamic data of some species in Li-Fe-Si-H2O system
利用表1中数据,通过公式(2)~(4)可求得Li2H2SiO4,FeH2SiO4和FeH2SiO4·Fe(OH)2的![]() 分别为-1 795.881,-1 354.604和-1 853.267 kJ/mol。
分别为-1 795.881,-1 354.604和-1 853.267 kJ/mol。
沉淀物的溶度积可通过溶解平衡反应的自由能变化![]() 求得,公式如下:
求得,公式如下:
![]()
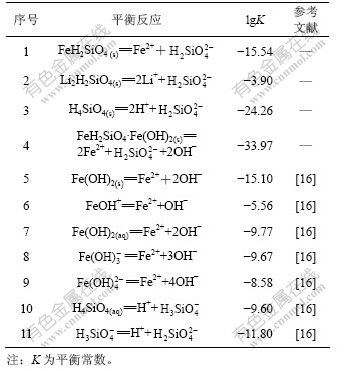
其中:R为8.3145 J/(mol·K);T为热力学温度,取298.15 K。利用表1的数据,可求得FeH2SiO4,Li2H2SiO4,FeH2SiO4·Fe(OH)2和H4SiO4的pKsp分别为15.54,3.90,33.97和24.23。Li-Fe-Si-H2O体系所涉及的平衡反应及其平衡常数见表2。在缺少有关离子活度系数的情况下,下面计算均以浓度代替活度。
表2 25 ℃时Li-Fe-Si-H2O体系的平衡反应及其平衡常数
Table 2 Equilibrium reactions and constants for Li-Fe-Si-H2O system at 25 ℃
溶液中游离Li,Fe和Si的存在形态有Li+,Fe2+,FeOH+,Fe(OH)2(aq),![]() ,
,![]() ,
,![]() ,
,![]() 和H4SiO4(aq),由平衡关系式(6)~(11)可知,它们的平衡浓度满足以下方程:
和H4SiO4(aq),由平衡关系式(6)~(11)可知,它们的平衡浓度满足以下方程:
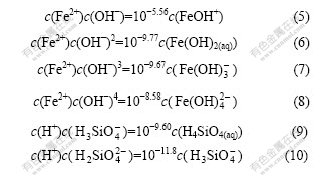
体系内可能存在的固体有FeH2SiO4,Li2H2SiO4,H4SiO4,Fe(OH)2和FeH2SiO4·Fe(OH)2,由平衡关系式(1)~(5)可知,某一固体存在时,与之相关的游离组分应满足其溶度积限定的平衡浓度:
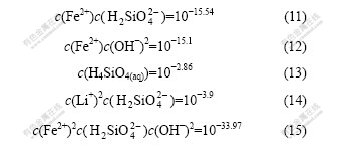
由表1数据可得,FeH2SiO4和Fe(OH)2生成FeH2SiO4·Fe(OH)2的![]() 为负,说明Fe(OH)2存在时,FeH2SiO4容易与之反应生成FeH2SiO4·Fe(OH)2。经过计算,在pH>6.5的中性至碱性区域内,FeH2SiO4·Fe(OH)2比FeH2SiO4稳定;pH=5.8~6.5时,FeH2SiO4能稳定存在;pH<5.8时,FeH2SiO4结合H+ 生成H4SiO4。
为负,说明Fe(OH)2存在时,FeH2SiO4容易与之反应生成FeH2SiO4·Fe(OH)2。经过计算,在pH>6.5的中性至碱性区域内,FeH2SiO4·Fe(OH)2比FeH2SiO4稳定;pH=5.8~6.5时,FeH2SiO4能稳定存在;pH<5.8时,FeH2SiO4结合H+ 生成H4SiO4。
由于Li2H2SiO4在碱性条件下容易生成,根据式(5)~(15),计算了pH>7时Fe-Si-H2O体系各溶解组分的lgc-pH图,然后,根据该体系![]() 浓度以及Li2H2SiO4的溶度积,计算Fe-Si-H2O体系中能生成Li2H2SiO4的Li+平衡浓度线,结果如图2所示。在图2的基础上绘制Li-Fe-Si-H2O体系主要物种的优势区图以及强碱性区域各沉淀的优势区图(25 ℃),分别如图3和图4所示。
浓度以及Li2H2SiO4的溶度积,计算Fe-Si-H2O体系中能生成Li2H2SiO4的Li+平衡浓度线,结果如图2所示。在图2的基础上绘制Li-Fe-Si-H2O体系主要物种的优势区图以及强碱性区域各沉淀的优势区图(25 ℃),分别如图3和图4所示。
从图3可知:FeH2SiO4·Fe(OH)2在中性至碱性范围内稳定存在,在强碱性条件下能分解为Fe(OH)2(s)。而Li2H2SiO4(s)仅在碱性较强、![]() 浓度较高的情况下生成,其优势区在图3中右上角虚线以上部分。
浓度较高的情况下生成,其优势区在图3中右上角虚线以上部分。
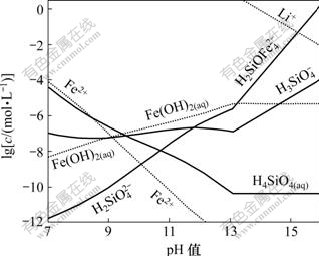
图2 25 ℃时Fe-Si-H2O体系溶解组分的lgc-pH图
Fig.2 lgc-pH diagram for Fe-Si-H2O system at 25 ℃
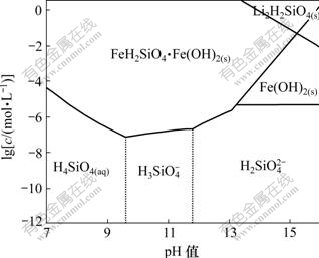
图3 25 ℃时Li-Fe-Si-H2O体系主要物种的优势区图
Fig.3 Predominance area phases diagram for Li-Fe-Si-H2O system at 25 ℃
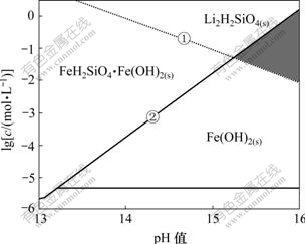
图4 25 ℃时强碱性区域Li-Fe-Si-H2O体系各沉淀的
优势区图
Fig.4 Predominance area phases diagram for Li-Fe-Si-H2O system in strong alkaline solutions at 25 ℃
根据公式(1),如果忽略复盐的复合能,![]() 取值为0,则Li2H2SiO4·Fe(OH)2的优势区即为Li2H2SiO4和Fe(OH)2 2个沉淀优势区的重合部分。因此,如果要利用Li+,Fe2+和
取值为0,则Li2H2SiO4·Fe(OH)2的优势区即为Li2H2SiO4和Fe(OH)2 2个沉淀优势区的重合部分。因此,如果要利用Li+,Fe2+和![]() 在液相形成Li2H2SiO4·Fe(OH)2,关键是要控制适当条件,使得Li+能与
在液相形成Li2H2SiO4·Fe(OH)2,关键是要控制适当条件,使得Li+能与![]() 生成Li2H2SiO4沉淀,并且提高碱度,抑制FeH2SiO4的生成,使Fe2+以Fe(OH)2的形式沉淀。结合图4可知:要在溶液中生成Li2H2SiO4·Fe(OH)2,
生成Li2H2SiO4沉淀,并且提高碱度,抑制FeH2SiO4的生成,使Fe2+以Fe(OH)2的形式沉淀。结合图4可知:要在溶液中生成Li2H2SiO4·Fe(OH)2,![]() 浓度应低于生成FeH2SiO4(s)的平衡浓度线①,Li+应高于生成Li2H2SiO4(s)的平衡浓度线②,而溶液应控制在强碱性范围内。碱性越强,Li2H2SiO4·Fe(OH)2的优势区域越宽。
浓度应低于生成FeH2SiO4(s)的平衡浓度线①,Li+应高于生成Li2H2SiO4(s)的平衡浓度线②,而溶液应控制在强碱性范围内。碱性越强,Li2H2SiO4·Fe(OH)2的优势区域越宽。
2 分析与讨论
通过对Li-Fe-Si-H2O体系的热力学分析可知:若要在水溶液中合成硅酸铁锂的前驱物,则必须保证较强的碱性。通常硅源采用正硅酸、偏硅酸、胶态化的二氧化硅,再采用可溶性的二价铁源,氢氧化锂为原料来制备硅酸铁锂。由于晶化所得的产物结晶程度不是很好或者只形成1种共沉淀形态的混合物,因此,通常需后续的高温煅烧才能得到晶型完整的硅酸铁锂,大多数液相法合成粉体材料时往往都需要高温煅烧过程。例如,Dominko等[8]以胶态化的二氧化硅、氯化亚铁、氢氧化锂为原料,在不锈钢高压釜中于150 ℃保温14 d,制备出灰绿色粉末,将粉末在700 ℃煅烧得到了硅酸铁锂。当pH值大于15时,溶液中的Fe2+极容易被氧化,即使采取措施控制沉淀过程的还原性氛围,也很难控制Fe2+在后续过滤洗涤的阶段不被 氧化。
目前,已报道制备硅酸铁锂的方法主要为固相合成法。与液相合成法类似,固相法仍然需要保证较高的碱度。固相法往往可采用乙酸亚铁、草酸亚铁和氧化亚铁为铁源,以乙酸锂、草酸锂、碳酸锂和氢氧化锂为锂源。在固相合成过程中,铁或锂的草酸盐、乙酸盐和碳酸盐在高温下分解为碱性的氧化亚铁或氧化锂,固相碱度随着酸性气体CO2的挥发而逐步增加。因此,固相法仍然是在碱性较高的还原性氛围下进行。固相法制备硅酸铁锂,其保护性气氛容易控制,工艺简单,流程短,便于制备。对于固/固反应,其反应速率比液相反应或者液/固反应进行得更慢;因此,研究者们通过不同的手段来强化反应,以提高反应速率。机械化学法在强化过程方面有很强的优势。机械化学法主要是将机械能转化为化学驱动力,提高反应体系的自由能,使反应物质发生化学变化或物理变化,从而加快反应速度或者降低反应所需的条件。Armand等[18]以FeO和Li2SiO3作为原料,球磨后在800 ℃烧结4 h得到硅酸铁锂。Nyten等[7]采用FeC2O4?H2O和Li2SiO3为原料,在球磨过程中加入10%的碳凝胶,在CO/CO2气氛中于750 ℃烧结24 h,合成了Li2FeSiO4材料,在60 ℃进行充放电,首次充电比容量为165 mA?h/g(理论容量的99%),首次放电比容量为140 mA?h/g(理论容量的84%)。Zaghib等[19]采用FeC2O4?H2O和Li2SiO3为原料,球磨后在800 ℃烧结12 h得到了Li2FeSiO4材料。X线衍射分析结果表明:该材料为单一相结构,平均微晶粒尺寸为78 nm。
还有研究人员采用溶胶凝胶法制备前驱物,然后在高温下煅烧前驱物而制备得硅酸铁锂。在这种方法中,溶胶凝胶过程主要是为了获得胶态化二氧化硅,与锂源、铁源混合更均匀;而后续的烧结过程与高温固相合成相类似,随着前驱物的分解,酸性气体不断移除,固相碱度逐步升高至强碱性。Gong等[10]通过乙酸锰、乙酸锂、草酸亚铁和正硅酸乙酯与蔗糖一起球磨混合,球磨后在氮气保护下于600 ℃烧结10 h得到Li2MnFeSiO4材料,放电比容量为214 mA?h/g(理论容量的86%)。Gong等[20]将乙酸锂、草酸亚铁盐和正硅酸乙酯在水和乙醇体系中反应24 h,再蒸发乙醇得到前驱体,在前驱体中加入蔗糖,并通过高温煅烧得到Li2MnFeSiO4/C材料。杨勇[21]提出Li2MSiO4 (M= Mn1-xFex)作为可充锂电池正极材料的制备方法,制备时将锂盐、锰盐、亚铁盐和正硅酸乙酯在水和乙醇体系中混合,加热后烘干并通过高温煅烧得到硅酸铁锰锂材料。
结合上述热力学分析,本文作者在合成Li2FeSiO4方面进行了初步探索。试验的具体过程是:将氢氧化锂、草酸亚铁、二氧化硅按物质的量比2?1?1混合,在无水乙醇介质中抽真空进行球磨2 h,球磨后的前驱体转移至管式炉中,在高纯氮气的保护下于750 ℃烧结15 h,随炉冷却至室温,研磨得到Li2FeSiO4材料。Li2FeSiO4样品的衍射峰与Nyten等[7-9]报道的结果 一致。
3 结论
(1) 根据已有的热力学数据,绘制出25 ℃时Li-Fe-Si-H2O体系溶解组分的lgc-pH图,Li-Fe-Si-H2O体系主要物种的优势区图,强碱性区域Li-Fe-Si-H2O体系各沉淀的优势区图。
(2) 在强碱性体系,通过控制![]() 和Li+的浓度,可以制备出Li2H2SiO4·Fe(OH)2前驱体,且体系的碱性越强,Li2H2SiO4·Fe(OH)2的优势区域越宽,这更有利于合成出Li2H2SiO4·Fe(OH)2前驱体。
和Li+的浓度,可以制备出Li2H2SiO4·Fe(OH)2前驱体,且体系的碱性越强,Li2H2SiO4·Fe(OH)2的优势区域越宽,这更有利于合成出Li2H2SiO4·Fe(OH)2前驱体。
(3) 从热力学理论对液相法制备硅酸铁锂进行了分析。采用固相法制备硅酸铁锂,其保护性气氛容易控制,工艺简单,流程短,便于制备。
参考文献:
[1] Andersson A S, Thomas J O, Kalska B, et al. Thermal stability of LiFePO4-based cathodes[J]. Electrochemical and Solid-state Letters, 2000, 3(2): 66-68.
[2] Paolo P P, Maria C, Silvera S, et al. A new synthetic route for preparing LiMnPO4 with enhanced electrochemical performance[J]. J Electro Chem Soc, 2002, 149(7): A886-890.
[3] Zhao H C, Dahn J R. Reducing carbon in LiFePO4/C composite electrodes to maximize specific energy, volumetric energy, and tap density[J]. J Electrochem Soc, 2002, 149(9): A1184-A1189.
[4] 赵中伟, 刘旭恒. Li-Fe-P-H2O系热力学分析[J]. 中国有色金属学报, 2006, 16(7): 1257-1263.
ZHAO Zhong-wei, LIU Xu-heng. Thermodynamic analysis of Li-Fe-P-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(7): 1257-1263.
[5] 张宝, 罗文斌, 李新海, 等. LiFePO4/C锂离子电池正极材料的电化学性能[J]. 中国有色金属学报, 2005, 15(2): 300-304.
ZHANG Bao, LUO Wen-bin, LI Xin-hai, et al. Electrochemical properties of LiFePO4/C for cathode materials of lithium ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(2): 300-304.
[6] 陈学军, 赵新兵, 曹高劭, 等. 一步固相合成Nb 掺杂LiFePO4/C及其电化学性能[J]. 中国有色金属学报, 2006, 16(10): 1665-1670.
CHEN Xue-jun, ZHAO Xin-bing, CAO Gao-shao, et al. Electrochemical properties of Nb doped LiFePO4/C prepared by one-step solid-state synthesis[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(10): 1665-1670.
[7] Nytén A, Abouimrane A, Armand M, et al. Electrochemical performance of Li2FeSiO4 as a new Li-battery cathode material[J]. Electrochemistry Communications, 2005, 7(2): 156-160.
[8] Dominko R, Bele M, Gaberscek M, et al. Structure and electrochemical performance of Li2MnSiO4 and Li2FeSiO4 as potential Li-battery cathode materials[J]. Electrochemistry Communications, 2006, 8(2): 217-222.
[9] Dominko R, Conte D E, Hanzel D, et al. Impact of synthesis conditions on the structure and performance of Li2FeSiO4[J]. Journal of Power Sources, 2008, 178(2): 842-847.
[10] GONG Zheng-liang, LI Yi-xiao, YANG Yong. Synthesis and characterization of Li2MnxFe1-xSiO4 as a cathode materials for Lithium-ion battery[J]. Electrochemistry Communications, 2006, 9(12): A542-A544.
[11] 王淀佐, 胡岳华. 浮选溶液化学[M]. 长沙: 湖南科学技术出版社, 1988: 23-24.
WANG Dian-zuo, HU Yue-hua. Flotation solution chemistry[M]. Changsha: Hunan Science Technology Press, 1988: 23-24.
[12] 孙传尧, 印万忠. 硅酸盐矿物浮选原理[M]. 北京: 科学出版社, 2001: 91-92.
SUN Chuan-yao, YIN Wan-zhong. The flotation theory of silicate mineral[M]. Beijing: Science Press, 2001: 91-92.
[13] 温元凯, 邵俊. 离子极化导论[M]. 合肥: 安徽教育出版社, 1985: 262-267.
WEN Yuan-kai, SHAO Jun. The theory of ionic polarization[M]. Hefei: Anhui Education Press, 1985: 262-267.
[14] 李小斌, 李永芳, 刘祥民, 等. 复杂硅酸盐矿物Gibbs自由能和焓的一种近似计算法[J]. 硅酸盐学报, 2001, 19(3): 232-237.
LI Xiao-bin, LI Yong-fang, LIU Xiang-min, et al. A simple method of estimation of Gibbs free energy and enthalpy of complicate silicates[J]. Journal of the Chinese Ceramic Society, 2001, 19(3): 232-237.
[15] 伊赫桑巴伦. 纯物质热化学手册[M]. 程乃良, 牛四通, 徐桂花, 译. 北京: 科学出版社, 2003.
Barin I. Thermochemical data of pure substances[M]. CHENG Lai-liang, NIU Si-tong, XU Gui-hua, trans. Beijing: Science Press, 2003.
[16] 迪安 J A. 兰氏化学手册[M]. 尚久方, 操时杰, 辛无名, 等译. 北京: 科学出版社, 1991.
Dean J A. Lange’s handbook of chemistry[M]. SHANG Jiu-fang, CAO Shi-jie, XIN Wu-ming, et al, trans. Beijing: Science Press, 1991.
[17] 林传仙, 白正华, 张哲儒. 矿物及有关化合物热力学数据手册[M]. 北京: 科技出版社, 1985.
LIN Chuan-xian, BAI Zheng-hua, ZHANG Zhe-ru. The handbook of mineral and the related compounds thermodynamic data[M]. Beijing: Science and Technology Press, 1985.
[18] Armand M. Lithium insertion electrode materials based on orthosilicate: US, 6085015[P]. 2000-07-04.
[19] Zaghib K, Salah A A, Ravet N, et al. Structural, magnetic and electrochemical properties of lithium iron orthosilicate[J]. Journal of Power Sources, 2006, 160: 1381-1386.
[20] Gong Z L, Li Y X, He G N, et al. Nanostructured Li2FeSiO4 electrode material synthesized through hydrothermal-assisted sol-gel process[J]. Electrochemical and Solid-State Letters, 2008, 11(5): A60-A63.
[21] 杨勇. 可充锂电池用硅酸铁锂/碳复合正极材料及其制备方法: 中国, 1803608[P]. 2006-07-19.
YANG Yong. Lithium iron orthosilicate/C composite cathodes and preparation method for rechargeable lithium battery. China, 1803608[P]. 2006-07-19.
收稿日期:2009-02-09;修回日期:2009-05-16
基金项目:国家重点基础研究发展计划(“973”计划)项目(2007CB613603);教育部“新世纪优秀人才支持计划”项目(NCET-05-0692)
通信作者:赵中伟(1966-),男,河北永年人,教授,从事功能材料和有色金属冶金研究;电话:0731-88830476;E-mail: zhaozw@mail.csu.edu.cn


