DOI:10.19476/j.ysxb.1004.0609.2019.04.20
球形锂离子筛的制备及其吸附性能
柳 睿,伍攀羽,石西昌,陈 亚,徐 徽
(中南大学 冶金与环境学院,长沙410083)
摘 要:
采用了悬浮聚合造粒法,以聚苯乙烯和Li1.6Mn1.6O4粉体为原料制备球形锂离子筛前驱体,经0.5 mol/L的HCl解析脱锂,得到球形锂离子筛。并利用X射线衍射、扫描电子显微镜、原子吸收分光光度计等测试手段对样品的晶体结构、形貌、吸附性能等进行表征。吸附-解析实验结果表明,球形离子筛前驱体在HCl中处理2 h后解析基本完成。球形锂离子筛对Li+的吸附速率比较快,在含锂溶液中吸附3 h基本达到平衡。升高温度有利于离子筛对Li+的吸附,在pH 12.57、温度70 ℃下,离子筛的平衡吸附量为24 mg/g。吸附过程符合Langmuir吸附等温方程和动力学二级模型,是单分子层化学吸附。球形锂离子筛对盐湖卤水中的锂具有良好的吸附和选择性以及良好的循环吸附性能,在卤水中经过10次循环吸附后,吸附量仍有9.2 mg/g,Mn的总溶损率只有1.92%。
关键词:
锂离子筛;Li1.6Mn1.6O4;造粒;吸附;动力学;卤水;
文章编号:1004-0609(2019)-04-0828-09 中图分类号:TQ131 文献标志码:A
近年来,锂离子电池在便携式电子设备及电动汽车等行业上的应用发展迅猛,对锂的需求量越来越 大[1]。目前,固体锂矿越来越少,液体锂矿如盐湖卤水等成为重要的锂资源,盐湖卤水中的锂资源约占全球已探明锂资源的76%[2-3],因此,加强卤水提锂的研究对于我国锂资源的开发利用具有重大意义。我国绝大多数的盐湖卤水属于高镁锂比型卤水[4],由于镁和锂的化学性质相似而很难分离,吸附法因具有选择性高、循环稳定性高、吸附量高等优点,已成为盐湖提锂最具工业前景的方法之一[5-6]。锰系锂离子筛因为对锂的选择吸附性好、吸附量大,是目前综合性能最好的无机锂离子筛[7-9]。但目前研究合成的锂离子筛多为粉体[10],其流动性、渗透性和过滤性较差,将其投放在卤水中,粉体间的床层阻力大,容易阻断液体的流动,固液分离将变得十分困难,不利于在工业上实现连续的操作,因此粉体离子筛的造粒是实现离子筛提锂工业化的关键[11-12]。
国内外的学者对离子筛的造粒做了很多探索。MIYAI等[13]采用二甲基甲酰胺(DMF)作为溶剂溶解PVC,掺入离子筛前驱Li1.33Mn1.67O4,采用了溶剂转相法制得毫米级球形PVC基锂离子筛[14-15],在海水提锂实验中测得其锂吸附量为17.91 mg/g,比同等条件下粉体锂吸附量(25.40 mg/g)下降了30%。YOSEP等[16]用具有亲水性的琼脂糖作为粘结剂,掺入锂离子筛前驱体Lii.33Mn1.67O4,制得球状琼脂糖基锂离子筛,经过解析后在pH值为13的锂模拟溶液中测得其吸附量为20.82 mg/g,与锂离子筛粉体(24.02 mg/g)相差不大;海水提锂实验结果显示其吸附容量为3.40 mg/g,比在模拟溶液中吸附量下降了80%。HONG等[17]用交联聚氨基葡萄糖对Li1.33Mn1.67O4进行造粒,用硫酸酸洗的洗脱率达93%,在Li浓度为30 mg/L的海水中,造粒后的LMO颗粒吸附量约为10 mg/g,与粉末状的吸附剂相差不大;XIAO等[18]采用反向悬浮聚合法,用过硫酸铵引发丙烯酰胺的聚合对Li4Mn5O12进行造粒,制得粒状PAM-MnO2离子筛,303K时对锂溶液中Li的最大平衡吸附量为18.60 mg/g。
本文参考离子交换树脂的合成方法,采用悬浮聚合法对粉体锂离子筛进行造粒[19-20],制得粒径20~80目的PS-MnO2离子筛,通过球形离子筛在含锂溶液以及卤水中的一系列解析-吸附实验,考察了球形离子筛对锂的吸附性能,并对其吸附过程进行了研究。
1 实验
1.1 实验仪器设备与材料
实验用到的主要分析测试仪器:原子吸收分光光度计(TAS-990F,北京普析通用仪器有限责任公司),X射线衍射仪(RigakuD.max,日本理学),扫描电子显微镜(JSM-6360lv,日本电子株式会社)。
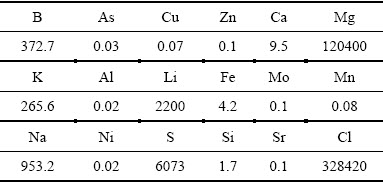
原材料及主要的化学药品:Li1.6Mn1.6O4前驱体,实验室自制;聚乙烯醇(PVA,AR),氯化钠(AR),LiCl(AR),LiOH·H2O(AR),西陇化工股份有限公司;过氧化苯甲酰(BPO,AR),苯乙烯(AR),国药集团化学试剂有限公司;浓盐酸(AR),衡阳市凯信化工试剂有限公司。卤水为青海某盐湖的老卤卤水,其主要成分如表1所示。
表1 老卤卤水的主要成分
Table 1 Composition of salt lake brine (mg/L)
1.2 球形锂离子筛的制备
球形锂离子筛采用悬浮聚合造粒法制备,将一定量的氯化钠和PVA溶于纯水得到水相,再将Li1.6Mn1.6O4粉体以及溶解了BPO的苯乙烯油相溶液加入到三口烧瓶中,升温至聚合温度,在恒温下均匀搅拌一定时间后得到黑色球形颗粒,经过滤、洗涤、干燥后得到球形锂离子筛前驱体,前驱体中Li1.6Mn1.6O4占30%。将锂离子筛前驱体置于0.5 mol/L的HCl溶液中,在30 ℃、搅拌的条件下解析4 h,水洗、干燥后即得到以苯乙烯树脂为基体的球形锂离子筛。制备流程如图1所示。
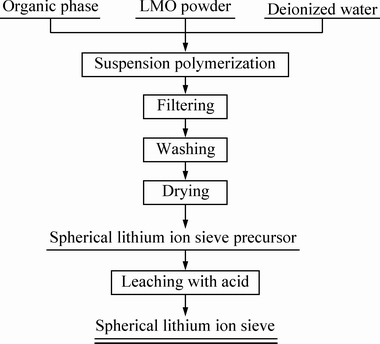
图1 球形锂离子筛的制备流程
Fig. 1 Preparation process of spherical lithium ion sieve
1.3 吸附-解析实验
在锂溶液中的吸附实验:将2 g球形锂离子筛置于100 mL不同Li+浓度的溶液(由LiOH.H2O、LiCl和去离子水配制的锂溶液)中,在恒温下以100 r/min的搅拌速度搅拌吸附一定时间,取上清液分析溶液中Li+浓度,按式(1)计算锂离子筛对Li+的吸附量q:
 (1)
(1)
式中:q为每克锂离子筛吸附Li+的量,mg/g;ρ0为溶液中Li+的初始质量浓度,mg/L;ρt为吸附t时间后溶液中Li+质量浓度,mg/L;V为溶液的体积,L;m为锂离子筛的质量,g;0.3代表球形离子筛中含有30%的有效成分。
解析实验:将一定量的球形锂离子筛前驱体或吸附锂后的锂离子筛置于0.5 mol/L的HCl中,在30 ℃、搅拌的条件下解析一定时间,分析溶液中Li+、Mn2+的浓度,按式(2)计算锂的解析率或锰的溶损率:
 (2)
(2)
式中:ηi为Li的解析率或Mn的溶损率,%;ρi,t为解析t时间后离子i(Li+或Mn2+)在溶液中的质量浓度,mg/L;V为溶液的体积,L;m为锂离子筛的质量,g;ηi,0为离子i(Li+或Mn2+)在锂离子筛中的含量。
卤水中吸附-解析锂的实验:锂离子筛在卤水中吸附-解析实验在柱状吸附柱进行,在吸附柱中安装了30 g球形锂离子筛。吸附时,100 mL卤水在吸附柱中采用下进上出方式循环吸附一定时间,每次吸附或解析后均用100 mL纯水洗涤吸附柱。
Li+分离效果实验:盐湖卤水成分比较复杂,含多种金属离子,为了能够有效地从复杂的卤水体系中提取锂,锂离子筛对Li+的选择性吸附性能是评价离子筛性能的指标之一;因此考察了锂离子筛对卤水中主要金属离子(Li+、Mg2+、Na+、K+)的分配系数D和分离系数b。实验中取一定量锂离子筛置于卤水中,在30°C恒温水浴搅拌吸附一定时间,测定吸附前后卤水中各元素的含量变化,按式(3)和式(4)计算各离子的分配系数Di和与Li+的分离系数β:
 (3)
(3)
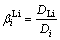 (4)
(4)
式中:ρi,0表示吸附前溶液中i离子的浓度,mg/L;ρi,e表示吸附后溶液中i离子的浓度(包括洗水中离子的量),mg/L;V为溶液的体积,L;m为锂离子筛的质量,g;DLi和Di分别表示离子Li+和离子i的分配系数,L/g。
2 结果与讨论
2.1 球形锂离子筛的表征
实验室合成的Li1.6Mn1.6O4呈棕黑色粉体,其SEM像如图2所示。从图2可以看出,该粉体的粒度细小,而盐湖卤水的黏度大,将这种粉状的锂离子筛投入卤水后,吸附后很难进行固液分离。若安装在吸附柱中,粉体间的床层阻力大,容易阻断液体的流动,固体和液体间的分离也将会变得非常困难,因此不能直接用于盐湖卤水吸附提锂的工业应用。经过悬浮聚合造粒以后,得到球形的锂离子筛,用标准筛进行筛分,选取粒径0.425~0.85 mm的样品进行实验,样品的照片如图3所示,从图3可以看出,造粒后的样品其外观为黑色球形颗粒,颜色与粉体锂离子筛相仿,粒度与普通离子交换树脂粒径大小相接近。

图2 Li1.6Mn1.6O4粉末的SEM像
Fig. 2 SEM image of Li1.6Mn1.6O4 powder

图3 球形锂离子筛的照片
Fig. 3 Photo of spherical lithium ion sieve
图4(a)和(b)所示分别为球形锂离子筛颗粒和颗粒表面的SEM像。从图中可以看出,颗粒外形为球形,表面为疏松多孔结构。图4(c)所示为球形锂离子筛前驱体颗粒的截面,图4(d)所示为酸处理后的球形锂离子筛颗粒的截面。从图4(c)和(d)可以看出,颗粒内部有很多的孔洞,有些孔洞和表面相连通,经酸处理后得到的粒状锂离子筛内部孔隙率明显增加。图4(e)和(f)所示分别为球形锂离子筛颗粒截面上C和Mn元素分布图,可以看出,C和Mn元素在截面均匀分布,说明Li1.6Mn1.6O4在聚苯乙烯中均匀分布。这些图谱说明,造粒后的锂离子筛为多孔球形结构,表面有明显的疏松孔洞,增加了球形锂离子筛与溶液接触面积,增强其离子吸附交换性能。相对利用其他方法造粒的锂离子筛,该锂离子筛具有更高的强度和均匀的球形外形,这些为实现卤水上柱吸附奠定了基础。
对Li1.6Mn1.6O4粉体、造粒后球形锂离子筛前驱体及球形锂离子筛吸附前后的样品进行X射线衍射分析,结果如图5所示。图5(a)所示为Li1.6Mn1.6O4粉体的XRD谱,图5(b)、(c)、(d)所示分别为造粒后得到的球形锂离子筛前驱体、前驱体经酸处理后得到的球形锂离子筛以及锂离子筛吸附锂后的样品的XRD谱。从图5可以看出,造粒、解析和吸附后离子筛的特征峰数量和峰间距与Li1.6Mn1.6O4粉体基本相近,没有发生明显变化,说明造粒后,离子筛的有效成分仍然是Li1.6Mn1.6O4,没有发生改变。造粒后的离子筛的图谱中在(111)晶面(19°左右)处出现了一个很宽的峰,这是因为聚苯乙烯的影响。图5(c)中的特征峰与(b)中的相比,稍向右偏移,在解析过程中,H+离子和Li+发生交换,Li+析出离开而H+进入材料,因为H+的半径比Li+小,使得晶格略变小,晶面间距变窄,根据布拉格定律,布拉格角(2θ)将略微增大;对比图5(c)和(d)可知,布拉格角(2θ)略微下降,这表明H+和Li+在吸附期间再次发生交换。
2.2 球形锂离子筛的吸附及解析性能
2.2.1 前驱体的解析性能
图6所示为球形离子筛前驱体在HCl解析过程中的锂解析率和锰溶损率随解析时间变化的关系。从图中可以看出,2 h时解析过程基本完成,解析率为66%,相比于粉体Li1.6Mn1.6O4材料的解析率(83%)下降了17%,这说明粉体离子筛造粒后,有些粉体Li1.6Mn1.6O4粉体被包裹在有机物中,无法与溶液充分接触,导致了锂的解析率下降。
2.2.2 溶液中Li+浓度对离子筛锂吸附量的影响
为了考察溶液中Li+浓度对离子筛锂吸附量的影响,用LiOH·H2O、LiCl和去离子水配制了含不同Li+质量浓度的溶液进行实验。在实验中发现,溶液的pH对锂离子筛吸附Li+的性能影响很大,当pH小于10时其吸附量很低,当pH大于11后其吸附量迅速增大,且吸附量随着pH的增大而增大,因此,实验中选择了高pH下进行锂离子的浓度影响的实验。调节pH为12.93,温度30 ℃,吸附3h。溶液中Li+浓度对锂离子筛吸附锂的影响实验结果如图7所示。

图4 粒状锂离子筛的SEM-EDS像
Fig. 4 SEM-EDS images of spherical lithium ion sieve
从图7可以看出,随着溶液中Li+浓度的增加,离子筛对锂的吸附量增大;Li+浓度为143 mg/L时,离子筛对锂的吸附量为10.86 mg/g;而当Li+浓度增加到2150 mg/L时,离子筛对锂的吸附量为21.08 mg/g,在高Li+浓度下更容易达到饱和,但随着浓度的增大,吸附量的增加趋势变缓。球形锂离子筛对不同的锂浓度的溶液都有良好的吸附性能,对锂浓度的适应范围广。
2.2.3 温度对离子筛锂吸附量的影响
将5g离子筛置于pH 12.57、Li+浓度2.15 g/L的溶液中,分别于30、40、50、60、70 ℃下吸附锂,每隔一段时间取上清液分析锂吸附量,得到如图8所示曲线。
从图8可以看出,球形锂离子筛开始吸附锂的速率很快,而且受温度的影响比较小,吸附1 h时各温度下的吸附量均达到了17~19 mg/g。随后吸附速率逐渐变慢,而且吸附过程受温度的影响变大,随着温度的升高吸附量明显增大。30 ℃时,吸附4 h的吸附量约为20 mg/g;而当溶液的温度提高到70 ℃时,吸附4 h时,吸附量就达到了24 mg/g。吸附4 h后,吸附速率变得很慢,基本达到了平衡。其在锂溶液中的吸附量高于大多数造粒离子筛的。由于球形锂离子筛的表面有效成分能够与溶液中的Li+充分接触,所以开始 吸附时速率快,化学反应步骤为控制步骤,温度对速率的影响小。随着表面吸附饱和,溶液中的Li+必须扩散到颗粒内部才能继续被吸附,扩散过程影响了吸附的速率,因此温度对吸附速率的影响变大。

图5 锂离子筛造粒前后及球形离子筛吸附前后的XRD谱
Fig. 5 XRD patterns of spherical lithium ion sieve

图6 锂离子筛前驱体解析效果与解析时间的关系
Fig. 6 Effect of desorption time on extraction of lithium ion sieve

图7 Li+浓度对锂离子筛吸附锂的影响
Fig. 7 Effect of Li+ concentrations on adsorption of lithium ion sieve

图8 锂吸附量与温度的关系
Fig. 8 Effect of temperature on lithium adsorption capacity
2.2.4 球形锂离子筛在锂溶液中的吸附动力学
动力学的研究有助于理解反应的历程和机理,关于吸附反应的动力学模型已有不少报道,目前准一级动力学模型(见式(5))和准二级动力学模型(见式(6))被广泛用来研究吸附机理[21-22],确定吸附反应的速率常数:
 (5)
(5)
 (6)
(6)
式中:qe为平衡时离子筛对Li+的吸附量,mg/g;qt为吸附时间t时的吸附量,mg/g;k1为一级吸附动力学模型的速率常数,h-1;k2为二级吸附动力学模型的速率常数,g·mg-1·h-1。
将30 ℃下的实验结果分别用准一级吸附动力学模型和准二级吸附动力学模型进行拟合,拟合结果如图9所示。从图9可以看出,准二级动力学模型拟合相关系数 0.9986比准一级动力学模型拟合的0.7527要大,因此,可以认为球形锂离子筛对锂的吸附符合准二级吸附动力学模型,属于化学吸附[23]。
0.9986比准一级动力学模型拟合的0.7527要大,因此,可以认为球形锂离子筛对锂的吸附符合准二级吸附动力学模型,属于化学吸附[23]。

图9 30 ℃下离子筛吸附过程的准一级动力学拟合图和准二级动力学拟合图
Fig. 9 Linear fitting curves of lithium ion sieve adsorbing Li+ at 30 ℃ with pseudo-first-order (a) and pseudo-second-order rate equation (b)
二级吸附动力学模型拟合曲线的参数如表2所示,求得反应的速率常数k2为0.273 g·mg·h-1,平衡吸附量为21.51 mg/g,与实验所得数据21.08 mg/g相差不大。
表2 离子筛吸附Li+的二级动力学模型拟合参数
Table 2 Fitting parameters of ion sieve adsorbing Li+ according to pseudo-second-order dynamic equation
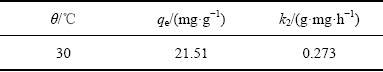
锂离子筛对Li+的吸附过程可以通过Langmuir吸附等温方程和Freundlich吸附等温方程进行拟合[24],其方程式如下:
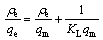 (7)
(7)
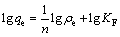 (8)
(8)
式中:qe为平衡吸附量,mg/g;ρe为吸附平衡后溶液中Li+浓度,mg/L;qm为最大吸附量,mg/g;KL为Langmuir实验常数,L/mg;n和KF为与量和吸附速率有关的Freundlich常数。
分别应用Langmuir 和Freundlich吸附等温方程对球形锂离子筛在不同Li+浓度溶液中于30 ℃吸附的数据进行线性拟合,拟合结果如图10和表3所示。从图10可以看出,球形离子筛对不同浓度含锂溶液的吸附等温线与Langmuir吸附模型的拟合曲线相关系数为0.9980,大于Freundlich吸附模型的拟合曲线相关系数0.9274。球形锂离子筛在不同Li+浓度溶液中的 等温吸附过程遵循Langmuir 吸附等温方程,从而可得离子筛对Li+的吸附是单层吸附。
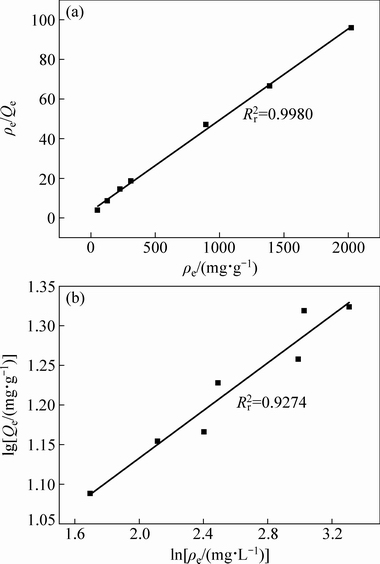
图10 离子筛在30 ℃于不同Li+浓度的溶液中吸附Li+的Langmuir模型等温拟合图和Freundlich模型等温拟合曲线
Fig. 10 Fitting lines of ion sieve adsorbing Li+ in different Li+ concentrations solutions with Langmuir (a) and Freundlich(b) models at 30 ℃
表3 锂离子筛在30 ℃下吸附Li+的Langmuir模型拟合参数
Table 3 Fitting parameters of ion sieve adsorbing Li+ according to Langmuir isotherm models at 30 ℃

通过Langmuir拟合参数来计算离子筛在30 ℃吸附反应下的标准吉布斯自由能 ;
;
 (9)
(9)
式中:R为摩尔气体常数,8.314 J·mol-1·K-1;T为绝对温度,K;β为Langmuir常数,β=KL·qm。计算得 =-358.1 kJ/mol,为负值,说明吸附反应是自发进行的。
=-358.1 kJ/mol,为负值,说明吸附反应是自发进行的。
2.2.5 球形锂离子筛在盐湖卤水中对锂的选择性
盐湖卤水中主要成分在球形离子筛吸附6 h前后的含量变化如表4所示,Li+含量在吸附前后变化比较大,其他离子的浓度只有少量减小,说明该球形锂离子筛在卤水中对Li+具有良好的吸附性能。在配制的锂溶液中,锂离子筛只有在高pH下才具有较大的吸附量,但卤水是偏弱酸性的溶液,锂离子筛却表现出很好的吸附性能,这是由于吸附过程是Li+和H+交换的过程,Li+进入锂离子筛,H+进入溶液,在配制的锂溶液中吸附时,由于H+的析出,会导致溶液的pH值下降,当溶液的pH降低到酸性时,吸附过程将不能继续进行。而含Mg2+高的卤水是一种缓冲体系,吸附过程中溶液的pH值变化不大[8],所以离子交换过程能够持续进行,锂离子筛对Li+仍然保持较大的吸附量,不用调整其pH值即可使用。
表4 盐湖卤水中各主要金属离子在吸附前后的含量变化
Table 4 Content changes of main metal ions in brine before and after adsorption

对吸附后的球型锂离子筛用100 mL纯水进行洗涤,洗液中离子的含量如表5所示。由表5可以看出,绝大多数被吸附的Mg2+、Na+和K+等离子进入了洗水中,只有少量的被吸附的Li+进入了洗水中。这说明吸附的Li+进入了离子筛中,形成稳定的相,而Mg2+、Na+、K+等只是被吸附在球型锂离子筛的表面和微孔中,很容易被洗涤下来。根据吸附后卤水中各主要金属离子的含量,加上洗液中各金属离子的量,计算出了各离子的分配系数D,如表6所示。可以看出DLi>>DK>DMg>DNa,该球形锂离子筛的吸附顺序为Li+>>K+>Mg2+>Na+。从表7中可以看出,Li+对Mg2+、K+和Na+的分离系数远大于1,说明该球形锂离子筛对锂有较高的选择吸附性。
表5 洗水中各主要金属离子的含量
Table 5 Content of main metal ions in washing water (mg/L)

表6 离子筛对卤水中主要金属离子的分配系数
Table 6 Distribution coefficients of ion sieve for main metal ions in brine (L/g)

表7 卤水中Li+对其他离子的分离系数
Table 7 Separation coefficients of Li+ to Na+, Mg2+ and K+ in brine

2.2.6 球形锂离子筛在卤水中的循环吸附性能
锂离子筛的稳定性可以通过循环吸附过程中吸附容量的变化来评估。将一定量的锂离子筛置于卤水中进行吸附,然后用0.5 mol/L HCl解析,再置于卤水中进行吸附,如此进行多次吸附-解析循环实验,实验结果如图11所示。
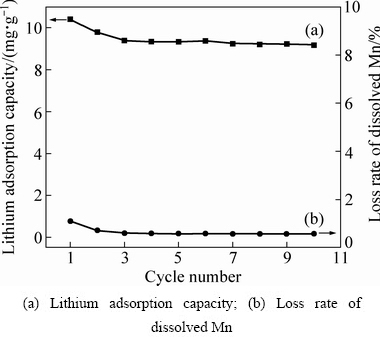
图11 球形锂离子筛在卤水中的循环性能
Fig. 11 Cycle performance of spherical lithium ion sieve in brine
从图11可以看出,在前三次循环吸附过程,随着循环次数的增加,锂离子筛对Li+的吸附量减小幅度较小,在第四次循环吸附以后,锂离子筛对Li+的吸附趋于稳定,减小的幅度很小;10次吸附-解吸循环后,吸附容量稳定在9.2 mg/g。在解吸过程中,Mn的溶损率也比较小,经过10次循环后,Mn的总溶损率仅为1.92%。球形锂离子筛由于在造粒时部分粉体Li1.6Mn1.6O4被包裹在有机物中,无法与溶液充分接触,导致在卤水中对锂的吸附量和解析时锰的溶损率都比粉状锂离子筛的低,这与用其他造粒的锂离子筛类似。
3 结论
1) 采用悬浮聚合造粒法,制备得到了以聚苯乙烯为载体的球形锂离子筛。造粒后离子筛中有效成分仍然是Li1.6Mn1.6O4,其晶体结构没有发生改变,球形锂离子筛表面为疏松多孔结构,该球形锂离子筛对Li+的吸附性能好。
2) 研究了温度和溶液初始Li+浓度对离子筛吸附性能的影响,结果表明离子筛的吸附性能随着温度及溶液初始Li+浓度的升高而增强,在70 ℃、Li+浓度2.15 g/L时的吸附量为21.08 mg/g。
3) 吸附过程符合准二级吸附动力学方程和Langmuir等温方程,表明离子筛对Li+的吸附为单分子层化学吸附,吸附反应速度由多个控制步骤决定。
4) 球型锂离子筛对卤水中Li+的选择吸附和循环性能好,经过10次循环后,对卤水的锂的吸附容量仍保持9.2 mg/g,在盐湖提锂和海水提锂工业化上很有潜力。
REFERENCES
[1] 莫 凡. 电动汽车行业: 电动汽车需求爆发对动力锂电池产业链投资机会研究[D]. 成都: 西南财经大学, 2014.
MO Fan. Electrombile industry studies: Impact of rising demand of electrombile on investment opportunities of the lithium-ion battery industrial chain[D]. Chengdu: Southwestern University of Finance and Economics, 2014.
[2] GUNTHER M, LARS R, MICHAEL H, MARTIN B. Lithium market researchglobal supply, future demand and price development[J]. Energy Storage Materials, 2017, 6: 171-179.
[3] NARINS T P. The battery business: Lithium availability and the growth of the global electric car industry[J]. The Extractive Industries and Society, 2017, 4(2): 321-328.
[4] 宋彭生, 李 武, 孙 柏, 乜 贞, 卜令忠, 王云生. 盐湖资源开发利用进展[J]. 无机化学学报, 2011, 27(5): 801-815.
SONG Peng-sheng, LI Wu, SUN Bai, NIE Zhen, BU Ling-zhong, WANG Yun-sheng. Recent development on comprehensive utilization of salt lake resources[J]. Chinese Journal of Inorganic Chemistry, 2011, 27(5): 801-815.
[5] 刘东帆, 孙淑英, 于建国. 盐湖卤水提锂技术研究与发展[J]. 化工学报, 2018, 69(1): 141-155.
LIU Dong-fan, SUN Shu-ying, YU Jian-guo. Research and development on technique of lithium recovery from salt lake brine[J]. Journal of Chemical Industry and Engineering, 2018, 69(1): 141-155.
[6] 陈自正, 沈卫华, 陈立芳, 成洪业, 漆志文. 纳米H2TiO3锂吸附剂的水热合成及其吸附性能[J]. 中国有色金属学报, 2017, 27(3): 547-554.
CHEN Zi-zheng, SHEN Wei-hua, CHEN Li-fang, CHENG Hong-ye, QI Zhi-wen. Hydrothermal synthesis and adsorption properties of nano scale H2TiO3adsorbent[J]. The Chinese Journal of Nonferrous Metals, 2017, 27(3): 547-554.
[7] CHITRAKAR R, KANOH H, MIYAI Y, OOI K. Recovery of lithium from seawater using manganese oxide adsorbent (H1.6Mn1.6O4) derived from Li1.6Mn1.6O4[J]. Industrial Engineering Chemical Research, 2001, 40(9): 2054-2058.
[8] SHI Xi-chang, ZHOU Ding-fang, ZHANG Zhi-bing, YU Liang-liang, XU Hui, CHEN Bai-zhen, YANG Xi-yun. Synthesis and properties of Li1.6Mn1.6O4 and its adsorption application[J]. Hydrometallurgy, 2011, 110(1/4): 99-106.
[9] SOROUR M H, EL-RAFEI A M, HANI H A. Synthesis and characterization of electrospun aluminum doped Li1.6Mn1.6O4spinel[J]. Ceramics International, 2016, 42(4): 4911-4917.
[10] 石西昌, 张志兵, 周定方, 周喜诚, 唐天罡, 尹世豪. Li1.6Mn1.6O4酸洗后离子筛在盐湖卤水中的吸附性能[J]. 中南大学学报(自然科学版), 2013, 44(3): 892-900.
SHI Xi-chang, ZHANG Zhi-bing, ZHOU Ding-fang, ZHOU Xi-cheng, TANG Tian-gang, YIN Shi-hao. Adsorption performance of ion-sieve obtained after Li1.6Mn1.6O4 pickled in brine[J]. Journal of Central South University (Science and Technology), 2013, 44(3): 892-900.
[11] XIAO Guo-ping, TONG Ke-feng, ZHOU Long-sheng, XIAO Jia-li, SUN Shu-ying, LI Ping, and YU Jian-guo. Adsorption and desorption behavior of lithium ion in spherical PVC-MnO2 ion sieve[J]. Industrialand Engineering Chemistry Research, 2012, 51(33): 10921-10929.
[12] XU Xin, CHEN Yong-mei, WAN Ping-yu, KHALED G, WANG Kai-ying, HE Ting, HERTANTO A, FAN Mao-hong. Extraction of lithium with functionalized lithium ion-sieves[J]. Progress in Materials Science, 2016, 84: 276-313.
[13] MIYAI Y, OOI K, NISHIMURA T, KUMAMOTO J. Lithium adsorptive properties of a new selective adsorbent derived from Li1.33Mn1.67O4[J]. Bulletin of the Society of Sea Water Science Japan, 1994, 48: 411-415.
[14] ZHU Gui-ru, WANG Pan, QI Peng-fei, GAO Cong-jie. Adsorption and desorption properties of Li+ on PVC-H1.6Mn1.6O4 lithium ion-sieve membrane[J]. Chemical Engineering Journal, 2013, 235: 340-348.
[15] XIAO Guo-ping, TONG Ke-fen, SUN Shu-ying, YU Jian-guo. Preparation of spherical PVC-MnO2 ion-sieve and its lithium adsorption property[J]. Chinese Journal of Inorganic Chemistry, 2012, 28(11): 2385-2394.
[16] YOSEP H, KIM H, PARK J. Millimeter-sized spherical ion-sieve foams with hierarchical pore structure for recovery of lithium from seawater[J]. Chemical Engineering Journal, 2012, 210: 482-489.
[17] HONG H, PARK I, RYU T, KIM B, CHUNG K. Granulation of Li1.33Mn1.67O4 (LMO) through the use of cross-linked chitosan for the effective recovery of Li+ from seawater[J]. Chemical Engineering Journal, 2013, 234: 16-22.
[18] XIAO Jia-Li, SUN Shu-Ying, SONG Xing-fu, LI Ping, YU Jian-guo. Lithium ion recovery from brine using granulated polyacrylamide-MnO2ion-sieve[J]. Chemical Engineering Journal, 2015, 279(1): 659-666.
[19] 侯昭升, 张 浩, 纪晨旭, 张冬梅, 曲文强, 孙 斌. 悬浮聚合法制备热膨胀聚(偏氯乙烯-丙烯腈-苯乙烯)微球及其性能[J]. 高分子材料科学与工程, 2015, 31(9): 49-52, 57.
HOU Zhao-sheng, ZHANG Hao, JI Chen-xu, ZHANG Dong-mei, QU Wen-qiang, SUN Bin. Preparation and properties of thermal-expandable microspheres with P(VDC-AN-St) shell by suspension polymerization[J]. Polymeric Materials Science and Engineering, 2015, 31(9): 49-52, 57.
[20] XU Xin, ZHOU You, FAN Mao-hong, Lü Zi-jian, TANG Yang, SUN Yan-zhi, CHEN Yong-mei, WAN Ping-yu. Lithium adsorption performance of a three-dimensional porous H2TiO3-type lithium ion-sieve in strong alkaline Bayer liquor[J]. RSC Advances, 2017, 7(31): 18883-18891
[21] BARKAT M, NIBOU D, CHEGROUCHE S, MELLAH A. Kinetics and thermodynamics studies of chromium (VI) ions adsorption onto activated carbon from aqueous solutions[J]. Chemical Engineering and Processing, 2009, 48(1): 38-47.
[22] BENHAMMOU A, YAACOUBI A, NIBOU L, TANOUTI B. Adsorption of metal ions onto Moroccan stevensite: Kinetic and isotherm studies[J]. Journal of Colloid and Interface Science, 2005, 282(2): 320-326.
[23] NAIYA T K, BHATTACHARYA A K, DAS S K. Removal of Cd(II) from aqueous solutions using clarified sludge[J]. Colloid and Interface Science, 2008, 325(1): 48-56.
[24] WANG Lu, MENG Chang-gong, HAN Mei, MA Wei. Lithium uptake in fixed-pH solution by ion sieves[J]. Journal of Colloid and Interface Science, 2008, 325(1): 31-40.
Preparation and adsorption properties of spherical lithium ion sieve
LIU Rui, WU Pan-yu, SHI Xi-chang, CHEN Ya, XU Hui
(School of Metallurgical and Environment, Central South University, Changsha 410083, China)
Abstract: A spherical lithium ion sieve precursor was synthesized by suspension polymerization using polystyrene resin and Li1.6Mn1.6O4 powder, and converted into a lithium ion sieve by leaching in 0.5 mol/L HCl solution. The crystal structure, morphology and adsorption capacity of the products were investigated by X-ray diffractometry, scanning electron microscopy and atomic absorption spectrophotometry. The desorption process was basically completed at 2 h. The adsorption rate of Li+ by the spherical lithium ion sieve is fast. The adsorption capacity of the ion sieve reaches to equilibrium value after adsorption for 3 h. Increasing temperature is beneficial to the adsorption of Li+ on the lithium ion sieve. The equilibrium adsorption capacity of the lithium ion sieve is 24 mg/g at pH 12.57 and 70 ℃. The adsorption process conforms to Langmuir adsorption isotherm equation and pseudo-second-order adsorption kinetics model, which is the monolayer chemical adsorption. After 10 cycles of adsorption in brine, the adsorption capacity is 9.2 mg/g, and the total loss rate of dissolved Mn is only 1.92%.
Key words: lithium ion sieve; Li1.6Mn1.6O4; granulation; adsorption; dynamics; brine
Received date: 2018-04-09; Accepted date: 2018-06-06
Corresponding author: HI Xi-chang; Tel: +86-13787108866; E-mail:xichangshi@csu.edu.cn
(编辑 龙怀中)
收稿日期:2018-04-09;修订日期:2018-06-06
通信作者:石西昌,教授,博士;电话:13787108866;E-mail:xichangshi@csu.edu.cn
摘 要:采用了悬浮聚合造粒法,以聚苯乙烯和Li1.6Mn1.6O4粉体为原料制备球形锂离子筛前驱体,经0.5 mol/L的HCl解析脱锂,得到球形锂离子筛。并利用X射线衍射、扫描电子显微镜、原子吸收分光光度计等测试手段对样品的晶体结构、形貌、吸附性能等进行表征。吸附-解析实验结果表明,球形离子筛前驱体在HCl中处理2 h后解析基本完成。球形锂离子筛对Li+的吸附速率比较快,在含锂溶液中吸附3 h基本达到平衡。升高温度有利于离子筛对Li+的吸附,在pH 12.57、温度70 ℃下,离子筛的平衡吸附量为24 mg/g。吸附过程符合Langmuir吸附等温方程和动力学二级模型,是单分子层化学吸附。球形锂离子筛对盐湖卤水中的锂具有良好的吸附和选择性以及良好的循环吸附性能,在卤水中经过10次循环吸附后,吸附量仍有9.2 mg/g,Mn的总溶损率只有1.92%。


