文章编号:1004-0609(2008)S1-0064-06
从铬精矿中制备硫酸铬(Ⅲ)的新工艺
李荣兴1,谢 刚1,杨大锦2,林 艳1
(1. 昆明理工大学 材料与冶金工程学院,昆明650093;
2. 云南冶金集团总公司 技术中心,昆明650031)
摘 要:
介绍一种从铬精矿中制备硫酸铬的新工艺。实验确定烧结、浸出、除铝、还原和分解等工艺步骤的最佳条件,并对产品(硫酸铬(Ⅲ))的性质进行分析。结果表明,采用本工艺制备的硫酸铬(III)纯度高,铬含量达到150~ 250 g/L。其中,适宜的烧结条件为:温度1 050~1 150 ℃,时间60~90 min;适宜的浸出条件为:温度80 ℃,时间120~130 min;适宜的除铝条件为:温度80 ℃,pH 7~8,时间120~150 min。
关键词:
中图分类号:TF 11 文献标识码:A
New technology of producing chromium (Ⅲ) sulfate from magnesium chromite
LI Rong-xing1, XIE Gang1, YANG Da-jin2, LIN Yan1
(1. Faculty of Materials and Metallurgical Engineering, Kunming University of Science and Technology, Kunming 650093, China;
2. The Technique Center of Yunnan Metallurgy Co. Ltd., Kunming 650031, China)
Abstract: The overall flow-sheet of producing chromium (Ⅲ) sulfate was described. The suitable conditions of each process such as sintering, leaching, aluminum removal, reduction, and decomposition conditions were experimentally studied. The results show that it is reasonable to produce high-purity chromium (III) sulfate by the flow-sheet pointed out. The ultimate product is Cr2(SO4)3 solution containing 150-250 g/L Cr. Finally, the optimum parameters of sintering, leaching and aluminum-removal are temperature of 1 050-1 150 ℃, period of 60-90 min; temperature of 80 ℃, period of 120-130 min; and temperature of 80 ℃, pH of 7-8, period of 120-150 min, respectively.
Key words: chromium; chromium sulfate; leaching ratio; reduction
金属铬及其化合物因具有硬度高,耐蚀性和耐磨性良好等优点,作为功能性镀覆层而备受瞩目,广泛应用于石油化工、纺织轻工、航天科技及海洋开发等领域[1-5]。六价铬化合物体系如CrO3因镀铬工艺简单、获得的镀层光亮平整,一直是镀铬工业采用的主要体系之一[6-9]。但在当今发展绿色科技的大环境下,六价铬电沉积工艺因具有高毒性和高污染性等问题日益引起世界各国的广泛关注,开发低毒、环保型的三价铬电沉积体系,以期取代传统的六价铬体系,已成为研究热点[10-12]。硫酸盐三价铬体系在镀铬工业中具有低毒低污染、电流效率高等优点,是很有价值的体系之一[13-16]。为了适应国内镀铬工业的发展和应用的需要,本研究组开展了从铬精矿制备三价铬盐,特别是Cr2(SO4)3的工艺研究,确定了合理经济的工艺流程,并获得各工艺步骤的最佳实验条件,具有重要的学术意义和广阔的应用前景。
1 实验
实验工艺流程如图1所示
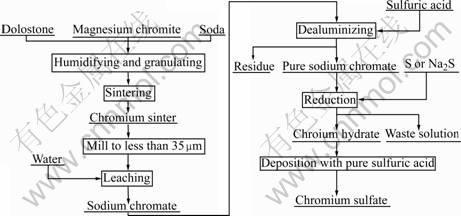
图1 硫酸铬(Ⅲ)制备工艺流程图
Fig.1 Production flow-sheet of chromium (Ⅲ) sulfate
白云石的化学成分为:CaO 35.68%,MgO 24.66%,SiO2 0.74%,Al2O3<0.10%,FeO<0.50%。实验所用的铬精矿采用某铬矿山开采得到的铬原矿经重选分离得到,其化学和矿物成分列于表1。苏打硫磺粉和硫酸为工业用品。
表1 铬精矿的化学和矿物成分
Table 1 Chemical and mineral compositions of magnesium chromite

2 结果与讨论
原料(铬精矿,白云石和苏打)称量配料,混合均匀后,制成d 6~8 mm的颗粒,在100 ℃的温度下焙烧,实验流程如图1所示。
在其它烧结条件不变的情况下,分别改变白云石配入量、苏打配入量、烧结温度及烧结时间等单因素条件,由此考察配料比例、烧结温度和烧结时间等条件的变化对后续浸出过程中铬化学走向的影响,其结果如图2所示。
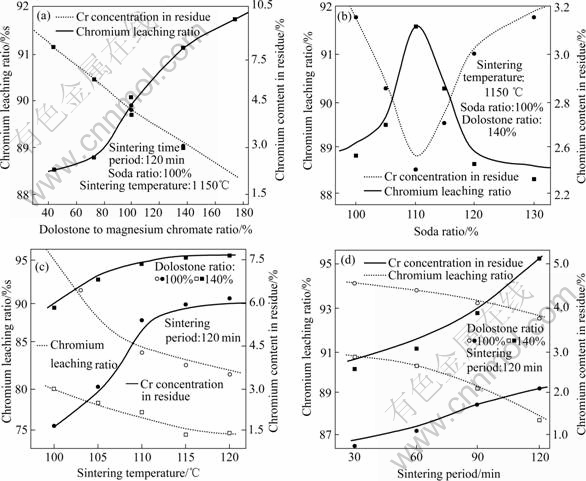
图2 烧结实验因素对铬化学行为的影响
Fig.2 Effects of sintering parameters on chromium chemistry behavior: (a) Dolostone ratio; (b) Soda ratio; (c) Sintering temperature; (d) Sintering period
从图2中可以看出适宜的烧结条件为:烧结温度1 050~1 150 ℃,烧结时间60~90 min,苏打和白云石的配入比分别为铬精矿的1.05~1.1倍和1~1.4倍(根据反应方程式(3)和(4)计算得出)。
对铬精矿配料用STA同步热分析仪进行差热-热重分析,其结果如图3所示。由该结果可知,配料在室温~200 ℃内脱去配料中的游离水。在330~640 ℃时,脱除结晶水,367.78 ℃时有一个吸热峰,主要是配料时碳酸钠吸附的结晶水。根据热重结果,计算得到碳酸钠的结晶水为10个水分子,与已知的碳酸钠含10个结晶水的结果相吻合。640~969.82 ℃配料明显有质量换失,这是其中的碳酸盐分解所致。但当烧结温度在650~700 ℃之间时,烧结反应(3)和(4)缓慢。由此可见,烧结时,首先发生Na2CO3 和 Mg?CaCO3的分解反应;而后,其分解产物再与铬精矿发生反应。焙烧反应可表述如下:
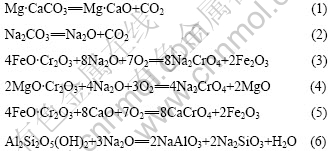
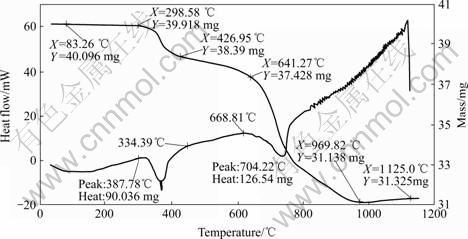
图3 铬精矿的STA分析结果
Fig.3 STA analytic results of chromium concentration
烧结反应主要在950~1 000 ℃温度区间完成。当烧结温度大于1 000 ℃时,烧结反应质量损失率小于1%, 这与实验结果有些不同。可能是因为氧必须经过颗粒表面矿物扩散进入颗粒内部后才能使焙烧反应继续进行。STA差热-热重实验与条件实验的物料颗粒的粒度不同,因此氧的扩散距离不同,造成反应结果有所差别。
原料先在以下条件下烧结后才进入浸出过程:白云石配入比为1.2,苏打配入比为1,烧结温度为1 100 ℃,烧结时间为60 min。烧结矿包含19.61% Cr2O3,并按照浸出实验条件的要求破碎。在其它浸出条件不变的情况下,分别改变烧结矿粒度、浸出温度、固液比及浸出时间等条件,考察矿粒度、温度、固液比及时间等单因素条件对铬浸出率的影响,各单因素实验结果如图4所示。
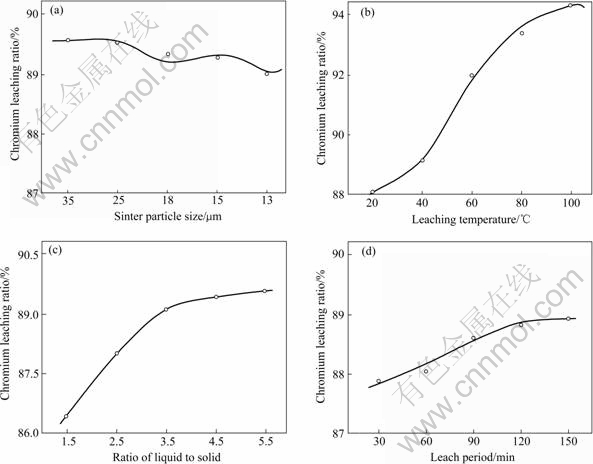
图4 浸出因素对铬烧结矿浸出率的影响
Fig.4 Influence of leaching parameters on chromium leaching ratio : (a) Sinter particle size; (b) Leaching temperature; (c) Liquid to solid ratio; (d) Leaching period
烧结后,烧结矿含18%~20%的Cr2O3,也就是40%~45%可溶的Na2CrO4,因此浸出渣在Na2CrO4溶解后为多孔状,但其不影响Na2CrO4的溶解和扩散。从图4可以看出,铬烧结矿的粒度对铬的浸出率无明显的影响。综合考虑,认为适宜的铬烧结矿粒度为<420 μm。
随着浸出温度的升高,浸出液的粘度降低,Na2CrO4的溶解速度和扩散速度加快,但加热浸出液将使能耗升高。根据图4(b)的实验结果,认为合适的浸出温度为80 ℃。
从图4(c)和图4(d)可以看出,随着浸出固液比和浸出时间的增加,铬浸出率增大。但固液比和浸出时间增加的同时,水耗和能耗也都增加。综合考虑各方面因素,认为适宜的固液比为1.5~2.5,浸出时间为100~120 min。
大约有6~8 g/L的Al2O3以NaAl(OH)4形式存在于浸出液中。如果不除去浸出液中的Al2O3,其将污染最终产物。除铝反应如方程式(7)所示。其它条件不变的情况下,分别改变温度和除铝时间,考察它们对铝脱除率的影响,实验结果如图5所示。
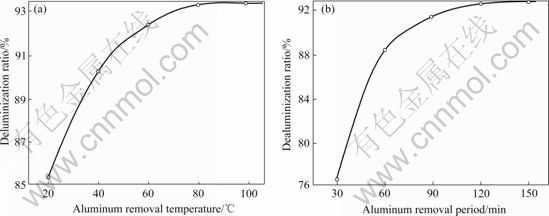
图5 除铝实验结果
Fig.5 Aluminum removal results: (a) Influence of temperature on deluminization ratio; (b) Influence of aluminum removal period on deluminization ratio
![]()
从图5中可以看出,升高温度和延长反应时间有利于除铝,但也增加了能耗,因此认为适宜的温度为80 ℃,时间为120~130 min。
溶液中Na2CrO4的还原反应可表述为如下方程式:
![]()
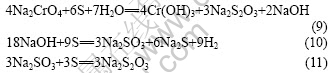
![]()
硫磺粉或者Na2S均可以作为还原剂,将Na2CrO4还原成Cr(OH)3?2H2O。为了后续的过滤和洗涤能顺利进行,需要控制还原产物的形态呈结晶状,而不是胶状。还原实验结果列于表2。
表2 Na2CrO4还原实验结果
Table 2 Na2CrO4 reduction experimental results
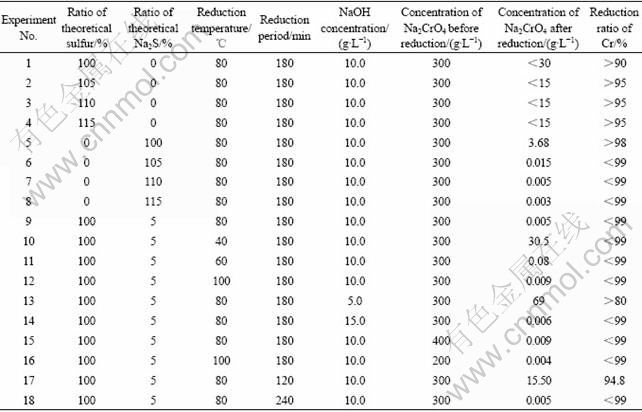
采用硫磺粉作为Na2CrO4的还原剂,铬的还原反应速率和比率均比采用Na2S作为还原剂时的低。但由于采用硫磺粉作为还原剂,获得的产物Cr(OH)3? 2H2O多呈结晶状,而采用Na2S作为还原剂时产生胶状的Cr(OH)3?2H2O,且Na2S的价格比硫磺粉高很多,因此还原过程采用两者的混合物,90%的硫磺粉和10%的Na2S。适宜的还原剂配入比为1.05~1.1 (根据方程式(8)和(9)计算所得)。
还原温度的升高有助于生成结晶状的Cr(OH)3? 2H2O和提高还原速率。但温度的升高将使能耗升高,因此适宜的还原温度为60~80 ℃。
表2显示,还原时间为180~240 min时,将还原剂分成5份,每隔30 min,加入1份还原剂进入铬酸钠溶液中。否则,Cr(OH)3?2H2O的生成速率太快,Cr(OH)3?2H2O将很容易变成胶状。
溶液中NaOH初始浓度为8~12 g/L。当NaOH初始浓度低于5 g/L,与硫磺粉的还原反应不会发生。与之相反,当NaOH浓度大于15 g/L,Cr(OH)3?2H2O变成胶状且NaOH消耗量增大,因此NaOH浓度不能大于15 g/L。当溶液中铬酸钠的浓度为200~400 g/L时,铬酸钠的浓度将不再影响Cr(OH)3?2H2O的生成和还原速率。实验获得的Cr(OH)3?2H2O中含有37.02% Cr,接近于纯的Cr(OH)3?2H2O。
Cr(OH)3?2H2O由纯的H2SO4和Cr2(SO4)3共沉淀生成,反应方程式如下:

分解反应释放大量能量,使反应温度维持在100 ℃以上,加快分解反应速率,并使反应发生完全。溶液中的杂质如Na2S, S 和 Na2S2O3也同时发生沉淀,转变成不会影响电镀的产物。生成的Cr2(SO4)3溶液含Cr 150~250 g/L,其pH 为 2.0~3.0。
3 结论
1) 采用本工艺流程能获得接近纯的Cr2(SO4)3溶液,含Cr 150~250 g/L,其pH为2.0~3.0。
2) 适宜的烧结条件为:烧结温度1050~1150 ℃,烧结时间60~90 min;白云石和苏打的配入量分别为1~1.4倍和1.05~1.1倍。
3) 适宜的浸出条件为:温度80 ℃,烧结矿粒度>420 μm,浸出时间120~130 min,固液比1.5~2.5。
4) 适宜的除铝条件为:pH7~8,温度80 ℃,时间120~150 min。
5) 适宜的还原条件为:还原剂配入量为1.05~1.1倍,其中含90% S和10% Na2S,还原温度60~80 ℃,还原时间180~240 min,NaOH初始浓度8~12 g/L。
6) 2Cr(OH)3?2H2O由纯的H2SO4与Cr2(SO4)3共沉淀生成。
REFERENCES
[1] ATKINSON T D, FJELLVAQ H, KJEKSHUS A. Synthesis, structure, and properties of chromium (Ⅲ) sulfates [J]. Journal of Solid State Chemistry, 2004, 177(11): 4351-4358.
[2] SULLY A H. Metallurgy of the rarer metals, chromium [M]. London: Butterworths Scientific Publication, 1954.
[3] VARDAR E, ERIC R H, LETOWSKI F K. Acid leaching of chromite [J]. Minerals Engineering, 1994, 7(5/6): 605-617.
[4] 李广志, 殷恒波, 李海霞. 硫酸铬(Ⅲ)生产工艺开发及在电镀中应用研究][J]. 江苏环境科技, 2007, 20(2): 11-14.
LI Guang-zhi, YIN Heng-bo, LI Hai-xia. Technology exploitation of synthesis of chromium (Ⅲ) sulfate and its application in electroplating [J]. Jiangsu Environmental Science and Technology, 2007, 20(2): 11-14.
[5] 阎江峰, 陈加希, 胡 亮. 铬冶金[M]. 北京: 冶金工业出版社, 2007.
YAN Jiang-fen, CHEN Jia-xi, HU Liang. Metallurgy of chromium [M]. Beijing: Metallurgical Industry Press, 2007.
[6] LINDSAY J, JAMES H. Decorative and hard chromium plating [J]. Plating and Surface Finishing, 2003, 90(8): 22-24.
[7] MAX C. Potential hazards of hexavalent chromate in our drinking water [J]. Toxicology and Applied Pharmacology, 2003, 188(1): 1-5.
[8] EL-SHARIF M. Replacing hexavalent chromium in electroplating [J]. Transaction of the Institute of Metal Finishing, 1997, 75(6): B143-B146.
[9] EL-SHARIF M. MCDOUGALL J, CHISHOLM C U. Electro- deposition of thick chromium coatings from an environmentally acceptable chromium (Ⅲ): Glycine complex [J]. Transaction of the Institute of Metal Finishing. 1999, 77(4): 139-144.
[10] MARVIN J U. Chromium(vol.Ⅱ): metallurgy of chromium and its alloys [M]. New York: Reinhold Publishing Corporation, 1956.
[11] CHAUDHARY A J, GOSWAMI N C, GRIMES S M. Electrolytic removal of hexavalent chromium from aqueous solutions [J]. Journal of Chemical Technology and Biotechnology, 2003, 78(8): 877-883.
[12] JOHN B V. Recent developments in the biochemistry of chromium (Ⅲ) [J]. Biological Trace Element Research, 2004, 99(1/3): 1-16.
[13] MANJANNA J, VENKATESWARAN G. Dissolution of chromium-substituted iron oxides in V(Ⅱ) formulations[J]. Hydrometallurgy, 2001, 61(1): 45-63.
[14] SHANKER A K, CERVANTES C, LOZA-TAVERA H, AVUDAINAYAGAM S. Chromium toxicity in plants [J]. Environment International, 2005, 31(5): 739-753.
[15] AMER A M. Processing of Ras-Shait chromite deposits [J]. Hydrometallurgy, 1992, 28(1): 29-43.
[16] GEVECI A, TOPKAYA Y, AYHAN E. Sulfuric acid leaching of turkish chromite concentrate [J]. Minerals Engineering, 2002, 15(11): 885-888.
通讯作者:李荣兴,副教授;电话:0871-5186166;E-mail: lrxlyw@163.com
(编辑 陈爱华)


