文章编号:1004-0609(2010)03-0572-06
合成温度对LiFePO4/C复合材料电化学性能的影响
郑 威,余红明,曹高劭,赵新兵
(浙江大学 材料科学与工程学系,杭州310027)
摘 要:
以FePO4为铁源、Li2CO3为锂源、聚丙烯为还原剂和碳源,采用一步固相法合成原位碳包覆磷酸亚铁锂(LiFePO4/C)复合材料,研究合成温度对材料LiFePO4/C复合材料电化学性能的影响。采用X射线衍射、扫描电镜和拉曼光谱技术对合成产物的晶体结构、表面形貌和碳结构进行表征,通过电化学阻抗谱(EIS)和充放电测试对材料的电化学性能进行测试和分析。结果表明:在600~750 ℃温度范围内都可合成纯LiFePO4/C复合材料,随着合成温度的升高,材料颗粒尺寸和石墨化程度都将增大;600 ℃保温8 h合成的材料颗粒尺寸为100~500 nm,其1 C放电比容量达到144.2 mA?h/g,5 C放电比容量达到119 mA?h/g。
关键词:
中图分类号:TM912.9 文献标识码:A
Effect of synthesis temperature on electrochemical performances of LiFePO4/C composites
ZHENG Wei, YU Hong-ming, CAO Gao-shao, ZHAO Xin-bing
(Department of Materials Science and Engineering, Zhejiang University, Hangzhou 310027, China)
Abstract: LiFePO4/C composites were synthesized by one-step solid-state reaction using FePO4 and Li2CO3 as raw materials and polypropylene as reductive agent and carbon source. The effect of synthesis temperature on the electrochemical performances of LiFePO4/C composites was studied. The microstructure, morphology of the products and the structure of carbon were characterized by X-ray diffractometry (XRD), scanning electron microscopy (SEM) and Raman microprobe spectra. The electrochemical impedance spectroscopy (EIS) and charge-discharge test were used to study their electrochemical performances. The results show that LiFePO4/C composites can be synthesized in the temperature range from 600 to 750 ℃. The size of the particle and the degree of graphitization increase with increasing synthesis temperature. The size of LiFePO4/C composites synthesized at 600 ℃ for 8 h is about 100?500 nm, and it has discharge capacities of 144.2 and 119 mA?h/g at 1 C and 5 C rates, respectively.
Key words: LiFePO4/C; lithium ion batteries; cathode materials
橄榄石型的磷酸亚铁锂被认为是最有前途的锂离子动力电池的正极材料,它具有较高的理论容量(接近170 mA?h/g),同时还具有价格低廉、环境友好、热 稳定性高、化学相容性好以及循环稳定性突出等优 点[1?2]。但LiFePO4的低电导率(室温下约为10?9 S/cm)和低锂离子扩散系数导致其高倍率性能差,从而大大限制其实际应用。目前,国内外对提高LiFePO4的高倍率性能进行广泛的研究,主要从以下两个方面解决问题:1) 采用不同位置的离子掺杂和表面包覆导电相提高LiFePO4的电导率[3?5];2) 优化制备工艺[6],采用不同的合成方法如水热法[7?8]、溶胶凝胶法[9]和微波 法[10]等制备纳米级别的LiFePO4颗粒,通过减小颗粒尺寸以缩短电子和锂离子的迁移距离,从而提高材料的电导率。
为降低成本,简化工艺同时提高材料的高倍率性能,本文作者在课题组前期的研究基础上[11?13],以三价铁(FePO4)为铁源、Li2CO3为锂源、聚丙烯为还原剂和碳源,采用一步固相法合成LiFePO4/C材料,通过充放电和电化学阻抗谱测试,研究了合成温度对LiFePO4/C复合材料性能的影响。
1 实验
以分析纯Li2CO3、FePO4·2H2O为原料,添加聚丙烯作为碳源和还原剂,以无水乙醇作为分散剂,按球料质量比5?1混料在行星式球磨机上以300 r/min的转速球磨8 h混合均匀。混合料在80 ℃下搅拌干燥后,在N2保护下以5 ℃/min升温至不同焙烧温度,保温8 h后炉内缓冷至室温,得到灰黑色的固体粉末。
试样的物相分析在Rigaku?D/MAX?2550PC型X射线粉末衍射仪上进行,使用CuKα辐射(λ=0.154 06 nm),Ni滤波片,管压40 kV,管流20 mA,扫描范围10?~80?。采用FEI Sirion型场发射扫描电子显微镜观察试样微观形貌。拉曼光谱分析在Labor Raman HR?800型激光拉曼谱仪上进行,功率为10 mW,波长为514.532 nm。采用EA?112型元素分析仪分析合成产物中的碳包覆量。
采用钮扣型模拟电池进行正极材料的电化学测试。工作电极中的正极材料活性物质、导电剂乙炔黑和粘结剂聚偏氟乙烯的质量比为75?15?10,对电极为金属锂片,隔膜为Celgard 2325复合膜,电解液为1 mol/L LiPF6的等体积比碳酸乙烯脂(EC)、二甲基碳酸脂(DMC)溶液。电池组装在充满氩气的手套箱中完成。采用PCBT-100-64D多通道电池程控测试仪进行恒流充放电测试,电池充电时电流与放电时电流相等,测试温度为室温,测试电压范围2.5~4.3 V(vs Li+/Li),充放电倍率分别为0.1 C、0.5 C、1 C、2 C和5 C。采用CHI660C型电化学工作站进行电化学阻抗谱(EIS)测试,测试温度为室温,施加的交流电压幅值5 mV,频率范围为105~10?2 Hz。
2 结果与讨论
图1所示为Li2CO3、FePO4·2H2O和聚丙烯混合物在N2气氛下以10 ℃/min的升温速度从室温加热到1 000 ℃的TG?DTA谱。从图1可知,从室温到480 ℃温度范围内,混合物存在两个明显的质量损失过程,100 ℃前的质量损失对应于游离态水的脱去,168 ℃左右的质量损失与FePO4·2H2O脱去结晶水有关,这一结果与文献[14]中的报道基本吻合。在DTA曲线上,449 ℃的放热峰对应LiFePO4晶体的生成,而472 ℃的吸热峰与聚丙烯的热解相关,这与LUYT等[15]报道的聚丙烯热解数据吻合,480 ℃后没有明显的质量损失,这表明LiFePO4/C合成温度高于480 ℃。因此,本实验中选择在550、600、650、700和750 ℃时合成LiFePO4/C复合材料。
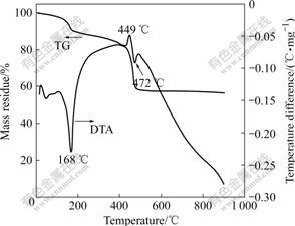
图1 FePO4·2H2O、Li2CO3和聚丙烯混合物的TG?DTA曲线
Fig.1 TG?DTA curves of mixture of FePO4·2H2O, Li2CO3 and polypropylene
图2所示为不同温度下合成LiFePO4/C的XRD谱。对照JCPDF(83?2092)可以看出,所合成材料的主相都可标定为正交晶系Pnmb空间群的橄榄石型LiFePO4。550 ℃合成材料中含Li2CO3杂相,因而LiFePO4中的锂含量不足,峰位向右有所偏移,说明其反应并不完全。从600 ℃开始,Li2CO3的杂相消失,并随着合成温度的升高,LiFePO4各晶面衍射峰变的越发尖锐,晶体生长越来越完善。
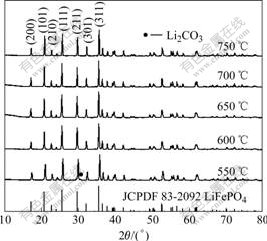
图2 不同温度下合成LiFePO4/C复合材料的XRD谱
Fig.2 XRD patterns of LiFePO4/C composites synthesized at different temperatures
图3所示为600、650、700和750 ℃下合成的LiFePO4/C复合材料的SEM像。从图3可以看出,不同温度下合成LiFePO4/C均呈现出近似球状的颗粒形貌。固相反应材料的长大阶段控制因素主要为原子和离子的扩散,根据Arrhenius公式可知,扩散系数与 T ?1成指数关系,所以随着温度的升高,在同样的合成时间下,颗粒长大明显,从平均颗粒尺寸不足500 nm增大至1 mm左右。

图3 不同温度下合成LiFePO4/C(复合材料)的SEM像
Fig.3 SEM images of LiFePO4/C composites synthesized at different temperatures: (a) 600 ℃; (b) 650 ℃; (c) 700 ℃; (d) 750 ℃
根据元素分析可知,600、650、700和750 ℃下合成LiFePO4/C中的碳含量(质量分数)分别为2.7%、2.4%、2.5%和2.6%,其碳含量相当。图4所示为所合成材料的Raman谱。从图4可以看出,所有材料较强的Raman谱均出现在1 305和1 580 cm?1附近。有关碳材料的Raman谱分析[16]认为,1 305 cm?1附近是反映碳无序化的D峰,1 580 cm?1附近是反映碳石墨化的G峰。通常认为,1 305和1 580 cm?1处Raman峰面积强度比Asp3/Asp2是表征碳石墨化程度的重要参数。随着焙烧温度从600 ℃升到750 ℃时,Asp3/Asp2值逐渐减小,这说明提高焙烧温度有利于碳的石墨化,这与文献[17]中的结果一致。相对于无定形碳而言,石墨化程度高的碳电导率更高,更有利于提高材料的电导率。
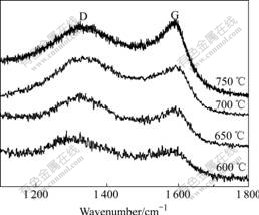
图4 不同温度下合成的LiFePO4/C的Raman谱
Fig.4 Raman spectra of LiFePO4/C synthesized at different temperatures
图5所示为不同温度下合成材料的电化学性能。图5(a)和5(b)所示分别为所合成的材料在0.1 C和1 C倍率下的放电曲线。由图5(a)和(b)可知,在0.1 C倍率充放电时,600、650、700和750 ℃合成材料的放电比容量分别达到159.4、153.7、149和153.5 mA?h/g;在1 C倍率充放电时,600、650、700和750 ℃合成材料的放电比容量分别可以达到144.2、141.1、84.2和102.9 mA?h/g。图5(c)所示为不同温度合成的LiFePO4/C在不同充放电倍率下连续循环时的放电比容量,从图5(c)可以看出,600 ℃合成材料的倍率性能最好。

图5 不同温度下合成的 LiFePO4/C的电化学性能
Fig.5 Electrochemical performances of LiFePO4/C synthesized at different temperatures: (a) Discharge voltage profiles at 0.1 C; (b) Discharge voltage profiles at 1 C; (c) Discharge capacities in continuous cycling at various rates; (d) Discharge voltage profiles of LiFePO4/C synthesized at 600 ℃ at various rates
通过比较材料在不同倍率下放电比容量可知,随着合成温度的升高,材料的性能先下降然后上升。随着合成温度的升高材料颗粒的增大比较明显,颗粒尺寸的增大将增加锂离子的扩散路径,促使充放电时电极极化加大,特别是在高倍率下极化将更为严重,从而降低材料的放电容量。但是由于碳石墨化程度随着合成温度的升高而加大,有利于提高材料的电导率减小极化,从而出现电学性能先下降然后有所上升的现象。以上分析表明,材料颗粒的大小和颗粒表面碳石墨化程度对材料的电学性能均有很大影响,其中颗粒尺寸影响较大,这与GABERSCEK等[18]通过建模计算的结果相符合。图5(d)所示为600 ℃时合成材料在不同倍率下的放电容量曲线。从图5(d)可以看出,在1 C、5 C充放电时,材料的放电比容量分别达到144.2和119.1 mA?h/g。
为了进一步研究焙烧温度对LiFePO4/C复合材料正极反应过程的影响,实验中对循环13次后的电池在室温下进行交流阻抗测试。图6所示为不同温度下合成的LiFePO4/C经过13次循环后的阻抗谱。
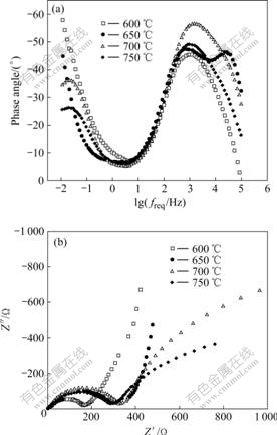
图6 不同温度下合成的LiFePO4/C复合材料经过13次循环后的阻抗谱
Fig.6 EIS spectra of LiFePO4/C composites synthesized at different temperatures after 13 cycles: (a) Bode plots; (b) Nyquist plots
从图6(a)所示的波特谱可以看出,600、650、700和750 ℃合成的材料在中频区(1 kHz左右)都存在一个峰值,这对应着固体电极界面发生法拉第过程的电荷转移电阻和非法拉第过程的双电层电容的并联。但是在700和750 ℃时,在低频区(<1 Hz=出现一个峰值,这对应着体电阻和电容的并联,该电阻和电容起源于活性材料低的离子电导率,它会随着材料电导率的提高而消失[19?20]。与此相应的能奎斯谱(见图6(b))中,700和750 ℃的阻抗谱由中频区的半圆和低频区的圆弧组成,低频区的倾斜线(倾斜线对应着扩散阻抗)并没有出现。HO等[21]提出,阻挡层扩散模型,同时利用EIS谱研究Li+在活性材料中的扩散,证明抛物线型的扩散阻抗出现的早晚与离子的扩散大小相关,表观扩散系数越大,阻抗谱中扩散阻抗出现得越早,由此可以看出,700和750 ℃ 中锂离子的扩散相比600和650 ℃非常缓慢因而其极化也更大,其中600 ℃的离子扩散系数最大。同时由图6(b)所示的Nyquist谱中可以看出,600 ℃压缩的半圆最小,这说明在由电荷转移电阻引起的电极极化中,600 ℃时极化最小,锂离子的脱嵌阻力也最小,这都与其较好的充放电性能相对应。
3 结论
1) 采用固相焙烧方法以Li2CO3、FePO4·2H2O和聚丙烯为原料合成原位碳包覆的LiFePO4/C复合材料。在600、650、700和750 ℃焙烧时均可合成出纯的LiFePO4材料,当合成温度不超过550 ℃时,材料中将出现杂相。
2) 不同温度下合成材料的表观形貌、晶体结构、碳的结构和其充放电性能均有较大的差异。材料颗粒的大小及颗粒表面碳石墨化程度对材料的电学性能均有很大影响。电化学阻抗谱和充放电测试证明颗粒 尺寸影响较大,对Li+的表观扩散系数有着显著的 影响。
3) 在600 ℃下焙烧合成的LiFePO4/C复合材料的颗粒细小均匀,尺寸为100~500 nm,其1 C放电比容量达到144.2 mA?h/g,2 C放电比容量达到135.4 mA?h/g,5 C放电比容量达到119 mA?h/g。
[1] PADHI A K, NANJUNDASWAMY K S, GOODENOUGH J B. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J]. Journal of The Electrochemical Society, 1997, 114(4): 1188?1194.
[2] DEB A, BERGMANN U, CAIRNS E J, CRAMER S P. Structural investigations of LiFePO4 electrodes by Fe X-ray absorption spectroscopy[J]. The Journal of Physical Chemistry B 2004, 108(22): 7046?7051.
[3] CHUNG S Y, BLOKING J T, CHIANG Y M. Electronically conductive phospho-olivines as lithium storage electrodes[J]. Nature Materials, 2002, 1(2): 123?128.
[4] YANG S F, ZAVALIJ P Y, WHITTINGHAM M S. Hydrothermal synthesis of lithium iron phosphate cathodes[J]. Electrochemistry Communications, 2001, 3(9): 505?508.
[5] 王晓琼, 李新海, 王志兴, 郭华军, 彭文杰, 刘凤举. 锂离子电池正极材料 LiFe0.9 Ni0.1PO4的合成与性能[J]. 中国有色金属学报, 2006, 16(4): 739?745.
WANG Xiao-qiong, LI Xin-hai, WANG Zhi-xing, GUO Hua-jun, PENG Wen-jie, LIU Feng-ju. Synthesis and performance of LiFe0.9Ni0.1PO4 as cathode material in lithium-ion battery[J]. The Chinese Journal of Nonferrous Metals, 2006, 16 (4): 739?745.
[6] WANG Y Q, WANG J L, YANG J, NULI Y N. High-rate LiFePO4 electrode material synthesized by a novel route from FePO4·4H2O[J]. Advanced Functional Materials, 2006, 16(16): 2135?2140.
[7] JIN B, GU H B. Preparation and characterization of LiFePO4 cathode materials by hydrothermal method[J]. Solid State Ionics, 2008, 178(37/38): 1907?1914.
[8] 庄大高, 赵新兵, 曹高劭, 米常焕, 涂 健, 涂江平. 水热法合成 LiFePO4的形貌和反应机理[J]. 中国有色金属学报, 2005, 15(12): 2034?2039.
ZHUANG Da-gao, ZHAO Xin-bing, CAO Gao-shao, MI Chang-huan, TU Jian, TU Jiang-ping. Morphology and reaction mechanism of LiFePO4 prepared by hydrothermal synthesis[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(12): 2034?2039.
[9] YANG J S, XU J J. Nonaqueous sol-gel synthesis of high-performance LiFePO4[J]. Electrochemical and Solid-State Letters, 2004, 7(12): A515?A518.
[10] PARK K S, SON J T, CHUNG H T, KIM S J, LEE C H, KIM H G. Synthesis of LiFePO4 by co-precipitation and microwave heating[J]. Electrochemistry Communications, 2003, 5(10): 839?842.
[11] MI C H, ZHAO X B, CAO G S, TU J P. In situ synthesis and properties of carbon coated LiFePO4 as Li-ion battery cathodes[J]. Journal of The Electrochemical Society, 2005, 52(3): A483?A487.
[12] MI C H, CAO G S, ZHAO X B. Low-cost, one-step process for synthesis of carbon-coated LiFePO4 cathode[J]. Materials Letters, 2005, 59(1): 127?130.
[13] 陈学军, 赵新兵, 曹高劭, 马胜林, 谢 健, 朱铁军. 一步固相合成Nb掺杂LiFePO4/C及其电化学性能[J]. 中国有色金属学报, 2006,16(10): 1665?1671.
CHEN Xue-jun, ZHAO Xin-bing, CAO Gao-shao, MA Sheng-lin, XIE Jian, ZHU Tie-jun. Electrochemical properties of Nb doped LiFePO4/C prepared by one-step solid-state synthesis[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(10): 1665?1671.
[14] WANG L, LIANG G C, QU X Q, ZHI X K, ZHANG J P, CUI J Y. Effect of synthesis temperature on the properties of LiFePO4/C composites prepared by carbothermal reduction[J]. Journal of Power Sources, 2009, 189(1): 423?428.
[15] LUYT A S, DRAMICANIN M D, ANTIC Z, DJOKOVIC? V. Morphology, mechanical and thermal properties of composites of polypropylene and nanostructured wollastonite ?ller[J]. Polymer Testing, 2009, 28(3): 348?356.
[16] KIM J K, CHOI J W, CHAUHAN G S, AHN J H, HWANG G C, CHOI J B, AHN H J. Enhancement of electrochemical performance of lithium iron phosphate by controlled sol-gel synthesis[J]. Electrochimica Acta, 2008, 53(28): 8258?8264.
[17] GEORGE T K F, KAO Y C. Synthesis and characterization of pyrolyzed sugar carbons under nitrogen or argon atmospheres as anode materials for lithium-ion batteries[J]. Materials Chemistry and Physics, 2002, 73(1): 37?46.
[18] GABERSCEK M, DOMINKO R, JAMNIKJ. Is small particle size more important than carbon coating? An example study on LiFePO4 cathodes[J]. Electrochemistry Communications, 2007, 9(12): 2778?2783.
[19] SHARMA N, PLVENTJ, RAO G V S, CHOWDARI B V R, WHITE T J. Tin Oxides with hollandite structure as anodes for lithium ion batteries[J]. Chemistry of Materials, 2005, 17(18): 4700?4710.
[20] LEVI M D, AURBACH D. Impedance of single intercalation particle and of non-homogeneous, multilayered porous composite electrodes for Li-ion batteries[J]. The Journal of Physical Chemistry B, 2004, 108(31): 11693?11703.
[21] HO C, RAISTRICK I D, HUGGINS R A. Application of A-C techniques to the study of lithium diffusion in tungsten trioxide thin films[J]. Journal of The Electrochemical Society, 1980, 127(2): 343?350.
基金项目:浙江省科技计划资助项目(2007C21100)
收稿日期:2009-05-19;修订日期:2009-09-25
通信作者:曹高劭,副教授,博士;电话:0571-87952181;E-mail: gscao@zju.edu.cn
摘 要:以FePO4为铁源、Li2CO3为锂源、聚丙烯为还原剂和碳源,采用一步固相法合成原位碳包覆磷酸亚铁锂(LiFePO4/C)复合材料,研究合成温度对材料LiFePO4/C复合材料电化学性能的影响。采用X射线衍射、扫描电镜和拉曼光谱技术对合成产物的晶体结构、表面形貌和碳结构进行表征,通过电化学阻抗谱(EIS)和充放电测试对材料的电化学性能进行测试和分析。结果表明:在600~750 ℃温度范围内都可合成纯LiFePO4/C复合材料,随着合成温度的升高,材料颗粒尺寸和石墨化程度都将增大;600 ℃保温8 h合成的材料颗粒尺寸为100~500 nm,其1 C放电比容量达到144.2 mA?h/g,5 C放电比容量达到119 mA?h/g。


