文章编号:1004-0609(2016)-04-0908-11
锌粉置换镓锗渣硫酸浸出过程
刘付朋,刘志宏,李玉虎,刘智勇,李启厚,文达敏
(中南大学 冶金与环境学院,长沙 410083)
摘 要:
摘 要:考察锌粉置换镓锗渣硫酸浸出中,硫酸浓度、温度、液固比、浸出时间和添加剂对Ga、Ge浸出率及浸出渣过滤性能的影响,揭示添加硝酸钠和十二烷基磺酸钠促进浸出过程的作用机理。结果表明:浸出液中添加适量硝酸钠或十二烷基磺酸钠,均可促进Ga、Ge浸出;此外,十二烷基磺酸钠还可改善浸出渣的过滤性能。添加剂的作用机理为硝酸根能使Ga、Ge单质及其硫化物氧化,从而促进Ga、Ge浸出;十二烷基磺酸钠则通过促进溶液中硅胶的絮凝,减少其对Ga、Ge的吸附,同时,使浸出渣的过滤性能得以改善。在温度为90 ℃、液固比为10 mL/g、搅拌速度为300 r/min、浸出时间为4 h、硫酸浓度为156 g/L、硝酸钠浓度为52.29 g/L、十二烷基磺酸钠浓度为20.5 g/L的条件下,Ga和Ge的浸出率可分别达到97.01%和90.45%,浸出料浆过滤速度由未添加十二烷基磺酸钠时的0.48 mL/min提高到30.65 mL/min。
关键词:
中图分类号:TF803.21 文献标志码:A
Ga、Ge光电和化学性能独特优异,广泛应用于半导体、红外光学、光纤通讯等高科技领域[1-2]。自然界中极少有独立Ga、Ge矿床存在,Ga、Ge主要伴生于其他有色金属矿中,在锌、铝等有色金属冶炼过程中得以富集回收[3]。
我国南方或西南地区产出的部分锌精矿,Ga、Ge含量较高,具有综合回收价值,是重要的Ga、Ge资源。在焙烧-浸出-净化-电积常规湿法炼锌中,锌精矿中伴生的Ga、Ge分散于浸出渣和除铁渣等副产物中,难以有效回收。我国某厂采用“两段逆流高酸氧压浸出工艺”处理富含Ga、Ge的锌精矿[4],浸出过程中,大部分Ga、Ge与Zn一同溶解进入浸出液。浸出液预中和后,以锌粉置换沉淀Ga、Ge,得到所谓“锌粉置换镓锗渣”,Ga和Ge含量分别为0.2%~0.4%和0.2%~0.5%(质量分数),具有较高的综合回收价值。锌粉置换镓锗渣成分和物相较为复杂,其所含Ga、Ge浸出难度较大。
针对湿法炼锌副产物中Ga、Ge的高效回收,国内外学者开展了颇为广泛的研究[4-20]。尽管还原挥发或硫化挥发等火法回收方法工艺简单、流程较短,但其存在回收率较低、能耗较高、污染严重等缺点[5]。因而,湿法回收技术是当前处理含Ga、Ge物料的主要工艺,且随着Ga、Ge萃取技术的完善和成熟,开发Ga、Ge物料的高效浸出工艺已成为当前的研究热点[6-12]。WARDEL[13]研究锌浸出渣的常压硫酸浸出工艺发现,当浸出温度为100 ℃时,向体系中通入SO2,Ga的浸出率可达92%,但Ge的浸出率仅为59%左右;王小能[14]研究认为,向浸出体系中通入氯气或加入盐酸,均可提高氧化焙烧渣锗的浸出率,但该工艺存在环境污染严重、后续处理难度较大的缺陷;KUL等[15]研究铜镉渣氧化酸浸工艺发现,在浸出过程中加入强氧化剂或通入空气,均可使Ge的浸出率达到90%左右,但浸出料浆过滤性能较差。为消除原料中的Si对Ga、Ge浸出的影响,HARBUCK[16-17]和王继民等[18]分别采用硫酸与氢氟酸混合酸浸出高硅锌浸出渣中的Ga、Ge,Ga、Ge的浸出率均可达98%以上;此外,黄和明等[19]也研究高硅含锗二次物料的浸出工艺,以氢氟酸为浸出剂,Ge的浸出率达到92%。尽管在浸出体系中引入氢氟酸可改善高硅含锗物料中Ge的浸出效果,但氟离子对设备腐蚀严重,且含氟浸出液后序处理难度较大。
综上所述,尽管针对各类物料中Ga、Ge的高效提取开展了大量研究,取得了一定的研究进展,但对高Si含Ga、Ge料的处理工艺仍有待完善。在前期研究工作中,刘付朋等[20]开展了高压酸浸处理高硅高铁含Ga、Ge物料的研究,通过向浸出体系中引入助浸剂以强化Ga、Ge的浸出,可使得Ga、Ge的浸出率分别达98%和94%以上,且浸出渣的过滤性能得到明显改善,但由于高压酸浸设备复杂、投资及运行成本较高,难以工业化。然而,这一工作表明,在浸出体系中引入助浸剂的思路是可行的。为此,本文作者拟在已有工作的基础上,通过向硫酸浸出体系中引入硝酸钠和十二烷基磺酸钠作为助浸剂,将物料中以金属和硫化物形态存在的Ga、Ge转化为易溶性的氧化物,抑制溶液中硅对Ga、Ge浸出的不利影响,改善浸出渣的过滤性能,从而实现高硅高铁含Ga、Ge物料中Ga、Ge的高效提取。
1 实验
1.1 实验原料
实验所用锌粉置换镓锗渣产自国内某冶炼厂,经干燥、磨细、混合后用作试验原料,其75%的粒度小于45 μm。物料化学成分、化学物相分析结果分别列于表1和2。物料的XRD谱如图1所示。物料EPMA点分析结果如图2和表3所示。物料中Ga、Ge、Fe、Si的元素面分布图如图3所示。
由表1可知,实验所用锌粉置换镓锗渣主要成分为Zn、Si、Cu、Fe等,其中Fe(Ⅱ)含量为3.74%(质量分数),占原料总铁含量的47.66%(质量分数);其Ga和Ge的含量分别为0.266%和0.362%(质量分数)。
表1 锌粉置换镓锗渣主要化学成分
Table 1 Main composition of zinc powder replacement residue containing gallium and germanium (mass fraction, %)

表2 锌粉置换镓锗渣中镓锗物相的化学分析结果
Table 2 Gallium and germanium phases in zinc powder replacement residue containing gallium and germanium by chemical analysis (mass fraction, %)
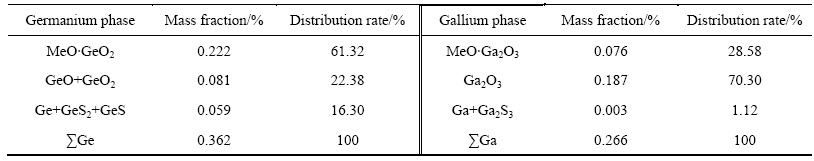
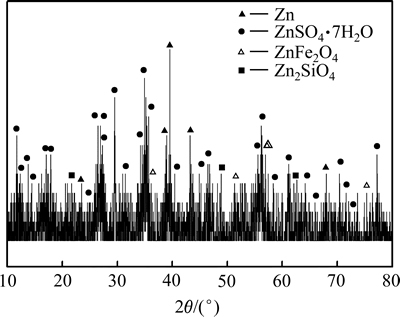
图1 锌粉置换镓锗渣XRD谱
Fig. 1 XRD pattern of zinc powder replacement residue containing gallium and germanium

图2 锌粉置换镓锗渣电子探针分析图
Fig. 2 EPMA image of zinc powder replacement residue containing gallium and germanium
表3 锌粉置换镓锗渣电子探针分析结果
Table 3 Electron probe microanalysis of zinc powder replacement residue containing gallium and germanium in Fig. 2
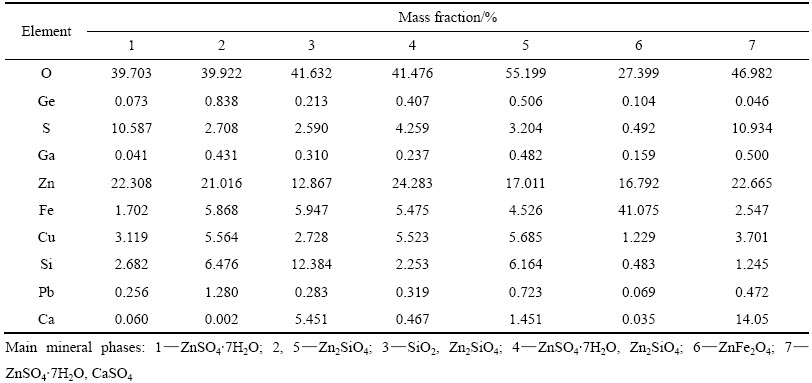
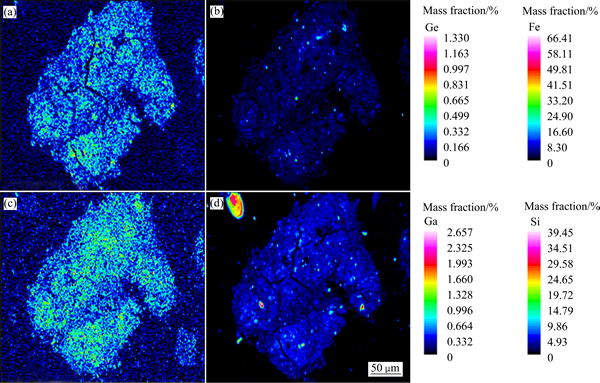
图3 Ge、Fe、Ga、Si元素在锌粉置换镓锗渣中的分布
Fig. 3 Distribution of Ge(a), Fe(b), Ge(c), Si(d) in zinc powder replacement residue containing gallium and germanium
由表2可知,Ge主要以MeO·GeO2、GeO2形态存在,少量为Ge、GeS、 GeS2;而Ga主要以Ga2O3、MeO·Ga2O3形态存在,少量为Ga、Ga2S3。图1中的XRD分析结果表明,锌粉置换镓锗渣中主要物相为金属锌、硫酸锌,也有少量铁酸锌、硅酸锌存在,由于含量较低,未见含Ga、Ge物相的衍射峰。由表3电子探针定量分析结果可知,锌粉置换镓锗渣中Ga、Ge主要分布在硅酸锌、铁酸锌中,在硅酸锌中Ga、Ge的分布要多于铁酸锌;Ga也分布硫酸钙中;Ga、Ge在单独的硫酸锌物相中分布较少。从图3所示的Ga、Ge、Fe、Si元素在锌粉置换镓锗渣中的分布图可知,Ga、Ge主要以弥散状态分布在整个物料中,在含Fe、Si的区域中均有分布。
1.2 实验方法
量取一定体积已知浓度的H2SO4溶液于500 mL 三口瓶中,将三口瓶置于恒温水浴中,升温至实验温度,然后按照预定的液固体积质量比加入一定质量的锌粉置换镓锗渣,开启搅拌,搅拌速度为300 r/min,保温一定时间。浸出结束后,料液真空抽滤,记录过滤时间,收集滤液并计量其体积,取样分析。滤渣干燥后称取质量,取样分析。
1.3 分析方法
采用Rigaku-TTRIII型X 射线衍射仪(Cu靶,Kα1=1.5406 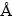 )分析锌粉置换镓锗渣及浸出渣中物质的物相组成;采用JSM-6360LV 型扫描电镜观察浸出渣形貌;采用JXA-8230型电子探针分析仪及化学选择性溶解的方法分析锌粉置换镓锗渣和浸出渣中Ga和Ge的物相组分及含量;采用NEXUS-670型FT-IR分析仪(KBr压片)分析浸出渣的红外光谱,了解表面活性剂的作用机理;采用EDTA直接滴定法分析浸出液中Zn的含量(GB/T 8151.1-2000);采用硅钼蓝分光光度法测定浸出液中SiO2的浓度(GB/T 8151.4-200);采用萃取分离苯芴酮分光光度法测定溶液及渣中Ge的含量(GB/T 8151.13-2000);采用电感耦合等离子发射光谱法测定溶液及渣中Ga、Fe、Cu的含量;浸出料浆置于d 100 mm布氏漏斗中,用SHZ-D(Ⅲ)水循环式真空泵在真空度为0.07 MPa条件下抽滤,测定浸出液过滤速率以表征浸出渣的过滤性能。
)分析锌粉置换镓锗渣及浸出渣中物质的物相组成;采用JSM-6360LV 型扫描电镜观察浸出渣形貌;采用JXA-8230型电子探针分析仪及化学选择性溶解的方法分析锌粉置换镓锗渣和浸出渣中Ga和Ge的物相组分及含量;采用NEXUS-670型FT-IR分析仪(KBr压片)分析浸出渣的红外光谱,了解表面活性剂的作用机理;采用EDTA直接滴定法分析浸出液中Zn的含量(GB/T 8151.1-2000);采用硅钼蓝分光光度法测定浸出液中SiO2的浓度(GB/T 8151.4-200);采用萃取分离苯芴酮分光光度法测定溶液及渣中Ge的含量(GB/T 8151.13-2000);采用电感耦合等离子发射光谱法测定溶液及渣中Ga、Fe、Cu的含量;浸出料浆置于d 100 mm布氏漏斗中,用SHZ-D(Ⅲ)水循环式真空泵在真空度为0.07 MPa条件下抽滤,测定浸出液过滤速率以表征浸出渣的过滤性能。
2 结果与讨论
2.1 硫酸浓度的影响
在温度90 ℃、时间4 h、助浸剂(NaNO3) 52.29 g/L、液固比10 mL/g、搅拌速度300 r/min、十二烷基磺酸钠5.46 g/L的条件下,考察了硫酸浓度对主要金属元素浸出率及浸出渣过滤性能的影响,其结果如图4所示。
由图4(a)可知,在试验所考察的酸度范围内,硫酸浓度的变化对Cu、Ga、Zn、Fe的浸出率影响不大,分别在97%、95%、85%和80%左右,但当硫酸浓度从120 g/L增加132 g/L时,Ge的浸出率迅速由67.60%提高至83.78%,进一步增加硫酸浓度时,Ge的浸出率逐步降低。其主要原因是:1) 高酸度下,十二烷基磺酸钠加速了Si的聚沉,使得硅胶对Ge的吸附损失降低,从而确保了Ge的浸出效果。这点可从图4(b)中得到证实,Ge和Si的浸出率变化具有较好的一致性,表明硅在聚沉过程中伴随着锗的吸附损失。同时,由图4(b)可知,十二烷基磺酸钠的加入,可有效改善浸出渣的过滤性能,这一特点在高酸度下表现得尤为突出。当酸度由120 g/L增加至156 g/L时,浸出液的过滤速度可从4.63 mL/min提高至17.10 mL/min;2) GeO2在硫酸中的溶解度随硫酸浓度的增加而降低,过高的酸度会使溶解的锗以GeO2形态沉降(如图5所示)。因此,考虑到Ga、Ge的浸出及浸出渣的过滤性能,选择初始H2SO4浓度为156 g/L为宜。
2.2 浸出温度的影响
在硫酸浓度156 g/L、液固比10 mL/g、时间4 h、搅拌速度300 r/min、助浸剂(NaNO3) 52.29 g/L、十二烷基磺酸钠7.65 g/L的条件下,考察了浸出温度对主要金属元素浸出率及浸出渣过滤性能的影响,其结果如图6所示。
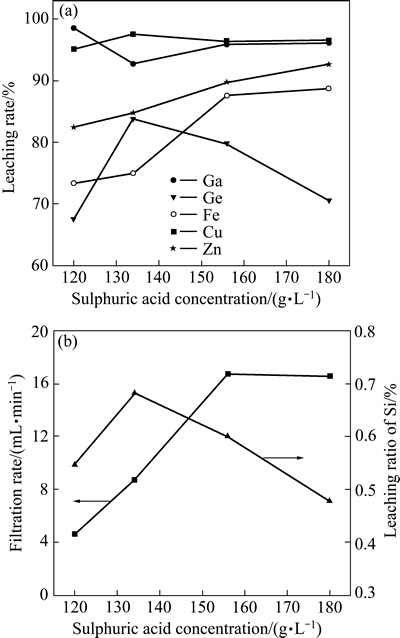
图4 硫酸浓度对主要金属浸出率及浸出渣过滤性能的影响
Fig. 4 Effects of sulfuric acid concentration on leaching rate of metals(a) and filterability of leaching residues(b)
由图6(a)可知,随着浸出温度的升高,Ga、Ge、Fe、Cu和Zn的浸出率均有不同程度的增加,但当浸出温度超过90 ℃时,均有所下降。提高浸出温度,有利于浸出剂和金属离子的传质,从而改善浸出效果。由图6(b)可知,在浸出温度低于90 ℃条件下,随温度的升高,Si的浸出率逐步提高,浸出液的过滤速度逐步增加;当浸出温度超过90 ℃时,Si的浸出率有所降低,其浸出液的过滤速度减小。其主要原因是:1) 温度的升高有利于硅胶聚沉物中非晶物相转为结晶态,从而使得浸出渣的过滤性能得到改善;2) 在一定温度范围内,温度的升高使得十二烷基磺酸在溶液中的电离程度增大,有利于溶液中硅胶对十二烷基磺酸的吸附,从而有利于溶液中Si的聚沉。但当温度过高时,硅胶对十二烷基磺酸钠的吸附能力降低,导致渣的过滤性能变差。综合考虑,选择浸出温度为90 ℃较为合理。
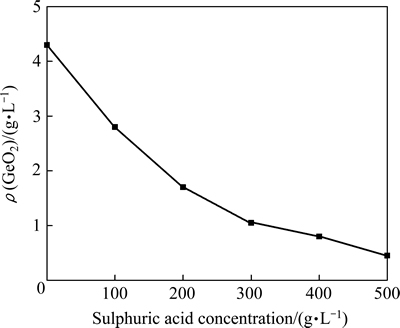
图5 GeO2在硫酸中的溶解性
Fig. 5 Solubility of GeO2 in aqueous H2SO4 solutions
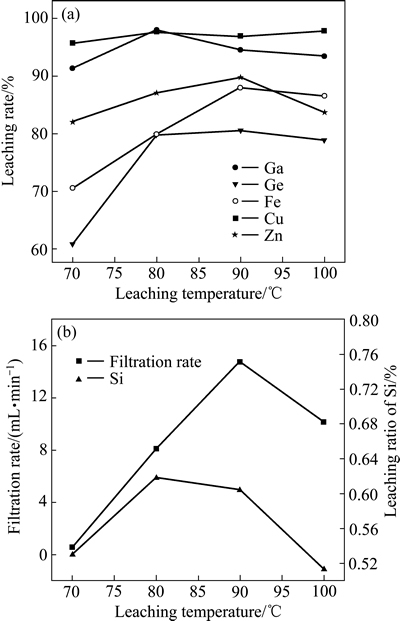
图6 温度对金属浸出率及浸出渣过滤性能的影响
Fig. 6 Effects of temperature on leaching rate of metals(a) and filterability of leaching residues(b)
2.3 液固比的影响
在温度90 ℃、硫酸浓度156 g/L、浸出时间4 h、搅拌速度300 r/min、助浸剂(NaNO3) 52.29 g/L、十二烷基磺酸钠5.46 g/L的条件下,考察液固比对主要金属元素浸出率和浸出渣过滤性能的影响,其结果如图7所示。
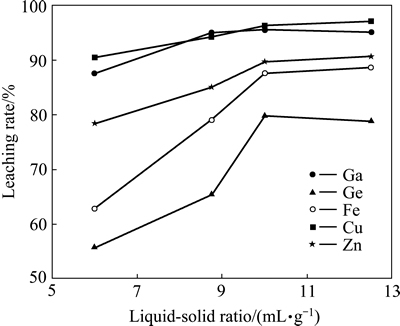
图7 液固比对主要金属浸出率的影响
Fig. 7 Effects of liquid-solid ratio on leaching rate of metals
由图7可知,随液固比增加,Zn、Fe、Cu的浸出率逐渐提高,但Ga、Ge的浸出率均呈现先增加后减少的趋势。液固比为10时,Ga、Ge、Fe、Zn的浸出率分别为95.53%、79.82%、87.58%、89.68%。尽管增加液固比可提高Ga、Ge的浸出率,但浸出矿浆的过滤速度逐渐降低,当液固比由6提高到12.5时,过滤速度由19.45 mL/min降低到11.56 mL/min,其主要原因是:随液固比的增加,Si的浸出率随之提高,但浸出液中Si的浓度反而有所降低,这使得Si的聚沉难以发生,浸出液中的Si主要以H2SiO3(胶体)形式存在从而导致料液的过滤速度较慢;而低液固比,浸出液中Si的浓度较高,甚至处于过饱和状态,这使得Si的聚沉较易发生,浸出液中的Si则可能主要以SiO2形式存在[21],从而改善了矿浆的过滤性能。不仅如此,随着液固比的增大,浸出液的量也随之加大,导致Ga、Ge的浓度随之降低,不利于后续Ga、Ge的富集。综合考虑,选择液固比为10较为合理。
2.4 浸出时间的影响
在液固比10 mL/g、浸出温度90 ℃、酸度156 g/L、搅拌速度300 r/min、十二烷基磺酸钠7.65 g/L、助浸剂(NaNO3)52.29 g/L的条件下,考察了浸出时间对主要金属元素浸出率的影响,其结果如图8所示。
由图8可知,随浸出时间的延长,Ga、Ge浸出率缓慢上升,而Fe的浸出率逐步降低,然而,当浸出时间超过4 h后,Ga、Ge的浸出率有缓慢下降的趋势。其主要原因是由于随着反应时间的增加,促使较多的Fe2+的氧化水解,且浸出液酸度也逐步降低,使得Fe重新沉淀进入渣相,并导致Ga、Ge因铁氧化物的机械夹杂及吸附,使其浸出率呈现下降的趋势。因此,浸出时间选择为4h较为适宜。
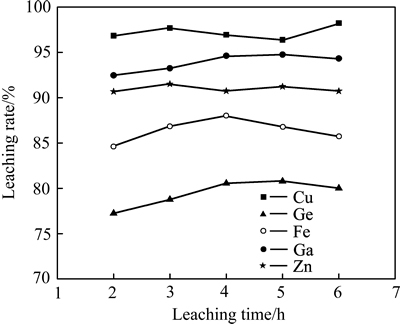
图8 浸出时间对主要金属浸出率的影响
Fig. 8 Effects of leaching time on leaching rate of metals
2.5 助浸剂NaNO3浓度的影响
在温度90 ℃、液固比10 mL/g、硫酸浓度156 g/L、浸出时间4 h、十二烷基磺酸钠0 g/L、搅拌速度300 r/min的条件下,考察了助浸剂(NaNO3)的添加及其浓度对物料主要金属浸出率的影响,其结果如图9所示。
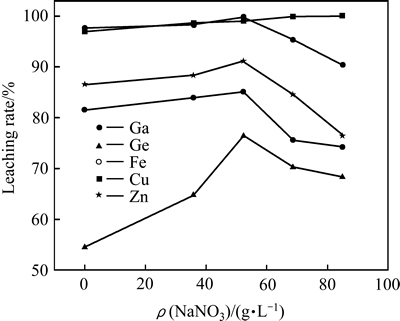
图9 NaNO3浓度对主要金属浸出率的影响
Fig. 9 Effects of NaNO3 concentration on leaching rate of metals
由图9可知,在常压浸出条件下,硝酸钠的引入会促进Ga、Ge、Cu、Zn的浸出,但过量的硝酸钠也会导致Ga、Ge、Fe的浸出率降低。在反应体系中,未添加硝酸钠时,Ga、Ge的浸出率分别为97.49%和54.62%。当硝酸钠用量为52.29 g/L时,Ga、Ge的最高浸出率分别可达99.56%、76.24%,但进一步增加硝酸钠用量时,反而不利于Ga、Ge的浸出。在常压酸浸中添加硝酸盐,使得锌粉置换渣中以金属态和硫化物等难浸物相存在的Ga、Ge,转化为易于浸出的氧化物,从而促进Ga、Ge的浸出。图10所示为不同NaNO3浓度下浸出渣XRD谱。从图10所示的不同硝酸钠浓度下的浸出渣的XRD谱可知,过量的硝酸钠会使溶液中Fe以Na2Fe(SO4)2·4H2O或FeOHSO4形式进入到渣中。由于Ga、Ge具有“亲铁性”,会使Ga、Ge以类质同象进入铁氧化物晶格或吸附其中,从而导致Ga、Ge的损失。另外,大量Fe的无定型沉淀,也会导致浸出渣的过滤性能变差。试验结果表明,硝酸钠的加入量为50 g/L左右较为适宜。
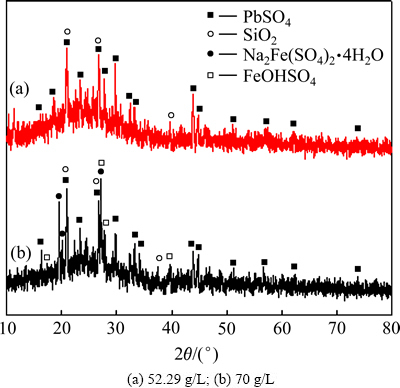
图10 不同NaNO3浓度下浸出渣XRD谱
Fig. 10 XRD patterns of leaching residues with different NaNO3 concentrations
2.6 十二烷基磺酸钠浓度的影响
在温度90 ℃、液固比10 mL/g、硫酸浓度156 g/L、浸出时间4h、搅拌速度300 r/min、NaNO3浓度52.29 g/L的条件下,考察了十二烷基磺酸钠用量对Ga、Ge等金属浸出率的影响,其结果如图11所示。
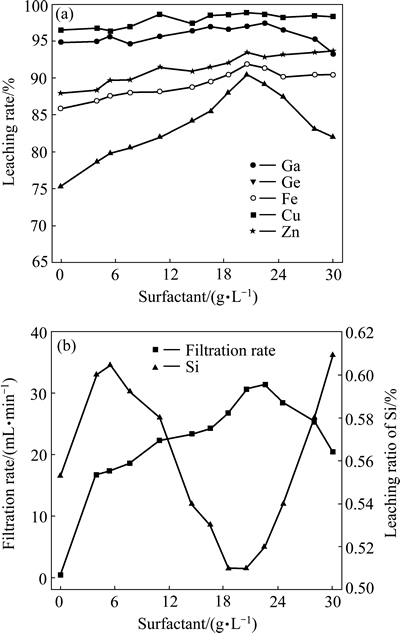
图11 十二烷基磺酸钠浓度对金属浸出率及浸出渣过滤性能的影响
Fig. 11 Effects of sodium dodecyl sulfate concentration on leaching rate of metals(a) and filterability of leaching residues(b)
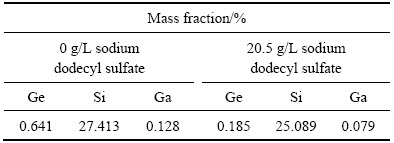
由图11可知,十二烷基磺酸钠的加入对Ge的浸出影响最为显著,同时,随其加入量的增加,浸出料浆过滤速度也逐渐提高。当十二烷基磺酸钠浓度从0 g/L上升至20.5 g/L时,Ge的浸出率由76.24%升高到90.45%,浸出液过滤速度则从0.48 mL/min提高到30.65 mL/min,Ge的浸出率及浸出液的过滤速度得到了较为明显的改善。这主要是由于十二烷基磺酸钠的加入改变溶液中Si的行为,促使不稳定的硅胶凝聚,使其由高活性的胶体转变为低活性的硅凝聚体。图12所示为不同表面活性剂浓度下浸出渣的SEM像。从图12可以看出,在未添加十二烷基磺酸钠时,所得浸出渣中Si的凝聚体以小颗粒为主,粒径20 μm左右,随十二烷基磺酸钠加入,浸出渣中的颗粒粒径逐渐增大,粒径可达上百微米,且形成较为致密的颗粒,这一变化降低了硅胶的吸附能力,从而消除了硅胶对Ga、Ge浸出率及浸出渣过滤性能的不利影响。这点从图13和表4的浸出渣定量分析结果中进一步证实,在未添加十二烷基磺酸钠时,Ge、Ga在浸出渣中的含量较高,平均值分别达0.641%、0.128%;而添加20.5 g/L十二烷基磺酸钠时,浸出渣中硅的凝聚体颗粒较大,Ge和Ga在渣中损失较少,平均值分别仅为0.185%、0.079%。尽管十二烷基磺酸钠也有利于提高Ga、Ge的浸出率,并改善浸出渣的过滤性能,但过量的十二烷基磺酸钠会包裹硅酸分子,阻止了硅胶的聚合,从而会恶化浸出渣的过滤性能。

图12 不同表面活性剂浓度下浸出渣的SEM像
Fig. 12 SEM images of leaching residues with different sodium dodecyl sulfate concentrations

图13 不同十二烷基磺酸钠浓度下浸出渣电子探针分析图
Fig. 13 EPMA images of leaching residues with different sodium dodecyl sulfate concentrations
表4 图13中不同十二烷基磺酸钠浓度下浸出渣电子探针定量分析结果
Table 4 Electron probe microanalysis of leaching residues with different sodium dodecyl sulfate concentrations in Fig. 13
2.7 助浸机理
上述结果表明,在硫酸浸出体系下,适当添加硝酸钠或十二烷基磺酸钠均可促进Ga、Ge的浸出,并改善浸出渣的过滤性能。其原因如下:
1) 硝酸钠的氧化作用。由表2的锌粉置换镓锗渣物相分析结果可知,Ga、Ge除了以氧化物形式存在外,还有部分以硫化物和金属形式存在,特别对于Ge来说,由于单质锗的性质十分稳定,只能溶于热的氢氟酸、王水和浓硫酸[18],硝酸盐的加入会使这部分Ga、Ge发生氧化,转化为相应的氧化物,从而更加促进Ga、Ge的浸出,具体反应及见式(1)~(5),在 363.15 K下反应吉布斯自由能[22]的变化见表5。
 =
=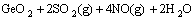 (1)
(1)
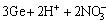 =
= (2)
(2)
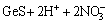 =
=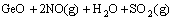 (3)
(3)
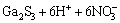 =
=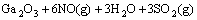 (4)
(4)
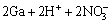 =
=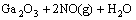 (5)
(5)
表5 363.15 K下反应方程吉布斯自由能变化
Table 5 Gibbs free energy change of reaction equation at 363.15 K

从表5反应方程的吉布斯自由能可以看出,反应温度为90 ℃ 时,各反应的吉布斯自由能均为负值,这表明在浸出体系下,采用硝酸根作为氧化剂,将Ga、Ge的单质和硫化物氧化为相应的氧化物在热力学上是可行的。
2) 十二烷基磺酸钠对硅的聚沉作用。由于Ga、Ge具有“亲硅”的特性,硅胶的形成必然导致Ga、Ge的吸附损失。为避免硅对Ga、Ge浸出的不利影响,除了避免其大量浸出外,还应采取措施使其聚沉为大颗粒低活性的硅颗粒。TERY[23-24]研究Si在酸性溶液中的分布行为,在高酸度下,溶液中的Si主要以H2SiO3溶胶或凝胶形态存在,此类胶体在酸性溶液中带正电荷。当在浸出体系中引入阴离子表面活性剂十二烷基磺酸钠后,其长链高分子部分会通过静电力、范德华力、氢键的作用下被吸附在胶体颗粒表面,从而打破体系中硅胶平衡状态,并通过架桥作用加速胶体颗粒凝聚,促使硅胶形成低活性的大颗粒凝聚体,从而降低硅胶对锗的吸附能力,并改善浸出渣的过滤性能[25-29]。图14所示为浸出渣的红外光谱。由图14中可以看出,添加20.5 g/L的十二烷基磺酸钠后的浸出渣红外光谱中出现了官能团—CH3 (2960 cm-1、 1460 cm-1)、—CH2—(2850 cm-1)、磺酸基(1178 cm-1)、Si—O键(798 cm-1、1095 cm-1)和Si—O—Si键(470.11 cm-1、589.71 cm-1)的振动吸收峰,表明溶液中形成的硅胶将十二烷基磺酸钠中高分子部分吸附,也正是这一吸附行为,加速了Si的凝聚沉淀。但表面活性剂添加量过多时,又会包裹硅酸分子,组织架桥结构难以形成,从而不利于硅胶吸附及聚合,反而会恶化浸出渣的过滤性能。
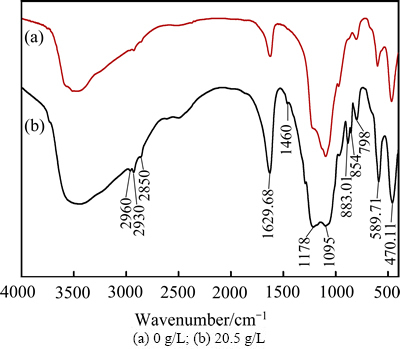
图14 不同十二烷基磺酸钠浓度下浸出渣的红外谱
Fig. 14 FTIR spectra of leaching residues with different sodium dodecyl sulfate concentrations
3 结论
1) 硫酸浓度对十二烷基磺酸钠的作用效果影响显著,硫酸浓度越高,十二烷基磺酸钠对浸出液中Si的聚沉作用越强,浸出渣的过滤性能也愈好,但酸度高于156 g/L时,Ge的浸出率降低,选择浸出硫酸浓度为156 g/L较为适宜。
2) 在常压硫酸浸出体系中,引入助浸剂NaNO3,可以使难溶性的金属相和硫化物转化为易溶性的氧化物,从而促进Ga和Ge的浸出。当助浸剂NaNO3用量为52.29 g/L时,Ga和Ge的浸出率可分别达99.56%和76.42%,但过多的NaNO3反而不利于Ga和Ge的浸出。
3) 在常压硫酸浸出体系中,引入十二烷基磺酸钠,不仅提高了Ga和Ge的浸出率,而且大大改善浸出渣的过滤性能,当十二烷基磺酸钠加入量为20.5 g/L时,Ga和Ge的浸出率分别达到97.01%和90.45%,矿浆的过滤速度由未加时的0.48 mL/min提高到30.65 mL/min;但十二烷基磺酸钠加入量超过20.5 g/L时,不但不利于Ga、Ge的浸出,还会恶化浸出渣的过滤性能。
REFERENCES
[1] 周令治, 陈少纯. 稀散金属冶金[M]. 北京: 冶金工业出版社, 2008: 46-68.
ZHOU Ling-zhi, CHEN Shao-chun. Scattered metal metallurgy[M]. Beijing: Metallurgical Industry Press, 2008: 46-68.
[2] BUTTERMAN W C, JORGENSON J D. Germanium[R]. U.S. Department of the Interior & U.S. Geological Survey, 2005.
[3] 雷 霆, 张玉林, 王少龙. 锗的提取方法[M]. 北京: 冶金工业出版社, 2006: 66-71.
LEI Ting, ZHANG Yu-lin, WANG Shao-long. The extraction methods of germanium[M]. Beijing: Metallurgical Industry Press, 2006: 66-71.
[4] 左小红. 硫化锌精矿两段逆流氧压浸出原理及综合回收镓锗工艺研究[J]. 湖南有色金属, 2009, 25(1): 26-28.
ZUO Xiao-hong. Zinc sulfide concentrates oxygen pressure leaching two counter-current principle and comprehensive recovery of gallium germanium technology[J]. Hunan Nonferrous Metals, 2009, 25(1): 26-28.
[5] OZAWA I, SAITO M K, SUGITA K, SATO K, AKIBA M, SUGO T. High-speed recovery of germanium in a convection- aided mode using functional porous hollow-fiber membrance[J]. Journal of Chromatography A, 2000, 888: 43-49.
[6] LEE H Y, KIM S G, OH J K. Process for recovery of gallium from zinc residues[J]. Transactions of the Institution of Mining and Metallurgy, 1994, 103(1/4): 76-79.
[7] MOSKALYK R R. Review of germanium processing worldwide[J]. Minerals Engineering, 2004, 17: 393-402.
[8] KINOSHITA T, AKITA S, NII S, KAWAIZUMI F, TAKAHASHI K. Solvent extraction of gallium with non-ionic surfactants from hydrochloric acid solution and its application to metal recovery from zinc refinery residues[J]. Separation and Purification Technology, 2004, 37: 127-133.
[9] DUMORTIOR R,WEBER M E, VERA J H. Removal and recovery of gallium from aqueous solution by complexation with sodium di-(n-octy1) phosphinate[J]. Hydrometallurgy, 2005, 76: 207-215.
[10] 王吉坤, 何蔼平. 现代锗冶金[M]. 北京: 冶金工业出版社, 2005: 194-215.
WANG Ji-kun, HE Ai-ping. Modern germanium metallurgy[M]. Beijing: Metallurgical Industry Press, 2005: 194-215.
[11] 翟秀静, 吕子剑. 镓冶金[M]. 北京: 冶金工业出版社, 2010: 94-102.
ZHAI Xiu-jing,  Zi-jian. Gallium metallurgy[M]. Beijing: Metallurgical Industry Press, 2010: 94-102.
Zi-jian. Gallium metallurgy[M]. Beijing: Metallurgical Industry Press, 2010: 94-102.
[12] 张魁芳, 曹佐英, 肖连生, 曾 理, 张贵清, 李青刚. 采用HBL121从锌置换渣高浓度硫酸浸出液中萃取回收镓[J]. 中国有色金属学报, 2014, 24(9): 2400-2408.
ZHANG Kui-fang, CAO Zuo-ying, XIAO Lian-sheng, ZENG Li, ZHANG Gui-qing, LI Qing-gang. Extraction of gallium from high concentration sulfuric acid leaching solution of zinc replacing slag by HBL121[J]. The Chinese Journal of Nonferrous Metal, 2014, 24(9): 2400-2408.
[13] WARDELL M P. Acid leaching extraction of Ga and Ge[J]. Journal of Metallurgy, 1987, 39(6): 40-45.
[14] 王小能. 氧化焙烧渣中锗在HCl-CaCl2-H2O体系中的浸出工艺及动力学研究[D]. 长沙: 中南大学, 2012: 10-40.
WANG Xiao-neng. Technical and dynamics studies on germanium extraction from oxidizing roasting slag in HCl-CaCl2-H2O system[D]. Changsha: Central South University, 2012: 10-40.
[15] KUL M, TOPKANA Y. Recovery of germanium and other valuable metals from zinc plant residues[J]. Hydrometallurgy, 2008, 92: 87-94.
[16] HARBUCK D D. Increasing germanium extraction from hydrometallurgical zinc residues[J]. Mineral & Metallurgical Processing, 1993, 10(1): 1-4.
[17] HARBUCK D D. Gallium and germanium recovery from domestic sources[R]. US: United States Department of the interior & Bureau Mines, 1992.
[18] 王继民, 曹洪杨, 陈少纯, 徐 毅, 张登凯. 氧压酸浸炼锌流程中置换渣中提取镓锗铟[J]. 稀有金属, 2014, 38(3): 471-479.
WANG Ji-min, CAO Hong-yang, CHEN Shao-chun, XU Yi, ZHAN Deng-kai. Recovery of Ge/Ga/In from replacement slag in pressure oxidation leaching process of zinc sulfide concentrate[J]. Chinese Journal of Rare Metals, 2014, 38(3): 471-479.
[19] 黄和明, 赵立奎. 高硅含锗物料中锗的提取工艺探讨[J]. 现代冶金, 2002, 2: 57-58.
HUANG He-ming, ZHAO Li-kui. Approach to recovery of germanium from high-silicon materials containing germanium[J]. Modern Metallurgy, 2002, 2: 57-58.
[20] 刘付朋, 刘志宏, 李玉虎, 刘智勇, 李启厚. 锌粉置换镓锗渣高压酸浸的浸出机理[J]. 中国有色金属学报, 2014, 24(4): 1091-1098.
LIU Fu-peng, LIU Zhi-hong, LI Yu-hu, LIU Zhi-yong, LI Qi-hou. Leaching mechanism of zinc powder replacement residue containing gallium and germanium by high pressure acid leaching[J]. The Chinese Journal of Nonferrous Metal, 2014, 24(4): 1091-1098.
[21] 彭容秋. 重金属冶金学[M]. 长沙: 中南大学出版社, 2003: 280-281.
PENG Rong-qiu. Metallurgy of heavy metal[M]. Changsha: Central South University Press, 2003: 280-281.
[22] DEAN J A. 兰氏化学手册[M]. 2版. 北京: 科学出版社, 2003.
DEAN J A. Lange’s handbook of chemistry[M]. 2nd ed. Beijing: Science Press, 2003.
[23] TERY B. The acid decomposition of silicate minerals partⅠ. Reactivities and modes of dissolution of silicates[J]. Hydrometallurgy, 1983, 10: 135-150.
[24] TERY B. The acid decomposition of silicate minerals part Ⅱ. Hydrometallurgical applications[J]. Hydrometallurgy, 1983, 10: 151-171.
[25] 罗古源. 水污染控制工程[M]. 北京: 高等教育出版社, 2006: 60-90.
LUO Gu-yuan. Water pollution control engineering[M]. Beijing: Higher Education Press, 2006: 60-90.
[26] 莫鼎成, 唐志红, 关影莲, 夏毅萍. 从高硅硫酸锌溶液中脱硅的方法[J]. 中国有色金属学报, 1992, 4(4): 38-40.
MO Ding-cheng, TANG Zhi-hong, GUAN Ying-lian, XIA Yi-ping. Method for the removal of silicon from high silica acid solution[J]. The Chinese Journal of Nonferrous Metal, 1992, 4(4): 38-40.
[27] 田立朋, 王 力. 表面活性剂对二氧化硅溶胶稳定性的影响[J]. 硅酸盐通报, 2009, 28(6): 1322-1326.
TIAN Li-peng, WANG Li. Effect of surfactants on silica colloids stability[J]. Bulletin of the Chinese Ceramic Society, 2009, 28(6): 1322-1326.
[28] 郭 玉, 寇 珏, 孙体昌, 徐承焱, 徐世红. 十二烷基磺酸钠和月硅酸在石英表面的吸附机理研究[J]. 矿冶工程, 2015, 35(2): 50-54.
GUO Yu, KOU Jue, SUN Ti-chang, XU Cheng-yan, XU Shi-hong. Adsorption mechanism of sodium dodecyl Sulfate and lauric acid on quartz by QCM-D[J]. Mining and Metallurgical Engineering, 2015, 35(2): 50-54.
[29] 刘 娟, 武耀锋, 张晓慷. 水分散型阳离子聚丙烯酰胺絮凝剂的絮凝性能及其机理[J]. 环境工程学报, 2015, 9(1): 119-124.
LIU Juan, WU Yao-feng, ZHANG Xiao-kang. Flocculation capability of aqueous dispersion polyacrylamide flocculant and its mechanism[J]. Chinese Journal of Environmental Engineering, 2015, 9(1): 14-16.
Sulfuric leaching process of zinc powder replacement residue containing gallium and germanium
LIU Fu-peng, LIU Zhi-hong, LI Yu-hu, LIU Zhi-yong, LI Qi-hou, WEN Da-min
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: The sulfuric acid leaching of the zinc powder replacement residue containing gallium and germanium was carried out. The effects of sulfuric acid concentration, temperature, liquid-solid ratio, leaching time and additives on the leaching efficiencies of gallium and germanium, together with the filterability of the leaching residues were investigated. The effective mechanisms of improving the leaching through adding sodium nitrate and sodium dodecyl sulfate were found out. The results show that adding both sodium nitrate and sodium dodecyl sulfate can improve the leaching of gallium and germanium. Moreover, adding sodium dodecyl sulfate can also improve the filterability of leaching residues obviously. These could be attributed to the fact that nitrate ions oxidize elemental gallium and germanium, as well as their sulfides, thereby increasing the leaching efficiencies of gallium and germanium, while the sodium dodecyl sulfonate promotes the flocculation of silica gel, thus the absorption of silica on gallium and germanium decreases and the filterability of the leaching residues improves. Leaching the zinc powder replacement residue for 4 h under the conditions of temperature of 90 ℃, liquid-solid ratio of 10 mL/g, stirring rate of 300 r/min, sulfuric acid concentration of 156 g/L, sodium nitrate of 52.29 g/L, sodium dodecyl sulfonate concentration of 20.5 g/L, the leaching rate of gallium and germanium reach 97.01% and 90.45%, respectively. In addition, the filtration rate of the leaching slurry increases from 0.48 mL/min to 30.65 mL/min with the addition dosage of sodium dodecyl sulfonate increasing from 0 to 20.5 g/L.
Key words: gallium; germanium; leaching; filterability
Foundation item: Project(2012M521544) supported by General Financial Grant from the China Postdoctoral Science Foundation
Received date: 2015-08-25; Accepted date: 2015-12-03
Corresponding author: LIU Zhi-hong; Tel: +86-731-88830478; E-mail: zhliu@csu.edu.cn
(编辑 李艳红)
基金项目:中国博士后科学基金面上项目(2012M521544)
收稿日期:2015-08-25;修订日期:2015-12-03
通信作者:刘志宏,教授,博士;电话:0731-88830478;E-mail: zhliu@csu.edu.cn
[1] 周令治, 陈少纯. 稀散金属冶金[M]. 北京: 冶金工业出版社, 2008: 46-68.
[3] 雷 霆, 张玉林, 王少龙. 锗的提取方法[M]. 北京: 冶金工业出版社, 2006: 66-71.
[4] 左小红. 硫化锌精矿两段逆流氧压浸出原理及综合回收镓锗工艺研究[J]. 湖南有色金属, 2009, 25(1): 26-28.
[10] 王吉坤, 何蔼平. 现代锗冶金[M]. 北京: 冶金工业出版社, 2005: 194-215.
[11] 翟秀静, 吕子剑. 镓冶金[M]. 北京: 冶金工业出版社, 2010: 94-102.
ZHAI Xiu-jing, Zi-jian. Gallium metallurgy[M]. Beijing: Metallurgical Industry Press, 2010: 94-102.
[12] 张魁芳, 曹佐英, 肖连生, 曾 理, 张贵清, 李青刚. 采用HBL121从锌置换渣高浓度硫酸浸出液中萃取回收镓[J]. 中国有色金属学报, 2014, 24(9): 2400-2408.
[14] 王小能. 氧化焙烧渣中锗在HCl-CaCl2-H2O体系中的浸出工艺及动力学研究[D]. 长沙: 中南大学, 2012: 10-40.
[18] 王继民, 曹洪杨, 陈少纯, 徐 毅, 张登凯. 氧压酸浸炼锌流程中置换渣中提取镓锗铟[J]. 稀有金属, 2014, 38(3): 471-479.
[19] 黄和明, 赵立奎. 高硅含锗物料中锗的提取工艺探讨[J]. 现代冶金, 2002, 2: 57-58.
[20] 刘付朋, 刘志宏, 李玉虎, 刘智勇, 李启厚. 锌粉置换镓锗渣高压酸浸的浸出机理[J]. 中国有色金属学报, 2014, 24(4): 1091-1098.
[21] 彭容秋. 重金属冶金学[M]. 长沙: 中南大学出版社, 2003: 280-281.
[22] DEAN J A. 兰氏化学手册[M]. 2版. 北京: 科学出版社, 2003.
DEAN J A. Lange’s handbook of chemistry[M]. 2nd ed. Beijing: Science Press, 2003.
[25] 罗古源. 水污染控制工程[M]. 北京: 高等教育出版社, 2006: 60-90.
LUO Gu-yuan. Water pollution control engineering[M]. Beijing: Higher Education Press, 2006: 60-90.
[26] 莫鼎成, 唐志红, 关影莲, 夏毅萍. 从高硅硫酸锌溶液中脱硅的方法[J]. 中国有色金属学报, 1992, 4(4): 38-40.
[27] 田立朋, 王 力. 表面活性剂对二氧化硅溶胶稳定性的影响[J]. 硅酸盐通报, 2009, 28(6): 1322-1326.
[28] 郭 玉, 寇 珏, 孙体昌, 徐承焱, 徐世红. 十二烷基磺酸钠和月硅酸在石英表面的吸附机理研究[J]. 矿冶工程, 2015, 35(2): 50-54.
[29] 刘 娟, 武耀锋, 张晓慷. 水分散型阳离子聚丙烯酰胺絮凝剂的絮凝性能及其机理[J]. 环境工程学报, 2015, 9(1): 119-124.


