改进的固相法制备电解质锂盐LiBOB及其纯度测定
张丽娟1, 3,孙菁2,李法强1,任齐都1, 3,王连亮1, 3
(1. 中国科学院 青海盐湖研究所,青海 西宁,810008;
2. 中国科学院 西北高原生物研究所,青海 西宁,810001;
3. 中国科学院 研究生院,北京,100039)
摘 要:
摘 要:用改进的固相法合成一种新型电解质锂盐——双乙二酸硼酸锂(LiBOB):首先将脱去结晶水的H2C2O4与LiOH·H2O研磨混匀,在60 ℃预热2 h后分批加入H3BO3,然后,于真空条件下在70 ℃和100 ℃分别保温6 h和3 h,得到LiBOB粗产品。对LiBOB粗产品用重蒸乙腈进行2次纯化,分别对2次提纯后的LiBOB样品纯度进行测定。用经2次提纯后的LiBOB配制成0.7 mol/L LiBOB-PC/EMC/DMC (V(LiBOB)?V(EMC)?V(DMC)=1?1?1)电解液,并在-40.0~60.0 ℃对其电导率进行测定。用该电解液体系组装电池,进一步测定电池的循环性能。研究结果表明:1次纯化后的样品纯度≥98.1%,2次纯化后的样品纯度≥99.6%;LiBOB所配制的电解液在较宽温度范围内的电导率较高,说明所制LiBOB已达到用作电池电解质锂盐的标准。
关键词:
锂离子电池;电解质;双乙二酸硼酸锂(LiBOB);固相法;纯度测定;
中图分类号:TM912.9 文献标志码:A 文章编号:1672-7207(2010)01-0067-06
Preparation by improved solid-state method and purity determination of LiBOB
ZHANG Li-juan1, 3, SUN Jing2, LI Fa-qiang1, REN Qi-du1, 3, WANG Lian-liang1, 3
(1. Qinghai Institute of Salt Lakes, Chinese Academy of Sciences, Xining 810008, China;
2. Northwest Institute of Plateau Biology, Chinese Academy of Sciences, Xining 810001, China;
3. Graduate University, Chinese Academy of Sciences, Beijing 100039, China)
Abstract: LiBOB was synthesized by an improved solid-state method. H2C2O4·2H2O was dehydrated to get anhydrous H2C2O4, and H2C2O4·2H2O was mortared with LiOH·H2O. The mixture of H2C2O4 and LiOH·H2O was preheated at 60 ℃ for 2 h before adding H3BO3 in several times to be mortared. In vacuum dryer, the mixture of the three starting materials was preheated in two steps: at 70 ℃ for 6 h and then at 100 ℃ for 3 h. The product was purified twice. The content of purified LiBOB was determined. Conductivities of LiBOB dissolved in various ternary solvent blends were menstruated with the change of temperature from -40.0 to 60.0 ℃. The cycle performance of cells based on LiBOB was tested. The results show that the purity of the obtained sample is larger than 98.1% in the first time and larger than 99.6% in the second time. 0.7 mol/L LiBOB-PC/EMC/DMC (V(LiBOB)?V(EMC)?V(DMC)=1?1?1) has higher conductivities in a wide temperature range, and the LiBOB sample meets the requirement of Li-ion battery.
Key words: Li-ion battery; electrolyte; LiBOB; solid-state method; purity determination
锂离子电池自20世纪90年代问世以来,以其高能量密度、长循环寿命等优点备受关注,并在各个领域发挥了重要作用[1-3]。电解质锂盐是锂离子二次电池的重要组成部分,其中,LiPF6已被应用于锂电池中且实现了商业化,但LiPF6仍然存在一些缺点,如:热稳定性较差,易于分解成LiF和PF5,而PF5易于水解形成HF和PF3O,对电池的性能产生有害的影响[4]。因此,研究新型电解质锂盐非常重要。在众多的新型锂盐中,LiBOB显示了其独特的优越性,已引起了广泛关注,并有望代替LiPF6[5]。与LiPF6相比较,LiBOB具有以下优点:不含F元素,不会产生HF腐蚀电极;分解温度高达302 ℃,其电解液体系具有更强的热稳定性,能提高锂离子电池的安全性;能够在负极表面形成稳定的固态电解质(SEI)膜,甚至能够在纯聚碳酸酯(PC)中稳定石墨负极,从而使得在锂离子电池电解液体系中以PC替换碳酸乙烯酯(EC)成为可能,为解决电池低温使用问题提供了一种很好的选择;是一种合成原料廉价易得、制备工艺简单、环境友好的产品。1999年公布的德国专利中报道了LiBOB的合成方 法[6]。这种制备方法简单易行,但在反应过程中伴随有大量的水产生。Xu等[7-8]用Li[B(OCH3)4]和(CH3)3SiOOCCSi(CH3)3在乙腈溶剂中合成了LiBOB。该方法合成的产品纯度虽然较高,但其合成路线复杂,成本太高。Yu等[9]提出了以固相法合成LiBOB的方法。在此,本文作者在原有合成方法基础上进行了改进,以改进的固相法为基础合成LiBOB,并对合成样品纯度进行测定。
1 实验
1.1 试剂及仪器
试剂为:H2C2O4·2H2O(纯度≥99.5%,成都金山化学试剂有限公司生产);H3BO3(纯度≥99.5%,沈阳化学试剂厂生产);LiOH·H2O(纯度≥99.0%,国药集团化学试剂有限公司生产);乙腈(分析纯,天津基准化学试剂有限公司生产),KMnO4(分析纯,北京化学试剂公司生产);H3BO3基准试剂(优级纯,成都金山化学试剂有限公司生产);甲亚胺-H酸(自制),0.7 mol/L LiBOB-PC/EMC/DMC(V(LiBOB)?V(EMC)?V(DMC)=1?1?1)溶液体系(自制);金属锂片(天津化学试剂厂生产);LiFePO4(自制);乙炔黑(电池级,杭州君一化工有限公司生产);聚偏氟乙烯(PVdF)(上海国药集团化学试剂有限公司生产);1-甲基-2-吡咯烷酮(化学纯,上海国药集团化学试剂有限公司生产)。
仪器为:101-2型电热鼓风箱(上海一恒科技有限公司制造),2XZ-1型旋片式真空泵(上海沪一泵业制造有限公司制造);RZ-52型旋转蒸发仪(上海亚荣生化仪器厂制造);DLSB型低温冷却液循环泵(江苏金坛市华欧实验仪器厂制造);501型超级恒温槽(上海岩华仪器公司制造);7320G型可见分光光度计(上海第三分析仪器厂制造);GBC-932 plus型火焰原子吸收光谱仪(澳大利亚GBC公司制造);UNIlab手套箱;CT2001A型LAND电池测试系统(武汉金诺电子有限公司制造);145A型电导率仪(美国Thermo公司制造);电池壳自制。
1.2 LiBOB的合成及纯化
传统的固相合成采用如下反应:
![]()
本实验采用分步合成法制备了LiBOB粗产品,其合成路线如下:

首先,将H2C2O4·2H2O于105~110 ℃烘干除去结晶水,得到无水的H2C2O4,再按反应式(3)的化学计量比分别称取一定量H2C2O4和LiOH·H2O,研磨,混合均匀。将混合物于60 ℃预加热2 h,然后,分批加入化学计量比的H3BO3。继续混合研磨,至原料彻底研细并混合均匀为止。将得到的混合物在真空干燥箱中于70 ℃干燥6 h后加入自制的干燥剂SYZ-01,再将温度升至100 ℃后继续真空干燥3 h,即得LiBOB粗产品。
将粗产品溶于新鲜的无水乙腈中,稍微加热后滤去不溶物。滤液进行蒸发浓缩后,在-40 ℃冷冻结晶4~5 h,过滤进行固液分离,得到白色固体。然后,将得到的固体在70~100 ℃真空干燥18 h,所得白色粉末即为LiBOB样品[10]。
1.3 提纯后样品纯度的测定
LiBOB的主要成分为C2O42-,Li+和B(III),通过测定这3种成分的含量,就可以较好地评价LiBOB的品质[11]。本文所指LiBOB的纯度为这3种成分质量分数之和。
1.3.1 LiBOB溶液的配制
分别准确称取0.196 6 g和0.190 1 g LiBOB 1次提纯(1号)和2次提纯(2号)后的样品,配制成100 mL溶液,进行化学分析。
1.3.2 C2O42-的含量测定
采用高锰酸钾滴定法测量C2O42-的含量。按国家标准GB 601—88[12]对高锰酸钾进行配制和标定,得到KMnO4溶液浓度为0.113 0 mol/L。
分别准确量取20 mL 1号和2号溶液于250 mL锥形瓶中,加入100 mL硫酸溶液,用高锰酸钾溶液对C2O42-进行滴定,平行测定3次。
1.3.3 B(III)的含量测定
采用分光光度法—甲亚胺-H法测硼[13],以试剂作空白,用1 cm的比色池在波长410 nm处测定B3+标准溶液(B3+标准系列为25 mL溶液中分别含有0,5.0,10.0,20.0,30.0,40.0 ?g B3+)的吸光值,绘制标准曲线(要求线性相关系数≥0.995)。
分别准确量取1号和2号溶液10 mL并稀释10倍,然后,分别量取2 mL稀释液于25 mL容量瓶中,按上述测定B3+标准溶液的方法进行测定,平行测定 3次。
1.3.4 Li+的含量测定
以火焰原子吸收光谱法[14]测定Li+标准溶液(Li+浓度分别0,1.000,2.000,3.000,4.000,5.000 mg/L),绘制标准曲线(要求线性相关系数r≥0.999)。
分别准确量取1号和2号溶液4 mL于100 mL容量瓶中定容。以火焰原子吸收光谱仪测定溶液中Li+浓度,平行测定3次。
1.4 LiBOB在三元混合溶剂中的电导率
根据文献[15],LiBOB在三元混合溶剂体系中具有较高的电导率,在此,选取0.7 mol/L LiBOB在体积比为1?1?1的PC/EMC/DMC三元混合溶剂体系中测定电导率。
准确称取一定量经2次提纯后的LiBOB,溶于体积比为1?1?1的PC/EMC/DMC三元混合溶剂中,配制成0.7 mol/L LiBOB-PC/EMC/DMC的电解液,并用电导率仪测定温度分别为-40,-30,-20,-10,0,10,20,30,40,50和60 ℃时的电导率。实验中有关碳酸酯溶液的配制均在手套箱内进行。实验温度分别由超级恒温槽(实验温度高于室温部分)及低温冷却液循环泵(实验温度低于室温部分)控制。
1.5 电池的组装及循环性能测试
以1-甲基-2-吡咯烷酮将LiFePO4、乙炔黑、PVdF(质量比为75?15?10)混合均匀后,涂在不锈钢钉状电极上,在120 ℃真空干燥4 h,制得LiPePO4电极。以LiPePO4为正极,锂片为负极,0.7 mol/L LiBOB-PC/ EMC/DMC电解液体系组装LiFePO4/Li实验电池[16],用电池测试系统测试电池的电化学性能。电压为4.2~2.7 V。
2 结果与讨论
2.1 合成方法的改进
与文献[9]中的固相制备方法相比,本文制备方法有效提高了原料利用率和LiBOB样品的纯度,其原因在于:
(1) 对原料进行了预处理,以制得的无水H2C2O4为起始反应物;将H2C2O4·2H2O进行预处理,脱掉结晶水。
(2) 增加了预加热步骤。将H2C2O4与LiOH·H2O研磨混合后预热,将产生的水除去,进一步降低了反应体系中水的含量。
(3) 改变了原料混合方式。3种原料一起搅拌研磨时,由于酸碱中和反应而生成水,致使混合物变得潮湿而不利于混合均匀。通过先混合研磨H2C2O4及LiOH·H2O,并预加热至混合物干燥后再分批加入H3BO3进行混合研磨的方法,有效提高了原料的混合程度。
(4) 在样品干燥过程中使用干燥剂进行保护,克服了制备过程中对气氛保护条件要求比较苛刻的不足。
2.2 各组分含量测定结果
2.2.1 C2O42-的含量分析结果
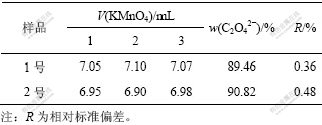
表1所示为滴定草酸根消耗高锰酸钾标准溶液的体积及计算结果。
表1 滴定C2O42-过程消耗KMnO4溶液体积及计算结果
Table 1 Volume consumption of KMnO4 solution during determine C2O42- and calculated results
LiBOB样品中的C2O42-含量可按式(4)和(5)进行计算:
![]() (4)
(4)
![]() (5)
(5)
式中:![]() 为
为![]() 的物质的量,mol;c(KMnO4)为KMnO4的浓度,mol/L;V为体积,mL;
的物质的量,mol;c(KMnO4)为KMnO4的浓度,mol/L;V为体积,mL;![]() 为
为![]() 的摩尔质量,g/mol;m(LiBOB)为LiBOB的质量,g;
的摩尔质量,g/mol;m(LiBOB)为LiBOB的质量,g;![]() 为
为![]() 的质量分数,%。
的质量分数,%。
计算结果表明:1号样品中,C2O42-的平均含量为89.46%,略低于理论值(90.84%),说明样品纯度不够高;2号样品中,C2O42-的平均含量为90.82%,与理论值非常接近,说明经过二次纯化得到较纯的样品。3次实验结果的相对标准偏差分别为0.36%和0.48%,说明该方法具有较高的准确度和较好的重现性,可用来测定LiBOB中C2O42-含量。
2.2.2 B( III)的含量分析结果
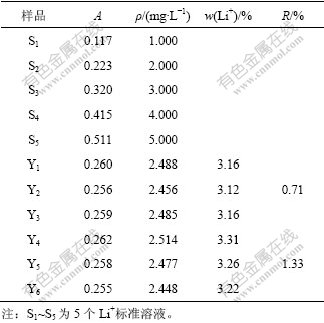
LiBOB纯化样品中B(Ⅲ)的含量如表2所示。由表2可得:1号样品B(Ⅲ)的平均含量为5.55%,2号样品B(Ⅲ)的平均含量为5.56%,均非常接近理论值5.58%,说明样品纯度较高。3次实验结果的相对标准偏差分别为0.43%和0.59%,说明该法能较准确地测定样品中B(Ⅲ)的含量,可用于LiBOB中B(Ⅲ)的 测定。
表2 LiBOB纯化样品中B(Ⅲ)的含量
Table 2 Concentrations of B(Ⅲ) in purified LiBOB

2.2.3 Li+含量分析结果
LiBOB纯化样品中Li+含量如表3所示。由表3可知:1号样品(即Y1,Y2和Y3)Li+含量的平均值为3.15%,低于理论值(3.58%),2号样品(即Y4,Y5和Y6)Li+含量的平均值为3.26%,也低于理论值。但由测定的C2O42-和B(Ⅲ)的含量可知,经2次提纯后的样品中两者测定结果均十分接近理论值,说明经2次提纯后的样品纯度较高。用原子吸收光谱法测定的Li+含量偏低,可能是测定过程中原子吸收光谱仪灯电流衰减,造成测定值比实际值偏低。
表3 LiBOB纯化样品中Li+的含量
Table 3 Concentrations of Li+ in purified LiBOB
C2O42-,Li+和B(Ⅲ)各有不同的测定方法,对纯化后的LiBOB中C2O42-,Li+和B(Ⅲ)三者含量的测定可知:经2次提纯后的样品满足用作锂离子二次电池电解质的标准(一般要求锂盐纯度≥99.5%)。一次纯化后主含量(c(C2O42-)+c(Li+)+ c(B(Ⅲ)))为98.16%。这虽然较提纯前的LiBOB主含量高,但仍然难以达到用作锂离子二次电池电解质锂盐的标准。而2次提纯后主含量(c(C2O42-)+ c(Li+)+c(B(Ⅲ)))为99.64%,满足用作锂离子二次电池电解质的标准。
2.3 不同温度下的电导率
不同温度下,0.7 mol/L LiBOB在三元等体积混合溶剂体系PC/EMC/DMC中的电导率如图1所示。
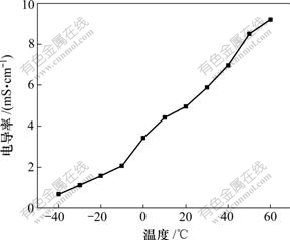
图1 不同温度下LiBOB 在三元等体积混合溶剂体系中的电导率
Fig.1 Change of conductivity at various ternary solvents and different temperatures
判断一种有机碳酸酯溶液能否用作锂离子二次电池电解液,最主要也是最容易检测的方法就是室温离子电导率是否大于1 mS/cm[17]。故在此测定了LiBOB在三元混合溶剂PC/EMC/DMC中的电导率。
由图1可知:当温度由-40.0升高至60.0 ℃时,0.7 mol/L LiBOB-PC/EMC/DMC (体积比为1?1?1)溶 液的电导率由0.672 mS/cm增加到9.210 mS/cm,室温(20 ℃)下的电导率为5.400 mS/cm,该溶液体系电导率较高。
2.4 电池循环性能测试
LiFePO4/Li电池在室温时0.5C(1C=150 mA/g)下的放电性能如图2所示。
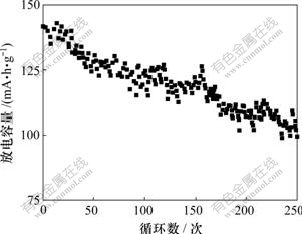
图2 LiFePO4/Li电池在室温、0.5C时循环的放电性能
Fig.2 Discharge performance of LiFePO4/Li batteries at 0.5C cycle and room temperature
由图2可知:基于LiBOB的电池可平稳放电,250次循环后容量略有衰减。所制备的LiBOB组装的电池具有较强的循环稳定性,其纯度达到了用作电池电解质锂盐的标准。
图3所示为LiFePO4/Li 电池首次循环的电压-容量曲线。
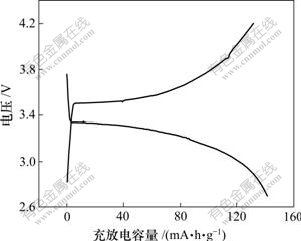
图3 在室温、0.5C下LiFePO4/Li电池首次循环的电压-容量曲线
Fig.3 Capacity density-voltage curves of LiFePO4/Li cells in initial cycle at 0.5C cycle and room temperature
由图3可知:电池的充放电平台明显,且2个平台间电势差较小,电池的首次放电比容量为141.9 mA?h/g,循环效率接近100%。
3 结论
(1) 用改进的固相法合成了LiBOB并提高了原料的利用率和样品的纯度。改进的固相法对原料进行了预处理,增加了预加热步骤,改变了原料混合顺序和混合方式;在样品干燥过程中使用干燥剂进行保 护,克服了制备过程中对气氛保护条件要求比较苛刻的不足。
(2) 对合成的LiBOB粗产品进行了2次纯化。1次纯化后主含量为98.16%,2次提纯后主含量为99.64%,经过2次提纯后,LiBOB已达到了二次电池用电解质的标准。
(3) 用所制备的LiBOB配制成0.7 mol/L LiBOB-PC/EMC/DMC的等体积三元混合电解液,该体系在较宽温度范围内(-40.0~60.0 ℃)的电导率较高,室温下的电导率为5.400 mS/cm,符合用作二次电池电解液的要求。
(4) 用制备的电解液组装的电池,循环性能较好,所制LiBOB达到用作电池电解质锂盐的标准。
参考文献:
[1] 张宝, 张明, 李新海, 等. 锂离子电池正极材料LiNi0.45Co0.10Mn0.45O2的合成及电化学性能[J]. 中南大学学报: 自然科学版, 2008, 39(1): 75-79.
ZHANG Bao, ZHANG Ming, LI Xin-hai, et al. Synthesis and electrochemical properties of LiNi0.45Co0.10Mn0.45O2 cathode material for lithium ion batteries[J]. Journal of Central South University: Science and Technology, 2008, 39(1): 75-79.
[2] HU Guo-rong, DENG Xin-rong, PENG Zhong-dong, et al. Preparation of spherical and dense LiNi0.8Co0.2O2 lithium-ion battery particles by spray pyrolysis[J]. Journal of Central South University of Technology, 2008, 15(1): 29-33.
[3] 胡传跃, 李新海, 王志兴, 等. 锂离子电池电解液过充添加剂的行为[J]. 中国有色金属学报, 2004, 14(12): 2125-2130.
HU Chuan-yue, LI Xin-hai, WANG Zhi-xing, et al. Behavior of overcharging additions for electrolyte used in Li-ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(12): 2125-2130.
[4] 蒲薇华, 何向明, 王莉, 等. 新型锂离子电池锂盐LiBOB研究进展[J]. 云南大学学报: 自然科学版, 2005, 27(5A): 479-483.
PU Wei-hua, HE Xiang-ming, WANG Li, et al. The development of lithium salts LiBOB for Li-ion battery electrolytes[J]. Journal of Yunnan University: Science and Technology, 2005, 27(5A): 479-483.
[5] 王赛, 仇卫华, 余碧涛, 等. 锂离子电池电解质盐双草酸硼酸锂的研究进展[J]. 电池, 2006, 36(3): 231-233.
WANG Sai, QIU Wei-hua, YU Bi-tao, et al. Research progress in lithium bis(oxalato) borate for Li-ion battery electrolytes[J]. Battery Bimonthly, 2006, 36(3): 231-233.
[6] Lischka U, Wietelmann U, Wegner M. Lithium bisoxalatoborate, the production thereof and its use as a conducting salt: Germany, DE 19 829 030[P]. 1999-10-07.
[7] Xu W, Angell C A. LiBOB and its derivatives weakly coordinating anions, and the exceptional conductivity of their nonaqueous solutions[J]. Electrochem Solid-State Lett, 2001, 4(1): E1-E4.
[8] Angell C A, Xu W . Non-aqueous electrolytic solution: USA, US 0 034 235 A1[P]. 2001-07-12.
[9] Yu B T, Qiu W H, Li F S, et a1. The electrochemical characterization of lithium bis(oxalate) borate synthesized by a novel method[J]. Electrochem Solid-State Lett, 2006, 9(1): A1-A4.
[10] 李世友, 马培华, 邓小川, 等. 一种双乙二酸硼酸锂的提纯方法: 中国, CN 100999529A[P]. 2006.
LI Shi-you, MA Pei-hua, DENG Xiao-chuan, et al. A method of purifying lithium bis(oxalato) borate: China, CN 100999529A[P]. 2006.
[11] 韩周祥, 魏剑英, 蔺常辉, 等. 导电锂盐LiBOB各组分含量的测定[J]. 电池, 2006, 36(2): 159-161.
HAN Zhou-xiang, WEI Jian-ying, LIN Chang-hui, et al. Determination of the component content of conductive lithium salt LiBOB[J]. Battery Bimonthly, 2006, 36(2): 159-161.
[12] GB 601—88, 化学试剂-滴定分析(容量分析)用标准溶液的制备[S].
GB 601—88, Chemical reagent-Preparation of standard solutionof titration (capacity analysis)[S].
[13] 中国科学院青海盐湖研究所分析室. 卤水和盐的分析方法[M]. 北京: 科学出版社, 1988: 97-101.
Lab of Qinghai Institute of Salt Lakes, Chinese Academy of Sciences. The analytical methods of salt brine and salt[M]. Beijing: Science Press, 1988: 97-101.
[14] 李雯. 电解质六氟磷酸锂的表征与研究[D]. 西宁: 中国科学院青海盐湖研究所, 2004: 58-63.
LI Wen. Study and application on the analysis of lithium hexafluorophosphate[D]. Xining: Qinghai Institute of Salt Lakes, Chinese Academy of Sciences, 2004: 58-63.
[15] 李世友. 锂离子二次电池新型电解质锂盐LiBOB的制备及性能研究[D]. 西宁: 中国科学院青海盐湖研究所, 2008: 57-82.
LI Shi-you. Synthesis and performance studies on the novel Li-ion battery electrolyte LiBOB[D]. Xining: Qinghai Institute of Salt Lakes, Chinese Academy of Sciences, 2008: 57-82.
[16] 卜源, 马晓华, 杨清河, 等. 一种用于锂离子电池的阻燃添加剂[J]. 电池, 2006, 36(1): 8-9.
BU Yuan, MA Xiao-hua, YANG Qing-he, et al. A flame retardant additive for Li-ion battery[J]. Battery Bimonthly, 2006, 36(1): 8-9.
[17] 郭炳琨, 徐徽, 王先友, 等. 锂离子电池[M]. 长沙: 中南大学出版社, 2002: 188-189.
GUO Bing-kun, XU Hui, WANG Xian-you, et al. Li-ion battery[M]. Changsha: Central South University Press, 2002: 188-189.
收稿日期:2009-03-20;修回日期:2009-06-25
基金项目:青海省科技攻关项目(2006-G-168)
通信作者:李法强(1975-),男,山东临沂人,博士,副研究员,从事盐湖资源综合利用、无机材料化学研究;电话:0971-6302401;E-mail: lithii@isl.ac.cn
[4] 蒲薇华, 何向明, 王莉, 等. 新型锂离子电池锂盐LiBOB研究进展[J]. 云南大学学报: 自然科学版, 2005, 27(5A): 479-483.
[8] Angell C A, Xu W . Non-aqueous electrolytic solution: USA, US 0 034 235 A1[P]. 2001-07-12.
[10] 李世友, 马培华, 邓小川, 等. 一种双乙二酸硼酸锂的提纯方法: 中国, CN 100999529A[P]. 2006.
[11] 韩周祥, 魏剑英, 蔺常辉, 等. 导电锂盐LiBOB各组分含量的测定[J]. 电池, 2006, 36(2): 159-161.
[12] GB 601—88, 化学试剂-滴定分析(容量分析)用标准溶液的制备[S].
[14] 李雯. 电解质六氟磷酸锂的表征与研究[D]. 西宁: 中国科学院青海盐湖研究所, 2004: 58-63.
[16] 卜源, 马晓华, 杨清河, 等. 一种用于锂离子电池的阻燃添加剂[J]. 电池, 2006, 36(1): 8-9.


