网络首发时间: 2013-12-27 08:48
层状硫化物K2xMnxSn3-xS6与Th (Ⅳ) 的离子交换性能研究
东华理工大学核资源与环境国家重点实验室培育基地
中国人民解放军91280部队
中国矿业大学矿山生态安全教育部工程研究中心
摘 要:
采用水热法获得制备层状硫化物K2xMnxSn3-xS6 (KMS-1) , 用扫描电镜 (SEM) , X射线衍射仪 (XRD) , 傅里叶红外光谱仪 (FTIR) 对其形貌及结构进行表征。结果表明制备的KMS-1为层状结构, 具有良好的晶体结构。采用静态批式法考察了接触时间、温度、Th (IV) 起始浓度, 溶液pH、Na+浓度等因素对KMS-1与Th (IV) 的离子交换的影响。结果表明, pH值对KMS-1与Th (IV) 的离子交换反应有显著影响, 吸附容量随着溶液pH的增大而增大, 且当pH>4时吸附容量不再随pH的变化而变化, 而Na+离子浓度对吸附影响较弱;KMS-1与Th (IV) 的离子交换反应在4 h时反应达到平衡, 反应过程符合准二级动力学方程, Qe=180.51 mg·g-1, k=2.005×10-4g·mg-1·min-1;R2=0.9987;吸附等温线符合Langmuir等温模型, R2为0.9985;热力学数据分析得出:ΔHo=60.73 kJ·mol-1·K-1, ΔSo=19.02 J·mol-1·K-1和ΔGo<0, 说明KMS-1吸附Th (IV) 是一个放热且自发的过程, 降低温度有利于KMS-1对Th (IV) 的吸附。该离子交换反应最大吸附量为180.51 mg·g-1。
关键词:
层状硫化物;K2xMnxSn3-xS6 (KMS-1) ;Th (IV) ;离子交换;
中图分类号: O647.32
作者简介:侯艳巧 (1988-) , 女, 河北衡水人, 硕士研究生, 研究方向:稀有及放射性元素分析;E-mail:906052332@qq.com;;罗明标, 教授;电话:13879488655;E-mail:luomingbiao@yahoo.cn;
收稿日期:2013-05-13
基金:江西省教育厅科技项目 (GJJ12379);国家自然科学基金项目 (21261001) 资助;
Ion-Exchange of Layered Metal Sulfide K2xMnxSn3-xS6 (KMS-1) with Th (Ⅳ)
Hou Yanqiao Luo Mingbiao Liu Jianliang Xu Jingjing
State Key Laboratory Breeding Base of Nuclear Resources and Environment, East China Institute of Technology
91280 Troops, People's Liberation Army
Engineering Research Center of Mining Environment and Ecological Safety of Education Ministry, China University of Mining and Technology
Abstract:
K2xMnxSn3- xS6 ( KMS-1) was synthesized by hydrothermal method. The determination of structure and morphology was characterized by scanning electron microscopy ( SEM) , X-ray diffraction ( XRD) , and Fourier transform infrared spectrometer ( FTIR) . The result indicated that the KMS-1 had layered structure and good crystal structure. In addition, the ion-change of the layered K2xMnxSn3- xS6 ( KMS-1) with Th ( IV) was studied as a function of contact time, temperatures, Th ( IV) initial concentration, pH value and Na+concentration under ambient conditions using batch technique. The results indicated that the absorption of KMS-1 with Th ( IV) was strongly dependent on pH values, but weakly dependent on Na+concentrate. Adsorption capacity increased with the increase of solution pH, and when the pH > 4, adsorption capacity no longer changed with pH; ion-change reaction of KMS-1 with Th ( IV) reached equilibrium in 4 h and absorption of KMS-1 with Th ( IV) was in accordance with pseudo second order kinetic model; the adsorption isotherm model used Freundlich model and Langmuir model. The adsorption isotherm was in accordance with Langmuir model, and Qe= 180. 51 mg·g- 1, k =2.005 ×10- 4g·mg- 1·min- 1; R2= 0. 9987. ΔHo, ΔSoand ΔGofree energy were calculated from the experimental data: ΔHo= 60. 73 kJ·mol- 1·K- 1, ΔSo= 19. 02 J·mol- 1·K- 1and ΔGo< 0. The results indicated that ion-exchange of KMS-1 with Th ( IV) was a spontaneous and thermopositive process, and the adsorption decreased with temperature increasing. The maximum adsorption quantity was 180. 51 mg·g- 1.
Keyword:
layered metal sulfide; K2xMnxSn3-xS6 (KMS-1) ; Th (IV) ; ion-change;
Received: 2013-05-13
核能是现代新型的能源之一, 因其具有强大的能量, 被广泛应用于电力、军事等领域。钍作为自然界中丰富的放射性元素, 被进一步开发利用。目前, 钍在核能中的应用已取得了技术上的突破, 许多国家已经或者正在设计利用钍为燃料的反应堆。同时由于稀土冶炼分离工艺的局限性, 钍的废物、废水大量排入环境中, 不仅导致钍资源的严重浪费, 而且由此造成的放射性污染也严重危害了生态环境和人类健康。因此无论是从环境角度还是经济角度, 核废物中的放射性核素吸附处理都成为人们研究的重大问题[1,2,3,4,5]。
目前, 人们已对放射性核素吸附处理做了大量研究, 沉淀、溶剂萃取、电浮选、离子交换、表面吸附等方法能有效地回收水溶液中钍[6]。然而, 物理表面吸附和沉淀还原受表面过程所限制, 很容易被氧化剂、污染物抑制和阻碍。与此相反, 离子交换剂的吸附作用是材料的整体性质, 因此吸附作用不存在表面技术性能的限制[7]。有离子交换性能的层状硫族化合物很少, 并且主要限制在碱金属的前过度金属硫族化合物AxMQ2 (A=碱金属离子, M=4, 5和6族早期过度金属, Q=S, Se, Te) 。然而这些材料由于不稳定易水解, 并不适于实际应用[8]。K2xMnxSn3-xS6 (KMS-1) 是一种新型的层状硫化物, 它能对水溶液中Th (Ⅳ) 进行吸附, 能有效实现钍的分离富集。它具有成本低, 在水溶液中稳定, p H适用范围广, 吸附容量高, 抗干扰离子能力强等优点。本文采用静态批式的方法研究了接触时间、p H值、离子强度、Th (Ⅳ) 初始浓度、温度等因素对KMS-1吸附Th (Ⅳ) 的影响。
1实验
1.1试剂和仪器
单质Sn, Mn (74μm) , 升华硫, Sr Cl2, HNO3, Na OH, KCO3、丙酮、乙醚, 以上试剂均为分析纯, 实验中的蒸馏水均为二次蒸馏水。721E型可见分光光度剂 (上海第三分析仪器厂) ;FA2104型分析天平 (上海天平仪器厂) ;SHA-B型水浴恒温振荡器 (江苏荣华仪器制造有限公司) p HS-3C型酸度计 (上海电磁仪器仪器厂) , SX-12-10型箱式电阻炉 (天津市泰斯特仪器有限公司) ;不锈钢反应釜, 内置聚四氟乙烯, 耐压1 MPa, 有效容积100 ml;JMS-6700F型场发射扫描电子显微镜 (日本电子) ;傅里叶红外仪 (FTIR, nicolet 380, 中国上海) ;XRD-6000型X射线粉末衍射仪 (日本岛津) 。
1.2 K2xMnxSn3-xS6 (KMS-1) 的制备
称取锡粉7.140 g (60 mmol) , 锰粉1.656 g (30mmol) , 升华硫5.784 g (180 mmol) , KCO34.157 g (30 mmol) , 量取40 ml水, 在聚四氟乙烯反应釜中混合后, 将反应釜置于SX-12-10型箱式电阻炉中加热至200℃并保温6 d, 然后冷却至室温。将固体用水、丙酮、乙醚依次洗涤数次, 称重。产品质量为13.5 g, 该合成反应产率约为77%。
1.3 Th (Ⅳ) 标准储备液
准确称取1.1897 g硝酸钍[Th (NO3) 4·4H2O]于100 ml烧杯中, 加100 ml浓HCl, 盖上表面皿, 加热蒸至近干, 再重复以上操作, 用HCl (1+2) 冲洗表面皿及杯壁, 加20 ml HCl (1+2) 后转入500ml容量瓶中, 再加10 ml HCl (1+2) , 用蒸馏水稀释至刻度, 摇匀, 此液即为1 mg·ml-1Th (Ⅳ) 标准储备液。
1.4离子交换试验
依次向碳酸酯瓶中加入离子交换剂KMS-1, Th (Ⅳ) 标准储备液, 维持离子强度的Na Cl O4溶液, 和二次蒸馏水, 维持体系总体积20 ml, 用少量的Na OH和HCl调节p H值所需值。置于振荡器上振荡至吸附平衡, 后过滤, 取滤液采用分光光度法测定滤液中Th (Ⅳ) 浓度[9]。
1.5表征手段
样品的XRD图谱是在岛津XRD-6000型X射线粉末衍射仪上分析的, 采用Cu Kα线, 激发电压40 k V, 电流40 m A。取钛酸纳米晶须和干燥的溴化钾 (质量比约为1∶50) , 放入玛瑙碾钵中碾磨;取部分放入液压器中压片后在傅立叶红外仪中进行红外表征观察。取一部分干燥好的材料, 放入酒精, 超声分散10 min, 装载入铜网后于JFM-2010 (HR) 型透射电镜中观察。取一部分干燥好的材料均匀放在导电胶上, 镀金15 min后, 于场发射扫描电镜中观察其形貌。
2结果与讨论
2.1 KMS-1的表征
2.1.1 SEM分析
水热反应得到的KMS-1的SEM图如图1 (a) 所示, 从图1 (a) 中可以清除地看出, 样品有很好的层状结构, 通过Mn/Sn S6的正八面体共边组合成层间架构, Mn和Sn原子占据相同的晶体位置, 并所有的S配体是三配位的。K离子是在层之间自由排列 (图1 (b) ) , 其这个特点很有利于离子交换[8]。
2.1.2 X射线粉末衍射 (XRD) 分析
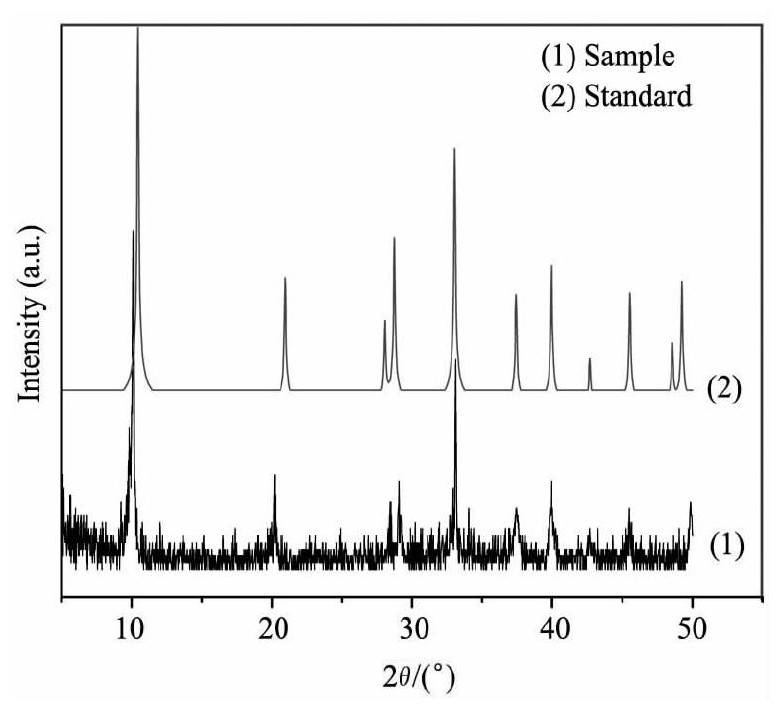
图2为KMS-1的X射线粉末衍射图理论的X射线粉末衍射图, 2θ=10.08°, 20.18°, 28.85°, 29.06°, 33.12°, 37.42°, 39.96°, 45.54°, 48.56°, 42.68°, 49.26°处的峰为KMS-1的特征峰, 从图2中可以看出样品的特征峰与标准的基本吻合, 且杂质峰不多, 说明合成的为KMS-1样品, 纯度较高。
2.1.3 IR分析
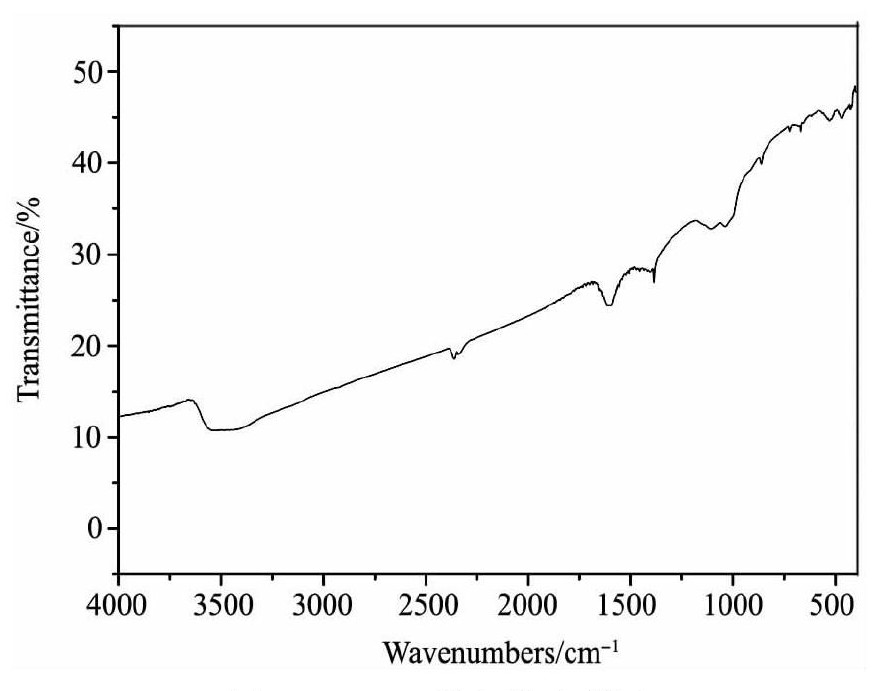
KMS-1的红外光谱如图3所示, 从图3中可以得出3200~3550 cm-1处是-OH的伸缩振动峰, 1630 cm-1处的是H-O-H的弯曲振动峰, 表明KMS-1还带有结晶水;可能是由于层状间隙中存在水分子;400~1000 cm-1的是Sn-S-Mn键的振动吸收峰区域[7]。
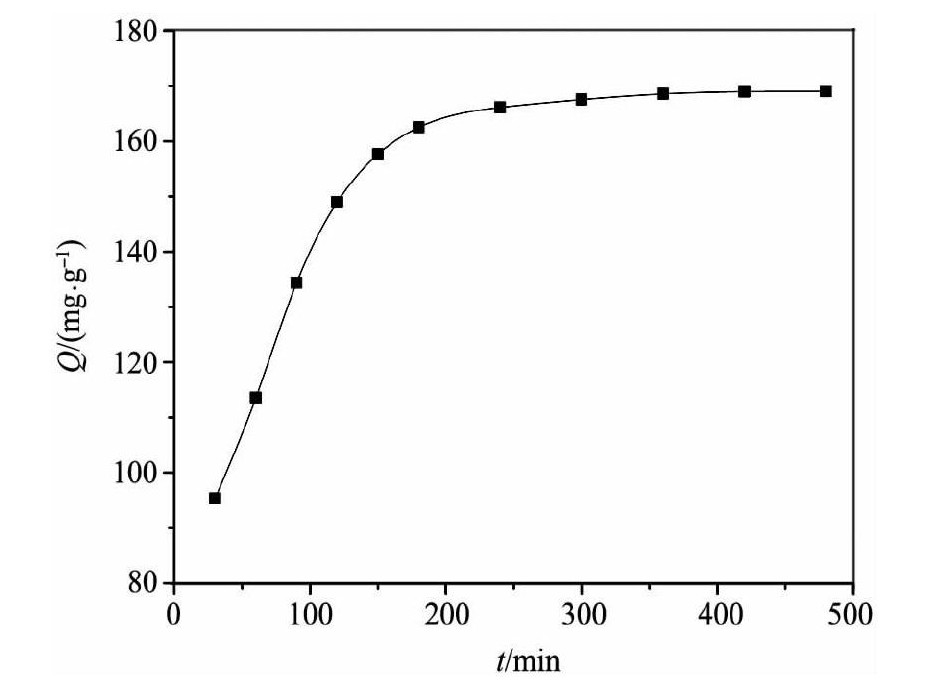
2.2吸附动力学研究
接触时间对离子交换反应KMS-1吸附Th (Ⅳ) 的影响如图4所示, 结果表明吸附量随着吸附时间的增加而增大, 在反应240 min后吸附量不在随时间的变化而变化, 表明KMS-1吸附Th (Ⅳ) 的浓度与溶液中Th (Ⅳ) 浓度趋于平衡, 交换速率趋于零。为考察吸附动力学机制, 根据准二级反应方程[10]:
图1 KMS-1的SEM形貌图 (a) 和结构模型图 (b) Fig.1 SEM image (a) and structural model (b) of KMS-1
图2 KMS-1的XRD图Fig.2 XRD patterns of KMS-1
图3 KMS-1的红外光谱图Fig.3 FTIR spectra of KMS-1

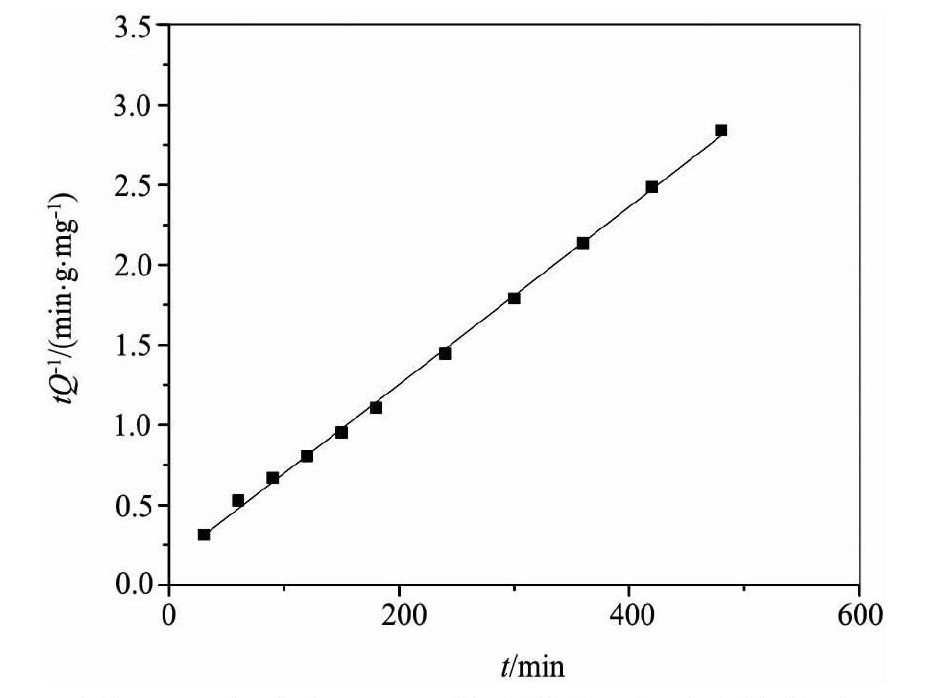
式中Qt和Qe分别为t时刻及平衡时的吸附量;k (g·mg-1·min-1) 是准二级反应方程中的速率常数。对KMS-1吸附Th (Ⅳ) 的动力学模型进行拟合, 结果如图5所示, 从图5可以求得Qe=180.51mg·g-1, k=2.005×10-4g·mg-1·min-1;R2=0.9987。表明二级动力方程能够很好的拟合KMS-1对Th (Ⅳ) 的吸附动力学过程。
2.3等温吸附模型的研究
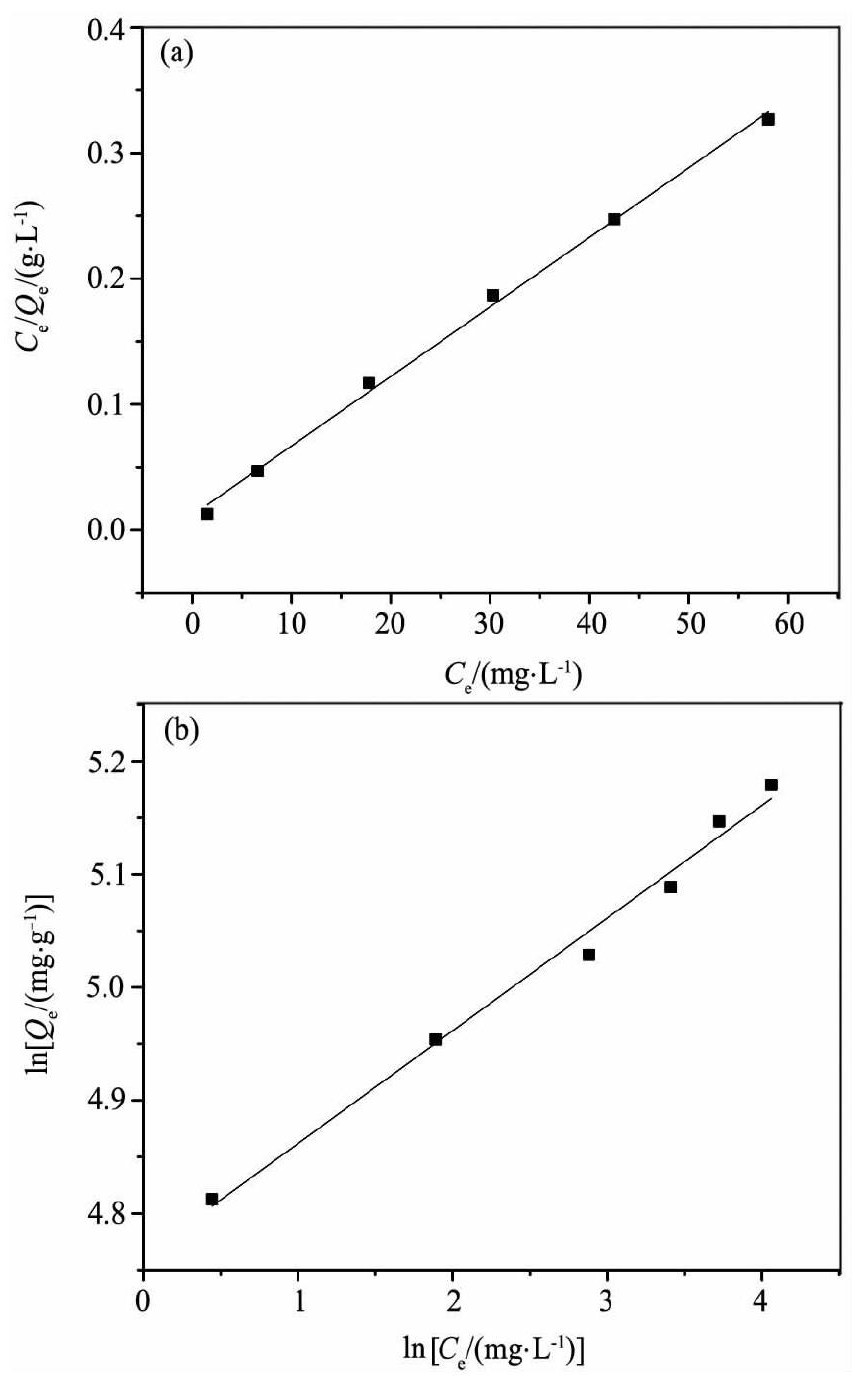
为了能很好地说明KMS-1与Th (Ⅳ) 的离子交换性能, 进行了不同Th (Ⅳ) 初始浓度对Th (Ⅳ) 在KMS-1上的吸附影响的研究。采用Langmuir和Freundlich模型对Th (Ⅳ) 在KMS-1上的吸附反应进行拟合, 如图6所示, 两种模型的表达式如下:
Langmuir吸附等温模型

图4 吸附时间对Th (Ⅳ) 在KMS-1的吸附影响Fig.4Effect of contact time on Th (Ⅳ) adsorption rate on KMS-1
(C0 (Th (Ⅳ) ) =200μg·ml-1, m/V=1 g·L-1, initial p H=3.0±0.1, T= (298±2) K)
图5 Th (Ⅳ) 在KMS-1的吸附准二级动力学模型Fig.5 Pseudo second order fitting for kinetic date correspond-ing to Th (Ⅳ) adsorption on KMS-1
(C0 (Th (Ⅳ) ) =200μg·ml-1, m/V=1 g·L-1, initial p H=3.0±0.1, T= (298.5±2) K)
Freundlich吸附等温模型

Ce是平衡时的浓度 (ml·L-1) , Qe是平衡时Th (IV) 的吸附量 (mg·g-1) , Qm是Th (IV) 在固相上的单层饱和吸附量 (mg·g-1) , b是吸附反应平衡常数, KF和1/n为Freundlich常数, 能够表示吸附强度的大小。
Langmuir和Freundlich等温模型常数列于表1, 结果表明KMS-1能够很好的吸附溶液中的Th (IV) 。从图6可以看出Langmuir模型相对于Freundlich模型能更好的拟合KMS-1与Th (IV) 的离子交换反应。KMS-1与Th (IV) 的离子交换是钍离子与材料层间空隙中的S2-结合, 显然钍离子与S2-的结合能量相同且离子是固定不能移动的, 所以Langmui模型更适合KMS-1的吸附反应。
2.4吸附热力学研究
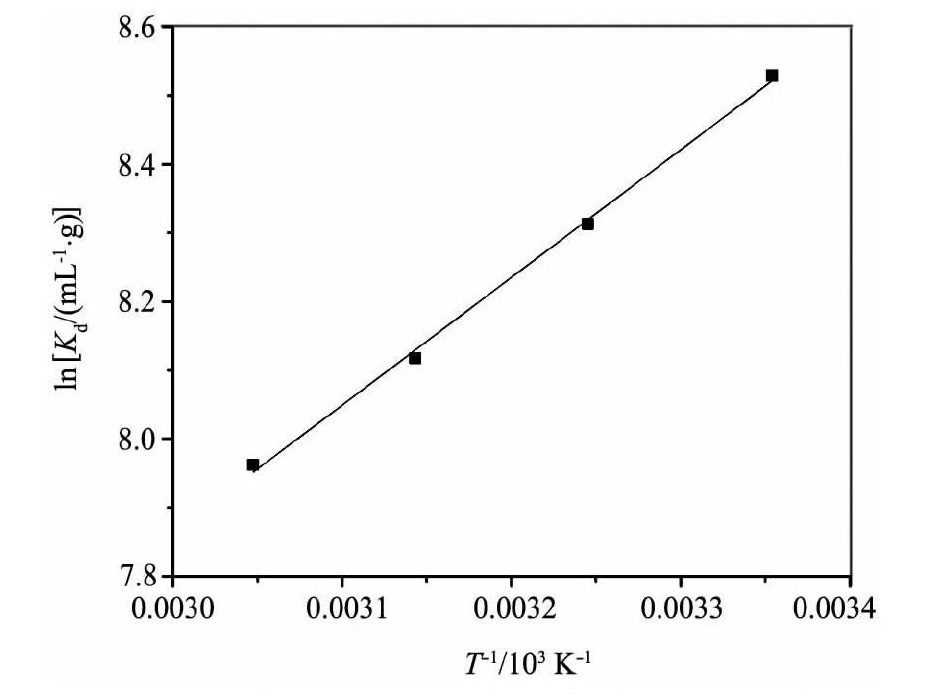
温度是影响吸附的重要因素之一。如图7所示, 研究了T=298.15, 308.15, 318.15 K条件下KMS-1对Th (IV) 的吸附。根据以下方程式计算热力学参数:

图6 KMS-1对Th (Ⅳ) 的吸附等温线Fig.6 Adsorption isotherms of Th (IV) onto KMS-1
(a) Langmuir model; (b) Freundlich model (C0 (Th (IV) ) =200μg·ml-1, m/V=1 g·L-1, I=0.01 mol·L-1Na Cl O4, initial p H=3.0±0.1, T= (298.5±2) K)
表1 Langmuir和Freundlich常数值Table 1 Values of Langmuir and Freundlich constants 下载原图

表1 Langmuir和Freundlich常数值Table 1 Values of Langmuir and Freundlich constants


式中Kd是分配系数, ΔHo (k J·mol-1·K-1) 和ΔSo (J·mol-1·K-1) 分别是标准焓和标准熵, T (K) 为温度, R (8.314 J·mol-1·K-1) 是气体常数。计算ΔHo, ΔSo, ΔGo的结果见表2。
从表2数据看出, ΔHo<0说明该吸附反应是放热反应, 适当降低温度有利于反应的正向进行, 提高吸附容量;ΔGo<0说明该反应能够自发进行;ΔSo>0也说明KMS-1与Th (IV) 的离子交换反应能够很好的进行。
2.5溶液p H和Na+离子浓度的影响
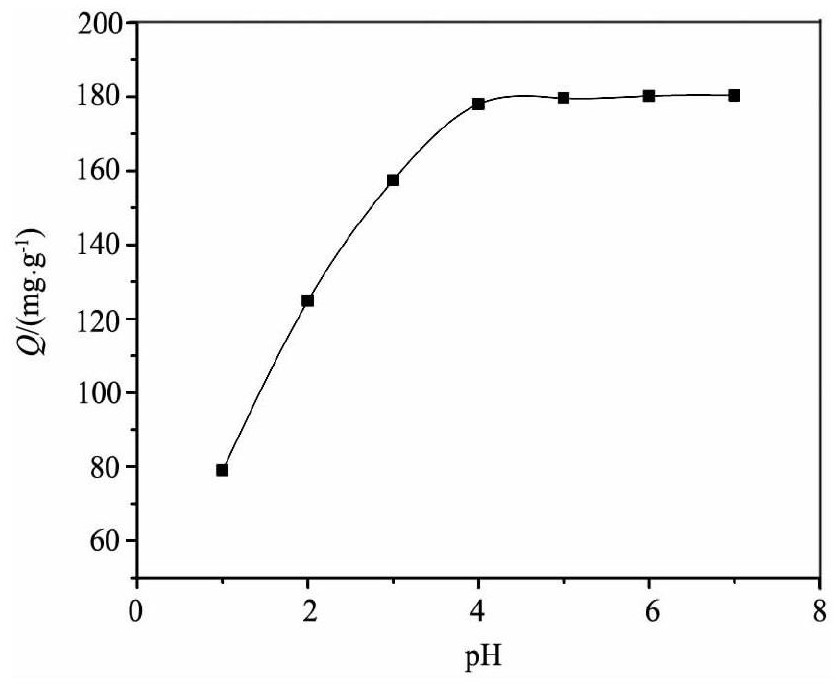
溶液p H是KMS-1吸附Th (IV) 的重要变量, 因为Th (IV) 会随着p H的增大而水解成不同的形式。在不同p H溶液中KMS-1对Th (IV) 吸附结果如图8所示结果表明, 结果表明KMS-1对溶液中Th (IV) 的吸附受p H影响很大。在p H=1~4时, 吸附量速速增大;当p H>4后, 吸附量达到最大并保持不变。
实验结果可以用软硬酸碱理论[11]和Th (IV) 的水解来解释。因为Th (IV) 会随着p H的增大而水解成不同的形式。当p H<3时, Th4+比较稳定, 是Th (IV) 的主要存在形式, 约≥88%, 而Th (OH) 3+小于12%;随着p H的增大, Th4+水解成Th (OH) 3+, Th (OH) 22+, Th (OH) 3+, Th (OH) 4[12,13,14,15]。由于KMS-1中S2-为软碱配体[7], 易于与软酸———Th (Ⅳ) 的水解产物结合, 形成强的共价键所以提高溶液p H有利于反应的进行。
表2 KMS-1吸附Th (IV) 的热力学参数Table 2Thermodynamics parameter of Th (Ⅳ) adsorp-tion by KMS-1 下载原图
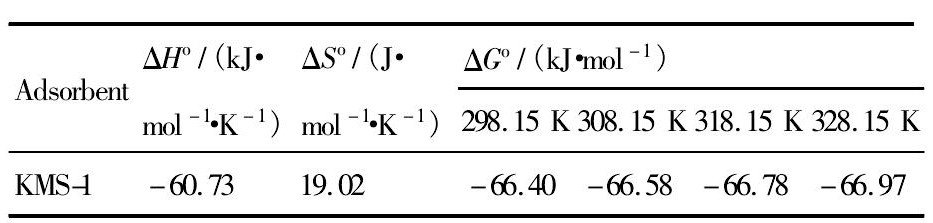
表2 KMS-1吸附Th (IV) 的热力学参数Table 2Thermodynamics parameter of Th (Ⅳ) adsorp-tion by KMS-1
图7 温度对KMS-1吸附Th (IV) ln Kd的影响Fig.7Effect of temperature on distribution coefficients of Th (IV) ln Kdonto KMS-1
(C0 (Th (IV) ) =200μg·ml-1, m/V=1 g·L-1, I=0.0 1 mol·L-1Na Cl O4, initial p H=3.0±0.1)
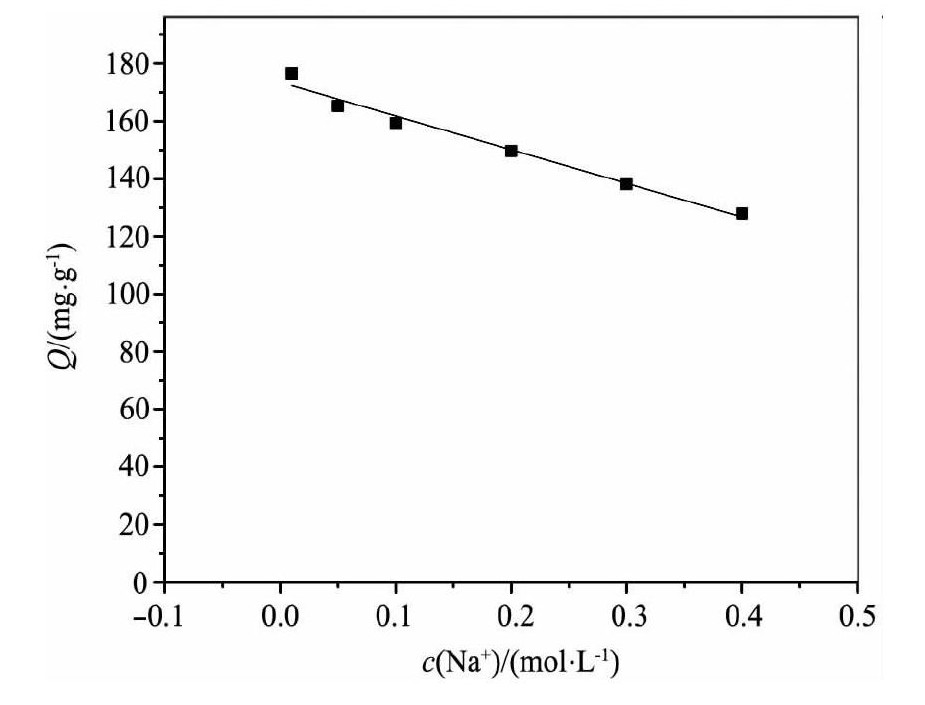
Na+离子强度对KMS-1对Th (IV) 吸附的影响如图9所示, 由图9可知离子强度对KMS-1吸附反应的影响并不明显, 说明KMS-1对Th (IV) 的吸附有很强的选择性。抗Na+离子的干扰是因为, 根据硬酸配硬碱的原理[11], Na+是硬酸, 软碱配体S优先与较软酸Th (IV) 结合, 形成更稳定的共价键。所以Na+的离子强度对该反应的影响不大。
图8 p H对KMS-1对Th (IV) 进行离子交换的影响Fig.8 Variation of Th (IV) uptake by KMS-1 with p H
(C0 (Th (IV) ) =200μg·ml-1, m/V=1 g·L-1, initial p H=3.0±0.1, T= (298.5±2) K)
图9 离子强度对KMS-1离子交换Th (IV) 的影响Fig.9Effect of ionic intensity on ionic-exchange of KMS-1with Th (IV)
(C0 (Th (IV) ) =200μg·ml-1, m/V=1 g·L-1, initial p H=3.0±0.1, T= (298.5±2) K)
3结论
1.Th (IV) 与KMS-1的离子交换反应在4 h时达到反应平衡, 说明该离子交换反应迅速, 并且反应速率服从准二级动力学方程。
2.KMS-1对Th (IV) 的反应是自发的放热过程, 降低温度有利于Th (IV) 与KMS-1的吸附交换反应, 提高吸附性能。
3.根据软硬碱理论, 溶液p H对吸附有很大影响, 随着p H的增大而增大, 当p H>4时, 吸附容量不再随p H的变化而变化, 而离子强度对吸附影响较弱, 说明KMS-1对Th (IV) 吸附有优良性能。
4.KMS-1对Th (IV) 的吸附容量大, 性能好, 是一种有潜力的核素吸附材料, 具有重要的应用价值。
参考文献
[11] Pearson R G.Hard and soft acids and bases[J].Am.Chem.Soc., 1963, 85 (20) :3533.