催化还原法从含碲硫酸铜母液中回收碲的工艺研究
郑雅杰,孙召明
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘 要:
摘 要:采用催化还原法对含碲硫酸铜母液中的碲进行回收。研究结果表明:加入NaCl,NaBr和KI中任意一种物质后,SO2对硫酸铜母液中Te(Ⅳ)的还原速度显著加快;当反应温度为85 ℃,NaCl浓度为1 mol/L,SO2流量为40 L/h,反应时间为2 h时,Te(Ⅳ)的质量浓度从6.72 g/L下降到0.10 g/L,Cu2+的质量浓度从7.78 g/L下降为1.10 g/L,Te(Ⅳ)还原率为98.50%,Cu2+还原率为85.86%;在干燥还原产物中碲、铜和氯所占质量分数分别为52.60%、28.54%和15.24%;NaCl作催化剂时,还原产物中的碲以单质形态存在。
关键词:
中图分类号:TQ125.3 文献标志码:A 文章编号:1672-7207(2010)06-2109-06
A novel technology for tellurium recovery from copper sulphate mother solution containing tellurium by catalyze reduction method
ZHENG Ya-jie, SUN Zhao-ming
(School of Metallurgy Science and Engineering, Central South University, Changsha 410083, China)
Abstract: Tellurium was recovered from copper sulphate mother solution containing tellurium by catalyze reduction method. The results show that when NaCl, NaBr and KI are added into copper sulphate mother solution, the reduction rate of Te(Ⅳ) increases significantly when Te(Ⅳ) is reduced by SO2; when reaction temperature is 85 ℃, concentration of NaCl is 1 mol/L, gas flow of SO2 is 40 L/h, reaction time is 2 h, mass concentration of Te(Ⅳ) decreases from 6.72 g/L to 0.10 g/L, mass concentration of Cu2+ decreases from 7.78 g/L to 1.10 g/L, the reduction ratios of Te(Ⅳ) and Cu2+ are 98.50% and 85.86%, respectively; contents of Te, Cu and Cl in dried products are 52.60%, 28.54% and 15.24%, respectively. There is crystal tellurium in dried product existing in forms of elemental tellurium when NaCl are used as catalyst.
Key words: copper refinery slime; copper sulphate; sulfur dioxide; catalyst; tellurium
地壳中碲平均丰度低(6×10-6),与锗、镓、硒、铟、铊、钪和铼等并称为稀散金属。碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生、电子信息、宇航、能源等工业领域[1-8],碲因此被誉为现代工业、国防与尖端技术的“维生素”,创造人间奇迹的“桥梁”,是当代高技术新材料的支撑材料。碲大多伴生于铜矿床中。自然界中碲矿物除了自然碲外,主要与贵金属以及重金属元素形成碲化物、碲硫(硒)化物以及碲的氧化物和含氧盐等矿物形式存在[9-10]。碲主要从铜和铅阳极泥中回收,回收碲的主要方法有铜粉置换[11]、碱浸法[12-13]、高压酸浸法[14]、溶剂萃取 法[15-16]、微生物[17-18]等方法。马玉天等[19]用SO2从低浓度硫酸溶液中还原制备碲粉。铜粉置换法是工业上从浓硫酸溶液中回收碲的主要方法,该法采用铜粉与碲生成碲化铜回收碲,但是,生产铜粉工艺复杂,回收碲时会消耗大量铜粉,且铜粉置换法生产成本高,后续铜碲分离也复杂。溶剂萃取法受酸度影响大,难以适应高浓度硫酸溶液,溶液须经处理方可采用萃取法提碲。中和法消耗大量碱,产生大量盐类,且碲品位低。目前,从高浓度硫酸溶液中较经济地回收碲的方法未见文献报道。为此,本文作者采用催化还原法从含碲硫酸铜母液中一步回收碲。由于该工艺具有流程短、碲回收率高、成本低等优点[20],已成功应用于工业生产。
1 实验
1.1 实验步骤及工艺流程
取含碲硫酸铜母液400 mL加入到1 L三颈瓶中,启动电动搅拌。用电加热套加热,当达到指定温度后加入催化剂,通入SO2还原,反应后过滤、洗涤得到粗碲,工艺流程如图1所示。
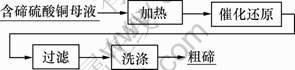
图1 含碲硫酸铜母液回收碲工艺流程
Fig.1 Process of tellurium recovered from copper sulphate mother solution containing tellurium
1.2 分析与检测
采用电感耦合等离子发射光谱仪(ICP)检测溶液成分,采用荧光分析仪(XRF)检测固体产物成分,采用X线衍射仪(XRD)检测产物物相,采用JSM-6360LV扫描电镜(SEM)观察固体产物表面形貌。
2 结果与讨论
铜阳极泥经硫酸化焙烧、硫酸浸出,浸出液经蒸发结晶脱铜后,碲以硫酸氧碲形式进入到硫酸铜母液。在上述过程中,会发生以下化学反应:
Cu2Te+2O2=2CuO+TeO2 (1)
2Ag2Te+3O2=2Ag2O+2TeO2 (2)
TeO2+H2SO4=TeOSO4+H2O (3)
含碲硫酸铜母液成分(质量浓度)如表1所示。由表1可知,含碲硫酸铜母液中Te质量浓度达到6.72 g/L。目前,碲价格为160万元/t,1 m3含碲硫酸铜母液中回收的碲价值达到1万元,具有较高的经济价值。
表1 含碲硫酸铜母液质量浓度
Table 1 Mass concentration of copper sulphate mother solution containing tellurium g/L

2.1 催化剂对Te(Ⅳ)和Cu2+还原率的影响
在400 mL含碲硫酸铜母液中分别加入催化剂NaCl,NaBr和KI,在反应温度为85 ℃,SO2流量为120 L/h,催化剂浓度为0.5 mol/L,反应时间为2 h时,催化剂NaCl,NaBr和KI对Te(Ⅳ)和Cu2+还原率的影响如表2所示。
表2 催化剂对Te(Ⅳ)和Cu2+还原率的影响
Table 2 Effects of catalysts on reduction ratios of Te(Ⅳ) and Cu(II) %
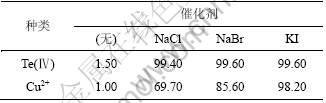
由表2可知:反应2 h后,不加催化剂时,Te(Ⅳ)和Cu2+还原率分别为1.50%和1.00%。加入NaCl,NaBr和KI后,Te(Ⅳ)还原率>99.00%,Cu2+的还原率从69.70%增加到98.20%,反应速度明显加快。
将上述3种催化剂分别加入到含碲硫酸铜母液后形成HX,并发生以下反应:
TeOSO4+2HX=TeOX2+H2SO4 (4)
TeOX2+H2O+SO2=TeX2+H2SO4 (5)
TeX2+SO2=Te+SO2X2 (6)
SO2X2+2H2O=H2SO4+2HX (7)
总化学反应为:
TeOSO4+2SO2+ 3H2O=Te+3H2SO4 (8)
Cl-,Br-和I-与TeO2+结合,降低了SO42-对反应的阻碍作用,加快了Te(Ⅳ)的还原速度。
卤素离子(X-)同时与溶液中铜发生如下化学 反应:
2Cu2++2X-+![]() +SO2+2H2O=Cu2X2↓+2H2SO4 (9)
+SO2+2H2O=Cu2X2↓+2H2SO4 (9)
反应产物Cu2X2不溶于硫酸,由曹锡章等[21]研究可知,Cu2+形成Cu2Cl2,CuBr和CuI的标准电极电位依次为0.538,0.640和0.860 V。因此,在其他条件相同的情况下,Cu2Cl2,CuBr和CuI的Cu2+还原率依次增大。
在催化剂作用下,未烘干和烘干产物X线衍射图(XRD)分别如图2和图3所示。
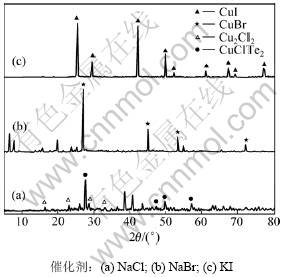
图2 不同催化剂作用下未烘干还原产物XRD图
Fig.2 XRD patterns of wet reduction products with different catalysts
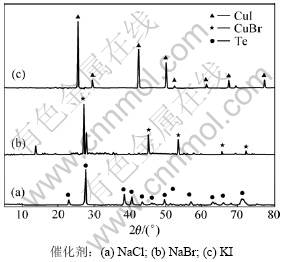
图3 不同催化剂作用下烘干还原产物XRD图
Fig.3 XRD patterns of dried reduction products with different catalysts
由图2可知:在NaCl,NaBr和KI作用下,未烘干产物分别存在Cu2Cl2和CuClTe2,CuBr,CuI等物相,均未发现单质碲物相。
由图3可知:NaCl作催化剂的还原产物经过烘干,Cu2Cl2和CuClTe2的衍射峰消失,出现碲的衍射峰。还原产物加热烘干时,发生以下变化:
4CuCl+O2=2CuCl2+2CuO (10)
2Cu2Cl2Te2+O2=2CuCl2+2CuO+4Te (11)
因此,加热烘干削弱了Cu2Cl2和CuClTe2的衍射强度,同时使CuClTe2分解,形成单质碲。
烘干后产物电镜扫描(SEM)结果如图4所示。用NaCl催化时,还原产物聚集成团;用NaBr催化 时,还原产物颗粒粗大;用KI催化时,还原产物颗粒细小。

图4 不同还原产物的SEM图
Fig.4 SEM images of different reduction products
用NaCl催化时, Te(Ⅳ)形成Te的还原电位与Cu2+形成Cu2Cl2的还原电位相近,还原时Cu2Cl2和Te几乎同时生成,产物出现团聚现象。用NaBr催化时,Cu2+形成CuBr的还原电位高于Te(Ⅳ)形成Te的还原电位,Cu2+部分优先还原形成块状产物CuBr,随后,Te(Ⅳ)和Cu2+同时被还原。用KI催化时,I-自身具有还原剂性质,可以同时将Cu2+和Te(Ⅳ)还原,在I-浓度为0.5 mol/L时,Cu2+和Te(Ⅳ)被迅速还原为Cu2I2和Te,由于成核速度快,产物颗粒细小。
NaBr和KI为催化剂时还原产物局部电子能谱图(EDS)如图5所示。

图5 不同还原产物的EDS图
Fig.5 EDS patterns of different reduction products
从图5可知:用NaBr催化时,产物A成分及质量分数为:Te,60.9%;Cu,17.8%;Br,21.5%;B(三角形)成分及质量分数为:Cu,41.8%;Br,58.2%。用KI催化时产物A(团装)成分及质量分数为:Te,11.0%;Cu,13.01%;I,37.2%;B成分及质量分数为:Te,1.13%;Cu,32.4%;I,54.22%。
催化剂种类对Te还原实验结果表明:SO2还原时,NaCl,NaBr和KI均对Te(Ⅳ)的还原具有明显催化作用。NaCl价格低,因此,选择NaCl作为催化剂。
2.2 反应时间对Te(Ⅳ)和Cu2+还原率的影响
采用NaCl作催化剂,当反应温度为85 ℃,SO2流量为 40 L/h,NaCl浓度为0.5 mol/L时,反应时间对Te(Ⅳ)和Cu2+还原率的影响如图6所示。
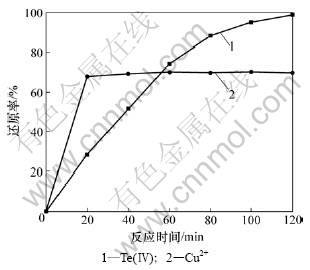
图6 反应时间对Te(Ⅳ)和Cu2+还原率的影响
Fig.6 Effects of reaction time on reduction ratio of Te(Ⅳ) and Cu2+
从图6可知:当反应20 min时,Cu2+还原率为68.9%,Te(Ⅳ)还原率为25.0%;继续延长反应时间,Cu2+还原率上升缓慢,Te(Ⅳ)还原率增加明显;反应2 h时,Te(Ⅳ)还原率为99.0%。因此,适宜反应时间为2 h。
2.3 NaCl浓度对Te(Ⅳ)和Cu2+还原率的影响
上述其他条件不变,当温度为85 ℃,SO2为40 L/h,反应时间为2 h时,NaCl浓度对Te(Ⅳ)和Cu2+还原率影响如图7所示。
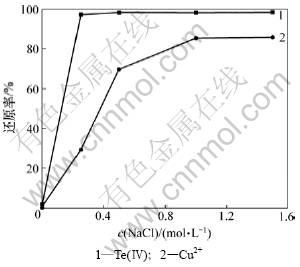
图7 NaCl浓度对Te(Ⅳ)和Cu2+还原率的影响
Fig.7 Effects of NaCl concentration on reduction ratio of Te(Ⅳ) and Cu2+
由图7可知:当NaCl浓度大于0.25 mol/L时,碲还原率为99%;铜还原率随NaCl浓度上升而增大,当NaCl浓度大于1 mol/L时,铜还原率为86%。
根据反应式(9),由勒沙特列原理可知:增加NaCl浓度,有利于Cu2+ 生成Cu2Cl2。因此,Cu2+还原率随NaCl浓度增大而增大;随着反应进行,Cu2+还原率逐步减少,且还原形成的Cu2+与Cl-形成铜氯络合物而溶解,导致铜还原率不再随Cl-浓度升高而降低。考虑到Te(Ⅳ)与Cu2+还原率,适宜NaCl浓度为1 mol/L。
2.4 SO2流量对Te(Ⅳ)和Cu2+还原率的影响
上述其他条件不变,当NaCl浓度为1 mol/L时,SO2流量对Te(Ⅳ)和Cu2+还原率的影响如图8所示。

图8 SO2流量对碲和铜还原率的影响
Fig.8 Effects of SO2 flow on reduction ratio of Te(Ⅳ) and Cu2+
由图8可知:当SO2流量为20 L/h时,Te(Ⅳ)还原率为98%,继续增加SO2流量时,碲还原率上升缓慢;Cu2+还原率随着SO2流量增加而先增加后降低,当SO2流量为40 L/h时,Cu2+还原率达到最大值86%。增加SO2流量,加速了HCl挥发,实际降低了氯离子用量,Cu2+形成Cu2Cl2的含量减少,铜还原率降低。因此,适宜SO2流量为40 L/h。
2.5 反应温度对Te(Ⅳ)和Cu2+还原率的影响
上述其他条件不变,当SO2流量为40 L/h时,反应温度对Te(Ⅳ)和Cu2+还原率影响如图9所示。
由图9可知:当反应温度从40 ℃上升到85 ℃时,碲还原率由36%增加到97%;继续升高反应温度,Te(Ⅳ)还原率上升缓慢;当反应温度为60 ℃时,Cu2+还原率为86%;继续升高反应温度,铜还原率上升缓慢。由阿仑尼乌斯公式可知,提高反应温度可以提高化学反应速度,所以,Te(Ⅳ)还原率随反应温度升高而增大。Cu2+表现出相似规律。但反应速度受许多因素影响,温度的升高同时也引起其他反应条件的变化(如SO2在硫酸中溶解度降低,加速HCl挥发等),改变了反应的平衡条件,导致Cu2+还原率在反应温度超过60 ℃后受温度影响较小。适宜反应温度为85 ℃。

图9 反应温度对碲和铜还原率的影响
Fig.9 Effects of reaction temperature on reduction ratio of Te(Ⅳ) and Cu2+
根据上述研究,从含碲硫酸铜母液中回收碲的适宜条件是:NaCl浓度为1 mol/L,反应温度为85 ℃,SO2流量为40 L/h,反应时间为2 h。取含碲硫酸铜母液10 L在适宜条件下进行放大实验。放大实验结果表明:NaCl作催化剂,经过还原后,Te(Ⅳ)质量浓度从6.72 g/L降到0.10 g/L,Cu2+质量浓度从7.78 g/L降到1.10 g/L,碲和铜还原率分别达到98.50%和85.86%。XRF分析结果表明:烘干还原产物中碲含量为52.60%,铜含量为28.54%,氯含量为15.24%。
3 结论
(1) 在H2SO4质量浓度为880 g/L、Cu2+质量浓度为7.78 g/L、Te质量浓度为6.72 g/L的含碲硫酸铜母液中,通SO2还原,当反应温度为85 ℃,SO2流量为120 L/h,反应时间为2 h时,Te还原率仅为1.50%;分别加入催化剂NaCl,NaBr和KI,且催化剂浓度为0.5 mol/L时,Te(Ⅳ)还原率均为99%。
(2) 使用NaCl作催化剂,向含碲硫酸铜母液中通SO2还原,Te(Ⅳ)还原率随反应时间、NaCl浓度、SO2流量和反应温度的增加而增加。当反应温度为85 ℃、NaCl浓度为1 mol/L,SO2流量为40 L/h,反应时间为2 h时,含碲硫酸铜母液中Te(Ⅳ)质量浓度从6.72 g/L下降为0.10 g/L,Cu2+质量浓度从7.78 g/L下降为1.10 g/L,碲和铜的回收率分别达到98.50%和85.86%。
(3) 以NaCl为催化剂,SO2还原硫酸铜结晶母液中Te(Ⅳ),得到产物经XRD检测,产物中存在单质碲,其中碲、铜和氯所占质量分数分别为52.60%,28.54%和15.24%。
参考文献:
[1] 马玉天, 龚竹青, 徐卫红. 化学气相沉积法制备光谱选择性碲膜[J]. 中南大学学报: 自然科学版, 2006, 37(5): 908-912.
MA Yu-tian, GONG Zhu-qing, XU Wei-hong. Preparation of tellurium films with spectral selectivity by chemical vapour deposition method[J]. Journal of Central South University: Science and Technology, 2006, 37(5): 908-912.
[2] Siciliano T, Di Giulio M, Tepore M, et al. Ammonia sensitivity of RF sputtered tellurium oxide thin films[J]. Sensors and Actuators B, 2009, 138(2): 550-555.
[3] Tsiulyanu D, Tsiulyanu A, Liess H D, et al. Characterization of tellurium-based films for NO2 detection[J]. Thin Solid Films, 2005, 485(1/2): 252-256.
[4] Petragnania N, Stefanib H A. Advances in organic tellurium chemistry[J]. Tetrahedron, 2005, 61(7): 1613-1679.
[5] 袁武华, 王峰. 国内外易切削钢的研究现状和前景[J]. 钢铁研究, 2008, 36(5): 56-57.
YUAN Wu-hua, WANG Feng. Present research status and prospects on free cutting steel at home and abroad[J]. Research on Iron & Steel, 2008, 36(5): 56-57.
[6] 涂锋华, 王维扬, 董德平. 压电陶瓷微位移驱动器在FY-3卫星G型辐射制冷器上的应用[J]. 科学技术与工程, 2008, 8(14): 4029-4030.
TU Feng-hua, WANG Wei-yang, DONG De-ping. Piezoelectric ceramic actuators applied to G-radiant cooler for FY-3 meteorological satellite[J]. Science Technology and Engineering, 2008, 8(14): 4029-4030.
[7] 叶振华, 周文洪, 胡伟达, 等. 碲镉汞红外双色探测器响应光谱研究[J]. 红外与毫米波学报, 2009, 28(1): 4-6.
YE Zhen-hua, ZHOU Wen-hong, HU Wei-da, et al. Spectral study on response of HgCdTe IR two color detector arrays[J]. Infraredmillim Waves, 2009, 28(1): 4-6.
[8] LIANG Feng-xia, QIAN Hai-sheng. Synthesis of tellurium nanowires and their transport property[J]. Materials Chemistry and Physics, 2009, 113(2/3): 523-526.
[9] 钱汉东, 陈武, 谢家东, 等. 碲矿物综述[J]. 高校地质学报, 2000, 6(2): 178-186.
QIAN Han-dong, CHEN Wu, XIE Jia-dong, et al. A review of tellurium minerals[J]. Geological Journal of China Universities, 2000, 6(2): 178-186.
[10] 程裕淇. 大百科全书: 地质学卷[M]. 上海: 中国大百科全书出版社, 1993: 150-160.
CHENG Yu-qi. Encyclopedic: Geology[M]. Shanghai: Encyclopedia of China Press, 1993: 150-160.
[11] 刘兴芝, 宋玉林, 武荣成, 等. 碲化铜法回收碲的物理化学原理[J]. 广东有色金属学报, 2002, 12: 55-58.
LIU Xing-zhi, SONG Yu-lin, WU Rong-cheng, et al. Physicochemical principle for recovering tellurium by copper telluride method[J]. Journal of Guangdong Non-ferrous Metals, 2002, 12: 55-58.
[12] Rhee K I, Lee C K, Ha Y C, et al. Tellurium recovery from cemented tellurium with minimum waste disposal[J]. Hydrometallurgy, 1999, 53(2): 189-201.
[13] Rhee K I, Lee C K, Ha Y C, et al. Recovery of tellurium from copper anode slimes by hydrometallurgical processes[J]. TMS Annual Meeting: Extraction and Processing Division, 1997: 495-504.
[14] 王吉坤, 冯桂林, 张博亚, 等. 采用加压酸浸工艺从铜阳极泥中浸出碲的方法: 中国, 200610010746.6[P]. 2006-03-14.
WANG Ji-kun, FENG Gui-lin, ZHANG Bo-ya, et al. A method on leaching tellurium from copper anode slime by process of acid leaching under pressure: CN, 200610010746.6[P]. 2006-03-14.
[15] Balogh I S, Andruch V. Comparative spectrophotometric study of the complexation and extraction of tellurium with various halide ions and N, N′-di(acetoxyethyl)indocarbocyanine[J]. Analytica Chimica Acta, 1999, 386(1/2): 161-167.
[16] Mandal D K, Bhattacharya B, Das R D. Recovery of tellurium from chloride media using tri-iso-octylamine[J]. Separation and Purification Technology, 2004, 40(2): 177-182.
[17] 廖梦霞, 汪模辉, 邓天龙. 我国首例独立碲矿床资源的开发战略[J]. 四川有色金属, 2004(3): 55-57.
LIAO Meng-xia, WANG Mo-hui, DENG Tian-long. Strategy on tellurium recovery from an unique independent tellurium ore deposit in the world by biohydrometallurgy[J]. Sichuan Nonferrous Metals, 2004(3): 55-57.
[18] Rajwade J M, Paknikar K M. Bioreduction of tellurium to elemental tellurium by pscudomonas mendocina MCMB-180 and its practical application[J]. Hydrometallurgy, 2003, 71(3): 243-248.
[19] 马玉天, 龚竹青, 陈文汨. 从硫酸溶液中还原制取金属碲粉[J]. 中国有色金属学报, 2005, 16(1): 189-194.
MA Yu-tian, GONG Zhu-qing, CHEN Wen-mi. Preparation of powdered tellurium by reduction from sulfuric acid solution[J]. The Chinese Journal of Nonferrous Metals, 2005, 16(1): 189-194.
[20] 郑雅杰, 孙召明, 汪蓓. 阳极泥预处理及回收稀散金属的方法: 中国, 200810032022.0[P]. 2008-08-08.
ZHENG Ya-jie, SUN Zhao-ming, WANG Bei. The pretreatment of copper refinery slime and the method of recovery rare elements: CN, 200810032022.0[P]. 2008-08-08.
[21] 曹锡章, 宋天佑, 王杏乔. 无机化学[M]. 北京: 高等教育出版社, 1994: 499-501.
CAO Xi-zhang, SONG Tian-you, WANG Xin-qiao. Inorganic chemistry[M]. Beijing: Higher Education Press, 1994: 499-501.
(编辑 刘华森)
收稿日期:2009-10-07;修回日期:2009-12-28
基金项目:广东省重大科技专项基金资助项目(2008A090300016)
通信作者:郑雅杰(1959-),男,湖南常德人,教授,博士生导师,从事冶金、水污染控制、化学镀与电镀研究;电话:0731-88836285;E-mail: zzyyjj01@yahoo.com.cn


