浸矿细菌胞外聚合层中多糖含量的测定
富瑶,杨洪英,范有静,张长征
(东北大学 材料与冶金学院,辽宁 沈阳,110819)
摘 要:
摘 要:以稳定期的浸矿细菌菌液为研究对象,探讨苯酚-硫酸法测定浸矿细菌胞外聚合层中多糖含量的最佳条件,并用红外光谱检测浸矿细菌胞外聚合层中多糖的结构组成。研究结果表明,苯酚-硫酸法测定浸矿细菌胞外聚合层中多糖含量的最佳条件为:最大吸收波长490 nm,浓硫酸用量5 mL,苯酚溶液质量分数5%;在最佳条件下测得的浸矿细菌胞外多聚合层中的多糖质量浓度为12 mg/L;由红外光谱分析浸矿细菌胞外聚合层中的多糖,发现其结构中含有O—H,C=C,—CH3和C—H键。
关键词:
中图分类号:TF80 文献标志码:A 文章编号:1672-7207(2010)05-1686-05
Determination of polysaccharide content in extracellular polymers of leaching bacteria
FU Yao, YANG Hong-ying, FANG You-jing, ZHANG Chang-zheng
(School of Materials Science and Metallurgy, Northeastern University, Shenyang 110819, China)
Abstract: The leaching bacteria liquid in the stationary phase was studied. The optimum condition was discussed for the polysaccharide content determined by phenol-sulfuric acid method in the extracellular polymers of leaching bacteria. The infrared spectrum was used to detect the structure of the polysaccharide in the extracellular polymers of leaching bacteria. The results show that the optimum conditions are 490 nm for the maximum adsorption wavelength, 5 mL of H2SO4 and 5% phenol (mass fraction). The measured value is 12 mg/L for the polysaccharide content in the extracellular polymers of leaching bacteria by phenol-sulfuric acid method in the optimum condition. IR analysis results show that the O—H, C=C, —CH3 and C—H bond exist in the extracellular polymers of leaching bacteria.
Key words: phenol-sulfuric acid method; leaching bacteria; extracellular polymers; polysaccharide; infrared spectrum
细菌胞外聚合层(Extracellular polymers,EPS)普遍存在于微生物群体中,它是附着在细菌表面或围绕在细菌周围的菌体新陈代谢产物[1],呈现松散透明黏液状或是胶质状[2];其主要成分为多糖、蛋白质、脂肪等[3-4]。细菌胞外聚合层可用于细菌个体的自我保护、黏附聚集、空间构型、信息交流等[5-6]。在生物冶金中,细菌胞外聚合层是浸矿反应的发生场所[7],具有调节硫化物表面吸附,影响离子交换,提高氧化活性等作用[8-9]。采用苯酚-硫酸法可测定浸矿细菌胞外聚合层中多糖的含量。该比色法的测定原理是:在强酸条件下,多糖在浓硫酸水合产生的高温下迅速水解成单糖,并脱水生成糠醛衍生物,该衍生物与苯酚反应在490 nm处有最大吸收峰的橙黄色物质,且其吸光度与浓度呈线性关系[10-11]。应用苯酚-硫酸法测定不同的糖类物质,其最佳测定条件不同,应以待测多糖作为研究对象,找出其最适测定条件,才能得到较准确的测定结果[12-13]。本文选取浸矿细菌胞外聚合层中的多糖为研究对象,通过单因素条件实验,得出苯酚-硫酸法测定该多糖的最佳条件,并通过红外光谱分析检测该多糖的化学结构,以便为进一步研究浸矿过程中细菌胞外聚合层与矿物之间的作用机理提供技术支持。
1 材料及方法
1.1 菌种
供试菌种为HQ0211菌。该菌是混合浸矿菌株,由主体菌嗜酸氧化亚铁硫杆菌以及嗜酸氧化硫硫杆菌和嗜酸氧化亚铁微螺菌组成,其以Fe2+和S为能源,在pH为1.0~2.5、温度为25~46 ℃条件下自养。
1.2 待测多糖的制备
1.2.1 培养菌液
菌液采用摇瓶培养:9K培养基[14-15]内接入10%的种子液(种子液的菌体质量浓度为108 g/L),初始pH调至1.7,控温为44 ℃,转速为190 r/min,待菌液生长至电位达600 mV以上,得到生长处于稳定期的 菌液。
1.2.2 胞外聚合层中多糖的提取
取3.0 mL培养的菌液于离心管中,以11 500 r/min常温离心12 min,收集沉淀,沉淀中加入3.0 mL 3% EDTA溶液,混匀,以11 500 r/min再次常温离心12 min,上清液用孔径为0.45 ?m微孔滤膜过滤,滤液为待测的多糖样品。
1.3 测定指标
多糖含量的测定采用苯酚-硫酸法,使用TU-1901紫外可见分光光度计测定吸光度;多糖化学键的结构分析采用Spectrum One红外光谱仪扫描,固体样品采用KBr压片。
2 结果与讨论
2.1 最佳测定条件的选择
2.1.1 最大吸收波长
取多糖样品1.0 mL置于试管中,加入浓硫酸5.0 mL,摇匀后加入质量分数为5%的苯酚溶液1.0 mL,混合均匀后在室温下显色20 min,得待测多糖的显色液。以蒸馏水代替多糖,同样按上述方法显色,作为空白样。采用分光光度计扫描显色液的波长,扫面范围设置为440~540 nm,根据扫描结果,确定最大吸收峰对应的波长为最大吸收波长。吸光度随测定波长的变化如图1所示。从图1可见:在440~540 nm的扫描区域,显色液的吸光度先增大后减小,且于490 nm处出现最大吸收峰,这说明浸矿细菌胞外聚合层中的多糖显色液的最大吸收波长为490 nm。
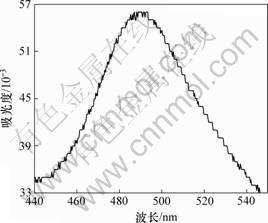
图1 多糖显色液的波长扫描图谱
Fig.1 Wavelength scanning graph of polysaccharide color liquid
2.1.2 浓硫酸用量
取多糖样品1.0 mL分别置于不同编号的试管中,依次加入浓硫酸4.0,4.5,5.0,5.5和6.0 mL,混匀后加入质量分数为5%的苯酚溶液1.0 mL,摇匀,于室温下显色20 min。同样做每种浓硫酸用量的空白样品实验,并在最大波长490 nm处测定显色液的吸光度。吸光度随浓硫酸用量的变化结果如图2所示。由图2可见:显色液的吸光度在浓硫酸用量为5.0 mL时达到最大,此后吸光度不随浓硫酸用量的增加而增大,而是略有减小。这表明实验中浓硫酸的用量存在最适
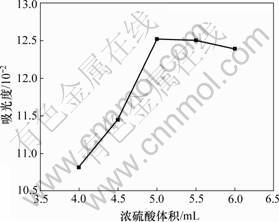
图2 浓硫酸用量对吸光度的影响
Fig.2 Influence of sulfuric acid on absorbance
值,即5.0 mL,高于或低于此用量时,都不能达到最佳的显色效果。
2.1.3 苯酚溶液质量分数
采用确定的最大吸收波长和最佳浓硫酸用量,改变苯酚溶液的质量分数,分别设定为3%,4%,5%,6%和7%,其他操作条件相同,同样做每种质量分数的空白样品实验,测定多糖显色液的吸光度。图3所示为吸光度随苯酚质量分数的变化结果。可见:当使用质量分数为5%的苯酚溶液时,显色液的吸光度达最大值,而且明显大于其他显色液的吸光度。该结果表明实验中苯酚溶液的质量分数控制为5%时可达最佳测定效果,即该质量分数的苯酚溶液恰好与糠醛衍生物充分反应。
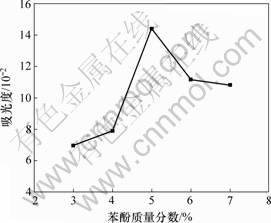
图3 苯酚质量分数对吸光度的影响
Fig.3 Influence of concentration of phenol on absorbance
2.1.4 反应时间
按照确定的最佳测定条件,将所用多糖样品和试剂全部加入后,迅速混匀,并采用扫描的方法测定反应时间,扫描时间设置为1 200 s。吸光度随反应时间的变化结果如图4所示。根据图4可知,当多糖样品和试剂混合后,反应立即发生,吸光度波动;反应发生200 s后结束,吸光度稳定。此结果说明:用苯酚-硫酸法测定浸矿细菌胞外聚合层中的多糖含量时,多糖和试剂反应200 s后吸光度才能稳定。
2.2 精密度和稳定性实验
2.2.1 精密度实验
按照最佳测定条件,进行平行实验,结果如表1所示。从表1可知:6次平行实验的相对标准偏差为1.75%,低于2.00%,这表明采用苯酚-硫酸法测定浸矿细菌胞外聚合层中的多糖含量,结果精密度较高。
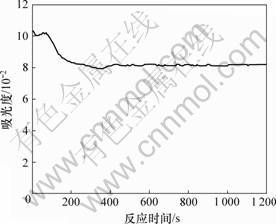
图4 多糖显色液的反应时间扫描图谱
Fig.4 Scanning graph of reaction time for polysaccharide color liquid
表1 平行实验结果
Table 1 Parallel experimental results

2.2.2 稳定性实验
取多糖样品1.0 mL,按上述最佳测定条件比色,测定显色15,30,45,60,75和90 min时的吸光度,结果如图5所示。从图5可知:多糖显色液在比色后的15~90 min内,吸光度稳定在一条直线上,基本不变。这表明采用苯酚-硫酸法测定浸矿细菌胞外聚合层中的多糖含量时,显色液可稳定显色90 min,即在多糖显色的90 min内,显色液的吸光度均为有效值。
2.3 标准曲线
2.3.1 标准曲线的制作
用干燥至恒重的蔗糖准确配置质量浓度为0.1 g/L的标准液。准确量取该蔗糖标准液0.05,0.10,0.15,0.20,0.25和0.30 mL于试管中,并分别用蒸馏水补至体积为1.0 mL,按照最佳测定条件比色,以蒸馏水做空白样品实验,测定吸光度,绘制蔗糖标准曲线,如图6所示。该曲线的相关系数r=0.999,这表明:当蔗糖质量浓度为0~0.03 g/L时,质量浓度与吸光度之
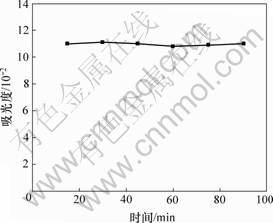
图5 多糖显色液的吸光度随时间的变化曲线
Fig.5 Absorbance curve for polysaccharide color liquid changing along with time
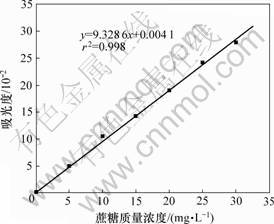
图6 蔗糖质量浓度与吸光度的关系
Fig.6 Relationship between sucrose concentration and adsorption
间基本符合郎伯-比尔定律,呈现良好的线性关系;即使用该标准曲线,可科学地计算多糖含量。
2.3.2 标准液的最大吸收波长
蔗糖标准液的吸收波长如图7所示。由图7可以看出:蔗糖标准液的最大吸收波长也为490 nm,与提取的多糖显色液的一致。由此说明,提取的多糖与蔗糖标准液有相同的最大吸收波长;因而可根据蔗糖标准曲线计算浸矿细菌胞外聚合层中多糖的含量。
2.4 多糖含量的测定
将平行实验得到的吸光度平均值0.119代入到标准曲线回归方程中,计算出提取的浸矿细菌胞外聚合层中的多糖含量为12 mg/L。
2.5 多糖的红外光谱检测
采用红外光谱分析浸矿细菌胞外聚合层中多糖的
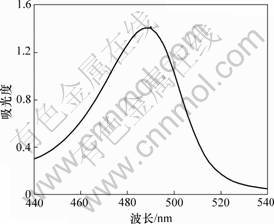
图7 蔗糖显色液的波长扫描图谱
Fig.7 Wavelength scanning graph of sucrose color liquid
表2 多糖的红外吸收峰
Table 2 Infrared absorption band of polysaccharide
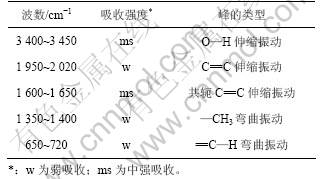
化学结构,结果见表2。从表2可知,提取的多糖具有O—H,C=C,—CH3和C—H键,这些化学键符合糖类物质的结构特性,其可组成多糖的主体构架。
3 结论
(1) 采用苯酚-硫酸法测定浸矿细菌胞外聚合层中的多糖含量,其最佳测定条件如下:比色波长为490 nm,浓硫酸用量为5.0 mL,苯酚溶液质量分数5%,反应时间200 s,显色反应稳定时间为90 min。
(2) 测定浸矿细菌胞外聚合层中的多糖含量时,苯酚-硫酸法具有较高的精密度和稳定性;选用蔗糖标准曲线可以客观地计算提取的多糖含量;测得的稳定期菌液的多糖含量为12 mg/L。
(3) 浸矿细菌胞外聚合层中的多糖含有O—H,C=C,—CH3和C—H等化学结构。
参考文献:
[1] Omoike A, Chorover J. Adsorption to goethite of extracellular polymeric substances from Bacillus subtilis[J]. Geochimica Acta, 2006, 70(4): 827-838.
[2] Bhaskar P V, Bhosle N B. Bacterial extracellular polymeric substance (EPS): A carrier of heavy metals in the marine food-chain[J]. Environment International, 2006, 32(2): 191-198.
[3] Sand W, Gehrke T, Jozsa P G, et al. Biochemistry of bacterial leaching-direct vs. indirect bioleaching[J]. Hydrometallurgy, 2001, 59(2): 159-175.
[4] 杨显万, 沈庆峰, 郭玉霞. 微生物湿法冶金[M]. 北京: 冶金工业出版社, 2003: 40-41.
YANG Xian-wan, SHEN Qing-feng, GUO Yu-xia. Microorganism hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 2003: 40-41.
[5] 朱长亮, 杨洪英, 贾炳国, 等. 细菌胞外聚合物的工程应用现状及研究进展[J]. 金属矿山, 2008(2): 5-6.
ZHU Chang-liang, YANG Hong-ying, JIA Bing-guo, et a1. Status quo of engineering application of extracellular polymeric substances(EPS) from bacteria and progress in its research[J]. Metal Mine, 2008(2): 5-6.
[6] Arredondo R, Garcia A, Jerez C A. Partial removal of lipolysaccharide from thiobacillus ferrooxidans affects its adhesion to solids[J]. Environ Microbiol, 1994, 60(8): 2846-2851.
[7] Sand W, Gehrke T. Extracellular polymeric substances mediate bioleaching/biocorrosion via interfacial processes involving iron(Ⅲ) ions and acidophilic bacteria[J]. Research in Microbiology, 2006, 157(1): 49-56.
[8] Tributsch H. Direct versus indirect bioleaching[J]. Hydrometallurgy, 2001, 59(2/3): 177-185.
[9] Schippers A, Sand W. Bacterial leaching of metal sulfides proceeds by two indirect mechanisms via thiosulfate or via polysulfides and sulfur[J]. Environ Microbiol, 1999, 65(1): 319-321.
[10] 郭金龙, 陈有君, 孙国琴, 等. 苯酚-硫酸法测定杏鲍菇多糖方法的研究[J]. 食品科学, 2008, 29(12): 555-558.
GUO Jin-long, CHEN You-jun, SUN Guo-qin, et a1. Study on phenol-sulfuric acid method for determination of polysaccharide content in pleurotus eryngii[J]. Food Science, 2008, 29(12): 555-558.
[11] 陈战国, 周利燕, 李鹏程. 苯酚-硫酸法测定太白泡沙参总多糖的含量[J]. 陕西师范大学学报: 自然科学版, 2009, 37(4): 48-51.
CHEN Zhan-guo, ZHOU Li-yan, LI Peng-cheng. Determination of the total polysaccharide in the A.potaninii korsh. from taibai mountain in China with phenol-sulfuric acid method[J]. Journal of Shanxi Normal University: Natural Science Edition, 2009, 37(4): 48-51.
[12] 郑必胜, 唐芳勇, 闫文娟, 等. 苯酚-硫酸法测定广东虫草菌丝体多糖含量的研究[J]. 农产品加工学刊, 2008(8): 18-19.
ZHENG Bi-sheng, TANG Fang-yong, YAN Wen-juan, et al. Study on polysaccharides from guangdong cordyceps mycelium by phenol-sulfuric acid method[J]. Academic Periodical of Farm Products Processing, 2008(8): 18-19.
[13] 李燕平, 袁永俊, 张黎明, 等. 苯酚-硫酸法测定牛肝菌多糖含量[J]. 西华大学学报: 自然科学版, 2009, 28(3): 76-79.
LI Yan-ping, YUAN Yong-jun, ZHANG Li-ming, et al. Determination of the contents of polysaccharides in boletus by phenol-sulfuric acid method[J]. Journal of Xihua University: Natural Science, 2009, 28(3): 76-79.
[14] Acharya C, Kar R N, Sukla L B. Bacterial removal of sulphur form three different coals[J]. Fuel, 2001, 80(15): 2207-2216.
[15] 王艳锦, 巢雁加, 郑正, 等. 载体对氧化亚铁硫杆菌氧化活性的影响及生物量分析[J]. 环境工程学报, 2007, 1(8): 136-139.
WANG Yan-jin, CHAO Yan-jia, ZHENG Zheng, et al. Effect of carrier on the oxidative activity of thiobacillus ferrooxidans and analysis of biomass[J]. Chinese Journal of Environmental Engineering, 2007, 1(8): 136-139.
收稿日期:2010-01-03;修回日期:2010-04-15
基金项目:国家自然科学基金资助项目(50674029,50874030);国家高技术研究发展计划项目(2006AA06Z127);高等学校博士学科点专项科研基金资助项目(20060145015);中央党校基本科研业务费专项资金资助项目(N090602010)
通信作者:杨洪英(1960-),女,河北新河人,教授、博士生导师,从事生物冶金研究;电话:024-83680373;E-mail: yanghy@smm.neu.edu.cn


