硫化锑精矿湿法清洁冶金新工艺
高亮,杨建广,陈胜龙,刘小文,李静,唐谟堂
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘 要:
的浸出—净化—电积的闭路循环实验。考察温度、添加剂种类及浓度、Sb3+浓度和电流密度对沉积锑的形貌和质量的影响,得到避免爆锑形成的优化条件:阴极电流效率高达99%,每吨锑电耗约为1 200 kW·h。利用隔膜电积阳极室生成的SbCl5为浸出剂,得到SbCl5浸取硫化锑矿的最佳条件:温度为85 ℃,H+浓度为3.5 mol/L,液固比为8:1,SbCl5过量系数为理论量的1.1倍,浸出时间为1.5 h,在此条件下,硫化锑矿的浸出率达到99.5%。浸出液经过锑粉还原、硫化除重金属及Na3PO2除砷,得到的净化液用于电沉积能够得到质量良好的沉积物。
关键词:
中图分类号:TF818 文献标志码:A 文章编号:1672-7207(2012)01-0028-10
A new process for cleaning hydrometallurgy of antimony sulfide
GAO Liang, YANG Jian-guang, CHEN Sheng-long, LIU Xiao-wen, LI Jing, TANG Mong-tang
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: The experiment of leaching-purification and electrodeposition of antimony sulfide was carried out. The temperature, additives, antimony-ion concentration and current density on the deposition of antimony in morphology and quality were studied. In the optimal conditions obtained, explosive antimony can be avoided, the cathode efficiency reaches 99% and the power consumption is only about 1 200 kW·h per ton of antimony. Using the anolyte as leaching agent, the optimum conditions of extracting antimony sulfide by SbCl5 were obtained. The results show that with the experimental parameters of leaching temperature of 85 ℃, the concentration of H+ of 3.5 mol/L, the ratio of liquid to solid of 8, the SbCl5 amount of 1.1 times of theoretic amount and the reaction time of 1.5, the leaching rate of antimony sulfide is 99.5%. Through the reduction of antimony powder, sulfide purifying of heavy metal and arsenic removal by Na3PO2, the leaching solution is pure enough to deposit high quality antimony.
Key words: antimony sulfide; electrodeposition by SbCl3; explosive antimony; leaching by SbCl5; purification
在我国有色金属的生产中,硫化矿冶炼过程产生的低浓度二氧化硫烟气一直是我国酸雨的重要来源之一。随着生产技术的进步,目前铜、铅、锌等硫化矿采用富氧强化熔炼技术,已基本解决了低浓度二氧化硫污染问题。而硫化锑矿冶炼因为其生产规模较小、硫化锑易挥发,大多采用传统的挥发熔炼(焙烧)—还原熔炼工艺,存在SO2烟气浓度低而难于利用、污染严重、熔炼温度高、能耗大等问题。近年来,人们进行了多项研究来改进传统炼锑工艺,如:广西华锡集团进行了富氧强化熔池熔炼实验,但因其生产规模较小、硫化锑易挥发等,实现产业化将存在比较大的技术及工程难题;湿法炼锑中碱法炼锑工艺因存在副产品增生积累严重、电流效率低等问题,20世纪70年代停产后一直没有再用;辰州矿业用氯化—水解法生产高纯氧化锑,提高了产品质量,但该工艺需大量的纯水稀释溶液,废水排放量大;FeCl3浸出—电积法和矿浆电解法也仅限于实验室技术, 且存在杂质积累速度较快、电流效率低等问题,产业化的可能性很小[1-3]。鉴于此,开发新的锑清洁冶金工艺对我国锑冶炼工业意义重大。Tang等[4]采用新氯化-水解工艺处理广西大厂脆硫锑铅矿,制得锑白产品。该工艺对解决当时锑冶炼产生的大量低浓度二氧化硫污染问题作出了贡献,但近年来随着环境保护对废水排放的要求越来越严格,该工艺面临越来越大的压力。本文作者进行三氯化锑水溶液电沉积研究,然后,利用电积过程中阳极生成的五氯化锑作为浸出剂,对辉锑矿进行酸性浸出;最后,对浸出液进行净化除杂,得到合格电解液,从而实现浸出-电积的闭路循环,以解决湿法炼锑废水排放量大的问题。
1 试验原料及流程
1.1 试验原料
本研究所用到的锑精矿来自湖南某冶炼厂,化学成分如表1所示,其中57.23%的Sb以硫化锑形态赋存,1.72%以三氧化二锑形态赋存,2.90%以锑酸盐形态赋存。电积用的电解液来自上述锑精矿浸出后净化液,稀释使用前主要成分见表2。阴离子交换膜为山东海洋化工科学研究院生产的DF120型阴离子交换膜,其他试剂主要是SbCl3,盐酸,NaCl,Na2S,Na3PO2和多种添加剂,均为分析纯。
表1 硫化锑矿化学成分(质量分数)
Table 1 Chemical composition of antimony sulfide %
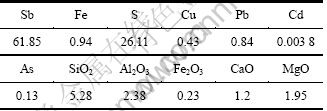
表2 电解液的化学成分分析(质量浓度)
Table 2 Chemical composition of electrolyte g/L

1.2 试验流程
试验简单流程如图1所示。试验先以配制的SbCl3水溶液电积,在阳极室富集得到较高浓度的SbCl5溶液后,以SbCl5作为浸出剂进行浸出试验,浸出液经过净化除杂后返回电积过程,试验进入浸出—电积的闭路循环。
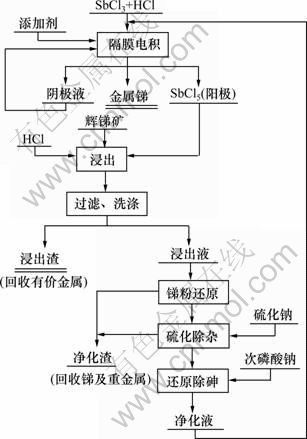
图1 试验流程图
Fig.1 Experimental flow chart
2 SbCl5浸出-Sb电积试验研究
2.1 三氯化锑水溶液电沉积锑研究
氯盐体系电沉积锑具有电流效率高、电能消耗低等优点,但一直困扰人们的是氯化锑水溶液电解会析出所谓的“爆锑”。爆锑是一种呈无定形的阴极产物,当使用硬物打击、研磨、接触电火花或加热到125 ℃以上时就会发生爆炸放热,放出白烟[2]。显然,具有这种性质的锑在工业上既无用又危险。本实验旨在研究形成正常锑的条件范围,以避免电积过程中爆锑的 形成。
2.1.1 实验原理
在三氯化锑水溶液中,随Cl-浓度的增加,Sb将以氯络合物的形式存在,当Cl-浓度大于3 mol/L后,Sb绝大部分以![]() 的形式存在[5]。因此,在阴极上放电的离子既可以是Sb3+,也可能是络阴离子直接放电。一般认为,络离子可以在电极上直接放电,并且是配位数较低的络离子直接放电,这是因为Cl-能吸附在电极/溶液界面上,使电极过程活化,降低电极反应的活化能,使络离子的放电较简单离子容易[2]。因此,SbCl3水溶液电积的阴极反应为:
的形式存在[5]。因此,在阴极上放电的离子既可以是Sb3+,也可能是络阴离子直接放电。一般认为,络离子可以在电极上直接放电,并且是配位数较低的络离子直接放电,这是因为Cl-能吸附在电极/溶液界面上,使电极过程活化,降低电极反应的活化能,使络离子的放电较简单离子容易[2]。因此,SbCl3水溶液电积的阴极反应为:
![]() →SbCl3→
→SbCl3→![]() →SbCl2+ (1)
→SbCl2+ (1)
SbCl2++3e→Sb+Cl- (2)
Sb3++3e=Sb,![]() =0.240 V (3)
=0.240 V (3)
此外,在电积条件下,阴极析氢超电势远比Sb析出电位负,故一般情况下很少有氢气析出。阳极则可能发生如下反应:
Sb5++2e=Sb3+,![]() =0.750 V
=0.750 V
O2+4H++4e→2H2O,![]() =1.229 V
=1.229 V
Cl2+2e→2Cl,![]() =1.358 V
=1.358 V
从上述标准电位看出:在一般情况下,阳极不会析出O2和Cl2,整个电极反应主要是在阴极Sb3+还原为金属Sb而得到产品,在阳极Sb3+氧化成Sb5+,形成浸出剂SbCl5的再生。
2.1.2 实验方法
实验采用的SbCl3来自硫化矿浸出后的净化液,其稀释前主要成分如表2所示,用盐酸和NaCl共同调节溶液酸度和总氯浓度。实验在自制的隔膜电解槽中进行,电解槽置于恒温水浴箱中控制电解温度,用阴离子交换膜把阴阳极室隔开,阴极室溶液约为550 mL,阳极室溶液约为500 mL,阴极液面高出阳极液面约为10 mm,以保证一定的液压差,有利于阴离子的交换。采用紫铜板为阴极,高纯石墨板为阳极,其尺寸(长×宽×厚)分别为50 mm×60 mm×1 mm和 50 mm×60 mm×10 mm。
2.1.3 结果与讨论
(1) 温度对电沉积过程的影响。在Sb3+质量浓度为70 g/L,H+浓度为4 mol/L,Cl-浓度为5.8 mol/L,NaCl质量浓度为40 g/L,添加剂A质量浓度为30 mg/L,电流密度为200 A/m2和电积时间为8 h条件下,分别考察温度为30,35,40和45 ℃时,阴极产物质量,结果如图2和图3所示。
结果表明:当温度为30 ℃时,沉积物光亮致密,但沉积物表面有明显的宏观爆裂,可以确定形成的是爆锑(图2(a));当温度升高到35 ℃时,发现沉积过程不易控制,沉积稳定的情况下形成表面粗糙的正常锑,而沉积条件波动幅度稍大则会形成爆锑;当温度达到40 ℃以上时,没有爆锑现象的发生,沉积物表面粗糙呈暗灰色(图2(b)),且随温度升高,沉积物表面瘤状颗粒数量减少,粒度变小,沉积物明显比较低温度下平整。
图3所示为温度对阴阳极电流效率和电耗的影响,从图中可以看出,阴阳极电流效率随温度升高而升高,在40 ℃后达到平衡,阴极电流效率高达99%以上,阳极效率也达到了88.23%,阳极效率难以再提高一方面是随反应进行阳极Sb3+减少导致氧化接触面减少,另一方面游离的Cl-因挥发和消耗导致SbCl5的生成速度减慢。此外,随温度升高每吨锑电耗大幅下降最后趋于平缓,原因是随温度升高,溶液比电阻下降,离子传质速度加快,使槽电压降低[6]。综上所述,选择电沉积温度在40~45 ℃之间为宜,因为温度再升高对沉积物形貌、电效和电耗的影响已不明显,反而容易造成溶液的挥发加剧。
(2) 添加剂种类及浓度对电积过程的影响。在温度为(42±2) ℃,其他条件与2.3.1节中的条件相同,分别考察表面活性物质A~F的单一或复合添加对沉积物质量的影响(添加剂A~F是脱附电位比Sb3+析出电位(-1.15 V,相对饱和甘汞电极)更负的脂肪醇、胺或季铵盐和动物胶等[7]),结果如图4和表3所示。图4所示为不同添加剂下得到的阴极沉积物宏观形貌照片。

图2 爆锑与正常锑的宏观形貌照片
Fig.2 Appearance photos of explosive and normal antimony
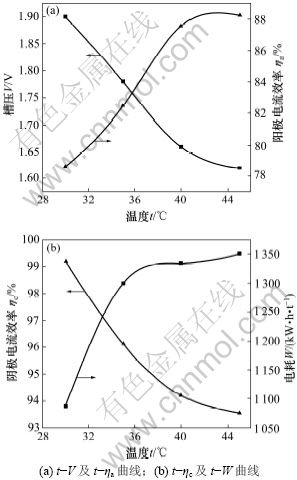
图3 槽压(V)、电耗(W)和阴阳极效率(ηc,ηa)随温度(t)的变化曲线
Fig.3 Curves of cell voltage, power consumption and electrode efficiency varied with temperature
由图4可知:当同时使用添加剂A+D时,能得到致密平整的正常锑,沉积物质量较好,呈钢灰色(图4(c));其他单一或复合添加剂都不能得到沉积形貌较好的锑板。可见:添加剂A+D对改善氯盐体系锑电积过程作用明显。
此外,不同添加剂浓度对沉积物质量也有一定影响,添加剂用量过少,则不能起到应有效果;反之,则会大量吸附在电极表面,导致阴极极化电压显著上升,同时溶液电阻增加,槽压大幅上升,得到的沉积物质量较差。因此,还必须研究添加剂A和D的用量。表3所示为不同浓度添加剂A和D对电沉积过程的影响。从表3可以看出:添加剂过少或过多都不能达到较好的结果,且随添加剂用量的增加,平均槽压有增加的趋势。除添加剂浓度过高的情况外,添加剂的用量对阴阳两极的电流效率都影响不是很大,实验结果表明,选择添加剂A质量浓度为30 mg/L和添加剂D质量浓度为20 mg/L能得到形貌最好的锑,电积时间延长到20 h以上仍能得到良好的沉积效果。
(3) Sb3+浓度对电积过程的影响。加入添加剂A和D,其质量浓度分别为30 mg/L和20 mg/L,氯化钠 加入量随Sb3+质量浓度而变,以保证Cl-浓度达到5.8 mol/L左右,其他条件同上,分别考察Sb3+质量浓度为30,50,70,90和110 g/L的情况下,阴极产物质量,结果如图5和图6所示。

图4 不同添加剂下得到的阴极沉积物宏观形貌照片
Fig.4 Appearance photos of cathode deposits with different additives
实验结果表明:Sb3+质量浓度为30 g/L时,只能在极板表面得到一薄层鳞状爆锑,随后得到的是粉锑,粉锑沉积速度较快,并有落槽现象发生;当Sb3+质量浓度为110 g/L时,得到的沉积物局部爆裂,表面无明显光泽;其他浓度下得到的产物均为正常锑,沉积物平整致密,呈钢灰色。图5所示为不同起始Sb3+质量浓度下得到的阴极产物SEM像,其中起始Sb3+质量浓度为30 g/L和110 g/L时取样自爆锑裂口附近。由图5可以看到:当Sb3+质量浓度为30 g/L时,有大量粒度5~10 μm的方形晶粒;在Sb3+质量浓度为110 g/L时,也有少量粒宽约5 μm的晶粒,而在远离裂口的部分没有发现;在Sb3+质量浓度为70 g/L时,没有类似的大颗粒。由于这种大晶粒的存在,导致晶间应力发生变化,颗粒越多越大,晶间应力也越大,最后发生爆裂形成爆锑。从晶相来看,沉积物呈现清晰的凤尾草晶形,并且爆锑的晶枝细而短(如图5(b)和图5(d)),长约1 μm,正常锑的晶枝则相对粗且稍长,因此,表现出正常锑表面不如爆锑光滑、略显粗糙,这与文献[1]所述的一致。
图6所示为槽压、电耗和阴阳极电流效率与Sb3+浓度的关系。从图6可以看出:除阳极效率随Sb3+浓度的增高而降低外,槽压、电耗都有1个最低点,阴极效率也有一最高点,这一点对应的Sb3+质量浓度约为70 g/L,出现这种现象的原因是当溶液中Sb3+浓度过低时,电极表面会发生浓差极化现象;当Sb3+质量浓度过高时,溶液比电导下降,离子发生缔合[8-9]。所以,保持溶液中Sb3+质量浓度在70 g/L为宜。
表3 不同浓度添加剂A和D对电沉积过程的影响
Table 3 Effect of different concentrations additive A and D on electrodeposition
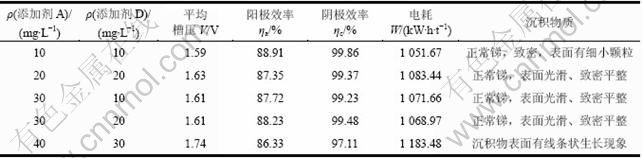

图5 不同起始Sb3+质量浓度下阴极沉积物不同倍数SEM像
Fig.5 SEM images of deposits at different mass concentrations of Sb3+
(4) 电流密度对电积过程的影响。在温度45 ℃,Sb3+质量浓度为70 g/L、H+浓度为4 mol/L、Cl-浓度为5.8 mol/L、NaCl浓度为40 g/L、添加剂A质量浓度为30 mg/L和D质量浓度为20 mg/L的条件下,分别考察电流密度为200,250,300和400 A/m2时阴极产物质量,结果如图7和图8所示。
由图7可见:电流密度越小,阴极沉积物质量越好;当电流密度为200 A/m2和250 A/m2时,得到的阴极锑表面光滑致密,产物为正常锑;当电流密度为300 A/m2时,得到的沉积物平整致密,表面有少量细小颗粒,沉积物整块未爆锑;当电流密度增大到400 A/m2时,沉积物表面有明显的爆裂现象,部分爆锑,且随电流密度的增加,沉积物表面颜色逐渐由暗变亮。
图8所示为槽压、电耗和阴阳极电流效率与电流密度的关系。由图8可知:槽压和电耗随着电流密度度的增加而增加,阴阳极电流效率随电流密度的增加而较小。经综合考虑,选择电流密度为250 A/m2。
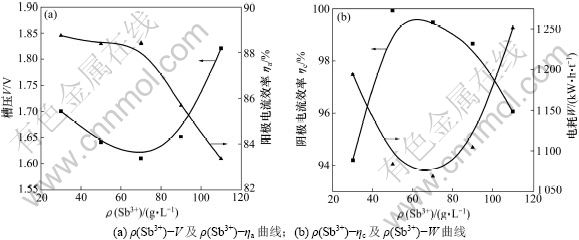
图6 槽压(V)、电耗(W)和阴阳极效率(ηc,ηa)随Sb3+质量浓度的变化曲线
Fig.6 Curves of cell voltage, power consumption and electrode efficiency varied with mass concentrations of Sb3+

图7 不同电流密度下阴极沉积物的宏观形貌照片
Fig.7 Appearance photos of cathode deposits at different current densities
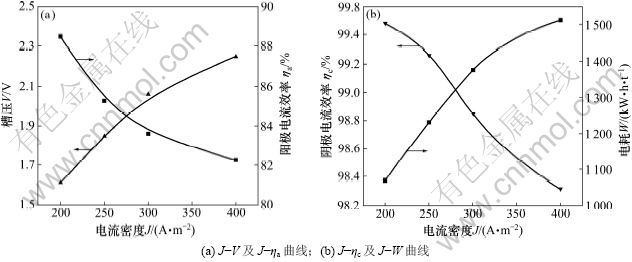
图8 槽压(V)、电耗(W)和阴阳极效率(ηc,ηa)随电流密度(J)的变化曲线
Fig.8 Curves of cell voltage, power consumption and electrode efficiency varied with current density
2.2 SbCl5浸出辉锑矿研究
在浸出实验之前,对电积阳极液进行表征分析,确定其成分为SbCl5。其原理是在酸性溶液中Sb3+能被硫酸铈氧化成Sb5+(Sb3++2Ce4+=Sb5++2Ce3+),过量的硫酸铈可以使甲基橙褪色;实验先测定阳极液中Sb3+含量,再通过硫酸联胺还原测定总锑含量,利用差减法确定阳极液中Sb5+含量。SbCl5浸取辉锑矿的 实验过程如下。
2.2.1 实验原理
浸出反应是利用隔膜电极过程中阳极生成的SbCl5,以SbCl5为浸出剂是基于Sb5+有较强的氧化能力(![]() =0.75 V),它能氧化硫化锑矿中的硫,过程的主要反应可用下式描述:
=0.75 V),它能氧化硫化锑矿中的硫,过程的主要反应可用下式描述:
Sb2S3+3SbCl5=5SbCl3+3S
锑以SbCl3的形式进入溶液,而硫大多数呈固体元素硫形态析出,少量被氧化成SO4-。SbCl3还能与Cl-形成稳定的络阴离子![]() 和
和![]() 等,因此,在一定浓度的HCl溶液中,可以促进浸出反应的进行。
等,因此,在一定浓度的HCl溶液中,可以促进浸出反应的进行。
2.2.2 实验方法
浸出实验在500 mL锥形瓶中进行,根据酸度、液固比和SbCl5过量系数确定HCl和SbCl5用量,配制浸出液加入锥形瓶中,置于恒温油浴中加热。待升温至要求温度时,加入30 g辉锑矿,搅拌速度约为300 r/min,反应达到时间后趁热过滤,用1 mol/L稀盐酸洗涤,然后称量、分析。
2.2.3 结果与讨论
(1) 温度的影响。研究结果表明[10-11]:硫化锑矿的氯化浸出受化学反应控制,反应温度在60 ℃以下时,温度的变化对浸出率无明显影响,只有在更高的温度下才有利于浸出反应的进行。因此,实验在固定H+浓度为4 mol/L,液固比为8:1,SbCl5过量系数为1.1及反应1.5 h条件下,分别考察温度为75,85和95 ℃对浸出率的影响,结果如表4所示。
从表4可知:浸出的最佳温度为85 ℃,同时进一步验证了浸出受化学反应控制;而在95 ℃时,浸出率反而有所降低,主要原因是此时溶液挥发较快,实验装置不能保证完全密封,造成主成分挥发和在器壁上的滞留损失。
表4 温度对浸出率的影响
Table 4 Effect of temperature on leaching ratio

(2) H+浓度的影响。唐谟堂等[5, 11]关于三氯化锑水解体系的热力学研究表明:在硫化锑矿的氯化浸出中,浸出剂具有足够高的总氯浓度,是保证浸出体系不产生水解的先决条件,同时也要保证足够高的酸度。根据其拟合的线性回归方程,在五氯化锑作浸出剂的实验中,氯离子浓度的影响不大,只需考虑酸度的影响。实验选取浸出温度为85 ℃,液固比为8:1,SbCl5过量系数为1.1及反应时间为1.5 h条件下,分别考察H+浓度为2,3,4和5 mol/L对浸出率的影响,结果如图9所示。
由图9可见:当H+浓度低于3 mol/L时,浸出率明显受到很大影响,原因是此时溶液中锑浓度过 高,浸出又消耗了一定量盐酸,导致发生了SbCl3水解,滤液明显较为混浊;当H+浓度达到3 mol/L以后,浸出率受酸度的影响不再明显,此时浸出率都达到了99%以上。经综合考虑,最佳酸度可选择H+浓度为 3.5 mol/L。
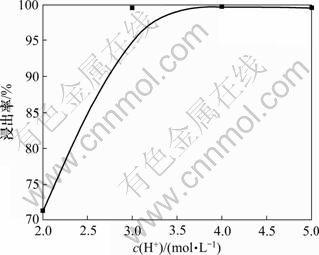
图9 H+浓度对浸出率的影响
Fig.9 Effect of concentration of H+ on leaching rate
(3) 液固比的影响。由于实验选用SbCl5为浸出剂且硫化锑精矿的品位较高,当液固比小于5时,已不能再加入盐酸和水[11-12],故选择液固比为6,7,8和10,并在浸出温度为85 ℃,H+浓度为3.5 mol/L,SbCl5过量系数为1.1及反应时间为1.5 h条件下,考察液固比对浸出率的影响,结果如图10所示。
由图10可见:随液固比的增大,浸出率逐渐增加并趋于平缓,确定最佳液固比为8。在较低液固比下溶液中锑浓度过高,发生水解,且低的液固比使得反应比表面积降低,不利于化学反应控制的浸出过程;液固比过高,一方面酸耗增加,另一方面浸出剂浓度降低,同样不利于浸出反应。
(4) SbCl5过量系数的影响。SbCl5的用量直接影响氧化还原反应的快慢和进行的程度。实验在浸出温度为85 ℃,H+浓度为3.5 mol/L,液固比为8:1及反应时间为1.5 h条件下,选择SbCl5过量系数为0.9,1.0,1.1和1.2考察其对浸出率的影响,结果如图11所示。
从图11可以看出:Sb3+浸出率随SbCl5过量系数的增大而增大,过量系数达到1.10以后,浸出率都达到99.5%以上,继续增加SbCl5用量,对浸出率影响不大,反而增加了后续还原工序的负担;当SbCl5用量过少,浸出速率减慢,副反应(Sb2S3+6HCl= 2SbCl3+3H2S↑)加剧,导致酸耗增加,污染严重。综合考虑,SbCl5过量系数选择1.10为宜。
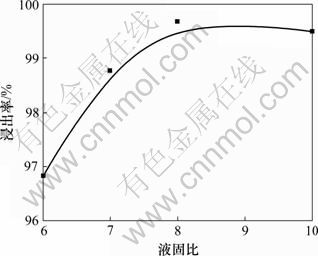
图10 液固比对浸出率的影响
Fig.10 Effect of liquid-solid ratio on leaching rate
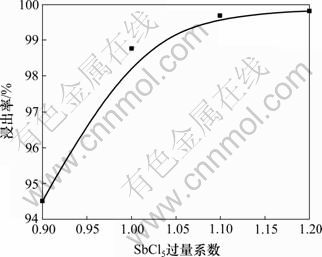
图11 SbCl5过量系数对浸出率的影响
Fig.11 Effect of amount of SbCl5 on leaching rate
(5) 时间的影响。鉴于氯盐体系浸取硫化锑矿较为容易,短时间内就能达到较高的浸出率,因而选择浸出时间分别为0.5,1.0,1.5和2.0 h对浸出率的影响,其他条件是:温度为85 ℃,H+浓度为3.5 mol/L,液固比为8:1,SbCl5过量系数为1.10,结果如图12所示。
由图12可见:开始浸出的前0.5 h,反应剧烈,浸出速度很快,1.0 h后浸出率达到98%以上;往后则浸出过程平稳,浸出率在1.5 h以后大于99.5%,再往后浸出率变化不大,因此,选择最佳浸出时间为1.5 h。
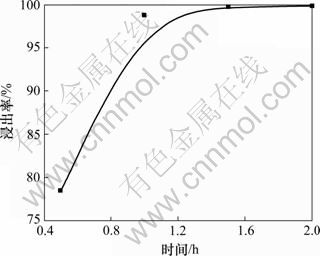
图12 时间对浸出率的影响
Fig.12 Effect of reaction time on leaching rate
2.3 浸出液的净化
浸出过程除主金属Sb进入溶液中外,其他杂质元素也不可避免地被浸出,杂质的存在对电积过程会产生严重影响,必须净化除去。标准电极电位与Sb接近的Cu和As在电解液中达到一定浓度,电积时会与Sb3+发生共沉积析出;Pb2+虽然还原电极电势较负,不可能与Sb3+同时析出,但在Cl-浓度较高的电解液中,Pb2+与Cl-形成PbCl![]() 络离子,出于动力学原因而夹杂于阴极锑中[13]。因此,浸出液的净化需除去的杂质主要是Cu,As和Pb。
络离子,出于动力学原因而夹杂于阴极锑中[13]。因此,浸出液的净化需除去的杂质主要是Cu,As和Pb。
2.3.1 锑粉还原
把电积得到的锑块碾磨成粉,根据浸出液中Sb5+的量决定锑粉用量。实验中由于Sb5+含量较少,为了还原完全,只能加大锑粉用量,同时要考虑As5+和Fe3+等杂质离子的还原,因此,确定锑粉最终用量为理论量的5.0倍,反应温度为60 ℃,搅拌,反应30 min。
2.3.2 硫化除重金属
在含大量锑的氯盐体系中用硫化法除重金属,是基于H+浓度大于3 mol/L条件下,Sb2S3的Ksp很大,新生成的Sb2S3立即被盐酸分解成Sb3+,难于稳定;而在此pH下,Cu,As,Pb和Cd的硫化物的Ksp仍很小,且其硫化物均难容于盐酸水溶液。选择Na2S作为除杂剂,根据溶液中Cu,As,Pb和Cd的含量,确定Na2S用量为理论量的2.0倍,H+浓度大于3 mol/L,反应温度为60 ℃,反应时间为30 min,冷却过滤。
2.3.3 次磷酸钠除砷
在盐酸浓度大于4 mol/L的溶液中,以Na3PO2为还原剂,保持微沸温度,As3+和As5+均被还原成棕色的单质砷[14]。实验确定Na3PO2用量为理论量的1.5倍,H+浓度大于4 mol/L,反应温度为60 ℃,反应时间为90 min,冷却过滤。
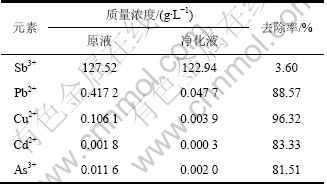
当阴极液中Sb3+质量浓度为30 g/L,温度为40 ℃时,不考虑电化学极化,求得![]() 0.227 V,根据同时放电原理,此时只要溶液中ρ(As3+)≥0.025 1 g/L,ρ(Cu2+)≥0.014 5 g/L,As3+和Cu2+就会与Sb3+在阴极同时析出。据此,可以确定净化液能基本达到电积要求,净化前后溶液成分及杂质去除率如表5所示。
0.227 V,根据同时放电原理,此时只要溶液中ρ(As3+)≥0.025 1 g/L,ρ(Cu2+)≥0.014 5 g/L,As3+和Cu2+就会与Sb3+在阴极同时析出。据此,可以确定净化液能基本达到电积要求,净化前后溶液成分及杂质去除率如表5所示。
表5 净化除杂前后溶液成分及杂质去除率
Table 5 Purifying before and after solution components and impurities removal
3 结论
(1) SbCl3水溶液隔膜电沉积金属锑,在一定的区间条件内可以避免爆锑形成。且该工艺具有电效高、电耗低、无氯气污染以及在阳极再生SbCl5作为浸出剂、形成闭路循环等优点。
(2) 经过条件实验,确定电积的最佳条件是: 电积温度为(42±2) ℃,电流密度为250 A/m2,阴极液Sb3+质量浓度为70 g/L,阳极液Sb3+质量浓度大于150 g/L,H+浓度为4 mol/L,NaCl质量浓度为40 g/L,Cl-浓度无需考虑(随溶液成分保持在5.8 mol/L左右),添加剂A质量浓度为30 mg/L,添加剂D质量浓度为20 mg/L,异极距为4 cm,阴阳极液面差约为10 mm。在此条件下,阴极效率大于99%,阳极效率大于88%,每吨锑电耗约1 200 kW·h,槽压约为1.85 V。
(3) 在电沉积过程中,温度、阴极液Sb3+浓度及添加剂种类对沉积物形貌和结构影响最大,在低温、高Sb3+浓度和无添加剂的条件下,极易形成爆锑;电流密度和酸度对阴极电流效率影响不大,但对槽压和电积电耗影响较大。
(4) 在SbCl5浸出硫化锑矿实验中,最佳浸出条件如下:浸出温度为85 ℃,H+浓度为3.5 mol/L,液固比为8:1,SbCl5过量系数为理论量的1.1倍,浸出时间为1.5 h,在此条件下,硫化锑矿的浸出率达到99.5%以上。
(5) 浸出液的净化基本达到了电积要求,但净化液中Pb2+含量仍然较高,一方面是由于原液中Pb2+含量高,另一方面是由于PbS的Ksp相对值较大,难于稳定。所以,今后的研究工作还需加强浸出液的净化过程。
(6) 隔膜材料对槽压、电耗以及阴阳两极离子交换能力也有重要影响,特别是在工业生产中,还应考虑隔膜的使用寿命,因此,应进一步进行隔膜的筛选实验。
参考文献:
[1] 赵天从. 锑[M]. 北京: 冶金工业出版社, 1987: 200-441.
ZHAO Tian-cong. Antimony[M]. Beijing: Metallurgical Industry Press, 1987: 200-441.
[2] 赵瑞荣, 石西昌. 锑冶金物理化学[M]. 长沙: 中南大学出版社, 2006: 242-284.
ZHAO Rui-rong, SHI Xi-chang. Antimony physical chemistry of metallurgy[M]. Changsha: Central South University Press, 2006: 242-284.
[3] 王成彦, 邱定蕃, 姜培海, 等. 脆硫锑铅矿矿浆电解实验研究[J]. 有色金属, 2002, 54(3): 24-27.
WANG Cheng-yan, QIU Ding-fan, JIANG Pei-hua, et al. Jamesonite treatment by slurry electrolysis process[J]. Nonferrous Metals, 2002, 54(3): 24-27.
[4] TANG Mong-tang, ZHAO Tian-cong, LU Jun-le, et al. Principle and application of the new chlorination-hydrolization process[J]. Journal of Central-South Institute of Mining and Metallurgy, 1992, 23(4): 405-411.
[5] 唐谟堂, 赵天从. 三氯化锑水解体系的热力学研究[J]. 中南矿冶学院学报, 1987, 18(5): 522-528.
TANG Mong-tang, ZHAO Tian-cong. A thermodynamic study on the hydrolysis of antimony trichloride[J]. Journal of Central-South Institute of Mining and Metallurgy, 1987, 18(5): 522-528.
[6] Iyer R K, Deshapande S G. Preparation of high-purity antimony by electrodeposition[J]. Journal of Applied Electrochemistry, 1987, 17: 936-940.
[7] 舒余德. 锑电积添加剂的研究[J]. 有色金属: 冶炼部分, 1984(5): 28-31.
SHU Yu-de. Researches on additives of antimony electrodeposition[J]. Nonferrous Metals: Extractive Metallurgy, 1984(5): 28-31.
[8] Gandhia T, Rajaa K S, Misra M. Room temperature electrodeposition of aluminum antimonide compound semiconductor[J]. Electrochimica Acta, 2008, 53: 7331-7337.
[9] Besse F, Boulanger C, Bolle B, et al. In?uence of electrochemical deposition conditions on the texture of bismuth antimony alloys[J]. Scripta Materialia, 2006, 54: 1111-1115.
[10] 柳巧越, 孙文粹, 李承鹏, 等. FeCl3溶液浸取辉锑矿工艺过程的研究[J]. 华东化工学院学报, 1991, 17(3): 254-257.
LIU Qiao-yue, SUN Wen-cui, LI Cheng-peng, et al. Study on the leaching process of stibnite in ferric chloride solution[J]. Journal of East China Institute of Chemical Technology, 1991, 17(3): 254-257.
[11] Neiva-Correia M J, Carvalho J R, Monhemius A J. The leaching of tetrahedrite in ferric chloride solutions[J]. Hydrometallurgy, 2000, 57: 167-179.
[12] Balá? P, Achimovi?ová M. Selective leaching of antimony and arsenic from mechanically activated tetrahedrite, jamesonite and enargite[J]. International Journal of Mineral Processing, 2006, 81: 44-50.
[13] CHEN Jin-zhong, CAO Hua-zhen, LI Bo, et al. Thermodynamic analysis of separating lead and antimony in chloride system[J]. Transactions of Nonferrous Metals Society of China, 2009, 19: 730-734.
[14] 冯树屏. 砷的分析化学[M]. 北京: 中国环境科学出版社, 1986: 28-38.
FENG Shu-ping. Analytical chemistry of arsenic[M]. Beijing: China Environmental Science Press, 1986: 28-38.
(编辑 杨幼平)
收稿日期:2010-12-28;修回日期:2011-03-17
基金项目:国家自然科学基金资助项目(50804056; 51174237);湖南有色集团—中南大学有色金属研究基金资助项目(2009)
通信作者:杨建广(1976-),男,江西赣州人,博士,副教授,从事电化学与材料冶金研究;电话:0731-88830470;E-mail: jianguang_yang@hotmail.com
摘要:研究硫化锑精矿的浸出—净化—电积的闭路循环实验。考察温度、添加剂种类及浓度、Sb3+浓度和电流密度对沉积锑的形貌和质量的影响,得到避免爆锑形成的优化条件:阴极电流效率高达99%,每吨锑电耗约为1 200 kW·h。利用隔膜电积阳极室生成的SbCl5为浸出剂,得到SbCl5浸取硫化锑矿的最佳条件:温度为85 ℃,H+浓度为3.5 mol/L,液固比为8:1,SbCl5过量系数为理论量的1.1倍,浸出时间为1.5 h,在此条件下,硫化锑矿的浸出率达到99.5%。浸出液经过锑粉还原、硫化除重金属及Na3PO2除砷,得到的净化液用于电沉积能够得到质量良好的沉积物。


