文章编号:1004-0609(2010)06-1234-07
不同菌种对雌黄的生物浸出机理
袁秋红1,王跃虎1,张广积1,罗志雄2,杨 超1
(1. 中国科学院过程工程研究所 湿法冶金清洁生产技术国家工程实验室 生化工程国家重点实验室,北京 100190
2. 国家安全监管总局信息研究院,北京 100029)
摘 要:
分别采用嗜酸氧化亚铁硫杆菌(At.f)、嗜酸氧化硫硫杆菌(At.t)以及中度嗜热西伯利亚硫杆菌(S.s)对雌黄进行浸出。结果表明:嗜酸氧化硫硫杆菌浸出雌黄的效果较好,浸出过程是细菌直接与矿物作用;中温菌浸出雌黄则主要通过将Fe2+氧化成Fe3+,再由Fe3+氧化溶解矿物,浸出后期在矿物表面生成覆盖层;嗜酸氧化亚铁硫杆菌很难在雌黄矿浆中生长;添加适量表面活性剂Tween-80能有效改善矿物表面润湿性,促进Fe3+对砷的浸出,但对细菌生长会造成影响,抑制细菌直接浸出。
关键词:
中图分类号:TF18 文献标志码:A
Bioleaching mechanism of orpiment with different bacteria strains
YUAN Qiu-hong1, WANG Yue-hu1, ZHANG Guang-ji1, LUO Zhi-xiong2, YANG Chao1
(1.National Engineering Laboratory for Hydrometallurgical Cleaner Production Technology, National Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;
2. National Institute of Occupational Safety, Beijing 100029, China)
Abstract: The orpiment was bioleached with Acidithiobacillus ferrooxidans(At.f), Acidithiobacillus thiooxidans(At.t) and Sulfobacillus sibiricu(S.s) in batch experiments. The results show that the orpiment can be leached with T.t and S.s, but At.f can not grow in the slurry. At.t and S.s show different mechanisms during the bioleaching of orpiment. In the At.t bioleaching, the dissolution of orpiment is mainly caused by the bacteria attached onto the mineral surface. In the S.s bioleaching, the orpiment is dissolved by Fe3+ that is generated by the bacterial oxidation of Fe2+, and the mineral surface is covered by precipitation during the later stage of the leaching process. The addition of surfactant Tween-80 can enhance the Fe3+ leaching by improving the hydrophilicity of minerals, but inhibit the direct bacterial oxidation of orpiment.
Key words: orpiment; bioleaching; mesophilic bacteria; moderately thermophilic bacteria; surfactant
难处理金矿又称难浸金矿或难选冶金矿,是指常规氰化工艺中直接氰化率低于70%的金矿。我国有丰富的难处理金矿资源,其中含砷硫化矿占有很大比例。这类矿物中的金往往以显微或次显微金的形式被包裹、浸染在矿物晶格中,直接氰化浸出时金的提取率低,所以,在浸金前必须通过氧化预处理使被包裹的金暴露出来,才能达到理想的金提取率。目前工业上常用的氧化预处理工艺主要如下:焙烧氧化法、加压氧化法和细菌氧化法。其中细菌氧化法具有投资少、工艺简单、金回收率高且环境友好的优点。在易选易处理金矿石资源日益枯竭、全球生态问题日益受到重视的今天,细菌氧化法被称为“绿色冶金工艺”而倍受青睐,成为颇具希望的新技术[1]。
毒砂和黄铁矿是大多数难处理金矿石中的主要载金矿物,但也有部分金包裹在硫化砷矿物中(主要是雌黄),所以为了提高难处理金矿的生物预处理效果,必须研究细菌对雄黄和雌黄矿物的浸出性能和浸出机理。另一方面,由于砷的硫化物是一些矿冶废渣中的主要成分,这些废渣在长期露天堆存过程中会逐渐氧化溶解,释放出砷。这个溶解过程很可能与微生物的作用有关,因此,研究细菌对雌黄等砷硫化物的溶解机理,对含砷废渣的污染与防治也有很重要的意义。迄今为止已有许多文献报道毒砂、黄铁矿细菌氧化提金工艺的研究进展[2-6],但是就雄黄和雌黄细菌氧化机理的研究报道还很少。ZHANG等[7]用嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌揭示了药用雄黄细菌氧化的机理;EHRLICH[8]在20世纪60年代即尝试用细菌浸出雌黄,但是研究工作开展甚少;刘荣丽等[9]在处理含雄黄、雌黄的甘肃坪定金矿的试验中,细菌氧化浸出效果明显;刘树根和田学达[10]提出将细菌氧化脱砷技术用于含砷固体废渣的处理工艺中,但以上研究都没有涉及雌黄矿物的细菌氧化机理和浸出效果。本文作者采用嗜酸氧化亚铁硫杆菌、嗜酸氧化硫硫杆菌及中度嗜热西伯利亚硫杆菌浸出雌黄,研究其浸矿可行性和浸出行为,考察表面活性剂Tween-80对浸出效果的影响,并根据实验结果推测细菌浸出雌黄的机理。
1 实验
实验中使用的矿物为天然雌黄,由中国地质博物馆提供,其中S和As的含量(质量分数)分别为43.33%和56.67%,由北京矿冶研究总院测试研究所分析。根据化学式计算,雌黄中的含硫量为39%,含砷量为61%,分析结果与化学计量的比较表明,矿物中雌黄含量应该在90%以上。
实验中使用到3种不同的菌种:嗜酸氧化亚铁硫杆菌At.f (Acidithiobacillus ferrooxidans)、嗜酸氧化硫硫杆菌At.t (Acidithiobacillus thiooxidans)和中度嗜热西伯利亚硫杆菌S.s (Sulfobacillus sibiricu)[11]。At.f菌由中科院微生物所提供,At.t菌和中温菌S.s购于德国微生物菌种保存中心。3种细菌均采用Leathen培养基培养。At.f和At.t菌的最佳生长温度为35 ℃,pH为2.0;S.s菌最佳的生长温度为50 ℃,pH为1.8,S.s菌的生长需要添加一定量的酵母粉(0.2 g/L)作为有机碳源;在培养At.t菌时添加1 g硫粉作为细菌生长的营养物质。Leathen培养基组成为(NH4)2SO4 0.15 g/L、K2HPO4 0.05 g/L、KCl 0.05 g/L、MgSO4·7H2O 0.5 g/L和Ca(NO3)2·2H2O 0.05 g/L。
采用250 mL锥形瓶进行摇床浸出实验,浸出温度根据不同菌种而定,摇床转速为160 r/min。实验中雌黄的矿浆浓度为20 g/L,即采用2 g矿粉添加100 mL培养基(包括接种菌液) 配置而成。用At.f和S.s菌浸出时添加5 g FeSO4·7H2O。每隔24 h采用pH计测量矿浆的pH值和氧化还原电位φ(vs SHE)。被取样浸出液中的总砷浓度采用ICP光谱分析法分析。原矿与细菌浸出后矿渣采用D/Max-RB型X射线衍射仪(XRD)、FEI QUANTA 600型扫描电子显微镜(SEM)及EDΛX Genesis型电子能谱(EDX)分析。
2 结果与讨论
Fe3+可以氧化硫化砷[12]。图1所示为分别在常温和中温下加入不同量的硫酸铁时,体系的氧化还原电位(φ)及砷的浸出率随时间的变化情况。氧化还原电位对氧化亚铁硫杆菌等铁氧化细菌氧化活性的影响已被许多研究结果证实[6],浸出液的氧化还原电位主要决定于介质的pH值及其中Fe3+与Fe2+的浓度比。可以发现,所有浸出体系的φ在反应1 d后都显著下降,之后其下降速率随时间的延长而减慢;不同体系中砷的浸出率在第一天都上升较快,在随后的几天中趋于平缓。与酸浸体系浸出结果比较,用硫酸铁浸出雌黄矿时,砷的浸出率随Fe3+的浓度增加而提高,且较高温度条件更有利于Fe3+溶解矿物反应的发生,从而提高砷的浸出率。雌黄矿物能被Fe3+氧化溶解,则理论上只要细菌能在雌黄矿浆中生长繁殖,并将Fe2+氧化生成氧化剂Fe3+,雌黄即能被细菌浸出。
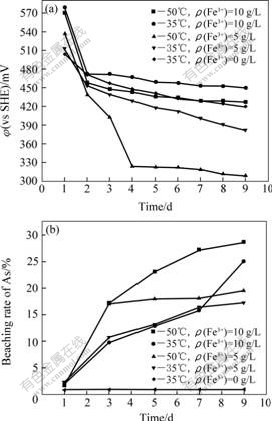
图1 常温和中温下添加不同浓度的Fe3+浸出雌黄时体系氧化还原电位及砷的浸出率随时间的变化
Fig.1 Curves of φ and leaching rate of As vs time when bioleaching orpiment with different concentrations of Fe3+ at 35 ℃ or 50 ℃
采用不同菌种浸出雌黄时,在恒温水浴摇床中连续浸出10 d后,砷的浸出率如图2所示。与没有接种细菌的体系比较,所有接种菌株的浸出体系溶液中砷的浓度均有所提高,而在没有接种细菌的对照实验中,溶液中砷含量基本保持不变,表明雌黄在单纯酸浸条件下基本不溶解。从砷浸出率结果可以看出,不同菌种对矿的作用效果不同。其中At.t菌对雌黄矿的浸出效果最好,采用中温菌S.s浸出时,As的浸出率高于采用常温菌At.f时的浸出率。采用At.f菌浸出雌黄时,在前3 d的浸出速率较快,而后期浸出速率明显下降。图3所示为采用不同菌种浸出时体系pH值随时间的变化曲线。从图3可以看出,雌黄经细菌氧化过程中,pH值的整体变化趋势是下降的,但在中温菌S.s.浸出过程中,pH值在初始阶段明显上升,这是由于细菌氧化Fe2+生成Fe3+的反应耗酸造成的。从各浸出体系的φ变化(见图4)也可以看出,用中温菌S.s浸出的初始阶段,体系的φ明显上升,表明在这个阶段,较多的Fe2+被氧化生成Fe3+,在Fe3+的作用下,雌黄矿物被溶解浸出,即通过以下反应使雌黄溶解[13]:
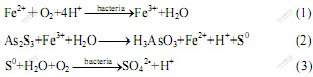
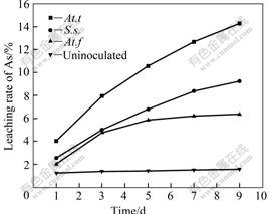
图2 采用不同细菌浸出时砷的浸出率随时间的变化
Fig.2 Variations of leaching rate of As with time when bioleaching with different bacteria strains
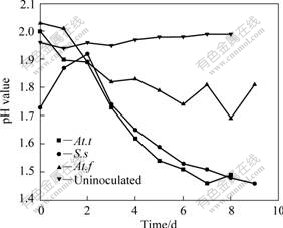
图3 采用不同菌种浸出时体系的pH值随时间的变化
Fig.3 Variations of pH value with time when bioleaching with different bacteria strains
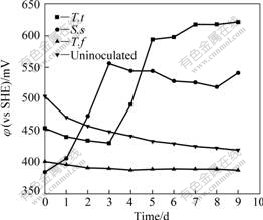
图4 采用不同菌种浸出时体系φ随时间的变化
Fig.4 Variations of φ with time when bioleaching with different bacteria strains
但在At.f菌浸出过程中,体系中pH值和φ基本上是一直呈下降趋势的,表明At.f菌难以在雌黄矿浆环境中生长,不能氧化Fe2+生成Fe3+。在At.f.菌浸出过程中造成的砷溶解应该是由接种过程中带入的Fe3+造成的。
与At.f菌和中温菌S.s不同的是,At.t菌不能将Fe2+氧化生成Fe3+,只能以硫作为能量来源。采用At.t菌浸出雌黄时,雌黄矿是其所处体系中唯一的硫源。由于雌黄不能被稀酸溶解,所以At.t菌浸出雌黄的过程中应该是细菌先吸附到矿物表面,然后通过某种生化反应直接与矿物发生作用,使矿物溶解。矿物中的硫最终被氧化为硫酸,而砷则释放到溶液中。其机理很可能与元素硫的生物浸出过程类似。采用显微镜观察发现,在采用At.t菌浸出2 d后细菌大量繁殖。At.t菌氧化硫后产生硫酸,导致pH值迅速下降(见图3),发生的反应可用以下反应式来表示[13]:
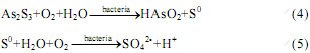
2.3 硫培养后的At.f菌和S.s菌对雌黄的浸出
At.f菌和S.s菌都是既可以氧化Fe2+也可以氧化硫的细菌,很可能也存在直接氧化溶解雌黄的能力,为此,在本实验中将这两种细菌在无铁情况下培养一段时间,待细菌数量达到一定密度后接种到雌黄矿浆中。浸出过程中体系的pH值、φ及砷浸出率的变化如图5所示。
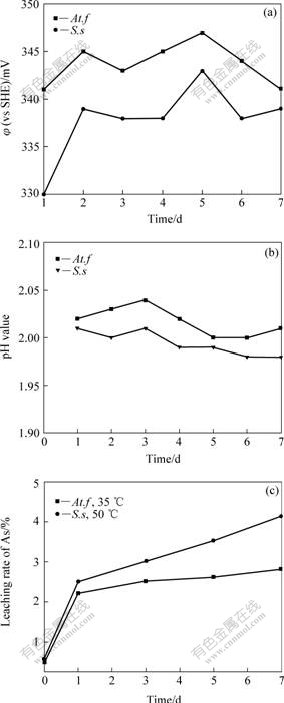
图5 采用无外加亚铁时用硫培养后的细菌浸出雌黄时体系φ、pH值及砷的浸出率随时间的变化
Fig.5 Variations of φ, pH value and leaching rate of As with time in bioleaching of orpiment with bacteria strains cultivated by leathen medium containing sulfur without additional Fe2+
由图5可知,无论是采用常温菌At.f还是中温菌S.s进行浸出,浸出体系的pH值都在2.0附近小幅度变化,没有显著下降;氧化还原电位值都维持在340 mV左右,基本没有发生变化;砷的浸出率在第一天上升较快,之后上升非常缓慢,在中温菌浸出体系中,砷的浸出率要比在常温菌浸出体系中增长得快。由该组实验的结果可以看出,嗜酸氧化亚铁硫杆菌和中度嗜热西伯利亚硫杆菌在没有添加亚铁的情况下很难浸出雌黄,它们对矿物的浸出作用主要在于将Fe2+氧化生成Fe3+,然后通过Fe3+的强氧化性去氧化溶解矿物。
为了进一步理解细菌浸出雌黄矿的机理,分别采用扫描电镜、电子能谱及X射线衍射方法对矿物样品和细菌浸出后矿渣进行分析,结果如图6、7所示。从图6的电镜结果可以看出,在浸出前,矿物颗粒表面比较光滑且有光泽,但浸出后的渣样中出现较为明显的侵蚀痕迹,并出现破碎现象。其中经中温菌S.s浸出后的矿渣表面硫的比例升高,并出现铁和氧的谱峰,表明在浸出过程中可能产生元素硫,并与黄铁矾等铁化合物在雌黄表面形成覆盖物。表明At.t菌浸出雌黄过程中是直接与矿物作用,使雌黄中的硫和砷同时溶解。
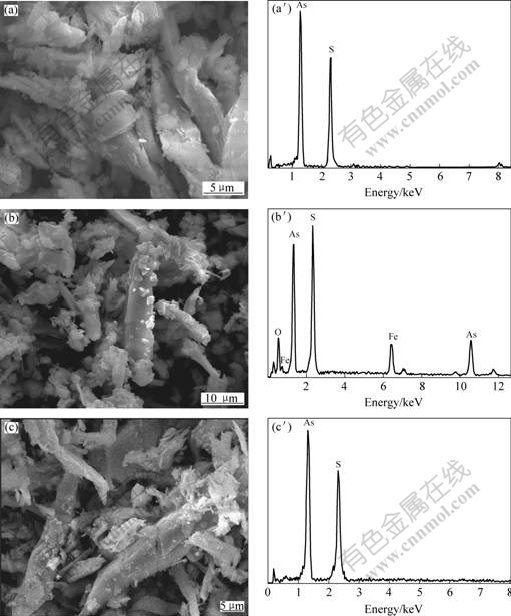
图6 细菌浸出前、后雌黄矿表面的扫描电镜照片和电子能谱分析
Fig.6 SEM images ((a), (b), (c)) and EDX patterns ((a′), (b′), (c′)) of orpiment before and after bioleaching: (a), (a') Before bioleaching; (b), (b') Residues by leaching with S.s.; (c), (c') Residues by leaching with At.t.
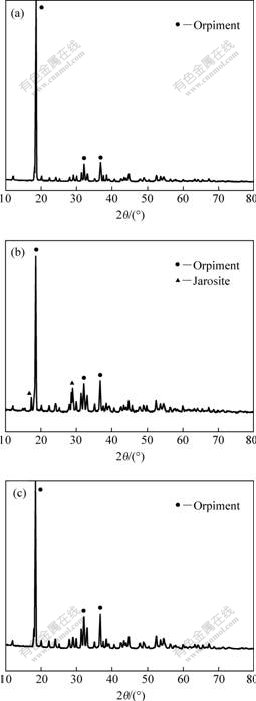
图7 矿物样品和细菌浸出后浸渣的XRD谱
Fig.7 XRD patterns of mineral sample and leached residues: (a) Mineral sample; (b) Residues by leaching with S.s; (c) Residues by leaching with At.t
对比样品与浸出后矿渣的XRD谱(见图7)可以看出,采有中温菌S.s和At.t菌浸出后,雌黄矿的峰均明显减弱,但并没有单独的元素硫峰出现。中温菌S.s的XRD谱证实黄钾铁矾沉淀的存在,但没有发现砷酸铁的峰,说明中温菌浸出雌黄过程中,砷主要以毒性很高的As3+存在。从热力学角度看,As3+可以被Fe3+氧化,故不能排除As3+被氧化为As5+,并形成砷酸铁沉淀的可能性。但对浸出后的矿渣进行XRD分析并没有发现砷酸铁。有研究表明,已对Fe3+对As3+的氧化离不开黄铁矿的催化作用,否则反应基本无法进行。故雌黄生物浸出的产物中是否有砷酸铁的存在,还有待进一步的实验论证。
雌黄具有很强的疏水性,且密度较小,细小的矿物颗粒很容易浮在培养基表面,在表面形成一层膜,阻碍空气中的O2和CO2的传质,同时细小的雌黄矿物易附着于细菌表面,影响细菌对营养物质的吸收和代谢产物的排放,对细菌生长造成影响,这可能是At.f.菌在雌黄矿浆中无法正常生长的原因。因此,本实验还考察了不同浓度的表面活性剂Tween-80对3种不同菌种浸出雌黄矿的影响。图8所示为添加不同浓度表面活性剂后各菌种浸出雌黄时砷的浸出率。由图8可知,浸出体系中加入的Tween-80的浓度为10–3 g/L时,对3种不同菌种浸出体系砷的浸出都有抑制作用,加入Tween-80的量为10-5 g/L时,对At.f菌和中温菌S.s浸出有一定的促进作用,此原因有待进一步的深入研究。加入少量的表面活性剂能改善矿物表面的润湿性,同时增强矿物与浸出剂的接触,强化浸出。但加入表面活性剂的量过多时,对细菌毒性太大[15],会抑制细菌的生长和繁殖,降低矿物浸出效果。
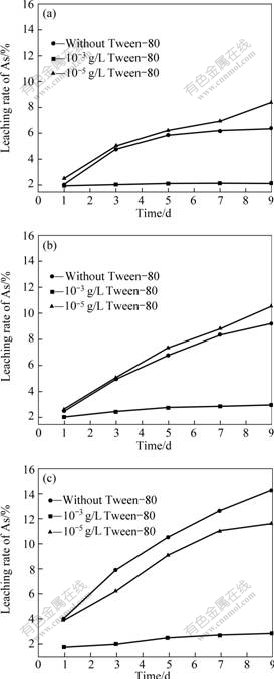
图8 不同菌种浸出雌黄时Tween-80浓度对As浸出率的影响
Fig.8 Effects of Tween-80 concentration on bioleaching of orpiment with different bacteria strains: (a) Inoculating At.f; (b) Inoculating S.s; (c) Inoculating At.t
3 结论
1) 在雌黄生物氧化过程中,不同的细菌浸出矿物的效果不同,其中嗜酸氧化硫硫杆菌At.t.和中温菌S.s.能有效浸出雌黄,嗜酸氧化亚铁硫杆菌At.f.很难在雌黄矿浆体系中生长。
2) 嗜酸氧化硫硫杆菌At.t.和中温菌S.s.浸出雌黄的机理不同。At.t.浸出雌黄,主要是通过细菌吸附到矿物表面直接与矿作用造成氧化溶解;中温菌S.s.浸出雌黄时细菌将Fe2+氧化生成Fe3+,Fe3+对矿物溶解起主要作用,在不外加Fe2+时,对雌黄的浸出作用明显减弱;浸出后期生成黄钾铁矾沉淀,覆盖在雌黄表面对其进一步氧化起到抑制作用。
3) 加入表面活性剂Tween-80在浓度小于10–5 g/L时,能改善雌黄矿物表面的润湿性,促进矿物浸出,但当浓度大于10–3 g/L时,对细菌生长毒性较大,将抑制砷的浸出。
REFERENCES
[1] 訾建威, 杨洪英, 巩恩普, 杨 立, 赵玉山, 范有静. 细菌氧化预处理含砷难处理金矿的研究进展[J]. 贵金属, 2005, 26(1): 66–70.
ZI Jian-wei, YANG Hong-ying, GONG En-pu, YANG Li, ZHAO Yu-shan, FAN You-jing. A review on biooxidation pretreatment of arsenic-bearing refractory gold ores[J]. Precious Metals, 2005, 26(1): 66–70.
[2] 罗志雄, 张广积, 方兆珩. 采用中温菌和常温菌浸出含砷金精矿[J]. 中国有色金属学报, 2007, 17(8): 1342–1347.
LUO Zhi-xiong, ZHANG Guang-ji, FANG Zhao-heng. Bioleaching arsenic-containing gold concentrates with MLY and At.f[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(8): 1342–1347.
[3] ARRASCUE M L, NIEKERK J V. Biooxidation of arsenopyrite concentrate using BIOX process: Industrial experience in Tamboraque, Peru[J]. Hydrometallurgy, 2006, 83(1/4): 90–96.
[4] OKIBE N, JOHNSON B. Biooxidation of pyrite by defined mixed cultures of moderately thermophilic acidophiles in pH-controlled bioreactors: Significance of microbial [J]. Biotechnology and Bioengineering, 2004, 87(5): 574-584.
[5] KOMNITSAS C, POOLEY F D. Optimization of the bacterial oxidation of an arsenical gold sulfide concentrate from Olympias, Greece[J]. Minerals Engineering, 1991, 4(12): 1297–1303.
[6] MARQUEZ M, GASPAR J, BESSLER K E, MAGELA G. Process mineralogy of bacterial oxidized gold ore in Sao Bento Mine(Brasil)[J]. Hydrometallurgy, 2006, 83(1/4): 114–123.
[7] ZHANG Jing-hong, ZHANG Xu, NI Yong-qing, YANG Xiao-jun, LI Hong-yu. Bioleaching of arsenic from medicinal realgar by pure and mixed cultures[J]. Process Biochemistry, 2007, 40(9): 1265–1271.
[8] EHRLICH H L. Bacterial action on orpiment[J]. Economic Geology, 1963, 58(6): 991–994.
[9] 刘荣丽, 伍赠玲, 戴红光, 葛广福. 甘肃坪定金矿含砷硫化矿的细菌浸出[J]. 矿产综合利用, 2006(5): 6–8.
LIU Rong-li, WU Zeng-ling, DAI Hong-guang, GE Guang-fu. Bioleaching of as-containing sulphide ore of Pingding gold mine in Gansu[J]. Multipurpose Utilization of Mineral Resources, 2006(5): 6–8.
[10] 刘树根, 田学达. 含砷固体废物的处理现状与展望[J]. 湿法冶金, 2005, 24(4): 183–186.
LIU Shu-gen, TIAN Xue-da. Situation and prospect on treating of arsenic-containing solid waste[J]. Hydrometallurgy of China, 24(4): 183–186.
[11] MELAMUD V S, PIVOVAROVA T A, TOUROVA T P, KOLGANOVA T V, OSIPOV G A, LYSENKO A M, KONDRAT’EVA T F, KARAVAIKO G I. Sulfobacillus sibiricus sp. nov., a new moderately thermophilic bacterium[J]. Microbiology, 2003, 72 (5): 605–612.
[12] 李 岚, 蒋开喜, 刘大星, 王海北. 加压氧化浸出处理硫化砷渣[J]. 矿冶, 1998, 7(4): 46–50.
LI Lan, JIANG Kai-xi, LIU Da-xing, WANG Hai-bei. Oxidative pressure leaching of arsenic sulfide residues[J]. Mining & Metallurgy, 1998, 7(4): 46–50.
[13] EHRLICH H L. Bacterial oxidation of As(III) compounds in environmental chemistry of arsenic[M]. New York: CRC Press, 2002: 313–328.
[14] WIERTZ J V, MATEO M, ESCOBAR B. Mechanism of pyrite catalysis of As(III) oxidation in bioleaching solutions at 30 ℃ and 70 ℃[J]. Hydrometallurgy, 2006, 83(1/4): 35–39.
[15] ZHANG Cheng-gui, XIA Jin-lan, ZHANG Rui-yong, PENG An-an, NIE Zhen-yuan, QIU Guan-zhou. Comparative study on effects of Tween-80 and sodium isobutyl-xanthate on growth and sulfur-oxidizing activities of Acidithiobacillus albertensis BY-05[J]. Transaction of Nonferrous Metals Society of China, 2008, 18(4): 1003–1007.
____________________________________
基金项目:国家重点基础研究发展计划资助项目(2010CB630904);国家高技术研究发展计划重点资助项目(2007AA060904);国家自然科学基金资助项目(50574081)
收稿日期:2009-05-04;修订日期:2010-01-10
通信作者:张广积,副研究员,博士;电话:010-62554558;E-mail: gjzhang@home.ipe.ac.cn


