以废旧锂离子电池为原料制备棒状草酸钴粉末
陈亮1,唐新村1,2,张阳1,曾智文1,李连兴2
(1. 中南大学 化学化工学院,湖南 长沙,410083;
2. 中南大学 粉末冶金国家重点实验室,湖南 长沙,410083)
摘 要:
子电池中回收钴并制备棒状草酸钴粉末的工艺。研究结果表明:该工艺采用H2SO4+Na2S2O3为浸出剂对正极材料浸出,在最优条件即液固比为10:1,H2SO4浓度为2.0 mol/L,Na2S2O3浓度为0.15 mol/L,温度为85 ℃,浸出时间为120 min时, 钴的浸出率达96.5%。浸出液中加入碳酸氢铵调节pH至5.0以除出浸出液中的铝和铜,不经过滤操作直接使用次氯酸钠氧化沉淀铁和锰离子,过滤后滤液中仅含铁0.006 g/L,锰0.004 g/L,而钴的损失率仅为1.2%。滤液使用P507萃取分离钴和镍、锂,在相比为1.5:1.0,平衡pH为4.5,P507的体积分数为25%的条件下,经二级逆流萃取后钴的萃取率为99.4%。使用180 g/L的硫酸为反萃剂,相比为4~5时,钴的回收率达99.9%。反萃液使用草酸铵沉钴,沉钴的最优条件为50 ℃,终点pH为1.5,C2O42-与Co2+摩尔比n(C2O42-):n(Co2+)=1.15:1。经SEM分析,沉淀而得的钴产品为形貌良好的棒状草酸钴。整个流程方法简便,废旧锂离子电池中钴回收率达到95%,草酸钴中钴含量达31.1%,符合工业要求。
关键词:
中图分类号:TM 912.9;X 705 文献标志码:A 文章编号:1672-7207(2012)08-2921-05
Preparation of rod-like cobalt oxalate powder from spent lithium-ion batteries
CHEN Liang1, TANG Xin-cun1,2, ZHANG Yang1, ZENG Zhi-wen1, LI Lian-xing2
(1. School of Chemistry and Chemical Engineering, Central South University, Changsha 410083 China;
2. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083 China)
Abstract: A process for the recovery of cobalt and preparation of rod-like cobalt oxalate from the cathode active materials of the lithium-ion secondary batteries was presented. The results show that leaching efficiency of 96.5% of Co can be achieved under optimum conditions of liquid/solid ratio 10:1, 2 mol/L H2SO4, 0.15 mol/L Na2S2O3, with leaching time 120 min at 85 ℃. The removal of Al3+ and Cu2+ from the leach liquor can be achieved by adding ammonium bicarbonate and adjusting the pH to 5.0, and the oxidative precipitation of Fe2+ and Mn2+ was carried out by adding sodium hypochlorite. In this process, the loss of cobalt is not beyond 2% (mass fraction). In subsequent solvent extraction study, 99.4% of the cobalt is recovered with a two-stage counter-current extraction using 25% saponified P507 as an extractant at an O/A ratio of 1.5 and at equilibrium pH 4.5, the stripping rate of cobalt is 99.9% at O/A ratio of 4-5 with 180 g/L sulfuric acid solution. Finally, cobalt was chemically deposited as oxalate from the strip liquor. Experimental results show that the optimum cobalt oxalate precipitation conditions are temperation 50 ℃, terminal pH 1.5, n(C2O42-):n(Co2+)=1.15:1. Overall, this hydrometallurgical process is simple, 96.5% cobalt can be recovered from the spent lithium-ion batteries, and 31.1% (mass fraction) of cobalt is pound in cobalt oxalate.
Key words: spent lithium-ion batteries; oxidative precipitation; P507; cobalt oxalate
锂离子电池自1990年实现商业化以来,因具有能量密度大、寿命长且无记忆性等诸多优点,被广泛应用于移动电话、笔记本电脑和照相机等便携式电子设备中。据统计,2000年全球锂离子电池生产量达5亿只,预计2010年产量将超过46亿只[1]。锂离子电池寿命通常在500~1 000次之间,使用几百次(通常是2~3 a)以后,电极膨胀,容量下降,以至报废。废旧锂离子电池含有大量有价金属,其中,钴含量(质量分数)为5%~20%,锂5%~7%,镍5%~10%[2-3],回收这些有价金属尤其是钴将大大缓解钴资源的紧缺。同时,废旧锂离子电池的回收利用可减少其所含有害物质对环境的污染。因此,锂离子电池的综合回收利用不仅具有环保社会效益,还具有良好的经济效益。目前,锂离子二次电池的正极材料以LiCoO2为主。随着锂离子二次电池应用越来越广泛,为提高锂离子电池的性能,节约成本,LiNiO2,LiMnxNiyCo1-x-yO2和LiMn2O4等替代品逐渐进入市场[4-5],回收锂电池中钴的同时不得不进行多种金属如锰和镍的分离。已有锂离子电池回收方法中多针对单一含钴酸锂正极材料的废旧锂电池,而对与含锰和镍正极材料的处理较少,且规模也仅局限于实验室阶段[6-10]。Li[11]等采用盐酸浸出,浸出液先采用铁粉置换铜,针铁法除铜得到含钴镍锰的净化液,但并未提及钴镍锰的分离。Wang等[5]采用盐酸浸出,高锰酸钾氧化沉锰,丁二酮肟萃取镍,氢氧化钠沉钴。该法采用高锰酸钾氧化沉锰在用量上难以控制,而采用丁二酮肟萃取镍在工业应用上可行性不大。本文采用H2SO4+ Na2S2O3为浸出剂对废旧锂电池中活性成分浸出,采用次氯酸钠氧化沉淀锰,锰的沉淀效率高,且钴损失率不到2%,有效地实现锰钴分离;采用工业级萃取剂P507萃取分离钴、镍和锂,在最优条件下共萃的镍和锂含量仅为1.4%和3.1%,最后得到纯度达到99%草酸钴沉淀。该法经济有效可行,为工业化回收废旧锂电池中有色金属提供了依据。
1 实验
1.1 实验材料
实验所用的粉料为某废旧锂电池拆解厂通过对回收来的大量废旧锂电池进行手工拆壳、电池芯粉碎、筛分所得,其成分分析见表1。
1.2 实验原理与方法
采用H2SO4+Na2S2O3浸出废旧锂电池中活性成分,发生的反应为:
8LiCoO2+11H2SO4+Na2S2O3=
8CoSO4+Na2SO4+4Li2SO4+11H2O (1)
表1 粉料金属成分质量分数
Table 1 Metal composition of powder %

酸浸出后的滤液中还含有Al3+,Cu2+,Fe2+,Mn2+,Ni2+和Li+等杂质,采用水解沉淀法沉淀浸液中的铝和铜,不经过滤采用次氯酸钠直接氧化沉淀铁和锰[12],其与锰、铁的反应方程式如下:
ClO-+2Fe2++5H2O=2Fe(OH)3↓+4H++Cl- (2)
ClO-+2Mn2++H2O=MnO2↓+2H++Cl (3)
反应过程中有酸析出,实验采用不断加入稀NaOH溶液以保持反应pH恒定,待沉淀完全过滤,滤液采用P507萃取分离钴、镍和锂[13],硫酸反萃后草酸铵沉钴。实验工艺流程如图1所示。
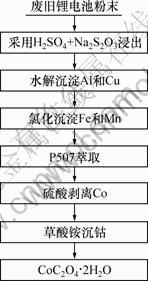
图1 废旧锂离子回收钴的工艺流程图
Fig.1 Flow sheet of hydrometallurgical process for recovery of cobaltfrom spent lithium-ion batteries
1.3 分析方法
采用PS-2真空型ICP-AES,对试样中钴以及其余元素的液相进行分析,使用PHS-3C型pH计测定pH值,采用日本RigakuD型X线衍射仪物相分析,采用JSM-6360型扫描电子显微镜形貌分析。
2 结果讨论
2.1 还原酸浸
实验以硫酸作为酸性介质,用Na2S2O3作为还原剂,在酸性条件下加热溶解活性物质。采用该浸出体系能有效抑制铜的浸出,所得浸液含极少量铜,浸出终点pH为0.8,大大减小下阶段除铜工序的负荷。实验采用2 mol/L H2SO4,液固比为10:1,0.15 mol/L Na2S2O3,于85 ℃反应2 h,钴的浸出率达到96.5%,滤液中各离子含量见表2。
表2 浸出液中各离子质量浓度
Table 2 Ion content of leaching solution g/L
![]()
2.2 水解净化
根据金属离子水解所需的pH要求,控制pH在5.5以下时,钴离子基本不水解,而铝、铜离子均水解而形成沉淀。实验控制温度为70 ℃,磁力搅拌下缓慢加入质量分数为10%的NH4HCO3溶液调节溶液pH至5.0,陈化30 min热过滤,分析可得铜、铝脱除率达99.4%和93.7%,同时大部分铁也随沉淀除去,而钴的损失小于2%。净化后溶液各离子质量浓度见表3。
表3 水解除杂后液相分析
Table 3 Solution composition of hydrolytic precipitation g/L

2.3 氧化沉铁锰
实验每次使用各离子含量如表3所示,料液体积为40 mL,依次考察反应pH、反应时间、反应温度对分离的影响,得到最优分离条件,并验证最优条件分离效果。取实验料液40 mL,固定搅拌速度为400 r/min,加入NaClO理论量的40%,使用NaOH调节溶液pH,考察反应终点pH、反应时间、反应温度对分离的影响,结果如图2~4所示。
从图2可以看出:随着反应终点pH的增大、反应温度的升高、反应时间的延长,锰和铁的沉淀率逐渐增大,但钴的损失量也随之增大。这是因为pH的升高使一部分铁水解为Fe(OH)3胶体,虽然铁水解有利于溶液中铁的脱除,但这些铁胶吸附一部分钴,使钴的损失加大;另外,随着pH增大,可使Co2+氧化成Co(OH)3沉淀而增大钴的损失率,不利于钴的回收。通过实验,得到用NaClO 氧化除铁锰的最佳工艺条件:终点pH=4.0,温度为80 ℃,反应时间为90 min。
用此方案对料液进行处理,铁的脱除率高达99.4%,锰的脱除率高达98.9%,而钴的损失率仅为1.2%,经氧化沉淀处理后的料液各元素含量见表4。
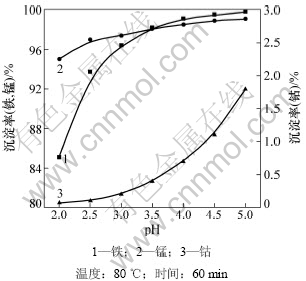
图2 反应终点pH对除杂的影响
Fig.2 Depositing efficiency at different terminal pH value
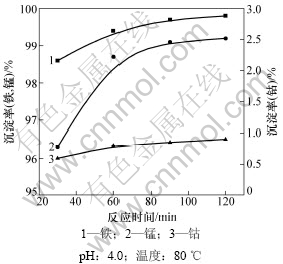
图3 反应时间对除杂的影响
Fig.3 Depositing efficiency at different reaction time
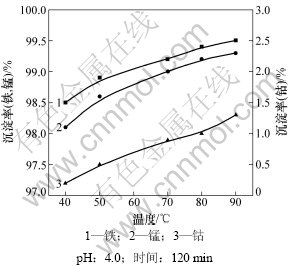
图4 反应温度对除杂的影响
Fig.4 Depositing efficiency at different reaction temperatures
表4 氧化除杂后料液中各离子质量浓度
Table 4 Ion mass concentration of solution after oxidation and degradation g/L

2.4 P507萃取分离钴镍
P507(2-乙基己基磷酸-2-乙基己基酯)为有机磷酸萃取剂,类似于国外PC-88A,是一种良好的钴、镍分离萃取剂,已在中国诸多工厂实践并创利。本实验采用25% P507为萃取剂,5% TBP为改质剂,磺化煤油为稀释剂,皂化率70%,相比为1.5:1,探讨水相pH对钴镍分离的影响,如图5和6所示。
由图5可见:溶液酸度对钴、镍萃取率影响很大;当pH为1~2时,3种离子的萃取率都很低,随着酸度的降低,钴的萃取率先是急剧升高,在pH大于4.0后,萃取率的增加趋于缓慢;而镍的萃取率则在pH大于3.5后急剧升高;对于锂来说,酸度对其影响较小,萃取率均很低。由图6可见:当溶液初始pH=3.5时,钴、镍的分离因数达到最大,且钴、锂的分离因数也很大。若继续降低酸度,大量的镍将进入有机相,达不到萃取分离的目的,故选择萃取初始水相pH为3.5,此时对应的平衡pH为4.5。实验控制平衡pH为4.5,经二级逆流萃取后钴的萃取率为99.4%,而共萃的镍和锂分别仅为1.4%和3.1%,共萃的镍和锂使用pH为3.5含钴200 mg/L的洗液洗涤1次,镍的洗脱率为99.3%,锂的洗脱率为99.6%,此时,有机相中含钴18.64 g/L,镍0.005 g/L,锂0.003 g/L,使用质量浓度为180 g/L的硫酸为反萃剂,反萃相比为4~5,反萃液中钴的质量浓度约50 g/L。反萃液各金属离子的浓度如表5所示。
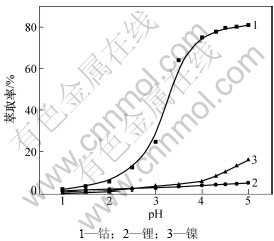
图5 水相pH对萃取率的影响
Fig.5 Extraction efficiency on different aqueous pH
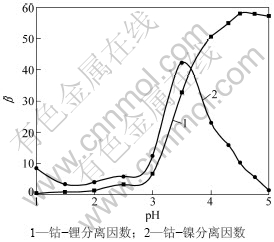
图6 水相pH对分离因数β的影响
Fig.6 Effect of pH value on separation factor
表5 反萃液中各离子含量
Table 5 Ion content of solution after stripping g/L

2.3 草酸铵沉钴
在反萃液中加入(NH4)2C2O4 饱和溶液, 沉钴工艺经条件试验发现, 最优沉钴条件如下: 50 ℃,终点pH为1.5,C2O42-与Co2+的摩尔比n(C2O42-):n(Co2+)= 1.15:1,此时含钴溶液的沉钴率最大,沉钴速率较快。沉钴后,溶液过滤,沉淀经烘干、过筛,沉钴率为98.11%,粉末经XRD分析为α-CoC2O4·2H2O,如图7所示。SEM 分析表明所得产品为棒状粉末,如图8所示。该工艺全流程钴的回收率为96.5%。所得CoC2O4 产品与企业产品标准的比较结果见表4。
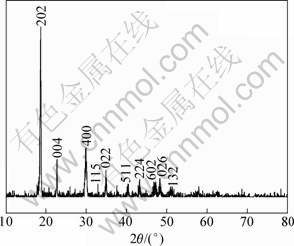
图7 产品α-CoC2O4·2H2O的X线衍射图谱
Fig.7 XRD pattern of α-CoC2O4·2H2O powder

图8 产品CoC2O4·2H2O的SEM形貌
Fig.8 SEM micrographs of he CoC2O4·2H2O powder
表6 草酸钴中各成分质量分数
Table 6 Metal composition of cobalt oxalate %

3 结论
(1) 用H2SO4+ Na2S2O3还原酸浸对溶解活性物质进行浸出,其最佳反应条件如下:H2SO4浓度为2.0 mol/L,Na2S2O3浓度为0.15 mol/L,温度为85 ℃,浸出时间为120 min。在该条件下, 活性物质的浸出率达到96.5%。
(2) 氧化沉铁锰的最佳条件如下:终点pH为4.0,温度为80 ℃,时间为90 min。在此条件下,铁的脱除率高达99.4%,锰的脱除率高达98.9%,而钴的损失率仅为1.2%。
(3) P507萃取分离钴和镍,锂的最佳条件如下:平衡pH为4.5,有机相组成为25%P507+5%TBP+70%璜化煤油,皂化率为70%,相比为1.5:1。
(4) 草酸铵沉钴的最佳条件如下:温度为50 ℃,终点pH=1.5,C2O42-与Co2+的摩尔比n(C2O42-): n(Co2+)=1.15:1,得到棒状α-CoC2O4·2H2O。
(5) 该工艺钴的回收率达到95%, 所得草酸钴产品基本达到工业品的要求,且该工艺消耗酸碱等耗材少,各步骤中溶剂可循环使用,污水排放量少。
参考文献:
[1] Kanamura K, Hoshikawa W, Umegaki T. Electrochemical characteristics of LiNi0.5Mn1.5O4 cathodes with Ti or Al current collectors[J]. Journal of The Electrochemical Society, 2002, 149(3): 339-345.
[2] Shin S M, Kim N H, Sohn J S, et al. Development of a metal recovery process from Li-ionbattery wastes[J]. Hydrometallurgy, 2005, 79(3/4): 172-181.
[3] Lee C K, Rhee K I. Preparation of LiCoO2 from spent lithium-ion batteries[J]. Journal of Power Sources, 2002, 109(1): 17-21.
[4] Castillo S, Ansart F, Laberty-Robert C, et al. Advances in the recovering of spent lithium battery compounds[J]. Journal of Power Sources, 2002, 112(1): 247-254.
[5] WANG Rong-chi, LIN Yu-chuan, WU She-huang. A novel recovery process of metal values from the cathode active materials of the lithium-ion secondary batteries[J]. Hydrometallurgy, 2009, 99(3/4): 194-201.
[6] NAN Jun-min, HAN Dong-mei, ZUO Xiao-xi. Recovery of metal values from spent lithium-ion batteries with chemicaldeposition and solvent extraction[J]. Journal of Power Sources, 2005, 152(1): 278-284.
[7] Freitas M B J G, Garcia E M. Electrochemical recycling of cobalt from cathodes of spent lithium-ion batteries[J]. Journal of Power Sources, 2007, 171(2): 953-959.
[8] 吴芳. 从废旧锂离子二次电池中回收钴和锂[J]. 中国有色金属学报, 2004, 14(4): 697-701.
WU Fang. Recovery of cobalt and lithium from spent lithium-ion secondary batteries[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(4): 697-701.
[9] 张阳, 满瑞林, 王辉, 等. 废旧锂离子电池中钴的回收[J]. 电池, 2009, 39(6): 321-323.
ZHANG Yang, MAN Rui-lin, WANG Hui, et al. The recovery of cobalt from spent lithium-ion battery[J]. Battery Bimonthly, 2009, 39(6): 321-323.
[10] LI Jin-hui, SHI Pi-xing, WANG Ze-feng, et al. A combined recovery process of metals in spent lithium-ion batteries[J]. Chemosphere, 2009, 77(8): 1132-1136.
[11] LI Jin-hui, LI Xin-ha, HU Qi-yang, et al. Study of extraction and purification of Ni, Co and Mn from spent battery material[J]. Hydrometallurgy, 2009, 99(1/2): 7-12.
[12] Darmane Y, Cherkaoui M, Kitane S, et al. Preparation of chemical manganese dioxide from Moroccan pyrolusite mine waste[J]. Hydrometallurgy, 2008, 92(1/2): 73-78.
[13] Park K H, Reddy B R, Jung S H, et al. Transfer of cobalt and nickel from sulphate solutions to spent electrolyte through solvent extraction and stripping[J]. Separation and Purification Technology, 2006, 51(3): 265-271.
(编辑 邓履翔)
收稿日期:2010-09-11;修回日期:2011-12-01
基金项目:国家自然科学基金资助项目(20876178);中南大学粉末冶金国家重点实验室开放课题(107102138)
通信作者:唐新村(1972-),男,湖南郴州人,副教授,从事电化学、固相反应和材料化学研究;电话:13469431444; E-mail:tangxincun@163.com
摘要:研究从废旧锂离子电池中回收钴并制备棒状草酸钴粉末的工艺。研究结果表明:该工艺采用H2SO4+Na2S2O3为浸出剂对正极材料浸出,在最优条件即液固比为10:1,H2SO4浓度为2.0 mol/L,Na2S2O3浓度为0.15 mol/L,温度为85 ℃,浸出时间为120 min时, 钴的浸出率达96.5%。浸出液中加入碳酸氢铵调节pH至5.0以除出浸出液中的铝和铜,不经过滤操作直接使用次氯酸钠氧化沉淀铁和锰离子,过滤后滤液中仅含铁0.006 g/L,锰0.004 g/L,而钴的损失率仅为1.2%。滤液使用P507萃取分离钴和镍、锂,在相比为1.5:1.0,平衡pH为4.5,P507的体积分数为25%的条件下,经二级逆流萃取后钴的萃取率为99.4%。使用180 g/L的硫酸为反萃剂,相比为4~5时,钴的回收率达99.9%。反萃液使用草酸铵沉钴,沉钴的最优条件为50 ℃,终点pH为1.5,C2O42-与Co2+摩尔比n(C2O42-):n(Co2+)=1.15:1。经SEM分析,沉淀而得的钴产品为形貌良好的棒状草酸钴。整个流程方法简便,废旧锂离子电池中钴回收率达到95%,草酸钴中钴含量达31.1%,符合工业要求。


