文章编号:1004-0609(2009)02-0383-06
Cr(Ⅵ)?柠檬酸?硝酸铁复合体系中光催化还原Cr(Ⅵ)
雷雪飞1,薛向欣1,雷雪营2
(1. 东北大学 材料与冶金学院,沈阳 110004;
2. 河北省廊坊市规划局,廊坊 065000)
摘 要:
利用高能球磨法制备了钙钛矿型硫酸盐掺杂的含钛高炉渣光催化剂,考察了初始pH值对Cr(Ⅵ)?柠檬酸?硝酸铁(Cr(Ⅵ)-CA-FN)复合体系中Cr(Ⅵ)吸附效率和光催化还原效率的影响,并探讨了Cr(Ⅵ)-CA-FN复合体系中Cr(Ⅵ)可能的光催化还原机理。结果表明:在Cr(Ⅵ)-CA-FN复合体系中,酸性条件下有利于Cr(Ⅵ)的光催化还原,最佳pH值为2.5;柠檬酸和Fe(Ⅲ)降低了吸附对Cr(Ⅵ)还原率的影响,有效地抑制电子?空穴对的复合,促进光生电子还原Cr(Ⅵ)离子;六价铬浓度的降低一部分是光催化还原所致,另一部分是由于催化剂本身含有的二价锰离子还原所致。
关键词:
含钛高炉渣;Cr(Ⅵ)?柠檬酸?硝酸铁复合体系;光催化还原;六价铬;
中图分类号:TQ 032.41 文献标识码: A
Photocatalytic reduction of Cr(Ⅵ) in
Cr(Ⅵ) -citric acid-ferric nitrate compound system
LEI Xue-fei1, XUE Xiang-xin1, LEI Xue-ying2
(1. School of Materials and Metallurgy, Northeastern University, Shenyang 110004, China;
2. Bureau of Urban Planning of Langfang, Langfang 065000, China)
Abstract:Using calcined sulfate-modified titanium-bearing blast furnace slag as photocatalyst, the photocatalytic reduction of Cr(Ⅵ) in Cr(Ⅵ) -citric acid-ferric nitrate compound systems were studied. The effects of pH values on the photocatalytic reduction and adsorption of Cr(Ⅵ) were investigated. The results indicate that the acidic solutions are favorable for the photocatalytic reduction of Cr (Ⅵ) in Cr(Ⅵ)-citric acid-ferric nitrate (Cr(Ⅵ)-CA-FN) compound system, and the optimum pH value for the reduction of Cr (Ⅵ) is 2.5. The effect of adsorption on the photocatalytic reduction of Cr(Ⅵ) decreases. The recombination rate of electron-hole pairs decreases, and hence the reduction efficiency of Cr(Ⅵ) enhances. The decline of Cr(Ⅵ) concentration is caused by the compound effect between the reduction of Mn2+ and the photocatalytic reduction.
Key words: titanium-bearing blast furnace slag; Cr(Ⅵ)-citric acid-ferric nitrate(Cr(Ⅵ)-CA-FN) compound system; potocatalytic reduction; Cr(Ⅵ)
Cr(Ⅵ)主要来源于电镀、制革、采矿、铬盐化工等工业排出的废水[1],是一种毒性较大的致畸、致突变剂。目前,常用的处理Cr(Ⅵ)的方法有亚铁还原法、离子交换法、光催化还原法、微生物法、硫化物及H2S还原法等[2?4]。其中光催化还原法由于钙钛矿型氧化物在紫外?可见光的照射下,具有较高的反应速率,在较短的反应时间内能达到理想的处理效果,而成为具有应用前景的方法。杨合等[5]利用磁选复合高能球磨以及高温煅烧的方法获得了具有一定光催化活性的钙钛矿型含钛高炉渣催化剂(Titanium-bearing blast furnace slag, TBBFS)。结果表明:于600 ℃获得的催化剂活性最高,反应1 h后,亚甲基蓝的脱色率达到P25 TiO2的27%。采用含钛高炉矿渣代替TiO2作为光催化材料,可以充分利用我国现有的固体废弃物,不但降低光催化材料的成本,而且为我国大量堆积的含钛高炉渣找到合理的利用途径,达到以废治废的目的。
在过去的研究中,往往只注重有机污染物的光催化氧化或无机污染物的光催化还原方面的研究,很少涉及有机和无机污染物共存的复杂体系。然而,很多工业废水和天然水中不仅包含着Cr(Ⅵ)等无机离子,还包含着有机污染物。研究表明:在光催化过程中,添加有机物作为空穴清除剂或与催化剂发生螯合反应能够促进Cr(Ⅵ)的还原[6]。本文作者的研究已经证明,酸性条件下易于六价铬的还原[7]。因此,利用攀钢的含钛高炉废渣, 掺杂一定比例的硫酸盐,采用高能球磨法,经过低温煅烧获得了钙钛矿型的硫酸盐修饰的含钛高炉渣催化剂(Sulfate-modified titanium-bearing blast furnace slag, STBBFS)。目前,还没有文献报道过应用含钛高炉废渣作为光催化剂处理有机和无机污染物共存的复合体系,因此,本文作者选择Cr(Ⅵ)?柠檬酸?硝酸铁(Cr(Ⅵ)-CA-FN)复合体系,采用STBBFS作为光催化剂,考察初始pH值对Cr(Ⅵ)-CA-FN复合体系中Cr(Ⅵ)吸附效率和光催化还原效率的影响,并探讨Cr(Ⅵ)-CA-FN复合体系中Cr(Ⅵ)可能的光催化还原机理,以便为进一步在实际废水处理方面的应用提供理论基础。
1 实验
1.1 STBBFS光催化剂的制备
以四川攀枝花钢铁有限公司的含钛高炉渣为原料(w(TiO2)≥15%)。先将大块的矿渣单独破碎,通过2~3级破碎得到直径为1 mm左右的微粒。然后,将获得的含钛高炉矿渣微粒与硫酸铵按质量比为40?1进行混合。利用高能球磨法将混合后的粉末放入球磨机内进行球磨。球磨后的粉末粒度主要分布在0.4 μm左右。最后,将球磨后的粉末在空气气氛和常压下煅烧,煅烧温度为300 ℃,保温2 h后随炉温自然冷却至室温,所得粉末即为STBBFS催化剂。
1.2 光催化实验
Cr(Ⅵ)的光催化还原实验在流动式光化学反应器中进行(见图1),反应器中心设有1只功率为500 W 的汞灯, 在灯和反应液之间用石英冷阱隔开,石英冷阱装有内循环冷却水,利用循环冷却水保持反应液温度基本恒定。在实验过程中,控制反应温度约为25 ℃。称取0.5 g STBBFS加入1 L含有六价铬(0.4 mmol/L)、柠檬酸(1.5 mmol/L)、硝酸铁(0.5 mmol/L)的储液槽中,通过磁力搅拌维持反应器中催化剂处于悬浮状态,通过蠕动泵使得反应液在储液槽和反应器中循环。进行光催化反应前,在黑暗中搅拌反应液,直到溶液浓度不再变化为止,以达到吸附平衡时的浓度作为光催化反应的初始浓度,消除暗态吸附对光催化反应的影响。
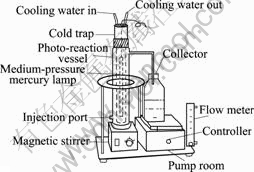
图1 光催化反应装置图
Fig.1 Schematic diagram of photochemical reactor
1.3 分析与测试
催化剂的成分由X射线荧光光谱仪(瑞士,SID-Elemental)测定;催化剂的晶相结构由X 射线衍射仪(XRD)(日本,Shimadzu)测定;催化剂表面中Cr和Mn离子的价态采用PHI-5300 ESCA 型X射线光电子能谱仪(XPS)(美国, Perkin-Elmer)测定;催化剂的红外光谱(FT-IR)通过Nicolet?380 型傅里叶变换红外光谱仪(美国,Thermo nicolet.)获得;催化剂的Zeta电位由Zeta电位分析仪(英国,Malvern)测定;pH值采用PHS?25型pH计(上海,雷磁)测定;Cr(Ⅵ)的吸光度采用UV?2550 型紫外?可见分光光度计(日本,Shimadzu)测定;光催化反应在XPA?4型流动式光化学反应器 (南京,胥江机电)中进行。催化剂的光催化活性通过测定Cr(Ⅵ)光催化还原效率来评价。

2 结果与分析
2.1 STBBFS光催化剂的XRD分析
图2所示为300 ℃时合成的STBBFS催化剂的XRD谱。由图2可看出,主要特征衍射峰出现在2θ为33.115?、47.498?、59.377?处,与钙钛矿的标准谱图(JCPDS 074212)完全吻合,说明STBBFS催化剂中存在钙钛矿结构[8]。经过半定量分析,STBBFS中含有38%的钙钛矿(CaTiO3),54%的透辉石(Ca(Mg, Al)(Si, Al)2O6),8%的镁黄长石?钙黄长石(Ca2(Mg0.5Al0.5) (Si1.5Al0.5O7))。
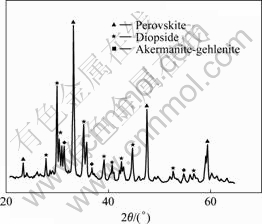
图 2 STBBFS光催化剂的XRD谱
Fig.2 XRD pattern of STBBFS photocatalyst
2.2 Cr(Ⅵ)-CA-FN复合体系初始pH值对Cr(Ⅵ)吸附效率和光催化还原效率的影响
图3 所示为不同pH值下,Cr(Ⅵ)-CA-FN复合体系中Cr(Ⅵ)的还原效率随时间变化曲线。图4所示为 Cr(Ⅵ)-CA-FN复合体系中不同初始pH值对Cr (Ⅵ)的平衡吸附效率以及还原效率的影响。从图3和4可看出,在Cr(Ⅵ)-CA-FN复合体系中,改变体系的初始 pH值对Cr(Ⅵ)还原效率和吸附效率都有显著影响。随着溶液初始pH值增大(pH值为2.5~7.5),六价铬的还原率和吸附率都明显降低。一方面,这可由Cr(Ⅵ)在不同pH值下存在的形式解释。六价铬在酸性条件下,主要以HCrO4?和 Cr2O72-形式存在,增加溶液的pH值,促进HCrO4?和Cr2O72向CrO42-转换。但不同Cr(Ⅵ)物种在催化剂表面上的吸附程度是不同的,HCrO4?和 Cr2O72的吸附程度远比CrO42-的强[9?10],因此,随着溶液pH值增大,STBBFS催化剂对Cr(Ⅵ)的吸附效率降低,同时,由于六价铬离子与氢氧根离子竞争催化剂表面的活性吸附位置[11],进一步导致了Cr(Ⅵ) 吸附效率降低。另一方面,催化剂在溶液中的等电点影响催化剂表面电荷的分布。图5所示为pH值对STBBFS催化剂Zeta电势的影响。从图5可看出,当pH<6.88时,STBBFS催化剂的Zeta电势皆为正值;当pH>6.88时,STBBFS催化剂的Zeta电势皆为负值。因而,STBBFS催化剂的等电点(pH值)为6.88。当溶液pH值低于6.88时,STBBFS催化剂表面质子化,表面正电荷变得更多,一方面,易于Cr(Ⅵ)吸附至催化剂表面;另一方面,也易于光生电子向表面转移[12?13],从而促进了Cr(Ⅵ)光催化还原效率的提高。反之,当溶液pH值增大,催化剂表面的负电荷更多,增加了催化剂表面与Cr(Ⅵ)离子之间的静电阻力,同时也抑制了光生电子向表面的转移,导致Cr(Ⅵ)还原率降低。虽然Cr(Ⅵ)-CA-FN复合体系在pH=1.5时,Cr(Ⅵ)的吸附效率较高,但Cr(Ⅵ)的还原效率低于pH=2.5和pH=3.5时的还原效率。这是由于当pH≤1.5 时,溶液中的H+含量比较大,H+同催化剂的接触机会也大大增加,在光催化过程中,部分H+会被竞争吸附到催化剂表面,减少了催化剂为Cr(Ⅵ)离子所提供的有效吸附位,同时也消耗催化剂表面的光生电子,不利于Cr(Ⅵ)的还原[9]。
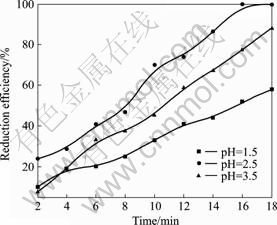
图3 Cr(Ⅵ)-CA-FN复合体系中Cr(Ⅵ)的还原效率随时间变化曲线
Fig.3 Change curves of photocatalytic reduction efficiency of Cr(Ⅵ) in Cr(Ⅵ)-CA-FN system with time
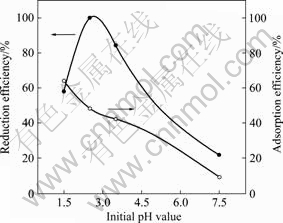
图4 Cr(Ⅵ)-CA-FN复合体系中初始pH值对Cr (Ⅵ)的平衡吸附效率以及还原效率的影响
Fig.4 Effects of initial pH values on photocatalytic reduction efficiency and adsorption efficiency of Cr(Ⅵ) in Cr(Ⅵ)-CA- FN system
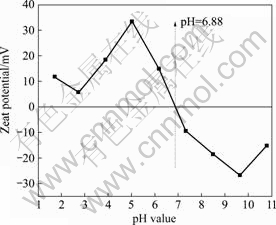
图5 pH值对STBBFS催化剂Zeta电势的影响
Fig.5 Effect of pH values on Zeta potential of STBBFS catalyst
2.3 Cr(Ⅵ)-CA-FN复合体系的光催化机理
图6所示为相同反应条件下不同体系中Cr(Ⅵ)的还原效率。从图6可看出,在Cr(Ⅵ)单一体系中,反应非常缓慢,反应18 min后,仅有2.15%的Cr(Ⅵ)被还原(见图6(a));在Cr(Ⅵ)-CA复合体系中,反应18 min后,67.06%的Cr(Ⅵ)被还原(见图6(b));在Cr(Ⅵ)-CA-FN复合体系中,反应16 min时,Cr(Ⅵ)的还原效率已达到100%(见图6(c))。大量的研究证明,光催化过程中存在电子供体(有机物)时,易于六价铬的去除。存在有机物种的情况下,易于清除催化剂表面的光生空穴,抑制电子?空穴对的再结合,因而促进了Cr(Ⅵ)被光生电子还原[6]。此外,MEICHTRY 等[14]利用定量电子顺磁共振波谱分析Cr(Ⅵ)-CA复合体系后发现,将近15%的Cr(Ⅵ)在光催化过程中转变为Cr(Ⅴ)-CA络合物,然后,逐步转化为Cr(Ⅲ)物种。因此,添加有机物时,不仅消耗了光生空穴,而且有机物与金属离子之间形成络合物,更进一步促进了Cr(Ⅵ)的还原。在Cr(Ⅵ)-CA复合体系中添加硝酸铁后,Cr(Ⅵ)的还原效率快速增长,明显高于Cr(Ⅵ)-CA复合体系和Cr(Ⅵ)单一体系的还原效率。这是由于加入硝酸铁后,Fe(Ⅲ)-CA络合物成为溶液中的主要物种,Fe(Ⅲ)-CA络合物的生成能够降低CA表面负电荷的数量[15],降低了Cr(Ⅵ)与CA之间的静电阻力,因而增加了Fe(Ⅲ)-CA络合物与Cr(Ⅵ)的碰撞机会。在UV-Vis的照射下,Fe(Ⅲ)-CA络合物发生光解,生成了瞬间的中间产物Fe(Ⅱ)-CA络合物,形成了Fe(Ⅲ)/Fe(Ⅱ)氧化还原对[16],电子经Fe(Ⅲ)/Fe(Ⅱ)氧化还原对转移到Cr(Ⅵ)离子上,将Cr(Ⅵ)离子还原为Cr(Ⅲ)。因此,在Cr(Ⅵ)-CA-FN复合体系中,由于生成了Fe(Ⅲ)/Fe(Ⅱ)氧化还原对,促进了电子转移到Cr(Ⅵ)离子,因而使得Cr(Ⅵ)-CA-FN复合体系中Cr(Ⅵ)的还原率明显高于Cr(Ⅵ)-CA复合体系和Cr(Ⅵ)单一体系的还原率。综上所述, Cr(Ⅵ)-CA-FN复合体系中光催化还原Cr(Ⅵ)的主要反应如下[14?15]:

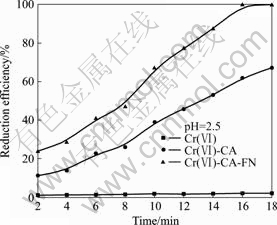
图6 相同反应条件下不同体系中Cr(Ⅵ)的还原效率
Fig.6 Photocatalytic reduction efficiency of Cr(Ⅵ) in different reaction systems under same reaction condition
图7 所示为STBBFS催化剂光催化反应前(暗态吸附后)与光催化20 min后的红外光谱。图中569和592 cm–1处的峰对应于钙钛矿;455、876、883和968 cm–1处的峰对应于硅酸盐;1 100 cm–1处的峰对应于硫酸根;665 cm–1处的峰对应于Cr2O3;1 390 cm–1处的峰对应于Cr6+;2 360 cm–1处的峰对应于空气中存在的CO2[17]。对比图7(a)和(b)发现,光催化前位于1 390 cm–1处,Cr6+的吸收峰在光催化反应后消失。此外,光催化反应后出现的665 cm–1处的峰对应于Cr3+,这说明Cr(Ⅵ)浓度降低并非STBBFS催化剂物理吸附所致,而是还原反应所致。
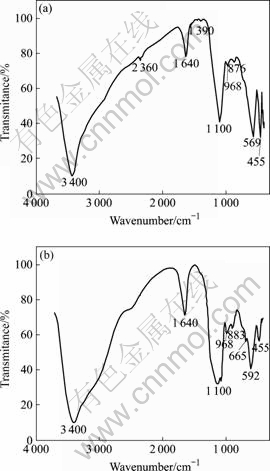
图7 STBBFS催化剂光催化反应前后红外光谱
Fig.7 FTIR spectra of STBBFS catalysis before (a) and after (b) photocatalysis reaction
通过对比未反应的STBBFS催化剂表面、吸附后催化剂表面以及光催化反应后催化剂表面的XPS谱,发现STBBFS催化剂中只有锰离子的价态发生了改变。未反应前,催化剂中锰离子以二价态存在;而在吸附和光催化反应后,催化剂中锰离子则出现了七价态[8]。这说明有一小部分Cr(Ⅵ)离子浓度降低是由二价锰离子还原造成的(反应中锰质量小于2 mg),而不是由于光催化引起的Cr(Ⅵ)还原。图8所示为光催化反应后STBBFS催化剂表面上铬离子的X射线光电子能谱。结合能为576、577.3和578.6 eV Cr的2p3/2峰对应于Cr(Ⅲ)[18?19],而580.1 eV则对应于Cr(Ⅵ)[18]。根据光催化后催化剂表面的XPS分析,总铬的含量小于0.1%。图9所示为六价铬的紫外?可见吸收光谱随时间变化曲线。从图9可看出,反应结束时,六价铬的特征峰已经不存在(即溶液中Cr(Ⅵ)全部被还原为Cr(Ⅲ))。综上所述:1) 反应结束时,只有少量铬以Cr(Ⅵ)形式存在于催化剂表面(小于0.1%),且生成的Cr(Ⅲ)物种不易于吸附在催化剂表面;2) Cr(Ⅵ)浓度降低一部分是光催化还原所致,另一部分则是催化剂本身含有的二价锰离子还原所致。
表1 含钛高炉渣的化学成分
Table 1 Chemical component and existing state form of TBBFS (mass fraction, %)

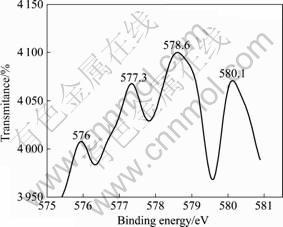
图8 STBBFS催化剂表面上铬离子的X射线光电子能谱
Fig.8 XPS spectrum of Cr 2p3/2 on surface of STBBFS catalyst
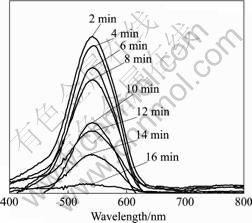
图9 Cr(Ⅵ)紫外?可见吸收光谱随时间变化曲线
Fig.9 UV-Vis spectra of Cr(Ⅵ) reduced by STBBFS catalyst at different illumination times
3 结 论
1) 于300 ℃煅烧的STBBFS催化剂具有钙钛矿结构,是钙钛矿、透辉石、镁?钙黄长石等多种矿物组成的催化剂。
2) Cr(Ⅵ)-CA-FN复合体系中,在酸性条件下有利于Cr(Ⅵ)的光催化还原,最佳pH值为2.5。
3) 存在CA和Fe(Ⅲ)时,降低了吸附对Cr(Ⅵ)光催化还原率的影响,且能有效地抑制电子?空穴对的复合,促进光生电子还原Cr(Ⅵ)离子。
4) 根据FTIR和XPS图谱分析,Cr(Ⅵ)浓度降低一部分是光催化还原所致,另一部分是催化剂本身含有的二价锰离子还原所致。
[1] GUPTA V K, GUPTA M, SHARMA S. Process development for the removal of lead and chromium from aqueous solutions using red mud—an aluminium industry waste[J]. Water Res, 2001, 35(5): 1125?1134.
[2] KOBYA M. Removal of Cr(Ⅵ) from aqueous solutions by adsorption onto hazelnut shell activated carbon: Kinetic and equilibrium studies[J]. Bioresource Technol, 2004, 91(3): 317?321.
[3] WANG L M, WANG N, ZHU L H, YU H W, TANG H Q. Photocatalytic reduction of Cr(Ⅵ) over different TiO2 photocatalysts and the effects of dissolved organic species[J]. J Hazard Mater, 2008, 152(1): 93?99.
[4] 唐建军, 袁辉洲, 邓爱华, 李荣先. Fe(Ⅲ)改性膨润土光催化降解水溶液中的4-氯苯酚[J]. 中国有色金属学报, 2007, 17(10): 1723?1727.
TANG Jian-jun, YUAN Hui-zhou, DENG Ai-hua, LI Rong-xian. Photocatalytic degradation of 4-chloropheno by Fe(Ⅲ) modified bentonite[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(10): 1723?1727.
[5] 杨 合, 薛向欣, 左 良. 含钛高炉渣催化剂光催化降解亚甲基蓝[J]. 过程工程学报, 2004, 4(3): 265?268.
YANG He, XUE Xiang-xin, ZUO Liang. Photocatalytic degradation of methylene blue with blast furnace slag containing Titanium[J]. The Chinese Journal of Process Engineering, 2004, 4(3): 265?268.
[6] YANG J K, LEE S M. Removal of Cr(Ⅵ) and humic acid by using TiO2 photocatalysis[J]. Chemosphere, 2006, 63(10): 1677?1684.
[7] JIANG F, ZHENG Z, XU Z Y, ZHENG S R, GUO Z B, CHEN L Q. Aqueous Cr(Ⅵ) photo-reduction catalyzed by TiO2 and sulfated TiO2[J]. J Hazard Mater B, 2006, 134(1/3): 94?103.
[8] 雷雪飞, 薛向欣. 酸度及酸介质对硫酸盐掺杂的含钛高炉渣光催化还原Cr(Ⅵ)的影响[J]. 化工学报, 2008, 59(9): 2247?2254.
LEI Xue-fei, XUE Xiang-xin. Effect of acidity and acidic medium on potocatalytic reduction of Cr(Ⅵ) by sulfate modified titanium -bearing blast furnace slag[J]. J Chem Ind Eng, 2008, 59(9): 2247?2254.
[9] CHENTHAMARAKSHAN C R, RAJESHWAR K, WOLFRUM E. Heterogeneous photocatalytic reduction of Cr (Ⅵ) in UV-Irradiated Titania Suspensions: Effect of Protons, Ammonium Ions, and Other Interfacial Aspects[J]. Langmuir, 2000, 16(6): 2715?2721.
[10] 陈心满, 徐明芳. UV/TiO2光催化还原Cr(Ⅵ)过程中吸附作用的影响及其消除[J]. 环境科学, 2006, 27(5): 913?917.
CHEN Xin-man, XU Ming-fang. Effects of absorption on photo-reduction of Cr (Ⅵ) by UV/TiO2 process and its elimination[J]. Environmental Science, 2006, 27(5): 913?917.
[11] MALKOC E, NUHOGLU Y. Potential of tea factory waste for chromium(Ⅵ) removal from aqueous solutions: Thermodynamic and kinetic studies[J]. Sep Purif Technol, 2007, 54(2): 291?298.
[12] PAPADAM T, XEKOUKOULOTAKIS N P, POULIOS I, MANTZAⅥNOS D. Photocatalytic transformation of acid orange 20 and Cr(Ⅵ) in aqueous TiO2 suspensions[J]. J Photochem Photobiol A, 2007, 186(2/3): 308?315.
[13] MOHAPATRA P, SAMANTARAY S K, PARIDA K. Photocatalytic reduction of hexavalent chromium in aqueous solution over sulphate modified titania[J]. J Photochem Photobiol A, 2005, 170(2): 189?194.
[14] MEICHTRY J M, BRUSA M, MAILHOT G, GRELA M A, LITTER M I. Heterogeneous photocatalysis of Cr(Ⅵ) in the presence of citric acid over TiO2 particles: Relevance of Cr(Ⅴ)–citrate complexes[J]. Appl Catal, B: Environ, 2007, 71(1/2): 101?107.
[15] TZOU Y M, WANG S L, WANG M K. Fluorescent light induced Cr(Ⅵ) reduction by citrate in the presence of TiO2 and ferric ions[J]. Colloids Surf A, 2005, 253(1/3): 15?22.
[16] DENG B, STONE A T. Surface-Catalyzed Chromium (Ⅵ) Reduction: Reactivity comparisons of different organic reductants and different oxide surfaces[J]. Environ Sci Technol, 1996, 30(8): 2484?2494.
[17] 彭文世, 刘高魁. 矿物红外光谱图集[M]. 北京: 科学出版社, 1982: 1?508.
PENG Wen-shi, LIU Gao-kui. Infrared spectra of inorganic and coordination compounds[M]. Beijing: Science Press, 1982: 1?508.
[18] STYPULA B, STOCH J. The characterization of passive films on chromium electrodes by XPS[J]. Corros Sci, 1994, 36(12): 2159?2167.
[19] OLOFA C, HORNSTROM O S. An AES and XPS study of the high alloy austenitic stainless steel 254 SMO tested in a ferric chloride solution[J]. Corros Sci, 1994, 36(1): 141?151.
基金项目:国家自然科学基金资助项目(50274025);教育部重大科技资助项目(307009);国家重点基础研究发展计划资助项目(2007CB613504)
收稿日期:2008-05-22;修订日期:2008-11-18
通讯作者:薛向欣,教授,博士;电话:024-83687371;E-mail: xuexx@mail.neu.edu.cn
摘 要:利用高能球磨法制备了钙钛矿型硫酸盐掺杂的含钛高炉渣光催化剂,考察了初始pH值对Cr(Ⅵ)?柠檬酸?硝酸铁(Cr(Ⅵ)-CA-FN)复合体系中Cr(Ⅵ)吸附效率和光催化还原效率的影响,并探讨了Cr(Ⅵ)-CA-FN复合体系中Cr(Ⅵ)可能的光催化还原机理。结果表明:在Cr(Ⅵ)-CA-FN复合体系中,酸性条件下有利于Cr(Ⅵ)的光催化还原,最佳pH值为2.5;柠檬酸和Fe(Ⅲ)降低了吸附对Cr(Ⅵ)还原率的影响,有效地抑制电子?空穴对的复合,促进光生电子还原Cr(Ⅵ)离子;六价铬浓度的降低一部分是光催化还原所致,另一部分是由于催化剂本身含有的二价锰离子还原所致。


