文章编号:1004-0609(2010)02-0301-07
纳米TiO2对钼(VI)的吸附性能
张 蕾,刘雪岩,姜晓庆,李 绮,康平利
(辽宁大学 化学学院,沈阳 110036)
摘 要:
研究纳米TiO2对Mo(VI)的吸附过程,考察溶液的pH值、时间、温度等因素对吸附的影响。结果表明:在pH 1~8范围内,纳米TiO2对Mo(VI)的吸附率均超过99%,吸附于纳米TiO2上的Mo(VI)可用2.0 mL的0.1 mol/L NaOH溶液定量洗脱;该吸附过程符合准二级反应动力学模型,其反应的表观活化能为22.7 kJ/mol,粒子内部扩散过程是其吸附控制步骤,但液相边界层向粒子表面的扩散过程不能忽略;吸附行为服从Langmuir和D-R等温模型。在室温下,纳米TiO2对Mo(VI)的饱和吸附容量为12.74 mg/g,平均吸附能为17.36 kJ/mol;吸附反应焓变和熵变均为正值,自由能变为负值,说明该吸附过程为自发的吸热过程。
关键词:
中图分类号:O 647.3 文献标识码:A
Adsorption properties of nano-TiO2 for Mo(VI)
ZHANG Lei, LIU Xue-yan, JIANG Xiao-qing, LI Qi, KANG Ping-li
(College of Chemistry, Liaoning University, Shenyang 110036, China)
Abstract: Titanium dioxide nanoparticles were employed for the sorption of Mo(VI) ions from aqueous solution. The process was studied in detail by varying the pH value, sorption time and temperature. The adsorption rate of Mo(VI) by the sorbent is over 99% at pH 1?8. Adsorbed Mo(VI) were desorbed by 2.0 mL of 0.1 mol/L NaOH. The kinetic experimental data properly correlate with the second-order kinetic model. The apparent activation energy is 22.7 kJ/mol. The overall rate process is mainly controlled by the intraparticle diffusion, while the boundary layer resistance cannot be ignored. The sorption data could be well interpreted by the Langmuir and D-R type sorption isotherms. At room temperature, the static saturated adsorption capacity is 12.74 mg/g, and the average sorption energy is 17.36 kJ/mol. The thermodynamic parameters: ΔHΘ>0, ΔSΘ>0 and ΔGΘ<0, which indicates a spontaneous and decalescence adsorption process.
Key words: Mo(VI); nano-TiO2; adsorption; kinetics; thermodynamics
泛使用,故目前对钼的研究非常活跃。钼的价格较昂贵,其用量在不断上升,而在地壳中的含量仅2 g/t,且钼矿资源中钼的品位也钼与机械工业、石油化工等的生产与发展密切相关,同时,钼化学品在纳米材料的研制及在杀菌剂、颜料、日用品等方面被广在不断下降,因而钼的提取和回收日显重要。分离富集钼的方法很多,主要有液萃取[1]、共结晶[2]、泡沫浮 选[3]、液膜法[4]和离子交换法[5]等。
纳米材料是近年来发展起来的一种新型功能材 料[6],它具有比表面积大、表面原子数目多等优点,已受到研究工作者的广泛关注。它对许多金属离子具有很强的吸附能力,是痕量元素分析中较为理想的分离富集材料[7]。
LI等[8]报道了纳米TiO2分离富集钨,李春香等[9]报道了纳米TiO2分离富集钼和钨的条件。有关纳米TiO2吸附性能的研究报道不多,HADJIIVANOV等[10] 研究了TiO2用于吸附Co、Ni、Cu金属离子的可行性,探讨了金属离子的吸附模型并研究了一些金属离子的吸附行为。LIANG等[11]报道了纳米TiO2对稀土离子和过渡金属离子吸附性能的研究。
由于有关纳米TiO2吸附钼的研究鲜见报道,因此本文作者以纳米TiO2作为吸附剂,探讨pH对吸附的影响及有关吸附机理,对纳米TiO2吸附钼的热力学与动力学行为进行较系统的研究。该项研究成果为钼的有效提取提供了参考途径。
1 实验
1.1 实验仪器与试剂
1.1.1 实验仪器
所用实验仪器如下:UV-Vis-NIR Cary 5000分光光度计,PHS?3C型精密pH计, KQ?100B型超声波清洗器,TDL80?2B台式离心机,TDA?8002型电热恒温水浴锅。
1.1.2 主要试剂
所用主要试剂如下:水杨基荧光酮(SAF);溴化十六烷基三甲铵(CTMAB),HCl,NaOH;纳米TiO2 (锐钛型20~50 nm),来自舟山明日纳米材料有限公司。实验所用试剂皆为分析纯,水为二次蒸馏水。
钼标准储备溶液(优级纯)的质量浓度为1.000 mg/mL,称取分析纯钼酸铵[(NH4)6Mo7O24·4H2O] 3.6804 g,用1?9(V(NH3)?V(H2O))氨水溶解,移入2 000 mL的容量瓶中,再用1?9(V(NH3)?V(H2O))氨水定容,摇匀。
1.2 实验方法
1.2.1 钼的测量方法
取适量的Mo(VI)标准溶液,在HCl介质中,加入水杨基荧光酮和溴化十六烷基三甲铵溶液,用水稀释后显色,于波长522 nm处,测定吸光度。
1.2.2 钼的吸附方法
量取10 mL一定浓度Mo(VI)标准溶液量于50 mL具塞锥形瓶中,用HCl和NaOH溶液调节Mo(VI)标准溶液的pH值,然后加入一定量的纳米TiO2,超声分散3 min,静置10 min,以4 000 r/min转速离心5 min,分析水相中Mo(VI)的浓度,按照1.2.1测定方法,测定吸光度A,计算Mo(VI)的含量和吸附率。
吸附率η的计算公式为

式中:ρ0为原溶液中吸附质的质量浓度,mg/L;ρ为吸附平衡时溶液中剩余吸附质的质量浓度,mg/L。
1.2.3 动力学实验
量取10 mL质量浓度为50 mg/L的Mo(VI)溶液置于一系列50 mL具塞锥形瓶中,调溶液pH为6.0,加入50 mg纳米TiO2,分别在273、296和323 K条件下,测定不同时间间隔下纳米TiO2的吸附量。
1.2.4 热力学实验
在一系列50 mL具塞锥形瓶中,加入不同质量浓度的Mo(VI)溶液10 mL,用HCl和NaOH调溶液的pH为6.0,加入50 mg纳米TiO2,分别在275、290和323 K条件下进行吸附实验。
2 结果与讨论
2.1 pH的影响
pH值对纳米TiO2吸附Mo(VI)起着重要的作用。在不同pH值条件下,纳米TiO2对Mo(VI)的吸附率的影响如图1所示。由图1可知,pH值在1~8范围内,纳米TiO2对Mo(VI)具有良好的吸附性能,吸附率达99%以上,即可以被定量吸附;当pH>8时,纳米TiO2对Mo(VI)的吸附能力下降。
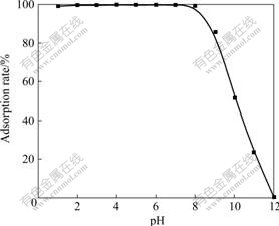
图1 pH值对纳米TiO2吸附Mo(VI)的影响
Fig.1 Effect of pH on adsorption rate of Mo(VI) for nano-TiO2
Mo(VI) 离子在溶液中的存在形式与溶液的pH值密切相关。在酸性条件下,Mo(VI)以Mo7O246?、Mo8O264?等形式存在,带较多的负电荷,而纳米TiO2表面带正电荷[12],容易吸附Mo(VI)离子。在碱性条件下,Mo(VI)则以四面体阴离子MoO42?形式存在,纳米TiO2表面带负电荷[12],对Mo(VI)吸附率较低。实验选择pH 6.0条件下进行吸附。
从图1可以知道,碱性条件下Mo(VI)的吸附率较低,本实验选择NaOH溶液解析Mo(VI)。实验发现用2.0 mL 0.1 mol/LNaOH溶液可定量洗脱Mo(VI),洗脱率为97%。
2.2 吸附动力学研究
2.2.1 吸附动力学模型
常用于描述吸附动力学方程的数学模型[13]如下:
1) Lagergren 准一级动力学方程
![]()
2) Ho 准二级动力学方程
![]()
式中:k1(min?1)、k2(g?mg?1?min?1)分别为一、二级吸附速率常数,qt(mg?g?1)为t时刻的吸附量,q1(mg?g?1)、q2(mg?g?1)为平衡吸附量。
分别以lg( q1?qt )对t、t/qt对t作图,对所有数据进行回归分析,从斜率和截矩可得到不同温度下纳米TiO2的k1、k2、q1、q2以及相关系数r1、r2值,实验数据如表1所列。
表1 不同温度下纳米TiO2吸附Mo(VI)的动力学参数
Table 1 Kinetic parameters for Mo(VI) adsorption on nano-TiO2 at different temperatures
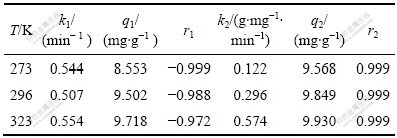
从表1可看出,在3种温度下,动力学实验数据与二级反应动力学模型有较好的拟合(r2>0.999)。此外,随着反应温度的升高,反应速率增大,由此可知,纳米TiO2对Mo(VI)的吸附过程是吸热过程。
2.2.2 吸附反应的活化能
Arrhenius公式常用于对反应活化能的求解[14],其表达式为

式中:k为反应速率常数,g?mg?1?min?1;A为指前因子;Ea为反应活化能,kJ?mol?1;R为理想气体常数,J?mol?1?K?1;T为绝对温度,K。
根据不同温度下Mo(VI)吸附动力学实验数据,以ln k对1000/T作图,可得到一条直线(图2),根据直线的斜率可求得纳米TiO2吸附Mo(VI)的表观活化能Ea为22.7 kJ/mol。
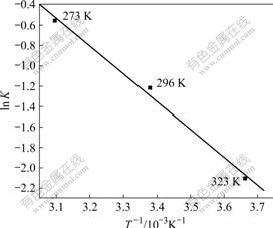
图2 活化能的阿伦尼乌斯曲线
Fig.2 Arrhenius curve of activation energy
2.2.3 扩散模型
为了确定吸附的速率控制步骤,将动力学数据用膜扩散和粒子扩散方程进行拟合,方程如下:
![]()
![]()
式中:F=qt /qe;qt,qe分别为t时刻的吸附容量和平衡吸附容量,mg?g?1;Rd为膜扩散的速率常数;B=π2Di /d2 (Di为内部扩散系数,d为粒子半径)。根据式(6)和式(7),用?ln(1?F)和?ln(1?F)?0.497 7对t做图,分别如图3和4所示。图3中直线没有通过原点,表明膜扩散不是纳米TiO2吸附Mo(VI)吸附过程的控制步骤。图4中直线近似通过原点,表明粒子内部扩散是吸附过程的主要控制步骤[15]。
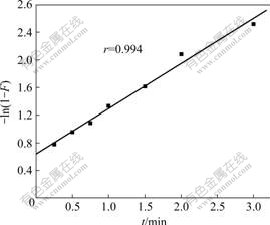
图3 液膜扩散拟合曲线
Fig.3 Fitted curve of liquid film diffusion
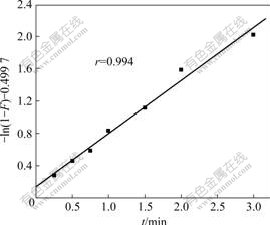
图4 粒子内部扩散拟合曲线
Fig.4 Fitted curve of intraparticle diffusion
2.2.4 内部粒子扩散模型
Mo(VI)在吸附剂内部的扩散过程可用Weber-Morris模型来描述[16],方程式如下:

式中:I表示吸附剂周围边界层对吸附过程的影响,I值越大,边界层对吸附的影响越大[17]。符合式(9)的吸附机理比较复杂,边界层向粒子表面的扩散过程(或粒子外部传质阻碍对扩散过程的影响)不可以忽略[18]。
将Weber-Morris模型数据进行分段线性拟合,拟合曲线如图5所示,由模型得到的内部扩散速度常数和线性相关系数r如表2所列。从图5可以看出,Weber-Morris模型曲线的2段线性拟合情况较好,说明粒子内部扩散过程是吸附过程的控制步骤;但扩散模型拟合直线并不经过原点,说明纳米TiO2吸附Mo(VI)机理比较复杂,吸附剂周围液相边界层向粒子表面的扩散过程不可以忽略。
2.3 吸附热力学研究
2.3.1 吸附等温模型和吸附容量
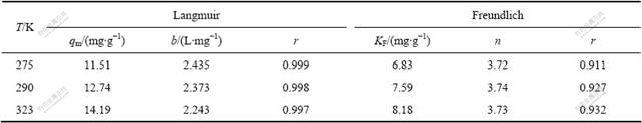
对于固?液体系的吸附行为,常用Langmuir和Freundlich吸附等温模型来描述[19]。
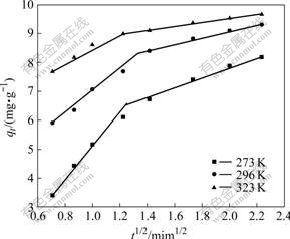
图5 在不同温度下Weber-Morris模型拟合曲线
Fig.5 Fitted curves of Weber-Morris at different temperatures
Langmuir等温式假设吸附是单分子层吸附模型,体相溶液和吸附层均可视为理想溶液,溶质与溶剂分子体积相等或有相同的吸附位。
![]()
式中:qm为饱和吸附量,mg?g?1;ρe为Mo(VI)吸附平衡时的质量浓度,mg?L?1;b为吸附平衡常数,L?mg?1。以ρe/qe对ρe做直线可得qm和b。
Freundlich模型是表征多层吸附的经验式:
![]()
式中:KF为吸附容量,mg?g?1;n为吸附常数。
<>2对Mo(VI)的吸附是吸热过程。
2.3.2 吸附过程中的热力学参数
纳米TiO2对Mo(VI)的吸附量随温度的升高而增加,这可通过吸附热力学函数?GΘ、?HΘ、?SΘ的计算值加以解释。
标准吉布斯自由能变、标准反应焓变、标准反应熵变与固?液分配系数KD之间的关系为
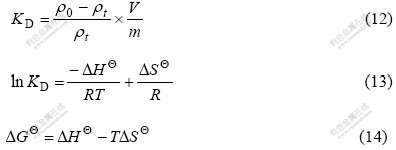
表2 不同温度下Weber-Morris模型多段线性拟合曲线系数及相关系数
Table 2 Calculated parameters for Mo(VI) adsorption on nano-TiO2 at different temperatures
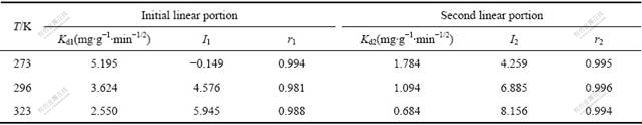
表3 不同温度下Langmuir和Freundlich吸附等温线吸附常数和线性相关系数
Table 3 Langmuir and Freundlich isotherm constants and correlation coefficients at different temperatures
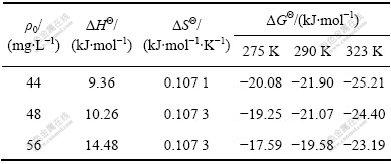
式中:ρ0为Mo(VI)溶液初始浓度(mg/L),ρt为t时刻溶液中Mo(VI)的浓度(mg/L),V为溶液体积(mL),m为纳米二氧化钛的加入量(g)。由于是实际溶液,因此,根据式(13)和(14)计算得到的是表观吉布斯自由能变(ΔGΘ),表观焓变(ΔHΘ)和表观熵变(ΔSΘ)。
表4所列为不同初始浓度的钼吸附于纳米TiO2的热力学表观参数。由表4可知,纳米TiO2吸附Mo(VI)的吸附焓变为正值,表明该吸附为焓推动的吸热过程,这与吸附等温线的结果也是一致的。吸附自由能为负值,表明吸附过程是自发行为,随着温度升高,ΔGΘ减小,说明高温有利于该反应进行。离子在固体表面的吸附导致自由度变小,但是实验结果ΔSΘ>0,可能是因为在溶液中,吸附质(如钼)并不以简单的离子形式存在,它们经常会与水结合(水化作用或水解作用) 生成水合离子或分子,当吸附质的水合离子或分子被吸附时,其结合水可能会离解出来,重新回到溶液中,这个过程会增加系统的熵值,导致ΔSΘ>0[20]。
表4 不同初始浓度的钼吸附于纳米TiO2的热力学表观参数
Table 4 Thermodynamic parameters for adsorption of Mo(VI) on nano-TiO2
2.3.3 平均吸附能
平均吸附能E是判断吸附类型的重要指标,其计算式为[21]
![]()
根据D-R模型的线性形式(式16),以lnqe对ε2作直线(见图6),由直线斜率求得K:

式中:E为平均吸附能(kJ/mol),K为与吸附能有关的常数,ε为Polanyi势能(kJ)。
根据式(15),在275、290和323 K条件下,纳米TiO2对Mo(VI)的平均吸附能分别为16.0、17.4和18.7 kJ/mol。E>16 kJ/mol,故该吸附反应属于化学吸附[22]。
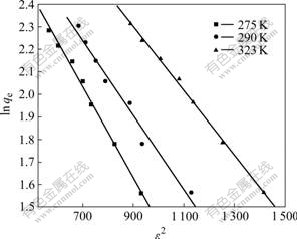
图6 在不同温度下D-R的吸附等温线
Fig.6 D-R adsorption isotherms at different temperatures
4 结论
1) 纳米TiO2对Mo(VI)的吸附在pH为1~8范围内,吸附率可达到99%,碱性条件下不利于Mo(VI)的吸附,实验发现2.0 mL 0.1 mol/L NaOH溶液可定量洗脱Mo(VI),洗脱率为97%。
2) 该吸附过程符合准二级反应动力学模型,常温下其反应速率常数为0.296 g?mg?1?min?1,反应的活化能为22.7 kJ/mol,吸附机理比较复杂,粒子内部扩散过程是其吸附控制步骤,但液相边界层向粒子表面的扩散过程不能忽略。
3) 纳米TiO2对Mo(VI)的吸附符合Langmiur、D-R等温式,在275、290和323 K条件下,其饱和吸附容量分别为11.51、12.74和14.19 mg/g,平均吸附能分别为16.0 、17.4 和18.7 kJ/mol,饱和吸附容量随体系温度升高而增大,说明此吸附反应为吸热过程,平均吸附能E>16 kJ/mol,故该吸附反应属于化学吸附过程。
4) 纳米TiO2对Mo(VI)的吸附热力学参数分别为:ΔHΘ>0,ΔGΘ<0,ΔSΘ>0,表明吸附反应为自发的吸热过程。
[1] 张子岩, 简椿林. 溶剂萃取法在钨湿法冶金中的应用[J]. 湿法冶金, 2006, 25(1): 1?9.
ZHANG Zi-yan, JIAN Chun-lin. Application of solvent extraction in tungsten hydrometallurgy[J]. Hydrometallurgy of China, 2006, 25(1): 1?9.
[2] 王惠君, 熊春华, 姚彩萍, 顾振宇. D201×4 树脂吸附钼(VI)的性能及机理[J]. 有色金属, 2006, 58(4): 29?32.
WANG Hui-jun, XIONG Chun-hua, YAO Cai-ping, GU Zhen-yu. Adsorption performance and mechanism of Mo(VI) on D201 ×4 resin[J]. Nonferrous Metals, 2006, 58(4): 29?32.
[3] 姬 涛, 金奇庭, 郭新超, 孙长顺. 钼酸铵生产酸洗废水的治理[J]. 工业用水与废水, 2007, 38(4): 12?14.
JI Tao, JIN Qi-ting, GUO Xin-chao, SUN Chang-shun. Treatment of acid-washing wastewater from ammonium molybdate production[J]. Industrial Water & Wastewater, 2007, 38(4): 12?14.
[4] 王献科, 李玉萍, 李莉芬. 液膜分离富集钼[J]. 中国钼业, 2002, 26(5): 34?36.
WANG Xian-ke, LI Yu-ping, LI Li-fen. Separation enrichment of molybdenum with liquid memberanes[J]. China Molybdenum Industry, 2002, 26(5): 34?36.
[5] 梁 宏, 卢基爵. 离子交换法从含钼酸性废液中回收钼[J]. 中国钼业, 1999, 23(3): 43?45.
LIANG Hong, LU Ji-jue. Recovery of molybdenum from contains molybdenum acid waste liquors with ion exchanging method[J]. China Molybdenum Industry, 1999, 23(3): 43?44.
[6] 陈松涛, 闫永胜, 徐婉珍, 刘 华, 荆俊杰, 谢吉民. 纳米TiO2预分离/富集FAAS法同时测定Cr(III)和Cr(VI)的研究[J]. 光谱学与光谱分析, 2007, 27(5): 1018?1020.
CHEN Song-tao, YAN Yong-sheng, XU Wan-zhen, LIU Hua, JING Jun-jie, XIE Ji-min. Combination of separation/ preconcentration based on nanoscale TiO2 and FAAS for the simultaneous determination of Cr(III)/Cr(VI) in water[J]. 2007, 27(5): 1018?1020.
[7] 张中太, 林元华, 唐子龙, 张俊英. 纳米材料及其技术的应用前景[J]. 材料工程, 2000, 3: 42?48.
ZHANG Zhong-tai, LIN Yuan-hua, TANG Zi-long, ZHANG Jun-ying. Nanometer materials & nanotechnology and their application prospect[J]. Materials Engineering, 2000, 3: 42?48.
[8] LI Shun-xing, DENG Nan-sheng, ZHENG Feng-ying, HUANG Yu-zhen. Spectrophotometric determination of tungsten(VI) enriched by nanometer-size titanium dioxide in water and sediment[J]. Talanta, 2003, 60(6): 1097?1104.
[9] 李春香, 秦永超, 梁 沛, 胡 斌, 彭天右, 江祖成. 纳米TiO2分离富集和ICP-A ES测定地质样品中的钼和钨[J]. 分析科学学报, 2002, 18(3): 186?189.
LI Chun-xiang, QIN Yong-chao, LIANG Pei, HU Bin, PENG Tian-you, JIANG Zu-cheng. Nanometer-size TiO2 separation/ preconcentration and ICP-AES determination of trace Mo and W in geological samples[J]. Journal of Analytical Science, 2002, 18(3): 186?189.
[10] HADJIIVANOV K, KLISSURSKI D, KANTCHEVA M. State and focalization of cobalt, nickel and copper ions adsorbed on titania(anatase)[J]. Journal of the Chemical Society, Faraday Transactions, 1991, 87(6): 907?912.
[11] LIANG P, JIANG Z C, HU B, QIN Y C. Study on adsorption behaviour of rare earth complexes on namometer-size titanium dioxide with ICP-AES[J]. Journal of Rare Earths, 2003, 21(4): 474?477.
[12] ZHANG L, LIU N, YANG L J, LIN Q. Sorption behavior of nano-TiO2 for the removal of selenium ions from aqueous solution [J]. Journal of Hazardous Materials, 2009, 17(2/3): 1197?1203.
[13] 杭义萍, 秦永超, 江祖成, 胡 斌. ICP-AES研究纳米TiO2材料对Ga, In, Tl的吸附性能[J]. 光谱学与光谱分析, 2005, 25(7): 1131?1134.
HANG Yi-ping, QIN Yong-chao, JIANG Zu-cheng, HU Bin. Study on the adsorption behavior of Ga, In and Tl on nanometer-size titanium dioxide by ICP-AES[J]. Spectroscopy and Spectral Analysis, 2005, 25(7): 1131?1134.
[14] 许光眉, 施 周, 邓 军. 石英砂负载氧化铁吸附除磷的热动学研究[J]. 环境工程学报, 2007, 1(6): 15?18.
XU Guang-mei, SHI Zhou, DENG Jun. Thermodynamic and kinetic investigation of phosphate adsorption on iron-oxide coated sand [J]. Chinese Journal of Environmental Engineering, 2007, 1(6): 15?18.
[15] AKSU Z. Application of biosorption for the removal of organic pollutants: A review[J]. Process Biochemistry, 2005, 40(3/4): 997?1026.
[16] SHAUHA M S, SARWAR M I, QADEER R. Adsorption of strontium ions from aqueous solution on Pakistani coal[J]. Journal of Radioanalytical and Nuclear Chemistry, 2005, 265(1): 73?79.
[17] ?ZER A, AKKAYA G, TURABIK M. The biosorption of acid red 337 and acid blue 324 on enteromorpha prolifera: The application of nonlinear regression analysis to dye biosorption[J]. Chemical Engineering Journal, 2005, 112(1/3): 181?190.
[18] MALL I D, SRIVASTAVA V C, AGARWAL N K, MISHRA I M. Removal of Congo red from aqueous solution by bagasse fly ash and activated carbon: Kinetic study and equilibrium isotherm analyses[J]. Chemosphere, 2005, 61(4): 492?501.
[19] 邹卫华, 陈宗璋, 韩润平, 谢 霜, 石 杰. 锰氧化物/石英砂(MOCS)对铜和铅离子的吸附研究[J]. 环境科学学报, 2005, 25(6): 779?784.
ZOU Wei-hua, CHEN Zong-zhang, HAN Run-ping, XIE Shuang, SHI Jie. Removal of copper cation and lead cation from aqueous solution by manganese-oxide-coated-sand [J]. Acta Scientiae Circumstantiae, 2005, 25(6): 779?784.
[20] ?ZER A, AKKAYA G, TURABIK M. Biosorption of acid blue (AB290) acid blue 324 (AB324) dyes on spirogyra rhizopus[J]. Journal of Hazardous Material, 2006, 135(1/3): 355?364.
[21] KILISLIOGLB A, BILGIN B. Thermodynamic and kinetic investigations of uranium adsorption on amberlite IR-118H resin[J]. Applied Radiation and Isotopes, 2003, 58(2): 155?160.
[22] EL-SHAHAWI M S, NASSIF H A. Retention and thermodynamic characteristics of mercury(II) complexes onto polyurethane foams[J]. Analytica Chimica Acta, 2003, 481(1): 29?39.
基金项目:辽宁省教育厅科技创新团队资助项目(2007T053);辽宁省“百千万人才工程”资助项目
收稿日期:2008-12-03;修订日期:2009-04-21
通信作者:张 蕾,教授,博士;电话:024-62207809;E-mail: zhanglei63@126.com
摘 要:研究纳米TiO2对Mo(VI)的吸附过程,考察溶液的pH值、时间、温度等因素对吸附的影响。结果表明:在pH 1~8范围内,纳米TiO2对Mo(VI)的吸附率均超过99%,吸附于纳米TiO2上的Mo(VI)可用2.0 mL的0.1 mol/L NaOH溶液定量洗脱;该吸附过程符合准二级反应动力学模型,其反应的表观活化能为22.7 kJ/mol,粒子内部扩散过程是其吸附控制步骤,但液相边界层向粒子表面的扩散过程不能忽略;吸附行为服从Langmuir和D-R等温模型。在室温下,纳米TiO2对Mo(VI)的饱和吸附容量为12.74 mg/g,平均吸附能为17.36 kJ/mol;吸附反应焓变和熵变均为正值,自由能变为负值,说明该吸附过程为自发的吸热过程。


