文章编号:1004-0609(2008)05-0929-05
SiO2在KCl-NaCl-NaF体系中的溶解度及溶解机理
何小凤,李运刚,田 薇,梁精龙
(河北理工大学 冶金与能源学院,唐山 063009)
摘 要:
用等温饱和法研究温度及熔盐组分对SiO2在KCl-NaCl-NaF体系中溶解度的影响。通过对熔盐急冷试样的X射线衍射分析和对该体系各物质间反应的热力学分析,确定了SiO2的溶解机理。结果表明:SiO2的溶解机理为6NaF(L)+3SiO2(S)=Na2SiF6(L)+2Na2SiO3(L);SiO2的溶解度随温度的升高、组元NaF摩尔分数的增加而增大,并且在KCl与NaCl摩尔比为1时,SiO2的溶解度与NaF摩尔分数呈线性关系。
关键词:
中图分类号:O 611.62;TN 304.12 文献标识码:A
Solubility and dissolving mechanism of SiO2 in
KCl-NaCl-NaF molten salt
HE Xiao-feng, LI Yun-gang, TIAN Wei, LIANG Jing-long
(School of Metallurgy and Energy, Hebei Polytechnic University, Tangshan 063009, China)
Abstract: The influence of temperature and component to solubility of SiO2 in KCl-NaCl-NaF molten salt was researched by isothermal saturation method. The dissolving mechanism of SiO2 was confirmed by X-ray diffraction to quench sample of molten salt and thermodynamic analysis to the system. The results show that dissolving mechanism of SiO2 is 6NaF(L)+3SiO2(S)=Na2SiF6(L)+2Na2SiO3(L), the solubility of SiO2 increases with the increase of temperature and of NaF content and appears linearity relation to NaF content at x(KCl)?x(NaCl)=1.
Key words: SiO2; KCl-NaCl-NaF; solubility; dissolving mechanism
由于硅无法在常温下由水溶液电沉积制得,人们开始研究从熔盐中电沉积硅[1-2]。最早提出这种方法的是DEVILLE[3],后经FELLINER[4]改进,于1 020 ℃的Na3AlF6- SiO2-Al2O3中,在金属钼上得到了成分为Mo3Si的均相硅化物沉积层。1980年,RAO等[5]在LiF-NaF-KF共晶体系中,通过添加K2SiF6或Na2SiF6,于745 ℃电沉积硅取得了成功。1996年STUBERGH等[6]在倍长石-冰晶石熔盐中电沉积硅取得了成功。2004年JIN等[7]报道了在850 ℃的氯化钙熔盐中电解还原固态二氧化硅粉末制备单质硅和硅基合金研究成果,并受到了普遍的关注[8-9]。LiF-NaF-KF熔盐体系虽然络合能力强,但对气氛过于敏感,当以K2SiF6或Na2SiF6为溶质时,体系挥发较严重,致使熔盐成分波动较大,影响电沉积过程。Na3AlF6-SiO2-Al2O3熔盐体系虽然对水、气氛不敏感,但该体系的熔点较高(大于900 ℃)。本课题组经过大量的对比实验,发现KCl-NaCl-NaF熔盐体系熔点较低,且可以溶解SiO2。由于SiO2的密度比KCl-NaCl- NaF熔盐的大,过量的SiO2沉淀在熔盐的底部,如果把该体系用于电沉积硅,可以解决熔盐中硅的补充问题。但是,关于KCl-NaCl-NaF-SiO2熔盐体系物理化学性质的研究尚无报道,作为重要的物理化学参数之一的溶解度,它不仅可以为电沉积硅工艺条件的选择提供依据,而且还可以通过研究各因素对溶解度的影响规律来推测熔盐的结构[10-13]。为此,本文作者研究了温度、NaF含量对SiO2在KCl-NaCl-NaF熔体中的溶解度的影响及溶解机理。
1 实验
1.1 试样制备
实验所用KCl,NaCl,NaF和SiO2试剂均为分析纯,在配置熔盐时先经200 ℃烘干8 h。按实验方案要求分别称取各组元,研磨混匀待用。
1.2 实验装置
如图1所示,电阻炉加热,DWK-702精密温度控制仪控温,铂-铑铂热电偶测温。坩锅为高纯石墨坩锅。
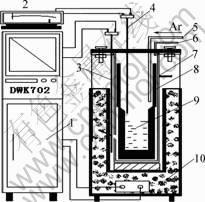
图1 实验装置图
Fig.1 Schematic diagram of experimental apparatus: 1—Apparatus for temperature control; 2—Apparatus for determination temperature; 3—Thermocouple for temperature control; 4—Thermocouple for determination temperature; 5—Ar entry hole; 6—Ar exit; 7—Stainless steel crucible; 8—Graphite crucible; 9—Molten salt; 10—Resistance stove
1.3 实验方法
测定溶解度的方法有等温饱和法、钢弹法和目测法[14],本文采用等温饱和法。根据实验方案,配置不同成分的熔盐,混匀后装入高纯石墨坩埚并放入炉内,通氩气保护,开始升温。待温度升至预定温度时,开始计时,并每隔0.5 h搅拌1次,使熔体成分均匀。按实验方案,定时用取样勺取出上清液,冷却后研成粉末进行硅含量的检测,并折合成SiO2的质量分数。实验过程中给坩锅加盖,以减少熔盐的挥发。
2 结果与讨论
2.1 SiO2溶解平衡时间的确定
测定SiO2的溶解度,必须先确定SiO2溶解达平衡的时间。在熔盐组分摩尔比x(KCl)?x(NaCl)?x(NaF)= 1?1?2,温度为800 ℃条件下,测定了SiO2在KCl-NaCl- NaF熔盐体系中的溶解量与溶解时间的关系,结果如图2所示。
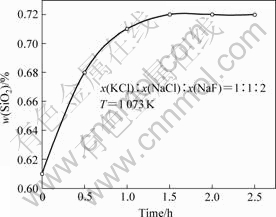
图2 SiO2溶解量与时间的关系
Fig.2 Relation between dissolving amount of SiO2 and time
由图2可以看出:曲线在1.5 h以后出现水平段,表明溶解达到了平衡,即在恒温1.5 h左右SiO2在该熔盐体系中的溶解达到饱和。为了既能使溶解充分达到平衡,又尽量减少熔体在高温下挥发损失而引起较大的实验误差,选用2 h作为饱和溶解时间。
2.2 温度对SiO2溶解度的影响
在x(KCl)?x(NaCl)?x(NaF)=1?1?2,溶解平衡时间为2 h,温度分别为700,750,800,850和900 ℃条件下,测定了SiO2在KCl-NaCl-NaF熔盐体系中的溶解度,实验结果如图3所示。
由图3可知,随着温度的升高,SiO2在KCl-NaCl- NaF中的溶解度呈现出增加的趋势。
2.3 NaF含量对SiO2溶解度的影响
在温度为800 ℃,x(KCl)?x(NaCl)=1的条件下,NaF含量对SiO2溶解度的影响见图4。
由图4可知,随着NaF含量的增加,SiO2在KCl-NaCl-NaF熔盐体系中的溶解度增大,并呈良好的线性关系,对数据进行回归得:

相关系数R=0.993 74。
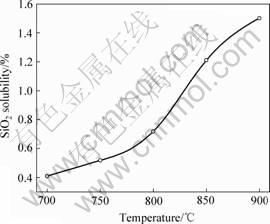
图3 温度对SiO2溶解度的影响
Fig.3 Influence of temperature on solubility of SiO2
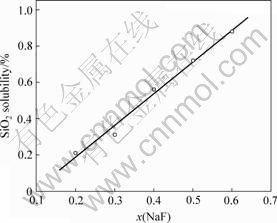
图4 NaF含量对SiO2溶解度的影响
Fig.4 Influence of NaF content on solubility of SiO2
2.4 KCl-NaCl-NaF-SiO2体系的固态相组成
熔盐固态下的相组成是推断熔盐在熔融状态下结构的重要依据之一。本研究对温度为900 ℃,x(KCl)?x(NaCl)?x(NaF)=1?1?2且SiO2饱和的熔盐取样在液氮中急冷固化,然后进行X射线衍射分析,结果见图5。
可以看出,在该试样中存在NaCl,KCl,NaF和Na2SiF6相。NaCl,KCl和NaF为配制试样时加入的物质,Na2SiF6显然是新生成物质。
另外,在试样的X射线衍射谱线中没有发现SiO2相,说明SiO2在KCl-NaCl-NaF体系中的物理溶解很少,Si进入熔盐中几乎完全靠化学溶解来完成。
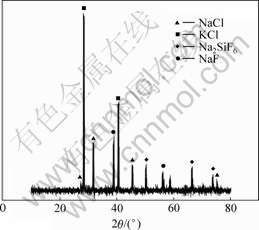
图5 试样的X射线衍射谱
Fig.5 XRD pattern of sample
2.5 结果讨论
2.5.1 SiO2在KCl-NaCl-NaF体系中的溶解机理
利用HSC4.0热力学软件分析由K-Na-Cl-F-Si-O构成的体系,显示可能存在102种不同相态的物质,考虑实际研究温度小于1 000 ℃以及该熔盐体系由KCl,NaCl,NaF和SiO2试剂配置而成,可以排除约91种物质。因此,该熔盐体系中可能存在的物质有NaF,NaCl,KCl,SiO2,SiCl4,SiF4,SiOF2,SiCl3F,SiClF3,Na2SiF6和Na2SiO3。根据这些物质可以推断配制该熔盐的原始物质NaF,NaCl,KCl和SiO2之间可能发生的化学反应见表1。
表1 体系中可能发生的化学反应及ΔGΘ [15]
Table 1 Chemical reaction and ΔGΘ in system
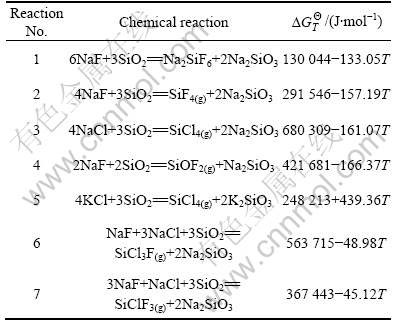
对于非标准状态下判断化学反应进行的方向要观察反应吉布斯自由能?G的正负,但是,化学反应的?G与实际条件有关,而许多情况下反应的实际条件又很复杂,?G难以计算,故常用ΔGΘ近似地判断反应进行的方向[16]。表1中各个化学反应的ΔGΘ和温度的关系见图6。
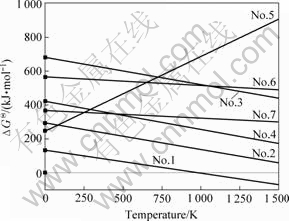
图6 ΔGΘ与温度的关系
Fig.6 Relations between ΔGΘ and temperature
从表1和图6可以看出:在本实验温度条件下,7个反应中可能发生的只有6NaF+3SiO2=Na2SiF6+ 2Na2SiO3。在标准状态下,当温度T≥997 K时,此化学反应可以进行,即此熔盐体系中有新物质Na2SiF6和2Na2SiO3生成。
在对该熔融盐体系急冷试样的X射线衍射结果中,发现了Na2SiF6相,但未发现Na2SiO3。这是因为Na2SiO3在KCl-NaCl-NaF-SiO2熔盐体系溶解很少或不溶解,由于液态Na2SiO3密度大于该熔融盐的密度而分层形成新的液相,这在实验过程对熔盐的搅拌操作时能明显地感觉到。因此,SiO2在KCl-NaCl-NaF熔盐体系中的溶解机理为:6NaF(L)+3SiO2(S)= Na2SiF6(L)+2Na2SiO3(L)。
2.5.2 温度和NaF含量对SiO2溶解度的影响
实验结果表明,随着温度或NaF浓度的升高,SiO2在熔盐体系中的溶解度增大,这也可以通过体系反应热力学分析证明这一点。根据上面分析结果,该体系可能发生的反应只有6NaF+3SiO2=Na2SiF6+ 2Na2SiO3。因此,下面的分析只围绕该反应进行。
分析固定条件:熔盐中x(KCl)?x(NaCl)=1?1;Na2SiO3和SiO2呈独立相活度均为1;假定Na2SiF6和NaF活度系数为1,Na2SiF6摩尔分数为0.01。
在上述条件下,随NaF含量不同,反应6NaF+3SiO2=Na2SiF6+2Na2SiO3的ΔG随温度的变化及开始温度见图7。
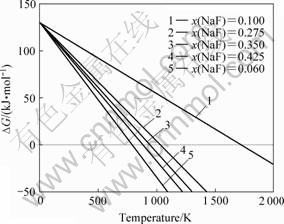
图7 NaF含量对ΔG的影响
Fig.7 Influences of NaF content on ΔG
可以看出,当NaF浓度分别为0.1,0.275,0.35,0.425和0.6时,反应向右进行的开始温度分别为1 720,1 031,942,880和788 K,随着NaF的浓度升高,反应向右进行的开始温度降低。
图8所示是在x(KCl)?x(NaCl)=1?1;Na2SiO3和SiO2活度均为1,假定Na2SiF6和NaF活度系数为1时,不同温度下NaF含量对Na2SiF6生成量影响的计算结果。可以看出,随着NaF含量的增多、温度升高,均可以使SiO2在KCl-NaCl-NaF体系中的溶解度增大,并且在各温度下, SiO2的溶解度与NaF含量呈较好的线性关系,这与实验结果吻合。
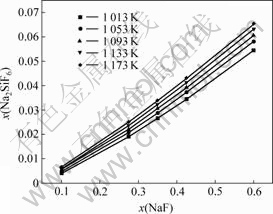
图8 温度、NaF含量对Na2SiF6含量的影响
Fig.8 Influences of temperature and NaF content on Na2SiF6 content
3 结论
1) SiO2在KCl-NaCl-NaF体系中的溶解度随温度的升高而增大。
2) SiO2在KCl-NaCl-NaF中的溶解度随NaF含量的增多而增大,且在温度一定的情况下与NaF含量呈良好的线性关系。
3) SiO2在KCl-NaCl-NaF体系中的溶解机理为6NaF(L)+3SiO2(S)=Na2SiF6(L)+2Na2SiO3(L)。
REFERENCES
[1] 吴纯素. 熔盐电沉积技术进展[J]. 材料保护, 1990, 23(1/2): 58-61.
WU Chun-su. Development of electrodeposition technology in fused salt[J]. Materials Protection, 1990, 23(1/2): 58-61.
[2] 段淑贞, 乔芝郁. 熔盐化学—原理和应用[M]. 北京: 冶金工业出版社, 1990: 202-203.
DUAN Shu-zhen, QIAO Zhi-yu. Molten salt—principle and application[M]. Beijing: Metallurgy Industry Press, 1990: 202-203.
[3] 王祝堂, 徐国钰. 硅与铝工业的发展[J]. 中国金属通报, 2004, 41: 8-11.
WANG Zhu-tang, XU Guo-yu. Development of silicon and aluminium industry[J]. China Metal Bulletin, 2004, 41: 8-11.
[4] FELLNER P, MATIASOVSKY K. Electrolytic silicide coating in fused salts[J]. Electrodeposition and Surface Treatment, 1975(3): 235-244.
[5] RAO G M, ELWELL D, FEIGELSON R S. Electrocoating of silicon and its dependence on the time of electrolysis[J]. Surface Technology, 1981(13): 331-337.
[6] STUBERGH J R, LIU Zhong-hua. Preparation of pure silicon by Electrowinning in a bytownite-crylite melt[J]. Metallurgical and Materials Transactions B, 1996, 27: 895-899.
[7] JIN Xian-bo, GAO Pei, WANG Di-hua, HU Xiao-hong. Electro-chemical preparation of silicon and its alloys from solid oxides in molten calcium chloride[J]. Angew Chcm Int Edit, 2004, 43: 733-735.
[8] Electrochemical extraction of silicon new approach for a more environmentally friendly large scale process[EB/OL]. [2004-01]. http//www. chemie.de /news/e /34607/?sort= 3,30.
[9] DAVID B. Green silicon production[EB/OL]. [2004-09]. http//www. sciencebase.com /sept04-iss. html.
[10] 杨 昇, 李 强, 顾松青. 氧化钪在冰晶石-氧化铝体系中的溶解性能研究[J]. 稀有金属, 2003, 27(3): 418-420.
YANG Sheng, LI Qiang, GU Song-qing. Solubility of Sc2O3 in nNaF·AlF3-Al2O3melts[J]. China Journal of Rare-Metals, 2003, 27(3): 418-420.
[11] 路贵民, 刘学山. 氧化钪在nNaF?AlF3-ScF3熔盐体系中的溶解[J]. 中国有色金属学报, 1999, 9(3): 624-626.
LU Gui-min, LIU Xue-shan. Dissolution of Sc2O3 in fluoride molten salt[J]. The Chinese Journal of Nonferrous Metals, 1999, 9(3): 624-626.
[12] 陈金钟, 李 冰, 汪 瑾, 于建国. 氧化镁在NdCl3-NaCl- KCl-MgCl2熔盐中的溶解行为[J]. 稀有金属, 2006, 30(2): 158-163.
CHEN Jin-zhong, LI Bing, WANG Jing, YU Jian-guo. Solubility of MgO in molten salt of NdCl3-NaCl-KCl-MgCl2[J]. China Journal of Rare-Metals, 2006, 30(2): 158-163.
[13] 高运明, 曾 智, 潘金华. 氧化铁在硼砂熔盐中溶解度研究[J]. 武汉科技大学学报: 自然科学版, 2006, 29(6): 552-554.
GAO Yun-ming, ZENG Zhi, PAN Jin-hua. Solubility of Fe2O3 in molten salts of borax [J]. Journal of Wuhan University of Science and Technology: Natural Science Edition, 2006, 29(6): 552-554.
[14] 任万忠, 陈小平, 于维谦. 稀土氧氯化物在冰晶石-氧化铝熔体中的溶解度[J]. 中国稀土学报, 2001, 19(4): 343-345.
YEN Wan-zhong, CHEN Xiao-ping, YU Wei-qian. Solubility of rare earth oxychloride in melt of cryolite[J]. Journal of The Chinese Rare Earth Society, 2001, 19(4): 343-345.
[15] 梁英教, 车荫昌. 无机物热力学数据手册[M]. 沈阳: 东北大学出版社, 1993: 16-442.
LIANG Ying-jiao, CHE Yin-chang. Inorganic matter thermodynamics data handbook[M]. Shenyang: Northeastern University Press, 1993: 16-442.
[16] 张家芸, 郉献然, 宋 波, 郭兴敏, 项长祥. 冶金物理化学[M]. 北京: 冶金工业出版社, 2004: 20-21.
ZHANG Jia-yun, XING Xian-ran, SONG Bo, GUO Xin-min, XIANG Chang-xiang. Physical chemistry of metallurgy[M]. Beijing: Metallurgy Industry Press, 2004: 20-21.
基金项目:国家自然科学基金资助项目(50474079)
收稿日期:2007-05-25;修订日期:2008-01-16
通讯作者:李运刚,教授;电话:13933356805;E-mail: lyg@heut.edu.cn
摘 要:用等温饱和法研究温度及熔盐组分对SiO2在KCl-NaCl-NaF体系中溶解度的影响。通过对熔盐急冷试样的X射线衍射分析和对该体系各物质间反应的热力学分析,确定了SiO2的溶解机理。结果表明:SiO2的溶解机理为6NaF(L)+3SiO2(S)=Na2SiF6(L)+2Na2SiO3(L);SiO2的溶解度随温度的升高、组元NaF摩尔分数的增加而增大,并且在KCl与NaCl摩尔比为1时,SiO2的溶解度与NaF摩尔分数呈线性关系。
[1] 吴纯素. 熔盐电沉积技术进展[J]. 材料保护, 1990, 23(1/2): 58-61.
[2] 段淑贞, 乔芝郁. 熔盐化学—原理和应用[M]. 北京: 冶金工业出版社, 1990: 202-203.
[3] 王祝堂, 徐国钰. 硅与铝工业的发展[J]. 中国金属通报, 2004, 41: 8-11.
[10] 杨 昇, 李 强, 顾松青. 氧化钪在冰晶石-氧化铝体系中的溶解性能研究[J]. 稀有金属, 2003, 27(3): 418-420.
[11] 路贵民, 刘学山. 氧化钪在nNaF?AlF3-ScF3熔盐体系中的溶解[J]. 中国有色金属学报, 1999, 9(3): 624-626.
[14] 任万忠, 陈小平, 于维谦. 稀土氧氯化物在冰晶石-氧化铝熔体中的溶解度[J]. 中国稀土学报, 2001, 19(4): 343-345.
[15] 梁英教, 车荫昌. 无机物热力学数据手册[M]. 沈阳: 东北大学出版社, 1993: 16-442.
[16] 张家芸, 郉献然, 宋 波, 郭兴敏, 项长祥. 冶金物理化学[M]. 北京: 冶金工业出版社, 2004: 20-21.


