嗜酸氧化亚铁硫杆菌ATCC23270周质蛋白的
选择性提取及差异表达
夏金兰,王 晶,张 倩,张瑞永,张成桂,欧阳叙东,邱冠周
(中南大学 资源加工与生物工程学院 生物冶金教育部重点实验室,湖南 长沙,410083)
摘 要:
摘 要:通过考察萃取时间、高渗液与低渗液的摩尔比以及总的渗透液体积对细胞质苹果酸脱氢酶的比活性(相对于细胞蛋白质总量)的影响,建立选择性提取Acidithiobacillus ferrooxidans ATCC23270周质蛋白的渗透休克实验方法;结合透射电镜和双向电泳实验方法,分析渗透处理前后细胞的形态和不同生长期的细胞周质空间蛋白表达差异。研究结果表明,合适的渗透休克实验条件为:细胞质量为0.1 g(湿重),渗透液的总体积为10 mL,渗透液的作用时间为15 min, 高渗液与低渗液的摩尔比为1?1;在高渗环境下,细胞收缩,周质空间变小;在低渗液环境下,细胞周质空间膨胀,外膜被胀破,周质空间内蛋白释放出来;双向电泳显示周质蛋白总体上以小相对分子质量蛋白为主,在不同的生长时期内的周质蛋白表达存在差异。
关键词:
Acidithiobacillus ferrooxidans;周质蛋白;双向电泳;苹果酸脱氢酶活性;渗透休克法;
中图分类号:Q93 文献标识码:A 文章编号:1672-7207(2009)04-0845-06
Selective extraction and differential electrophoregrams analysis of periplasmic proteins of Acidithiobacillus ferrooxidans ATCC23270
XIA Jin-lan, WANG Jing, ZHANG Qian, ZHANG Rui-yong, ZHANG Cheng-gui,
OUYANG Xu-dong, QIU Guan-zhou
(Key Laboratory of Biometallurgy of Ministry of Education, School of Minerals Processing and Bioengineering,
Central South University, Changsha 410083, China)
Abstract:The selective extraction of periplasmic proteins by osmotic shock was investigated. The effects of the extraction efficiency and the pollution from the cytoplasmic proteins were tested and monitored, respectively, in terms of the specific activity of malate dehydrogenase (MDH). And the morphology and differential expression of the periplasmic proteins of Acidithiobacillus ferrooxidans were analyzed by using TEM and 2-D electrophoresis. The results show that the preferable schema of osmotic shock is founded as follows: the wet mass of cell is 0.1 g, the molar ratios of hypertonic saline to hypotonic saline is 1?1, the volume of the osmotic solvent is 10 mL and the extracting time is 15 min. The TEM images show that under the treatment from hypertonic to hypotonic environment, the cell outer membrane is selectively burst, which makes the periplasmic space protein released. The 2-D electrophoregrams display the most of periplasmic proteins are small molecular weight protein and cells growth in different phase present difference in periplasmic proteins expression.
Key words: Acidithiobacillus ferrooxidans; periplasmic proteins; two-dimensional electrophoresis; MDH activity; osmotic shock extraction
嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)是一种嗜酸性化能自养革兰氏阴性细菌,可以通过氧化亚铁离子与硫单质或含硫化合物获得能量生长[1]。A. ferrooxidans对能源基质的氧化利用过程十分复杂,然而,该过程主要发生在细胞周质空间 内[2]。硫氧化途径中也有很多预测蛋白如硫双加氧酶、辅酶Q氧化还原酶、硫氰酸酶、硫化氢-三价铁氧化还原酶等存在于周质空间[3-6]。由于人们对A. ferrooxidans单质硫氧化过程的研究较少,目前还不能确定氧化元素硫的蛋白作用机制。虽然已有研究者对不同能源培养A. ferrooxidans的蛋白质组学进行了一定程度的研究和分析[7-8],但是,由于全蛋白数量庞大,功能迥异,给研究者研究分析造成了很大困难。最近,有研究者从特化细胞空间入手,对细胞周质空间等局部蛋白进行双向电泳差异分析[9]。特化空间蛋白相对总蛋白数量较少,而且功能相近,从而降低了研究分析的难度。在此,本文作者对周质蛋白提取方案——渗透休克法进行优化,并对单质硫培养基中不同生长时期的A. ferrooxidans抽提周质蛋白进行双向电泳分离和谱图对比分析,以便为利用蛋白电泳差异谱分析筛选A. ferrooxidans细胞周质能量传递相关关键蛋白奠定基础。
1 材料与方法
1.1 菌株、培养基和培养条件
A. ferrooxidans ATCC 23270来源于美国模式菌种收集中心。使用9K培养基进行液体培养,对菌种进行活化和传代。培养基成分为:(NH4)2SO4,3.0 g/L; MgSO4·7H2O,0.5 g/L;KCl,0.1 g/L;K2HPO4,0.5 g/L; Ca(NO3)2,0.01 g/L;S,5 g/L。用5 mol/L的H2SO4将培养基初始pH值调整为2。细菌用预先灭菌的5 L玻璃瓶于30 ℃恒温箱中,接种量为10%,浓度为 108 个/mL,通气培养。定期用显微镜计数法血球计数板计数[10],以时间对菌数作图测定单质硫培养基中细菌生长曲线。
1.2 缓冲液与主要试剂
高渗溶液组成为:10 mmol/L的Tris(pH8.0)缓冲液,20%蔗糖,25 mmol/L EDTANa2。低渗溶液为 5 mmol/L MgCl2。苹果酸脱氢酶测定试剂盒购于南京建成生物公司。将100 mg考马斯亮蓝G-250溶于 50 mL 90%乙醇中,加入85%正磷酸100 mL,最后,加蒸馏水至1 L,于常温保存,制得考马斯亮蓝G-250蛋白测定试剂。磷酸缓冲液(PBS)的组成为:NaCl,8.0 g;KCl,0.2 g;Na2HPO4·12H2O,3.48 g;KH2PO4,0.2 g;加蒸馏水至1 L。称取1 mg牛血清蛋白,溶于1 mL蒸馏水中,制成1 mg/mL蛋白质标准液。
固相pH梯度干胶条(IPG胶条,pH值为3~10,长度为24 cm)、IPG缓冲液(pH值为3~10)为Amersham Pharmacia公司产品,蛋白质相对分子质量标准,为MBI公司产品。
双向电泳水化液由8 mol/L尿素,2 mol/L硫脲,2% CHAPS,18 mmol/L DTT,0.5 mmol/L PMSF,0.5% IPG buffer和0.002%溴酚蓝组成。
平衡缓冲液由0.05 mol/L Tris缓冲液,6 mol/L尿素,30%(体积分数)甘油和2%(质量分数)SDS组成,pH=8.8。
1.3 周质蛋白提取方法优化
1.3.1 前期处理
用定性滤纸过滤处于对数生长期的A. ferrooxidans细菌培养基,滤液经离心收集细胞沉淀;10 000 r/min时,4 ℃离心15 min收菌。菌体先用9K基础盐培养基(不含单质硫)洗3次,再用pH值为2.0的H2SO4溶液洗涤3次。平均分为若干份备用,每份待处理,细菌湿重约为0.1 g。
1.3.2 周质蛋白原始提取方案
取1份收集的菌体内加入高渗液1 mL,在室温环境缓慢摇动30 min;于低速离心(6 000 r/min)重新收集菌体后,快速加入低渗液1 mL,混匀,冰浴30 min,在4 ℃、转速为16 000 r/min离心10 min,收集上清,即得取周质蛋白溶液[11]。
1.3.3 方法优化
通过对渗透液作用时间,渗透液加入体积,以及加入高渗液与低渗液的比例的改变观察提取效率变化情况,干燥后参照Bradford法测定蛋白质浓度[12],根据浓度和体积换算出总蛋白量。
1.3.4 最佳提取方案的确定
以周质蛋白提取液中胞质蛋白污染最少为原则,根据参与三羧酸循环酶苹果酸脱氢酶的活性与提取总蛋白的量之比确定最佳提取方案。苹果酸脱氢酶(Malate dehydrogenase, MDH)是一种二聚体酶蛋白,广泛存在于真核细胞和原核细胞中,是氧化还原代谢酶中的重要成员之一,是细胞质空间的标志酶之一[13]。通过检测MDH活性可以得知细胞质蛋白污染情况,MHD活性越高,说明污染越严重。MDH不但能够催化苹果酸氧化成草酰乙酸,而且能够将草酰乙酸还 原[14]。在MDH作用下,苹果酸被氧化,生成草酰乙酸,NAD+是脱氢酶的辅酶,以NAD+作为电子受体接受氢成为NADH+H+。NADH在340 nm处有吸收峰,NAD+没有吸收峰,因此,通过检测340 nm处吸光度的变化可以测定MDH活性[15]。MDH活性检测具体操作步骤和酶活性计算方法参考南京建成生物公司出品苹果酸脱氢酶测定试剂盒说明书。
1.4 不同生长时期的A. ferrooxidans周质蛋白双向电泳图谱差异比较
利用最佳提取方案分别对单质硫培养基培养的A. ferrooxidans对数期,稳定期和衰亡期细胞提取周质蛋白,透析后冷冻干燥成粉末状,在双向电泳上样前用水化液溶解后通过Bradford法测定浓度,以每根胶条300 ?g进行等量双向电泳[16]。固相pH梯度干胶条pH值为3~10,30 V水化12 h后逐步加压到8 kV,聚焦5 h,伏特小时数约为80 000 V?h。平衡后的IPG胶水平放在12%的SDS-PAGE胶上,用0.8%低熔点琼脂糖封胶,固定IPG胶后进行第二向电泳。凝胶用考马斯亮蓝染色法染色。
2 结果与讨论
2.1 周质蛋白最佳提取方案的确定
在周质蛋白提取方案其他条件不变的前提下,仅改变渗透液的作用时间,测算总蛋白量与苹果酸脱氢酶活性。蛋白量通过Bradford法测定浓度后根据体积换算得到,苹果酸脱氢酶活性利用苹果酸脱氢酶测定试剂盒检测,结果如表1所示。从表1可见,随着作用时间的增加,周质蛋白的提取量也相应增大,但污染也越来越严重,在作用时间最少(15 min)处为苹果酸脱氢酶比活性最小值,说明此时胞质蛋白污染最少。
表1 渗透液作用时间对苹果酸脱氢酶比活性的影响
Table 1 Effects of extraction time on specific activity of MDH

当作用时间为15 min,周质蛋白提取方案其他条件不变时,改变加入高渗液与低渗液的摩尔比,测算总蛋白量与苹果酸脱氢酶活性,实验参数值及结果如表2所示。表2表明,在高渗液摩尔数不变的前提下,通过增加低渗液体积,增大低渗液摩尔数,得到的周质蛋白量相应增加,苹果酸脱氢酶比活性先减少后增加,在高渗液与低渗液的摩尔比为1?1时出现最小值,说明在该摩尔比下胞质蛋白相对污染最少,效果最好。
表2 高渗液与低渗液摩尔比对苹果酸脱氢酶比活性的影响
Table 2 Effects of molar ratios of hyper- to hypo-osmotic pressure on specific activity of MDH

在作用时间为15 min,高渗液与低渗液的摩尔比为1?1的前提下,改变加入高渗液与低渗液的总体积,考察蛋白质提取量和苹果酸脱氢酶的比活性的变化,实验参数值和结果如表3所示。表3表明,随着渗透液总体积的增加,周质蛋白的提取总量相应增大,苹果酸脱氢酶比活性先减少后增加,在总体积为10 mL处最小,说明在该条件下胞质蛋白污染相对较少,提取效果较好。
表3 渗透液体积对苹果酸脱氢酶比活性的影响
Table 3 Effects of osmotic solvent volume on specific activity of MDH

可见,较合适的参数值为:最佳作用时间为15 min,高渗液与低渗液的最佳摩尔比为1?1,渗透液的最佳总体积为10 mL。在此条件下提取出的周质蛋白质量较高,而胞质蛋白的污染程度最小。
以最佳提取方案和原始提取方案分别提取3份菌体周质蛋白,测定浓度后换算为蛋白量,并测定蛋白提取液中苹果酸脱氢酶活性,结果如表4所示。可见,改良方案提取的蛋白量相对原始方案提高近50%,MDH比活性仅增加20%左右,即细胞质蛋白污染增加20%,相对污染降低1/2以上,说明改良的方案在增加得率的前提下减少了污染,确定为A. ferrooxidans周质蛋白提取的优化方案。
表4 改良的渗透休克法与原始方案的分离效果对比
Table 4 Comparison in extraction effect between modified and unmodified osmotic shock methods

2.2 渗透休克法处理后A. ferrooxidans细胞透射电镜分析
采用透射电镜检验了A. ferrooxidans 细胞经过渗透休克法处理后细胞溶胀或收缩状况,结果如图1所示。可见,细菌在高渗和低渗的环境下的细菌个体形态各有不同,在高渗环境下,细菌内水分外流,导致细胞收缩,细胞质膜(PM)和细菌外膜(OM)之间的空隙(PS)变小,周质空间变小;在细菌经过低渗液处理一段时间之后,细胞形态发生一定变化,细胞外大量水涌入细菌细胞周质空间,导致细胞周质空间急剧膨 胀,此时周质空间内蛋白可能随之被挤出,甚至外膜被破坏。
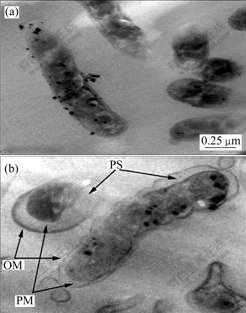
(a) 高渗液;(b) 低渗液
图1 分别在高渗和低渗环境中处理后的A. ferrooxidans细菌细胞的超薄切片透射电镜图
Fig.1 TEM images of A. ferrooxidans cells after treated by hypertonic solution and hypotonic solution
2.3 不同生长期A. ferrooxidans周质蛋白双向电泳对比分析
图2所示为生长在元素硫基质中的A. ferrooxidans生长曲线。可见,在以单质硫作为能源的9K培养基中,A. ferrooxidans在接种后25~150 h内处于对数生长期,150~300 h期间为稳定期,300 h后进入衰亡期。采用上述选择的周质蛋白提取条件,分别对对数生长期、稳定期和衰亡期的细胞周质蛋白进行了选择性提取。然后,采用双向电泳对所提取的周质蛋白进行进一步分离,得到电泳谱如图3所示。其中,标为1的圆圈内为图3(a)和3(b)中可能的相同蛋白质斑点,标为2的圆圈内为图3(b)和3(c)中可能的相同蛋白质斑点,标为3的圆圈内为图3(a),3(b)和3(c)中可能的相同蛋白质斑点,标为4的圆圈内为各自不同的特异蛋白质斑点。
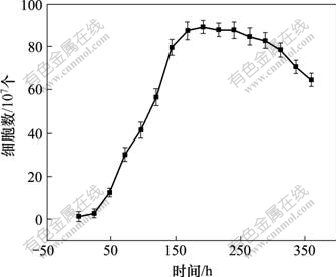
图2 S0培养基中A. ferrooxidans的生长曲线
Fig.2 Growth curve of A. ferrooxidans in elemental sulfur medium

(a) 100 h对数生长期; (b) 200 h稳定期; (c) 300 h衰亡期
图3 单质硫培养基下A. ferrooxidans不同生长期的周质蛋白双向电泳图谱
Fig.3 2D-electrophoregrams of periplasmic proteins in different growing phases of A. ferrooxidans grown in elemental sulfur media
从图3可知,在单质硫培养基中,A. ferrooxidans周质蛋白的特征为:
a. 以小相对分子质量蛋白为主,这可能与周质空间蛋白多为参与氧化还原的电子转移体有关,小相对分子质量蛋白可能更有利于调控,表达迅速;
b. 多为碱性蛋白[11],这可能与周质空间为酸性环境有关,碱性蛋白在酸性环境下远离等电点,更有利于稳定存在;
c. 对数期周质蛋白(图3(a))的相对分子质量明显更为偏小,显著斑点多位于碱性端,斑点明显清晰;
d. 与对数期相比,稳定期的周质蛋白(图3(b))总体依然以碱性蛋白为主,蛋白斑点也较清晰,其中有部分相似蛋白斑点,但稳定期中一些大相对分子质量蛋白表达增加(图3(b)中圆圈2所示),同时某些在对数期表达的蛋白(如图3(a)中的圆圈4)在稳定期中未见表达;
e. 与对数期和稳定期相比,衰亡期周质蛋白部分斑点与稳定期相似(图3(c)中圆圈2所示),但斑点数量明显增加(图3(c)),且多为酸性蛋白(图3(c)中圆圈4所示),说明可能已经有部分细胞已经衰亡溶解造成细胞质蛋白污染,通过检验样品中的苹果酸脱氢酶活性,发现酶活性加大(结果未给出),也证明了这点;
f. 3个不同时期只发现一组蛋白斑点始终存在(如图3中圆圈3所示),可能为某组成性蛋白,且位于酸性端。
3 结 论
a. A. ferrooxidans ATCC23270周质蛋白提取的合适方案为:对于0.1 g(湿重)细胞,以10 mL高渗液作用15 min后离心去上清,再以10mL低渗液悬浮菌体细胞15min后,离心取上清得到周质蛋白。
b. 周质蛋白总体上以小相对分子质量蛋白为主。
c. 对数期与稳定期多为碱性蛋白。
d. 对数期周质蛋白的分子量普遍偏小,显著斑点多位于碱性端,斑点明显清晰。
e. 稳定期的周质蛋白斑点也较清晰,其中有部分蛋白斑点与对数期相似,但稳定期中一些大相对分子质量蛋白表达增加,同时,某些在对数期表达的蛋白在稳定期中未见表达。
f. 衰亡期周质蛋白部分斑点与稳定期相似,斑点明显增加,且多为酸性蛋白。
g. 3个不同时期只发现一组蛋白斑点始终存在,可能为某组成性蛋白,且位于酸性端。这些结果为进一步研究周质空间内功能性蛋白奠定了基础。
参考文献:
[1] 杨 宇, 张燕飞, 黄菊芳, 等. 嗜酸氧化亚铁硫杆菌的保藏方法[J]. 中南大学学报: 自然科学版, 2006, 37(3): 472-475.
YANG Yu, ZHANG Yan-fei , HUANG Ju-fang, et al. Preservation of Acidithiobacillus ferrooxidans[J]. Journal of Central South University: Science and Technology, 2006, 37(3): 472-475.
[2] Rawlings D E. Characteristics and adaptability of iron- and sulfur- oxidizing microorganisms used for the recovery of metals from minerals and their concentrates[J]. Microbial Cell Factories, 2005, 4: 1-13.
[3] Rohwerder T, Wolfgang S. The sulfane sulfur of persulfides is the actual substrate of the sulfur-oxidizing enzymes from Acidithiobacillus and Acidiphilium spp.[J]. Microbiology, 2003, 149(7): 699-710.
[4] Prange A, Engelhardt H, Trüper G, et al. The role of the sulfur globule proteins of Allochromatium vinosum: mutagenesis of the sulfur globule protein genes and expression studies by real time RT-PCR[J]. Arch Microbiol, 2004, 182(2): 165-174.
[5] Sugio T, Katagiri T, Inagaki K, et al. Actual substrate for elemental sulfur oxidation by sulfur: ferric ion oxidoreductase purified from Thiobacillus ferrooxidans[J]. Biochim Biophys Acta, 1989, 973: 250-256.
[6] 张成桂, 夏金兰, 王 晶, 等. 嗜酸硫氧化细菌硫氧化系统研究进展[J]. 生物技术通报, 2007, 13(1): 59-65.
ZHANG Cheng-gui, XIA Jin-lan, WANG Jing, et al. A model of sulfur oxidation system of Acidithiobacillus spp[J]. Biotechnology Information, 2007, 13(1): 59-65.
[7] HE Zhi-guo, HU Yue-hua, ZHONG Hui, et al. Preliminary proteomic analysis of Thiobacillus ferrooxidans growing on elemental sulphur and Fe2+ separately[J]. Journal of Biochemistry and Molecular Biology, 2005, 38(3): 307-313.
[8] Ramirez P, Guiliani N, Valenzuela L, et al. Differential protein expression during growth of Acidithiobacillus ferrooxidans on ferrous iron, sulfur compounds, or metal sulfides[J]. Applied and Environmental Microbiology, 2004, 70(8): 4491-4498.
[9] Chi A, Valenzuela L, Beard S, et al. Periplasmic proteins of the extremophile Acidithiobacillus ferrooxidans: A high throughput proteomic analysis[J]. Mol Cell Proteomics, 2007, 6(12): 2239-225.
[10] 龚 平, 孙铁珩, 李培军. 重金属对土壤微生物的生态效应[J]. 应用生态学报, 1997, 8(2): 218-224.
GONG Ping, SUN Tie-heng, LI Pei-jun. Ecological effect of heavy metals on soil microbes[J]. Chinese Journal of Applied Ecology, 1997, 8(2): 218-224.
[11] Nossal N G, Heppel L A. The release of enzymes by osmotic shock from Escherichia coli in exponential phase[J]. Journal of Biological Chemistry, 1966, 241(13): 3055-3062.
[12] Bradford M. A rapid and sensitive for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(5): 248-254.
[13] 吉尔鲍特 G. 酶法分析手册[M]. 上海: 上海科学技术出版社, 1983.
Gilberte G. Enzyme analysis manual[M]. Shanghai: Shanghai scientific and Technical Press, 1983.
[14] 江 滟, 王 和. 沙门菌CWDMs苹果酸脱氢酶的检测[J]. 中国微生态学杂志, 2001, 13(4): 216-217.
JIANG Yan, WANG He. Determination of MDHs of the CWDMs of Salmonella Spp[J]. Chinese Journal of Microecology, 2001,13(4): 216-217.
[15] 陈亚红, 刘志洪, 蔡汝秀, 等. 细胞内NAD(P)H水平分析技术的研究进展[J]. 化学进展, 2004, 16(6): 962-968.
CHEN Ya-hong, LIU Zhi-hong, CAI Ru-xiu, et al. Determination of the Intracellular NAD(P)H Level[J]. Progress in Chemistry, 2004, 16(6): 962-968.
[16] Angelika G, Walter W, Michael D. Current two-dimensional electrophoresis technology for proteomics[J]. Proteomics, 2004, 4(12): 3665-3685 .
收稿日期:2008-10-05;修回日期:2008-12-25
基金项目:国家自然科学基金资助项目(50674101);“973”计划项目(2004CB619201);国家自然基金创新研究群体科学基金资助项目(50621063)
通信作者:夏金兰(1964-),男,湖南攸县人,博士,教授,从事微生物学和生物工程研究;电话:0731-88836944;E-mail: jlxia@mail.csu.edu.cn
[1] 杨 宇, 张燕飞, 黄菊芳, 等. 嗜酸氧化亚铁硫杆菌的保藏方法[J]. 中南大学学报: 自然科学版, 2006, 37(3): 472-475.
[6] 张成桂, 夏金兰, 王 晶, 等. 嗜酸硫氧化细菌硫氧化系统研究进展[J]. 生物技术通报, 2007, 13(1): 59-65.
[J]. Applied and Environmental Microbiology, 2004, 70(8): 4491-4498.
[10] 龚 平, 孙铁珩, 李培军. 重金属对土壤微生物的生态效应[J]. 应用生态学报, 1997, 8(2): 218-224.
[13] 吉尔鲍特 G. 酶法分析手册[M]. 上海: 上海科学技术出版社, 1983.
[14] 江 滟, 王 和. 沙门菌CWDMs苹果酸脱氢酶的检测[J]. 中国微生态学杂志, 2001, 13(4): 216-217.


