文章编号:1004-0609(2010)04-0749-07
改性后不同孔隙度多孔钛对成骨细胞的影响
陈良建1,2,张思慧1,李益民2,崔晓明1,郑 遥1,李 挺2
(1. 中南大学 湘雅三医院,长沙 410013;
2. 中南大学 粉末冶金国家重点实验室,长沙 410083)
摘 要:
关键词:
生物材料;医用钛合金;多孔钛;孔隙度;黏附;增殖;碱性磷酸酶;
中图分类号:R783.1 文献标志码:A
Effect of porosity of modified porous titanium on osteoblastic cells
CHEN Liang-jian1, 2, ZHANG Si-hui1, LI Yi-min2, CUI Xiao-ming1, ZHENG Yao1, LI Ting2
(1. Third Xiangya Hospital, Central South University, Changsha 410013, China;
2. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Abstract: The metal injection molding (MIM) method was used to fabricate porous Ti implants, the surface modification of the porous titanium was performed using alkali-heat treatment and biomimetic hydroxyapatite (HA) deposition. The influence of modified porous titanium on the cell toxicity, adhesion, proliferation and differentiation of the osteoblast cells were investigated. The results show that the modified porous titanium is nontoxic to cells. The morphologies of the cells vary with change of porosity of porous titanium. After cultured 7 d, MG63 is flat on the surface of 5% porosity titanium implant and extends to amphi-edge of the pore on the surface of 30% porosity titanium implant. The titanium implant with porosity of 60% can be clearly noticed that the pseudopodias adhere deeply to the hole wall and form the cell bridges, and the cells can grow into the pores. The number of the cell proliferation in high porosity groups is higher than that in low group. The alkaline phosphatase(ALP)content is influenced by the porosity of porous titanium, there is no significant difference between 5% and 30% porosity group (p<0.05), the ALP content of 60% porosity group is higher than that of low porosity group.
Key words: biomaterial; medical titanium alloy; porous titanium; porosity; adhesion; proliferation; alkaline phosphatase
钛及钛合金以其优良的生物相容性与适宜的力学性能已成为植入体的首选。但致密钛存在生物活性差、弹性模量与骨质不匹配等缺点。具有合适的多孔结构和力学性能的植入体能实现与周围骨质相匹配的力学性能,为骨组织长入植入体提供结构条件[1-3]。新生骨质能否长入多孔结构,实现生物固定,受多孔材料的孔隙度、孔径大小及分布和连通孔结构等结构因素和材料表面粗糙程度、化学组成、表面的亲水性、表面能的高低和适合的表面电荷等因素的影响[4]。适合成骨细胞生长的最佳孔隙度目前尚无确定参数,有待于进一步研究。钛的生物活性差,需通过表面改性的方法提高钛植入体的表面生物活性。羟基磷灰石(Hydroxyapatite,HA)的组成接近于生物体的骨组织的无机成分,具有非常好的生物相容性,体外实验HA表明可促进成骨细胞的黏附和增殖[5]。
本文作者采用注射成形技术制备不同孔隙度的多孔钛,采用酸碱热处理和仿生沉积HA对多孔钛进行表面改性,研究改性后不同孔隙度的多孔钛的细胞学相容性,多孔钛的孔隙度对成骨细胞黏附、增殖及分化等功能的影响,为制备仿生型钛植入体提供理论依据。
1 实验
粉末原料由HDH Ti(<77 μm)、TiH2(<65 μm)、NaCl(<290 μm)组成,均呈不规则形状。将原料粉末混合均匀后与自制的蜡基粘结剂混合制粒,粘结剂的主要成分为石蜡、高密度聚乙烯和聚乙醇等,粉末装载量为55%。采用MIM工艺制备生坯,经脱脂脱盐,在真空度为10-3Pa 经1 100 ℃烧结,制备不同孔隙度的多孔钛,试样为d 8 mm×3 mm 的圆片,孔隙度分别为5、30和60,孔径范围为5~300 μm。试样用丙酮、无水乙醇和去离子水超声波清洗,干燥备用。
将清洗干燥后的多孔钛置于5 mol/L NaOH溶液中,在80 ℃水浴摇床中处理48 h后取出,用去离子水反复清洗后干燥。碱处理后试样置于热处理炉中,以升温速度5 ℃/min升温至600 ℃,保温1 h,随炉冷却。将碱热处理后的多孔钛浸泡在模拟体液(Simulated body fluid,SBF)中,参照Kokubo’s SBF[6] 配置SBF液。此SBF液的化学组成见表1。表中为1 L模拟体液中的试剂含量,并以1 mol/L HCl调节pH值至7.25。3 d换液一次,21 d后取出,用去离子水超声波清洗后干燥,高温高压消毒备用。
将改性后的多孔钛样品按5 mL/g的比例浸泡于含10%小牛血清的RPMI1640培养基中,在培养箱中浸提72 h,收集浸提液于4 ℃保存。将L929细胞按
表1 SBF液的化学组成
Table 1 Composition of SBF solution
每孔3 000个细胞接种于96孔细胞培养板上,在5%CO2、饱和湿度、37℃恒温培养箱内培养1 d,使其完全贴壁。材料组取100%、50%、10% 3个浓度的浸提液,每组设8个平行孔。材料组换等量材料浸提液,阴性对照组换含10%小牛血清的新鲜RPMI1640培养基,阳性对照组换0.064%苯酚溶液,继续培养3 d,加入MTT溶液继续孵育4 h,弃上清,加入DMSO,振荡,490 nm酶联免疫检测仪测定吸光度值。
1.4.1 改性后多孔钛对MG63细胞增殖影响
以0.25%胰酶消化MG63,以10%小牛血清的DMEM调整至浓度为1.5×104个/mL的悬浮液,用加样器取2 mL细胞悬液分别接种于放有孔隙度为5%、30%和60% 3组多孔钛的24孔培养板内,每样本设3个复孔,在5%CO2、饱和湿度和37℃恒温培养箱内培养,在培养第3和7 d后,采用双盲法在倒置显微镜下计数板计数。
以0.25%胰酶消化MG63,以10%小牛血清的DMEM调整至浓度为1.5×104 mL-1的悬液,采用加样器取2 mL细胞悬液分别接种于放有3组多孔钛的24孔培养板内,每样本设3复孔,培养8 d后吸去培养液,加4 ℃预冷的2.5%戊二醛固定,在4 ℃保存。酒精梯度脱水,临界点干燥,喷金,扫描电镜(JSM- 6360LV)下观察成骨细胞在不同孔隙度多孔钛植入体表面的黏附形态。
1.4.3 碱性磷酸酶(Alkaline phosphatase,ALP)的检测
以0.25%胰酶消化MG63,以10%小牛血清的DMEM调整至浓度为1.5×104 mL-1的悬浮液,用加样器取2 mL细胞悬液分别接种于放有3组多孔钛种植的24孔培养板内,每样本设3个复孔,收集培养8 d和15 d各孔的上清液,按ALP测定试剂盒说明书(南京建成生物工程工程所第一分所)进行操作,用酶联免疫仪测定各孔吸光度值即OD值,参照标准曲线,计算ALP的含量。
选用SpSS11.0统计软件包,数据用平均值![]()
![]() 标准差(s)表示(
标准差(s)表示(![]() ±s),采用单因素方差分析,p<0.05时,差异有显著性。
±s),采用单因素方差分析,p<0.05时,差异有显著性。
2 结果与分析
图1所示为不同孔隙度多孔钛的SEM像。从图1中可看出,5%孔隙度组的试样表面几乎看不到孔隙结构(见图1(a));30%孔隙度组试样表面粗糙,多为微细孔隙(见图1(b)),孔径主要分布在5~25 μm;60%孔隙度组试样孔隙呈连通孔结构,形成蜂窝状,孔径主要分布在50~300 μm(见图1(c))。

图1 不同孔隙度多孔钛的SEM像
Fig.1 SEM images of porous titanium with different porosities: (a) 5% group; (b) 30% group; (c) 60% group
图2所示为碱热处理后60 ℃孔隙度多孔钛的表面形貌及XRD谱。从图2(a)可看出,试样表面及孔隙内均形成了一层多孔网状物,经X射线分析为钛酸钠。图3所示为碱处理多孔钛在SBF中处理21 d后的SEM像和EDS像。从图3碱热处理后的多孔钛在SBF液中浸泡21 d后SEM和EDS结果可看出,多孔钛表面及孔隙内均有成簇的颗粒形成,颗粒大小不一,能谱分析表明这是磷灰石颗粒。

图2 碱热处理后60%孔隙度多孔钛的表面形貌及XRD谱
Fig.2 Surface morphology (a) and XRD pattern (b) of alkali-heat-treated porous titanium with 60% porosity
图4所示为L929与多孔钛浸提培养3 d的形貌。从图4中可看出,3个浓度材料浸提液组和阴性对照组的细胞均覆盖整个底壁,细胞之间紧密相连,呈多边形,阳性对照组已无完整细胞,只能看到细胞裂解后的碎片。表2所列为碱热处理后多孔钛对L929毒性结果,L929细胞与100%、50%、10% 3个浓度材料组、阴性对照组和阳性对照组,培养3 d后,采用MTT法,利用490nm酶联免疫检测仪测定吸光度值。根据MTT法测定的OD值计算相对增殖率(R) ,细胞相对增殖率R=De/Dn×100%(De为试验组的OD值;Dn为阴性对照组的OD值)。按R值进行细胞毒性分级(CTS)。由表2 可看出,3种浓度改性后多孔钛浸提液的R值与阳性对照组比较差异均较显著(p<0.05),CTS分级均为0级,提示改性后的多孔钛无细胞毒性,符合《医疗器械生物学评价国家标准GB/T 16886.1—2001》中对材料细胞毒性的要求。
表2 碱热处理后多孔钛对L929毒性结果
Table 2 Results of cytotoxicity test of alkali-treated porous titanium with L929
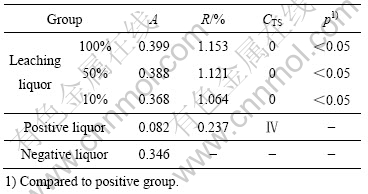
图3 在SBF中处理21 d后碱热处理多孔钛的SEM像和EDS谱
Fig.3 SEM image and EDS spectrum of alkali-heat-treated porous titanium after treated in SBF for 21 d
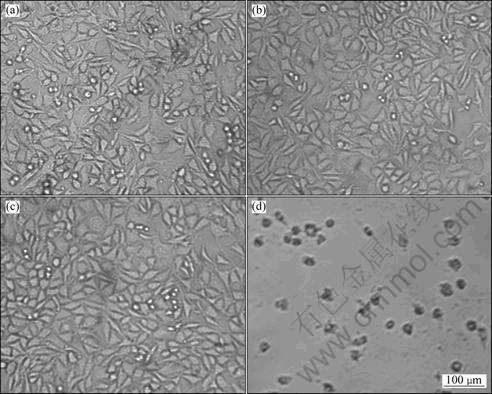
图4 L929与多孔钛浸提液培养3 d的形貌
Fig.4 Morphologies of L929 cells cultured with leaching liquor of alkali-treated porous titanium for 3 d: (a) 100%; (b) 10%; (c) Negative liquor; (d) Positive liquor
图5所示为改性4 d和7 d后多孔钛与MG63细胞增殖的比较。从图5可看出,增加样品与MG63细胞共培养时间,各样品中的MG63细胞数量也增加;在相同培养时间内,5%组与30%组细胞计数相当,60%孔隙度组高于5%组与30%组的。可能的原因是60%孔隙度组样品中大孔径孔隙的数量高于其余2组的,且具有连通孔结构,这为细胞的黏附增殖提供足够的空间,有利于营养成分在孔隙间的交换,为细胞向孔内的定向生长提供结构条件。ST-PIERRE等[7]研究发现,多孔支架材料的平均孔径大小影响MG63的增殖,大孔径孔隙有利于细胞增值,这与本研究的结果相一致。改性后多孔钛表面沉积的HA也具有诱导成骨细胞黏附增殖的作用。上述结果提示高孔隙度、大孔径且具有连通孔结构的多孔钛有利于成骨细胞MG63的增殖。
图5 改性4 d与7 d后多孔钛和MG63细胞增殖的比较
Fig.5 Comparison of cell proliferation of MG63 and modified porous titanium after modified for 4 and 7 d
图6所示为不同孔隙度多孔钛表面微结构与MG63复合培养8 d的表面形貌。从图6可看出,多孔钛的表面微结构形貌与孔径大小影响MG63细胞的黏附形貌和迁移的方向。在不同孔隙度的多孔钛样品表面,MG63细胞呈现出不同的黏附形貌,在5%与30%孔隙度组的样品表面,MG63细胞呈长梭形或圆球形,伸展不充分,伪足较少(见图6(a)和(b));而在60%孔隙度组样品表面,MG63细胞完全伸展,呈不规则多边形,伪足多,可见细胞以多个细长的伪足牢固附着于孔壁,形成细胞桥(见图6(c)和(d));样品表层孔隙孔径的大小影响MG63细胞的迁移的方向, MG63细胞的孔径约为30 μm,小于细胞的孔隙表面,可见细胞可伸展跨越整个孔固定在孔两端,从而形成桥状结构,忽略表面的多孔形态(见图6(c)和(d));孔径与细胞相当孔隙表面,可见细胞伸展多个伪足,将细胞悬吊在孔隙口,形成吊床样结构(见图6(c)和(d));孔径大于细胞的孔隙内表面,可见MG63细胞黏附在孔隙的底部与侧壁,平铺生长,或附着孔隙边缘,形成向孔隙内迁移的趋势(见图6(e))。
从上述结果可看出,多孔钛的孔隙度和孔径的大小影响MG63细胞的黏附形貌和迁移的趋势。改性后的60%孔隙度多孔钛表面黏附MG63细胞的形貌和伸展度优于5%与30% 孔隙度组的,其原因可能是细胞黏附与材料表面形貌和粗糙度、表面化学组成、亲水性、表面能和表面电荷等密切相关。一般认为,粗糙的表面结构、良好的表面化学组成与亲水性、表面能高和适合的表面电荷有利于成骨细胞的黏附。高孔隙度材料的表面积高于低孔隙度材料的,表面积与表面张力的乘积为表面能,孔隙度高的多孔钛表面能高于低孔隙度的多孔钛。SERGO等[8]研究发现,高表面能的表面对成骨细胞的吸附具有积极作用;孔隙度高的多孔钛能形成连通孔结构,这为细胞向多孔钛内部的迁移和生长提供空间和途径,有利于营养物质在孔隙间运送和交换、细胞外基质沉积、氧气进入及代谢产物排出,而材料表面沉积的细胞外基质在以蛋白质为介导的细胞黏附机制中发挥决定性的作用[9];孔隙度高的材料具有更好的锁水作用,细胞在亲水性表面的黏附、增殖比在疏水性表面的好[10];碱热处理多孔钛可在孔隙表面形成不规则钛酸凝胶微孔层,凝胶层水化后富含羟基(—OH),可提高表面的亲水性,有利于蛋白质吸附、细胞黏附和磷灰石的形成[7];仿生沉积HA,多孔钛的表面化学改变,沉积大量的Ca和P,能提供带正电荷的活性位点,有利于胞外基质中的纤维粘连蛋白(Fibronectin, Fn)和玻璃粘连蛋白(Vitronectin, Vn)吸附,Fn和Vn是影响细胞黏附的重要蛋白质,能促进成骨细胞的黏附[11] 。改性后高孔隙度的多孔钛表面特性比低孔隙度的多孔钛更有利于成骨细胞的黏附。
多孔钛表面孔隙孔径的大小影响MG63细胞向孔隙内迁移的趋势, MG63细胞大小约为30 μm,孔径小于MG63细胞的孔隙,细胞可直接伸展跨越孔隙并固定在孔隙的两端,形成细胞桥结构,忽略表面的多孔形貌;孔径与MG63细胞相当的孔隙,细胞以多个伪足伸展跨越孔固定在孔隙边缘,形成吊床样结构;孔径大于MG63细胞的孔隙,MG63细胞可平铺在孔隙底部和侧壁生长,或附着在孔隙边缘,形成向孔隙内迁移的趋势。该结果与ZINGER等[12]研究发现成骨良好的细胞形态可促进成骨细胞分化[14]。
图6 不同孔隙度多孔钛与MG63复合培养8 d后的表面形貌
Fig.6 Surface morphologies of MG63 cells cultured for 8 d on porous titanium with different porosities: (a) 5% group; (b) 30% group; (c), (d), (e) 60% group
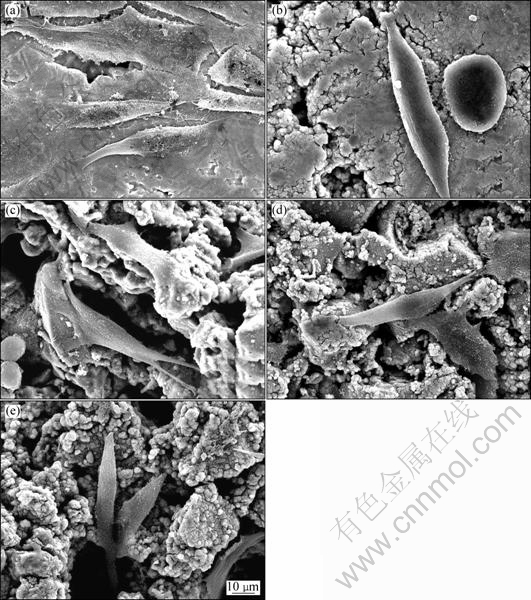
细胞只能迁移并定居到与本身大小相当或大于本身的孔洞的结果相一致。作为多孔植入材料,多孔结构的孔隙必需提供有利于细胞迁移、增殖和分化的空间,为形成骨基质及矿化创造条件,以及提供细胞进行新陈代谢所需的营养物质和氧分,代谢产物的排出需要毛细血管的长入孔隙来实现,毛细血管的大小为10~15 μm。本研究据上述结果推断,多孔钛孔隙的孔径尺寸应大于40 μm,即一个成骨细胞30 μm和一个毛细血管10~15 μm所需空间,连通孔的尺寸应大于15 μm,允许毛细血管长入,而有利于骨质长入的最佳孔径尺寸有待于体内植入试验来评价。
ALP是成骨细胞早期分化的指标。目前大多研究结果显示,随着表面粗糙度的增加,ALP含量也随之增高,粗糙表面促进成骨细胞向成熟状态分化[13]。
图7所示为改性后不同孔隙度多孔钛与MG63细胞复合培养7 d和14 d后ALP含量检测结果。从图7可看出,培养7 d后,5%孔隙度组与30%孔隙度组ALP含量差异无显著性(p>0.05),60%孔隙度组与5%和30%孔隙度组间差异有显著(p<0.05);培养14 d后,60%孔隙度组的ALP含量明显高于其他组的(p<0.05),这表明60%孔隙度组的MG63细胞进入ALP分化阶段的细胞数量明显多于其他组的。其原因可能是由于60%孔隙度多孔钛建立细胞黏附的比较好微环境,可诱导成骨细胞快速地聚集和分化,黏附增殖细胞越多,分泌的ALP量越大 ;60%孔隙度组细胞黏附形貌优于其它两组细胞形态的改变同样可促进细胞分化,
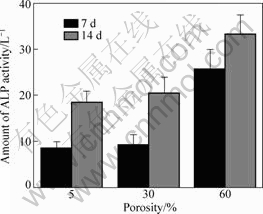
图7 改性后不同孔隙度多孔钛与MG63细胞复合培养7 d与14 d后碱性磷酸酶活性
Fig.7 Alkaline phosphatase activity of MG63 cells and modified porous titanium after cultured 7 d and 14 d
3 结论
1) 碱热处理可在多孔钛表面及孔隙表面形成一层多孔网状钛酸钠凝胶,通过模拟体液进行仿生沉积,能在多孔钛表面及孔隙内能形成成簇磷灰石;体外细胞培养(MTT法)证实碱热处理与仿生沉积的多孔钛无细胞毒性。
2) 孔隙度与孔径影响MG63细胞的黏附形貌、迁移趋势、增殖和分化功能。低孔隙度(低于30%)的多孔钛黏附细胞呈长梭形或圆球形,伪足扁平,伸展不充分;高孔隙度(高于40%)的多孔钛黏附细胞完全伸展,伪足多;MG63细胞(30μm)直接跨越孔径小于本身大小的孔隙;与细胞大小相当的孔隙,细胞以多个伪足伸展跨越孔固定在孔隙边缘,形成吊床样结构;孔径大于MG63细胞的孔隙,细胞可平铺在孔隙底部和侧壁生长,或附着在孔隙边缘,形成向孔隙内迁移的趋势。
3) 在同一培养时间内,60%孔隙度的多孔钛细胞增殖数、培养液中碱性磷酸酶的含量均高于低孔隙度组的。
REFERENCES
[1] MACDONALD D E, RAPUANO B E, DEO N, STRANICK M, SOMASUNDARAN P, BOSKEY A L. Thermal and chemical modification of titanium-alumium-vanadium implant materials effects on surface properties, glycoprotein adsorption, and MG63 cell attachment[J]. Biomaterials, 2004, 25(16): 3135-3146.
[2] GARRETT R, ABHAY P, DIMITRIOS P A. Fabrication methods of porous metals for use in orthopaedic applications[J]. Biomaterials, 2006, 27(13): 2651-2670.
[3] HOLY C E, FIALKOV J A, DAVIES J E, SHOICHET M S. Use of a biomimetic strategy to engineer bone[J]. J Biomed Mater Res A, 2003, 65(4): 447-453.
[4] ITALA A I, YLANEN H O, EKHOLM C, KARLSSON K H, ARO H T. Pore diameter of more than 100 micron is not requisite for bone ingrowth in rabbits[J]. J Biomed Mater Res, 2001, 58(6): 679-683.
[5] MAITZ M F, POON R W, LIU X Y, PHAM M T, CHU P K. Bioactivity of titanium following sodium plasma immersion implantation and deposition[J]. Biomaterials, 2005, 26(27): 5465-5473.
[6] KOKUBO T, KUSHITANI H, SAKKA S, KITSUGI T, YAMAMURO T. Solutions able to reproduce in vivo surface-structure changes in bioactive glass-ceramics A-W3[J]. Journal of Biomedical Materials Research, 1990, 24(6): 721-734.
[7] ST-PIERRE J P, GAUTHIER M, LEFEBVRE L P, TABRIZIAN M. Three-dimensional growth of differentiating MC3T3-E1 pre-osteoblasts on porous titanium scaffolds[J]. Biomaterials, 2005, 26(35): 7319-7328.
[8] SERGO V, SBAIZERO O, DAVID R C. Mechnical and chemical consequences of the residual stresses in plasma sprayed hydroxyaptite coatings[J]. Biomaterials, 1997, 18(6): 477-484.
[9] OTSUKIA B, TAKEMOTO M, FUJIBAYASHI S, NEO M, KOKUBO T, NAKAMUR T. Pore throat size and connectivity determine bone and tissue ingrowth into porous implants: Three-dimensional micro-CT based structural analyses of porous bioactive titanium implants[J]. Biomaterials, 2006, 27(35): 5892-5900.
[10] ALTANKOV G, GROTH T. Reorganization of substratum-bound fibronectin on hydrophilic and hydrophobic materials is related to biocompatibility[J]. J Mater Med, 1994, 5(9/10): 732-737.
[11] FENG B, CHEN JY, QI S K, HE L, ZHAO J Z, ZHANG X D. Carbonate apatite coating on titanium induced rapidly by precalcification[J]. Biomaterials, 2002, 23(1):173-179.
[12] ZINGER O, ANSELME K, DENZER A, HABERSETZER P, WIELAND M, JEANFILS J, HARDOUIN P, LANDOLT D. Time-dependent morphology and adhesion of osteoblastic cells on titanium model surfaces featuring scale-resolved topography[J]. Biomaterials, 2004, 25(14): 2695-2711.
[13] KIM H M, MIYAJI F, KOKUBO T, NAKAMURA T. Preparation of bioactive Ti and its alloys via simple chemical surface treatment[J]. Journal of Biomedical Materials Research, 1996, 32(3): 409-417.
[14] LIM J Y, TAYBOR A F, LI Z Y, VOGLER E A, DONAHUE H J. Integrin expression and osteopontin regulation in human fetal osteoblastic cells mediated by substratum surface characteristics[J]. Tissue Eng, 2005, 11(1/2): 19-29.
(编辑 李艳红)
基金项目:国家高技术研究发展计划新材料技术领域专项资助项目(2007AA03Z114);国家自然科学基金资助项目(35770576);湖南省自然科学基金资助项目(2007JJ5109)
收稿日期:2009-09-01;修订日期:2010-01-20
通信作者:陈良建,副教授,博士;电话:0731-8618554;E-mail:chen0313@xy3yy.com


