砷黄铁矿在酸性体系下的电化学氧化
李 骞, 杨永斌, 姜 涛, 邱冠周
(中南大学 资源加工与生物工程学院, 长沙 410083)
摘 要:
在酸性体系下研究砷黄铁矿的电化学氧化。 结果表明: 砷黄铁矿首先被氧化为As2S2, 覆盖于电极表面, 使电极表面发生钝化; 随着电位的继续升高, As2S2被氧化生成亚砷酸, 随后亚砷酸被氧化为砷酸, 亚铁离子被氧化成铁离子。 不同pH和温度下的腐蚀动力学研究表明, 随着pH值的增大, 体系的腐蚀电位正移, 腐蚀电流密度减小; 随着温度的升高, 砷黄铁矿的腐蚀电位负移, 腐蚀电流密度增大。 说明在研究的pH及温度范围内, 降低体系的pH或提高温度都有利于砷黄铁矿的氧化。 交流阻抗研究结果表明, 不同电位下电极表面发生的电化学反应机理不同, 测定结果与线性扫描的研究结果相吻合。
关键词: 砷黄铁矿; 电化学; 酸性介质 中图分类号: TF111.31
文献标识码: A
Electrochemical oxidation of arsenopyrite in acidic media
LI Qian, YANG Yong-bin, JIANG Tao, QIU Guan-zhou
(School of Resources Processing and Bioengineering, Central South University,Changsha 410083)
Abstract: The electrochemical research of arsenopyrite in acidic solution shows that arsenopyrite is firstly decomposed to As2S2, which coveres on the electrode and the dissolution of arsenopyrite is hence retarded. Then the As2S2 is oxidized to H3AsO3, H3AsO3 to H3AsO4, and Fe2+ is oxidized to Fe3+ with the increase of potential. The results attained at different pH and temperature show that the corrosion potential is positively shifted and the corrosion current density decreases with the increase of pH. While temperature increasing, the corrosion potential is negatively shifted and the corrosion current density increases. The results show that reducing the pH or raising the temperature of the system are advantageous to the oxidation of arsenopyrite. AC impedance measurements show that under different potentials, the mechanism of the arsenopyrite is different, which confirms satisfactorily the result obtained in linear polarization.
Key words: arsenopyrite; electrochemistry; acidic media
含砷金矿是典型的难处理金矿, 砷黄铁矿是其最重要的载金矿物。 在过去的几十年中, 从含砷难处理金矿中提取金的研究比较多, 研究发现无论在含砷金矿直接浸出过程中还是在预氧化过程中电化学反应都起着重要作用[1-3]。 因而近年来, 大量的研究工作主要集中在对砷黄铁矿的电化学氧化方面。 Beattie和Poline [4]使用循环伏安法对砷黄铁矿的氧化行为作了研究。 他们认为, 在pH>7的碱性溶液中, 砷黄铁矿的氧化由于受到沉积在电极表面的Fe(OH)3沉淀影响而减慢。 当pH值降低时, 氧化反应受到覆盖在电极表面的硫的影响。 而当提高温度时, 会产生厚而多孔的氢氧化膜。 Sanchez和Hiskey[5]也应用循环伏安法进行了研究, 认为砷黄铁矿在碱性溶液中的氧化反应分为两步。 首先砷黄铁矿被氧化为亚砷酸、 Fe(OH)3和单质硫, 然后亚砷酸继续被氧化为砷酸, 单质硫被氧化成硫酸。 同时, 他们还发现氧化反应在pH为8或更高的氰化溶液中, 砷黄铁矿对pH和氰化物都非常敏感。 Sanchez等[4]研究发现, 砷黄铁矿能在pH为1~10的范围内发生分解, 在pH为1.0的酸性溶液中, 约在0.5V(相对氢标电极而言)处生成硫覆盖在砷黄铁矿的表面。 Zheng和Isabel等[6-7]也研究发现砷黄铁矿在酸性介质中的溶解由于产生中间产物硫覆盖于表面, 阻碍了砷黄铁矿的进一步溶解。
生物氧化法在处理难处理金矿时具有金回收率高、 成本低、 无环境污染等优点, 因而具有巨大的经济潜力和工业应用前景[8-10]。 通常, 生物氧化是应用嗜酸性细菌如氧化亚铁硫杆菌, 所以一般都是在酸性培养基下进行试验研究[11-12]。 然而在酸性体系下对砷黄铁矿的电化学氧化行为的研究报道比较少, 而对碱性条件下砷黄铁矿的电化学氧化的研究较多[13-14]。
本文作者利用线性扫描、 交流阻抗等电化学手段研究了砷黄铁矿在酸性溶液中的氧化行为, 并对其氧化机理进行了探讨。
1 实验
1.1 电解池及电极
电解池为三电极系统, 以铂片电极做辅助电极, Ag/AgCl做参比电极, 但本研究中所有电位数据都已校正为相对于标准氢电极(SHE)。 工作电极在溶液中浸泡一定的时间达到平衡后进行测量; 每次测量, 均用不同型号的砂纸逐级打磨, 最后用600#砂纸打磨成镜面, 然后依次用甲醇、 5mol/L盐酸和二次蒸馏水清洗, 以更新工作面。 实验仪器为EG&G PAR公司的电化学测量系统(Potentiostat /Galvanostat Model 273A)。
按质量比80∶10∶10分别称取砷黄铁矿粉(化学成分为As46.0%、 Fe34.36%、 S19.64%, 粒度小于0.074mm以下达100%)、 分析纯固体石蜡和光谱纯石墨粉, 使石墨粉和矿粉充分混合均匀; 把固体石蜡置于烧杯中加热熔化后, 迅速加入已混合均匀的石墨粉和矿粉, 快速搅拌均匀后立即压入制样模型中, 马上用压片机压片, 在静压4.5×106Pa保持5min。 取出后, 打磨成直径为15mm、 厚度为3mm的圆柱体, 放入特制的可旋转的“塑料王”圆柱型电极套中, 粘接, 制成碳糊电极(CPE: Carbon Paste Electrode)。 电化学测试时工作电极的有效面积约1cm2。
1.2 溶液
实验用的电解液与生物生长的培养基相似, 其组成为(NH4)2SO4 3.0g/L、 KCl 0.1g/L、 K2HPO4 0.05g/L、 MgSO4·7H2O 0. 5g/L、 Ca(NO3)2 0.01g/L。 溶液pH值为2.0, pH值采用pHS-3C型酸度计测定, 用1mol/L H2SO4进行调整。 实验前用氮气排除溶液中的氧, 使溶液中的氧浓度为0g/mL, 溶解氧浓度采用JPB-607型溶氧仪测定。 采用恒温水浴槽使溶液保持恒定的温度。
2 结果与讨论
2.1 砷黄铁矿的阳极氧化曲线
图1所示为砷黄铁矿在温度20℃、 pH2.0、 扫描速率20mV/min、 静止条件下的线性扫描曲线。 由图可知, 在整个电位范围内, 只有一个阳极峰, 在电压为0.2~0.3V时产生。 电压在0.8V时电流急剧升高。 对扫描到0.2~0.3V处时的电极表面进行X射线衍射分析可知(图2), 发生了如式(1)所示的反应, 砷黄铁矿被氧化为As2S2, 覆盖于电极表面, 从而发生了钝化现象。 随着电位的继续升高, As2S2被氧化生成亚砷酸及亚砷酸被氧化为砷酸, 亚铁离子被氧化成铁离子, 反应式如下[15]:
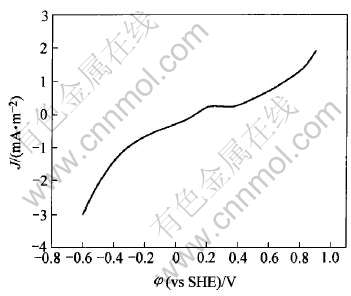
图1 砷黄铁矿在酸性溶液中氧化的阳极极化曲线
Fig.1 Anodic polarization curves of arsenopyrite in acidic solution
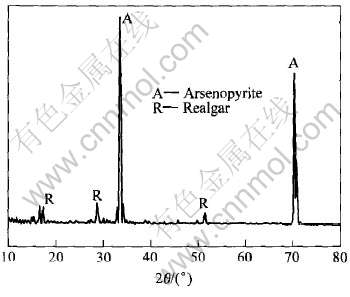
图2 0.2~0.3V处电极表面的X射线衍射谱
Fig.2 XRD pattern of arsenopyrite electrode surface at 0.2-0.3V
2.2 pH对砷黄铁矿氧化动力学的影响
在温度20℃、 扫描速率20mV/min、 静止的条件下, 用H2SO4调节pH值, 研究不同pH下的砷黄铁矿氧化动力学, 测得Tafel曲线的有关参数列于表1。 可以看出, 在所测的电位范围内, 随着pH 值的增大, 体系的腐蚀电位φcorr正移; 体系的腐蚀电流密度Jcorr减小; 阳极和阴极Tafel斜率逐步增大。
表1 不同pH条件下砷黄铁矿电极的Tafel参数
Table 1 Tafel parameters of arsenopyrite electrode in acidic solution under different pH conditions

随着pH值上升, 砷黄铁矿的腐蚀电位φcorr正移, 说明OH-离子抑制阳极反应。 随着pH值增大, 体系的腐蚀电流密度减小(Jcorr), 说明砷黄铁矿表面氧化腐蚀的反应速度减小。 由于阴极斜率和阳极斜率分别等于2.303RT/(nαF)和2.303RT/(nβF)[16], 阴、 阳极斜率增大, 就意味着电子传递系数 nα和nβ减小。 结合上面的研究说明在氧化过程中生成Fe(OH)3和As2S2沉积在电极表面, 阻碍了电极反应。
2.3 温度对砷黄铁矿氧化动力学的影响
在pH 2.0、 扫描速率20mV/min、 静止的条件下, 研究不同温度下的砷黄铁矿氧化动力学, 测得Tafel曲线的有关参数列于表2。 可以看出, 在所测的电位范围内, 随着温度值的升高, 体系的腐蚀电位φcorr负移; 体系的腐蚀电流密度Jcorr增大; 阳极和阴极Tafel斜率逐步减小。
表2 不同温度下砷黄铁矿电极的Tafel参数
Table 2 Tafel parameters of arsenopyrite electrode in acidic solution at different temperature conditions

随着温度的升高, 砷黄铁矿的腐蚀电位φcorr负移, 说明提高温度可以促进阳极反应。 随着温度增大, 体系的腐蚀电流密度Jcorr增大, 砷黄铁矿表面氧化腐蚀的反应速度增大。 阴阳极斜率减小, 就意味着电子传递系数 nα和nβ增大。 说明在高温下有利于阴、 阳极反应的电子交换和传递。
2.4 砷黄铁矿氧化的交流阻抗研究
在温度20℃、 pH 2.0、 扫描速率20mV/min、 静止的条件下, 频率为5~1×105Hz的范围内进行了在不同电位下砷黄铁矿氧化的交流阻抗研究。 交流阻抗的复变量平面图如图3所示。 可以看出, 当电位介于0.2~0.3V内时, 阻抗最大。 说明电极表面产生电化学反应, 并形成钝化膜, 阻碍阳极过程, 使电化学电阻增大; 降低表面的腐蚀(氧化反应)速度使相角移向低频。 该过程分别对应着线性扫描曲线中的反应(1), 等效电路如图4(a)所示。 其中Rr为电荷传递步骤的电化学反应电阻; Ca为吸附物吸、 脱附步骤的容抗; Cd为双电层电容; Re为溶液电阻。 总的阻抗的导纳Y为
![]()
当电位介于0.3~0.8V时, 随着电位的增大, 电化学电阻降低很快、 电容增大, 电极过程为吸附钝化膜的迅速破裂阶段, 容抗弧很快变小。 这些结果与图1的线性伏安曲线相应电位区的形状有很好的对应关系。 另外, 当电位介于0.5~0.8V时, Nyquist图明显出现一个高频的电容圈和一个低频的电感圈, 意味着电极表面出现了两个电极过程, 低频的电感圈是由于解吸附作用过程导致, 而高频
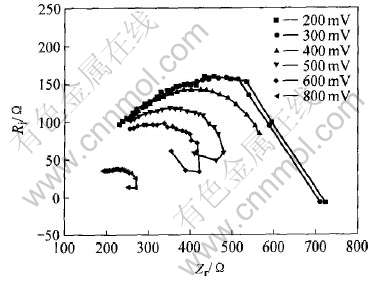
图3 砷黄铁矿电极在酸性溶液中的交流阻抗谱
Fig.3 EIS of arsenopyrite electrode under different potential conditions in acidic solution
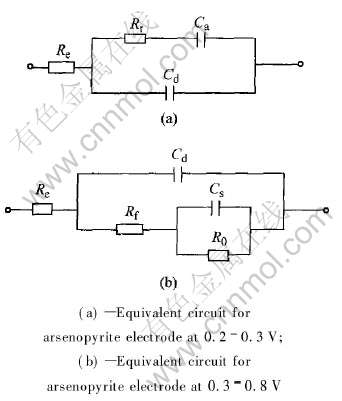
图4 砷黄铁矿氧化时相应的等效电路图
Fig.4 Equivalent circuit for arsenopyrite electrode in acidic solution
的电容圈则是由于吸附作用导致。 此时等效电路如图4(b)所示, 其中Rf为沉积膜中离子的迁移电阻, R0=Rr-Rf, 总阻抗的导纳Y为
![]()
3 结论
1) 线性扫描法测定表明砷黄铁矿在酸性溶液中在相对于标准氢电极电压为0.2V时开始氧化分解, 砷黄铁矿首先被氧化为As2S2, 覆盖于电极表面, 使电极表面发生钝化。 随着电位的继续升高, As2S2被氧化生成亚砷酸及亚砷酸被氧化为砷酸, 亚铁离子被氧化成铁离子。
2) 不同pH和温度下的腐蚀动力学研究表明, 随着pH 值的增大, 体系的腐蚀电位正移; 体系的腐蚀电流密度减小; 阳极和阴极Tafel斜率逐步增大。 随着温度的升高, 砷黄铁矿的腐蚀电位负移, 体系腐蚀电流密度增大, 砷黄铁矿表面氧化腐蚀反应速度增大。
3) 交流阻抗研究表明在不同电位时, 电极表面发生的电化学反应机理也不同。 测定结果证实了在线性扫描研究中的研究结果。
REFERENCES
[1]Cruz R, Laazaro I, Ignacio G, et al. Acid dissolution influences bacterial attachment and oxidation of arsenopyrite[J]. Minerals Engineering, 2005, 18: 1024-1031.
[2]Lina H K, Zheng Z M. Electrochemical oxidation of arsenopyrite in chloride solutions[J]. Hydrometallurgy, 1996, 42: 411-424.
[3]Costa M C, Botelho A M, Abrantes L M. Characterization of a natural and an electro-oxidized arsenopyrite: A study on electrochemical and X-ray photoelectron spectroscopy[J]. International Journal of Mineral Processing, 2002, 65: 83-108.
[4]Beattie M J V, Poline G W. A study of the surface oxidation of arsenopyrite using cyclic voltammetry[J]. Int J Miner Process, 1987, 20: 87-108.
[5]Sanchez V M, Hiskey J B. Electrochemical behavior of arsenopyrite in alkaline media[J]. Miner Metall Process, 1991, 2: 1-6.
[6]Zheng Z M, Lin H K. An electrochemical study of the oxidation of arsenopyrite in acidic media[A]. Proceedings of EPD Congress[C]. Warrendale, Penn: The Minerals, Metals and Materials Society, 1995: 389-410.
[7]Isabel L, Cruz R, Ignacio G, et al. Electrochemical oxidation of arsenopyrite in acidic media[J]. Int J Miner Process, 1997, 50: 63-75.
[8]Langhans D, Lord A, Lampshire D, et al. Biooxidation of an arsenic-bearing refractory gold ore[J]. Minerals Engineering, 1995, 8(1): 147-158.
[9]Ubaldini S, Veglio F, Toro L. Biooxidation of arsenopyrite to improve gold cyanidation [J]. Int J Miner Process, 1997, 52: 65-80.
[10]陈顺方, 钟文远. 难浸硫化金矿的微生物氧化预处理及应用现状[J]. 国外金属矿选矿, 2000(2): 6-8.
CHEN Shun-fang, ZHONG Wen-yuan. The microbe pretreatment and application advances of sulfur-bearing gold ores[J]. Metal Mine Concentration of Overseas, 2000(2): 6-8.
[11]王金祥, 程东会, 王立群. 金驹山原生金矿石生物浸出试验[J]. 湿法冶金, 2002, 21(1): 22-25.
WANG Jin-xiang, CHENG Dong-hui, WANG Li-qun. Bioleaching experiments on gold protoorefrom Jinjushan[J]. Hydrometallurgy of China, 2002, 21(1): 22-25.
[12]Farooqui A, Bajpai U. Biogenic arsenopyrite in holocene peat sediment, India[J]. Ecotoxicology and Environmental Safety, 2003, 55: 157-161.
[13]Sanchez V M, Hiskey J B. An electrochemical study of the surface oxidation of arsenopyrite In alkaline media[J]. Metall Trans B, 1988, 19: 943-949.
[14]Natarajan K A. Electrobioleaching of base metal sulfide[J]. Metall Trans B, 1992, 23: 5-11.
[15]杨洪英, 杨立, 魏绪钧. 氧化亚铁硫杆菌(SH-T)氧化毒砂的机理[J]. 中国有色金属学报, 2001, 11(2): 323-328.
YANG Hong-ying, YANG Li, WEI Xu-jun. Mechanism on bio-oxidation of arsenopyrite with Thiobacillus ferrooxidans strain SH-T[J]. The Chinese Journal of Nonferrous Metals, 2001, 11(2): 323-327.
[16]查全性. 电极过程动力学导论(第3版)[M]. 北京: 科学出版社, 2002: 31-72.
ZHA Quan-xing. Introduction to Kinetics of Electrode Processes[M]. Beijing: Science Press, 2002: 31-72.
基金项目: 国家重点基础研究发展计划资助项目(2004CB619204); 国家自然科学基金资助项目(50321402)
收稿日期: 2006-04-07; 修订日期: 2006-07-17
通讯作者: 李 骞, 博士研究生; 电话: 13207429207; E-mail: snt212@mail.csu.edu.cn


