热分解含氨草酸钴复盐制备纤维状多孔钴粉
湛菁1, 2,周涤非1,张传福1,贺跃辉2,岳建峰1
(1. 中南大学 冶金科学与工程学院,湖南 长沙,410083;
2. 中南大学 粉末冶金研究院,湖南 长沙,410083)
摘要:以氨为配位剂,通过配位沉淀法制备纤维状钴粉复杂前驱体,并采用XRD,IR,SEM和TGA/DTA研究前驱体粉末的物相、成分与形貌,系统考察前驱体粉末热分解过程中热分解条件如热分解气氛、热分解温度、热分解时间和升温速率对金属钴粉形貌、粒度和比表面积的影响。研究结果表明:在Co(Ⅱ)-C2O42--NH3-NH4+-H2O反应体系中得到的前驱体为含氨草酸钴复盐,形貌为纤维状,氨与钴离子配合并生成含氨草酸钴复盐是纤维状形貌形成的内在机制,它是通过含NH3基配合物以链状结构连接[(NH3)M-OX-M(NH3)]2+生长基元以轴向取向连生形成一维形貌;在弱还原性气氛、热分解时间为30~60 min、升温速率为15~20 K/min、热分解温度为623~723 K条件下,热分解含氨草酸钴复盐粉末可以制备比表面积为10.44 m2·g-1的纤维状多孔金属钴粉,其孔结构为两端开放的管状毛细孔且多为中孔。
关键词:
中图分类号:TF123.23 文献标志码:A 文章编号:1672-7207(2011)04-0876-08
Preparation of fibrous porous cobalt powders by thermal decomposition of cobalt oxalate complex with ammonia
ZHAN Jing1, 2, ZHOU Di-fei1, ZHANG Chuan-fu1, HE Yue-hui2, YUE Jian-feng1
(1. School of Metallurgy Science and Engineering, Central South University, Changsha 410083, China;
2. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Abstract: A novel precursor of fibrous cobalt powders was synthesized by coordination-precipitation process using ammonia as complex agent. The phase, composition and morphology of the novel precursor were characterized by XRD, IR, DTA/TGA and SEM analysis. The influences of various conditions in pyrolysis, such as decomposition atmosphere, decomposition temperature, decomposition time and heating rate, on the morphology, average size and specific surface area of the cobalt powders were investigated. The results show that the precursors obtained in reaction system Co(Ⅱ)-C2O42--NH3-NH4+-H2O is ammoniacal complex of cobalt oxalate and the morphology is fibrous. The formation of the complex of oxalate cobalt with ammonia precipitated by coordination of ammonia and cobalt reacting with oxalate is quite essential to form fibrous morphology for the precursor, which may be formed through [(NH3)M-OX-M(NH3)] 2+ growth units along the axial direction. The fibrous cobalt powders with 10.44 m2·g-1 for specific surface area are produced in weak reducing atmosphere, 623-723 K for decomposition temperature, 30-60 min for decomposition time, 15-20 K/min of heating rate. The structure of pores in cobalt powders is capillary tube with open ports and the majority is mesoporous.
Key words: cobalt oxalate complex with ammonia; cobalt powders; fibrous; porous; growth mechanism
超细钴粉由于其具有特殊的物理、化学性能,在硬质合金、电池、催化剂、磁性材料、吸波材料、陶瓷等领域应用中表现出许多优异性能[1-5]。应用中,粉末的理化性能决定其应用领域的发展前景[6],例如在磁记录介质方面,准一维形貌的金属钴粉具有磁晶各向异性和较高的磁化强度,在垂直磁记录材料和电磁屏蔽及吸波材料领域具有潜在应用前景;在硬质合金方面,球形超细钴粉能增加合金横向断裂强度、硬度和密度,使其具有更强的耐磨性与抗裂性等。目前,制备超细金属钴粉的方法主要有草酸钴或高纯氧化钴氢气还原法、热离解法、高压氢还原法、氧化金属还原法、微乳液法和多元醇还原法等[7-8],这些方法中绝大部分着重于制备球形金属钴粉,而对纤维状金属钴粉制备研究较少。ZHAN等[9-13]以草酸盐为沉淀剂,通过改进传统制备工艺获得了纤维状金属镍、氧化亚镍、镍钴合金和铁镍合金粉末的复杂前驱体,并通过控制热分解条件得到了相应的纤维状粉末。而以六水氯化钴和草酸铵或草酸为原料,氨水作为配合剂, PVP为分散剂,采用配位沉淀制备纤维状金属钴粉前驱体工艺已有报道[14],但报道中对前驱体物相、组成、形成机理以及热分解行为并未进行论述。为此,本文拟通过气氛调控,在一定温度范围内热分解含氨草酸钴复盐粉末制备纤维状多孔金属钴粉,并讨论前驱体的形成机理、物相组成及热分解行为。
1 实验
本实验所用试剂CoCl2·6H2O,NH3·H2O,C2H5OH,CH3COCH3,(NH4)2C2O4,H2C2O4和表面活性剂聚乙烯吡咯烷酮(PVP)均为分析纯。纤维状多孔金属钴粉制备过程如下:将草酸或草酸铵和表面活性剂按要求配制成100 mL溶液,将溶液放入恒温水浴槽中并保持一定搅拌速度;将CoCl2·6H2O按一定浓度要求溶解在100 mL含氨水的溶液中使钴离子完全配合,将配合好的金属钴离子溶液恒流加入到草酸或草酸铵溶液中,保持合适的搅拌速度和温度,用氨水调节反应pH,加料完毕后再搅拌一定时间得到沉淀物,经过滤、洗涤和表面处理后放入温度为373~473 K的真空干燥箱干燥得到含氨草酸钴复盐粉末(即前驱体),将干燥好的复盐粉末置于热分解炉中,在623~723 K、弱还原气氛条件下进行热分解即可得到纤维状多孔金属钴 粉末。
用日本理学D/max-rA10型衍射仪测定粉末的物相组成,光源采用Cu Kα线(波长为0.154 056 nm);用日本JSM-5600LV型扫描电镜观察粉末的形貌及粒径;用美国Micromeritics 公司生产的ASAP2010型比表面测定仪测定钴粉表面积、孔径分布等物理特征,测定所用吸附气体为氮气,吸附温度为77.35 K。以KBr压片,采用美国Nexus470型红外吸收光谱仪于 4 000~400 cm-1范围内记录前驱体粉末的红外吸收 光谱。
2 实验结果与讨论
2.1 纤维状前驱体粉末的物相组成与形成机理
图1所示是pH为8.0和9.0时前驱体粉末的XRD图谱。从图1可见:由配位沉淀得到的沉淀产物结晶完整,其XRD图谱与标准图谱(β-CoC2O4·2H2O图谱[15])大不一样,目前尚无标准的衍射卡可以参照分析。根据反应体系Co(Ⅱ)-C2O42--NH3-NH4+-H2O热力学分析可知[16]:当7.0<pH<12.0时,不仅有沉淀反应,而且有氨与金属Co2+的配位反应。整个反应过程为配位沉淀过程,因此,可以初步推断该沉淀产物为钴与氨配合后参与沉淀反应所形成的一种含氨草酸钴复盐粉末。
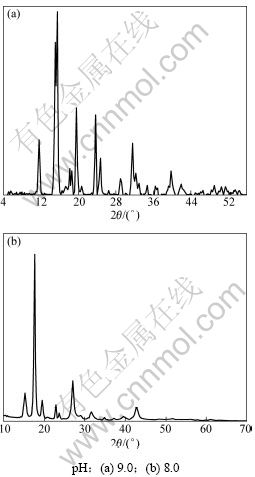
图1 含氨草酸钴复盐粉末的XRD图
Fig.1 XRD spectrum of cobalt oxalate containing ammonia powders
图2所示为不同pH下制备的前驱体粉末红外吸收光谱图。为了比较,图2(a)列出了pH=2.0时制备的β-CoC2O4·2H2O红外光谱图。从图2(a)可以看出:3 375 cm-1处的峰为C2O42-与水形成氢键产生的对称伸缩振动峰,1 624 cm-1处的峰为H—O—H弯曲振动峰和C=O不对称伸缩振动峰;1 360 cm-1和1 315 cm-1处的峰为C—O对称伸缩振动双峰;824 cm-1处的峰为 C—C伸缩振动峰,650~490 cm-1处的峰为M—O伸缩振动峰。图2(b)和(c)表明:随着pH升高,配位沉淀产物的红外光谱图明显与β-CoC2O4·2H2O谱图不同。从图2(b)可以看出:原来的3 375 cm-1处的峰移至3 348 cm-1处,在3 284 cm-1处出现1个新N—H伸缩振动峰,1 624 cm-1处的峰分裂为1 677,1 640和1 592 cm-1处的3个峰,其中:1 677和1 592 cm-1 处的峰为N—H伸缩振动峰,这说明在pH=8.0时得到的沉淀产物中已经有NH3或NH4+;在1 450~1 200 cm-1之间有3个中等强度的CO2-伸缩振动峰,对应1 361,1 317和1 269 cm-1处的峰;824 cm-1处的峰移至813 cm-1归属于C—C伸缩振动峰,650~490 cm-1处的峰仍然为M—O伸缩振动峰。图2(c)所示的红外光谱曲线与图2(b)所示的基本一致,说明在pH≥8.0时,沉淀产物的物相成分基本一致。由此可见:随着pH增加,配位沉淀过程溶液中游离氨含量越多,相应前驱体粉末中N—H特征频率峰也越来越强,沉淀产物中有氨进入,形成复杂钴盐。结合反应体系热力学分 析[16]、XRD分析和红外光谱图可以进一步确定沉淀产物为复杂含氨草酸钴复盐粉末,其中Co2+,C2O42-和NH3、结晶水具体含量还有待其他分析方法来确定。
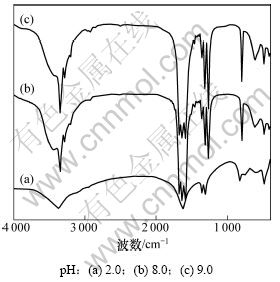
图2 不同pH条件下前驱体粉末的IR图谱
Fig.2 IR of precursors obtained at different pH values
图3所示为含氨草酸钴复盐粉末的SEM照片。从图3可知:含氨草酸钴复盐粉末形貌为纤维状,分散性好。根据金属草酸盐分子的结构可知[17],C2O42-含有双配位键,2个C2O42-基团可以与中心金属原子(M)形成1个二维平面结构的片状分子,在垂直于该片状分子平面的方向,配合连接着2个L配体,这些L配体可以进一步构成长链,这些长链又按照一定规则形成长方形或针状草酸盐类化合物晶体。本研究中,在Co2+-NH4+-NH3-C2O42--H2O体系进行配位沉淀反应时,溶液中的pH用氨水调节,反应体系中存在反应NH4++OH-?NH3·H2O。当pH≥8.0时,NH4+部分以NH3·H2O的形式存在并与Co2+形成配合离子后直接参与共沉淀反应过程。而与金属草酸盐分子平面垂直连接的L配体也变为具有极性的基团—NH2,这样,通过含NH3基配合物以链状结构连接[(NH3)M-OX- M(NH3)]2+的生长基元不断地沿轴向取向连生(其中,OX为草酸根离子),前驱体晶体呈现出明显的各向异性,其生长也呈现明显的择优取向,即具有高比表面能的晶核表面能吸附成核基元的概率要大于那些低表面能的晶核表面吸附成核基元的概率,从而导致高表面能晶核表面的优先生长,而在短径方向生长缓慢,最后,前驱体晶体呈现明显的纤维状形貌。所以,氨在草酸钴复盐粉末的结构与含量是前驱体粉末呈现纤维状形貌的主要原因。

图3 含氨草酸钴复盐粉末的SEM照片
Fig.3 SEM photographs of cobalt oxalate complexes with ammonia powders
2.2 含氨的草酸钴复盐粉末热分解行为
图4所示为β-CoC2O4·2H2O和含氨草酸钴复盐粉末的DTA/TGA曲线。
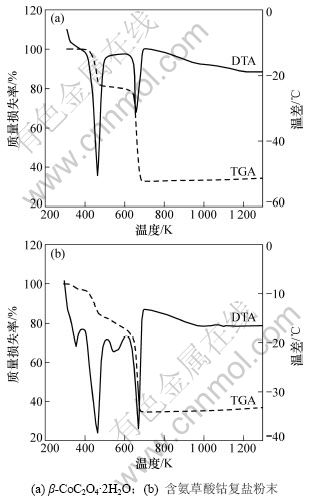
图4 CoC2O4·2H2O和含氨草酸钴复盐的TGA/DTA图
Fig.4 TGA/DAT curves of CoC2O4·2H2O and cobalt oxalate complex with ammonia
由图4(a)可知:β-CoC2O4·2H2O的热分解过程有2个吸热峰:第1个吸热峰出现在473 K左右,TGA曲线上的质量损失率约为19.15%,对应为二水草酸钴中2个结晶水的脱除;第2个吸热峰出现在673 K左右,TGA曲线上的质量损失率约为49.07%,对应为草酸钴的分解。由图4(b)可知:含氨草酸钴复盐粉末除了在473 K和673 K附近出现2个吸热峰,对应为脱除结晶水和草酸钴分解反应外,还在373 K和503 K附近出现了2个明显的吸热峰。由TGA曲线可见:质量损失率分别为2.86%和5.88%,逸出的气体具有刺鼻的氨味。整个样品总质量损失率为65.43%,略小于二水草酸钴的质量损失率,证明了复杂钴盐中NH3的存在。从873 K开始,TGA曲线又出现质量增大现象,估计是金属钴被氧化。因此,在热分解过程中,适当保持弱还原性气氛是必要的。
2.3 热分解气氛的影响
图5所示为不同热分解气氛条件下含氨草酸钴复盐粉末热分解产物的XRD图。由图5可以看出:在只通入氮气(含氧量小于0.05%)的情况下,热分解产物的物相包含有CoO,α-Co和β-Co物相(图5(a));而在通入混合气体(V(N2):V(H2)=9:1)时,热分解产物中只有α-Co和β-Co(图5(b))。这是因为超细金属钴粉很容易被氧化,在氮气气氛中由于微量氧的存在,金属钴粉被氧化成CoO。因此,在含氨草酸钴复盐粉末热分解过程中,热分解气氛必须控制为弱还原性气氛。
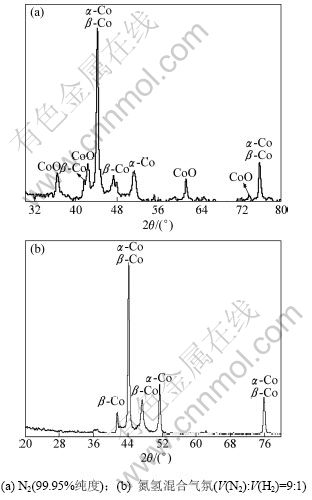
图5 在不同气氛下热分解含氨草酸钴得到的分解产物XRD图
Fig.5 XRD spectrum of decomposition product obtained in different pyrolytic atmospheres
2.4 热分解温度的影响
图6所示为含氨草酸钴复盐粉末在不同温度下热分解产物的SEM照片。由图6可知:含氨草酸钴复盐粉末经过热分解之后均发生了一定程度的收缩,且热分解产物粒子表面没有复盐粉末粒子表面光滑。热分解产物保持了含氨草酸钴复盐粉末纤维状形貌。这是由于在热分解过程中,含氨草酸钴复盐在弱还原性气氛中分解成金属原则上是1个复盐颗粒分解得到1颗金属颗粒,形成钴粒子的基本尺寸由复盐粉末粒子粒径决定。当热分解温度为623~723 K时,得到的热分解产物粒子粒径较小,孔隙较多,单个小颗粒之间聚集在一起(见图6(a)~图6(c));随着热分解温度升高,热分解产物由链状变为多孔纤维状,孔隙也逐渐较少;当温度为773 K时,热分解产物粒子间孔隙基本消失,开始出现烧结现象,纤维状更加明显。因此,纤维状多孔金属钴粉热分解温度为623~723 K。
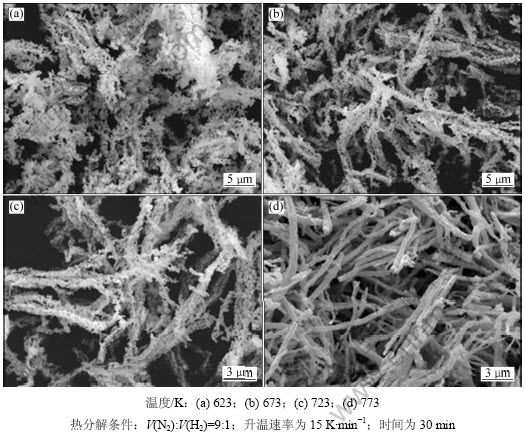
图6 不同温度下热分解含氨草酸钴得到的金属钴粉末SEM 照片
Fig.6 SEM photographs of cobalt powders obtained at different decomposition temperatures
此外,热分解温度对粉末其他理化性能也有很大影响,在热分解温度偏低时,所制得金属粉末的活性较大;当热分解温度从673 K增加到1 573 K时,金属粉末的活性从105%降到60%[16]。金属粉末活性可以用粉末比表面积来表征。图7所示为热分解温度对热分解产物比表面积的影响。由图7可知:当热分解温度为623 K时,热分解产物的比表面积为10.44 m2·g-1;随着温度升高,比表面积减小,当热分解温度为773 K时,金属钴粉比表面积仅为2.24 m2·g-1。这是因为在含氨草酸钴复盐热分解过程中,温度对粉末性能起决定作用,在一定的热分解温度下,含氨草酸钴复盐经过脱吸附氨、脱水、脱配位氨以及草酸钴分解几个过程,在这些过程中,由于颗粒之间接触面积较小,形成了链状或网状结构,增大了比表面积,粉末膨松;随着温度升高,粒子出现烧结现象,单个颗粒之间的接触面积增大,粉末由于体积收缩而变得密实,孔隙率减少,形貌逐渐变为密实纤维状,比表面积下降较大。因此,当热分解温度为623~723 K时即可得到比表面积较大的纤维状多孔金属钴粉。
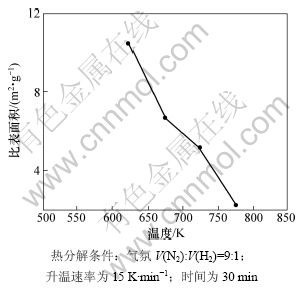
图7 热分解温度对纤维状多孔钴粉比表面积的影响
Fig.7 Effect of decomposition temperature on specific surface area of cobalt powders
2.5 升温速率的影响
图8所示为含氨草酸钴复盐粉末在不同升温速率下热分解产物的SEM照片。从图8(a)可见:当升温速率较小时,热分解产物体积变化不大,金属钴粉疏松多孔,形貌继承性好,为纤维状,比表面积为10.44 m2·g-1。从图8(b)可见:当升温速率较大时,所得到的金属钴粉体积收缩很大,粉末粒子较硬,比表面积为4.34 m2·g-1。这是由于在热分解过程中,有大量气体放出,当温度升高时,含氨草酸钴复盐在低温下是先脱NH3,接着脱水,然后脱配合氨,最后进行热分解。分解时产生气体平缓,这样,粉末在脱气时呈多孔隙的膨松状态,产物体积变化不大,粒子形貌继承性好;当升温速率很大时,脱NH3、脱水、脱配合氨和热分解同时进行,产生大量气体,导致草酸钴粉粒子爆裂,体积收缩大,团聚严重,比表面积小。

图8 不同升温速率下的金属钴粉形貌
Fig.8 SEM photographs of cobalt powders obtained at different heating-up velocities
2.6 热分解时间的影响
图9所示为含氨草酸钴复盐粉末在不同热分解时间下热分解产物的SEM图。从图9可知:当热分解时间为30 min和60 min时,金属钴粉蓬松多孔,纤维状形貌明显;延长热分解时间,金属钴粉出现烧结,粉末变致密,孔隙率减小,同时晶粒长大,粉末硬团聚严重。故适宜的热分解时间为30~60 min。

图9 不同热分解时间下得到金属钴粉形貌的照片
Fig.9 SEM photographs of cobalt powders obtained at different decomposition time
2.7 孔结构分析
图10所示为纤维状多孔金属钴粉的吸附-脱附等温线。根据BET分类法[17],该吸附等温线属于第Ⅲ类吸附等温线,起始部分上翘且向上凹,后半段急剧上升。这是由于在前半段发生了毛细管凝聚现象,使得等温线发生了上凹的变化,而在后半段由于毛细管凝聚作用和表面多层吸附,吸附量急剧增大,造成吸附曲线急剧上翘;又因为孔的孔径范围由小至大,由毛细管凝聚引起的吸附量急剧增加,吸附等温线向上翘呈现不饱和状态,因而出现了滞回圈现象。从吸附-脱附等温线可以看出:金属钴粉孔结构为两端都开放的管状毛细孔,孔的形状和直径较均一,由直径和排列都十分均匀的球粒聚集体所构成。
从通过BJH法解析脱附等温线得到的中孔孔径分布曲线可看出:曲线在3~4 nm和5~6 nm处有明显的中孔峰,表明粉末中孔率及中孔孔容较大,孔径分布均匀;粉末含有少量的大孔。
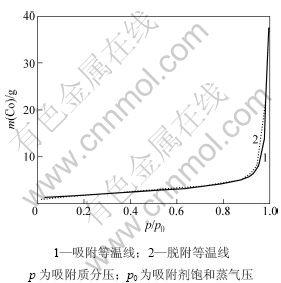
图10 纤维状金属钴粉的吸附脱附等温线
Fig.10 Adsorption and desorption isotherms of cobalt powders
3 结论
(1) 在Co2+-C2O42--NH3-NH4+-H2O反应体系中,通过氨与钴离子配合并参与沉淀即可得到一种复杂的前驱体,通过X线衍射、红外光谱和热重差热分析可知该前驱体为一种含氨草酸钴复盐粉末。
(2) 氨与钴离子配合并形成含氨草酸钴复盐粉末是决定前驱体呈现纤维状形貌的主要因素,这是由草酸盐分子晶体结构决定的。在含氨草酸钴复盐粉末中,由于在其轴向晶面上有很多含—NH2基团的极性键,而草酸盐晶体可以通过含NH3基配合物以链状结构连接[(NH3)M-OX-M(NH3)]2+生长基元得以不断地轴向取向连生形成纤维形状。
(3) 含氨草酸钴复盐粉末热分解行为是:在低温下脱吸附氨;接着脱结晶水;然后脱配合氨;最后,草酸钴在惰性气氛中分解为金属钴粉。
(4) 在弱还原性气氛下,保持热分解温度为623~723 K、升温速率为15 m2·g-1、保温时间为30~60 min,即可得到多孔纤维状金属钴粉,其比表面积可达10.44 m2·g-1。粉末的孔结构为两端开放的管状毛细孔且多为中孔。
参考文献:
[1] Legrand J, Ngo A T, Pileni M P. Domain shapes and superlattices made of cobalt nanocrystals[J].Advanced Materials, 2001, 13(1): 58-62.
[2] Graf H, Vancea J, Hoffmann H. Single-electron tunneling at room temperature in cobalt nanoparicles[J]. Applied Physics Letters, 2002, 80(7): 1264-1266.
[3] Dutta P, Dunn B C, Eyring E M, et al. Characteristics of cobalt nanoneedles in 10% co/aerogel fischer-tropsch catalyst[J]. Chemistry of Materials, 2005, 17(19): 5183-5186.
[4] GUO Fan, ZHENG Hua-gui, YANG Zhi-ping, et al. Synthesis of cobalt nanoparticles in ethanol hydrazine alkaline system (EHAS) at room temperature[J]. Materials Letters, 2002, 56(6): 906-909.
[5] Park J, Kim M G, Jun Y, et al. Characterization of super- paramagnetic “core-shell” nanoparticles and monitoring their anisotropic phase transition to ferromagnetic “solid solution” nanoalloys[J]. Journal of the American Chemical Society, 2004, 126(29): 9072-9078.
[6] Song Q, Zhang Z J. Shape control and associated magnetic properties of spinel cobalt ferrite nanocrystals[J]. Journal of the American Chemical Society, 2004, 126(1): 6164-6168.
[7] 吴琳琳, 湛菁, 黎昌俊, 等. 超细钴粉制备的研究进展[J]. 四川有色金属, 2001(2): 30-33.
WU Lin-lin, ZHAN Jing, LI Chang-jun, et al. Progress on the preparation of ultrafine cobalt powder[J]. Sichuan Nonferrous Metals, 2001(2): 30-33.
[8] 陈立宝, 贺跃辉, 邓意达. 镍钴粉末生产现状及发展趋势[J]. 粉末冶金技术, 2004, 22(3): 173-176.
CHEN Li-bao, HE Yue-hui, DENG Yi-da. Present Status and development trend of nickel and cobalt powder[J]. Powder Metallurgy Technology, 2004, 22(3): 173-176.
[9] ZHAN Jing, ZHANG Chuan-fu, LI Tie-jing, et al. Thermo- dynamic analysis on preparation of fibrous NiO precursor powders with oxalate precipitation process[J]. Transactions of Nonferrous Metals Society of China, 2005, 15(4): 926-930.
[10] ZHANG Chuan-fu, FAN You-qi, WU Jian-hui, et al. Preparation and characterization of porous copper powder by thermal decomposition of complicated copper oxalate[C]//YIN Wei-min. EPD of the Minerals, Metals and Materials Society. San Francisco: Minerals, Metals and Materials Society, 2009: 417-425.
[11] ZHANG Chuan-fu, ZHAN Jing, WU Jian-hui, et al. Preparation and characterization of fibrous NiO particles by thermal decomposition of nickelous complex precipitation precursors[J]. Transactions of Nonferrous Metals Society of China, 2004, 14(4): 713-717.
[12] WU Jiang-hui, ZHANG Chuan-fu, ZHAN Jing, et al. Preparation of fibrous nickel powder by complexing precipitation-thermal decomposition method[C]//YIN Wei-min. EPD of the Minerals, Metals and Materials Society. San Francisco: Minerals, Metals and Materials Society, 2009: 473-483.
[13] ZHANG Yin-liang, ZHANG Chuan-fu, ZHAN Jing, et al. Preparation of porous ultrafine fiber Fe-Ni alloy powder by coordinated coprecipitation direct reduction process[C]//TMS Annual Meeting. Supplement Proceedings. Volume 1: Fabrication, Materials, Processing and Properties. San Francisco: Minerals, Metals and Materials Society, 2009: 527-534.
[14] 董成勇, 张传福, 湛菁, 等. 纤维状复杂钴盐的制备[J]. 矿冶工程, 2006, 26(4): 54-57.
DONG Cheng-yong, ZHANG Chuan-fu, ZHAN Jing, et al. Preparation of fibrous cobalt complex[J]. Mining and Metallurgical Engineering, 2006, 26(4): 54-57.
[15] 徐明晗, 丁时锋, 宋鹂, 等. 用沉淀法制备超细草酸钴粉体[J].硅酸盐学报, 2008, 36(3): 367-372.
XU Ming-han, DING Shi-feng, SONG Li, et al. Preparation of ultrafine cobalt oxalate powder by the precipitation method[J]. Journal of the Chinese Ceramic Society, 2008, 36(3): 367-372.
[16] 湛菁. 纤维状多孔超细特种镍钴合金及复合氧化物粉末制备新方法研究[D]. 长沙: 中南大学冶金科学与工程学院, 2006: 24-38.
ZHAN Jing. Study on a novel method for preparation fibrous porous ultrafine special nickel-cobalt alloy and nickel-cobalt complex oxides powders[D]. Changsha: Central South University. School of Metallurgy Science and Engineering, 2006: 24-38.
[17] Donia A M, Dollimore D. Preparation, identification and thermal investigation of solid solution of cobalt-copper oxalates[J]. Thermochimica Acta, 1996, 290(1): 139-147.
[18] 严继民, 张启元, 高敬宗. 吸附与凝聚: 固体的表面与孔[M]. 北京: 科学出版社, 1986: 113-114.
YAN Ji-min, ZHANG Qi-yuan, GAO Jin-zong. Adsorption and Coagulation: Surface and pore of solid[M]. Beijing: Science Press, 1986: 113-114.
(编辑 陈灿华)
收稿日期:2010-03-10;修回日期:2010-05-20
基金项目:湖南省自然科学基金资助项目(09JJ4028);中国博士后基金资助项目(20070410989);湖南省科技计划项目(2010FJ3011)
通信作者:周涤非(1964-),男,湖南涟源人,博士研究生,副教授,从事粉体材料制备研究;电话:0731-88836048; E-mail:zdf2011p@163.com


