中国有色金属学报
中国有色金属学报 2004,(09),1575-1579 DOI:10.19476/j.ysxb.1004.0609.2004.09.024
NiTi形状记忆合金表面TiO2 薄膜的制备及其血液相容性
耿芳 石萍 F.T.Cheng
辽宁工学院材料与化学工程学院,辽宁工学院材料与化学工程学院,Department of Applied Physics ,HongKong Polytechnic University ,HongKong ,China 锦州121001 ,锦州121001
摘 要:
采用溶胶 凝胶法在NiTi合金表面制备了TiO2薄膜,用DSC分析了凝胶在加热过程中发生的转变。结果表明:在NiTi表面形成金红石型TiO2薄膜;覆盖有TiO2薄膜的NiTi合金与NiTi基体及316L不锈钢、Ti6Al4V相比,凝血时间延长,溶血率下降,说明TiO2膜可提高NiTi合金血液相容性。
关键词:
NiTi ;溶血 ;凝血 ;TiO2 ;
中图分类号: TG174
作者简介: 耿芳(1977),女,硕士研究生.; 石 萍,教授;电话:13591266349;E mail:p.shi@163.com;
收稿日期: 2004-02-01
TiO2 film preparation and hemocompatibility of NiTi shape memory alloy
Abstract:
TiO2 film was coated on the surface of NiTi alloys by sol-gel method. The variations of gel on heating were analyzed by DSC. The X-ray diffraction results indicate that TiO2 film formed on NiTi alloy is rutile. Compared with uncoated NiTi, 316L stainless steel and Ti6Al4V, TiO2 -coated NiTi exhibits excellent hemocompatibility, such as lower hemolysis rate and longer clotting time.
Keyword:
NiTi; hemolysis; clotting; TiO2 ;
Received: 2004-02-01
在金属植入材料中, NiTi形状记忆合金因为具有优良的耐蚀性和生物力学性能, 被认为是一种理想的生物医用材料, 然而, NiTi合金用作体内支架的血液相容性问题一直受到人们的关注。 近年来, 国内外学者试图通过对NiTi材料表面改性, 以改善材料的血液相容性。 在金属表面制备陶瓷膜可将金属较好的力学性能和陶瓷膜良好的化学稳定性及生物相容性有机结合在一起。 许多研究表明, TiO2
[1 ]
, Al2 O3
[2 ]
, SiC
[3 ]
等薄膜均具有良好的血液相容性, 钛及其合金较好的生物相容性也与其表面自然生成的TiO2 薄膜有关
[4 ]
。 抛光后在空气中自然生成的薄膜只有几纳米厚
[5 ]
, 而在NiTi合金表面制备TiO2 薄膜厚度可达几十到几百纳米, 且薄膜均匀致密, 薄膜内不含镍离子, 从而大大降低基体材料镍离子向外释放的危险性, 提高抗腐蚀性和生物相容性
[6 ]
。 TiO2 的制备方法很多, 溶胶-凝胶法制备TiO2 薄膜工艺简单, 合成温度低, 得到的产品纯度高, 化学组分均匀, 尤其适合于在形状复杂的基体上制膜。 本文作者用溶胶-凝胶法在NiTi形状记忆合金基体上制备TiO2 薄膜, 对成膜过程、膜结构及
薄膜的血液相容性进行了研究。
1 实验
1.1 TiO2膜的制备
将20 mL钛酸丁酯溶于88 mL无水乙醇中, 加入0.5 mL三乙醇胺作为稳定剂, 室温下在恒温磁力搅拌器上搅拌1 h, 再加入少量乙醇水溶液(2.6 mL水, 44 mL无水乙醇)和0.5 mL盐酸, 继续搅拌50 min, 制成均匀、 粘度适中的TiO2 透明浅黄色溶胶。 将NiTi合金试样匀速浸入溶胶中, 10 s后, 以缓慢速度匀速提拉, 然后立即放入100 ℃的烘箱中干燥5 min, 在无尘空气中冷却5 min后, 随炉缓慢升温至500 ℃, 保温1 h后随炉冷却至室温, 即得到所需样品。
1.2 TiO2膜特性及结构
采用SETARAM-Labsys热分析仪对凝胶在加热过程中所发生的变化进行分析, 保护气氛为氩气, 升温速率为10 ℃/min。 用X射线衍射分析NiTi合金制膜前后表面的相结构, 所用设备为D/MAX-2500PC 18kW衍射仪, 采用Cu靶, 管电压为40 kV, 管电流为30 mA。
1.3 血液相容性
将含50.8%Ni(摩尔分数)的NiTi合金、 316L不锈钢和Ti6Al4V线切割成尺寸为10 mm×10 mm×2 mm的试样。 新采人血20 mL, 用肝素做抗凝剂。
1) 凝血时间的测定:
在每个试样表面滴0.1 mL新鲜血液, 分别静置10、 20、 30、 40、 50 min后, 试样转移至盛有15 mL蒸馏水的烧杯中培养5 min, 没有凝固在样品上的红细胞起溶血反应, 均匀地分散在水中。 红细胞的浓度用溶液的吸光度表征, 吸光度值用752型分光光度计测定, 所用光的波长为545 nm。
2) 溶血率的测定:
取8 mL新鲜血液, 加入10 mL生理盐水, 进行稀释。 将样品置于10 mL生理盐水中, 37 ℃水浴中恒温30 min后加入0.2 mL稀释血, 轻轻混匀, 在水浴中继续保温60 min。 液体倒入试管中以1000 r/min速度离心分离, 取上层溶液于545 nm的波长处测吸光度值, 阳性对照用10 mL蒸馏水+0.2 mL稀释血, 阴性对照用10 mL生理盐水+0.2 mL稀释血。 根据公式α (%)=(D t -D nc )/(D pc -D nc ) 计算溶血率, 其中α 为溶血率, D t 为样品吸光度, D nc 为阴性对照吸光度, D pc 为阳性对照吸光度
[7 ]
。
2 结果与讨论
2.1 TiO2膜的形成及其影响因素
采用溶胶-凝胶法制备的表面膜为光滑、 均匀的金红石型TiO2 膜, 溶胶的水解与聚合反应过程直接影响溶胶-凝胶的质量和性能。 当水量比较少时, 基本上没有交联键生成, 随着水量增加, 交联键生成愈多, 凝胶化速度加快。 乙醇量增加, 则溶胶变稀, 粘度变小, 凝胶时间变长且膜变薄, 但均匀性好, 乙醇量过大时, 则难以成膜。 盐酸是反应的负催化剂, 抑制水解, 当其它条件不变时, 减少盐酸用量则凝胶时间变短, 甚至出现“胶冻体”。 对同一钛酸盐, 加入不同的酸做催化剂, 锐钛矿型TiO2 向金红石结构转变的温度不同, 其中盐酸催化剂使TiO2 结构转变温度最低
[8 ]
。 若溶胶太粘则膜过厚且不均匀、 成膜质量下降、 膜表面有裂纹、 掉粉严重甚至发黑。 这是由于膜过厚时其表面层已成凝胶, 而内部有机物、 水分尚未挥发掉, 在热处理过程中内部有机物挥发逸出甚至不完全燃烧炭化而造成的。 因此为提高成膜质量及膜的均匀性, 溶胶不宜过粘, 单次涂膜不宜过厚, 宜进行多次涂膜。 溶胶-凝胶法制备的TiO2 薄膜厚度大致为100 nm。 宏观观察表面结合牢固, 膜表面光滑, 成膜质量很好。 反应速度受pH值及温度影响, 适合的pH值在2.5~6.0, 可形成清亮的溶胶和透明的凝胶, pH越小, 凝胶透明性越好, 开裂程度减弱, 但相应转变时间增加。 温度越低, 形成的凝胶质量越好, 同时成胶时间增加, 温度越高, 凝胶时间缩短, 但胶体质量差, 透明性下降, 温度太高, 还会使溶胶瞬时聚沉, 得到TiO2 粉末。 混合溶液配置温度不超过40 ℃, 一旦得到澄清溶液, 即使升高温度也不会出现沉淀。 另外三乙醇胺对溶胶的形成有较大影响, 无三乙醇胺时难以形成稳定的溶胶, 而加入适量三乙醇胺后, 溶胶的凝胶时间长且稳定。 本实验中, 溶胶可在48 h以内用来制备TiO2 薄膜, 但涂膜的最佳陈化时间为2~24 h。 陈化时间长, 涂覆的薄膜不易均匀, 并有开裂现象; 陈化时间过短(或不进行陈化), 则薄膜内易出现小气泡。
2.2 TiO2薄膜的物相分析
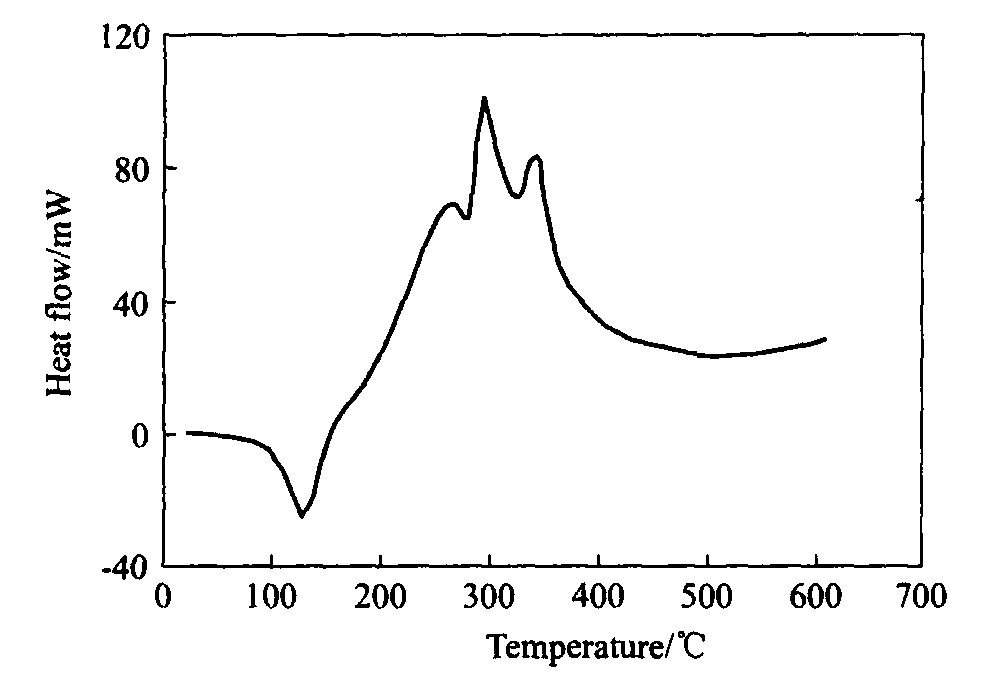
图1所示为TiO2 凝胶的DSC曲线。 由图1可见, 从80 ℃开始出现一个大的吸热谷, 这是由于凝胶中的吸附水和乙醇等物质的挥发引起的; 在约250 ℃处有一较小的放热峰, 可能是TiO2 由无定形向锐钛矿转变时所产生的
[9 ]
; 在280 ℃处有一大的放热峰, 估计在这个温度附近发生了残余有机相的分解和燃烧, 此后则发生聚合反应形成化学键
[10 ]
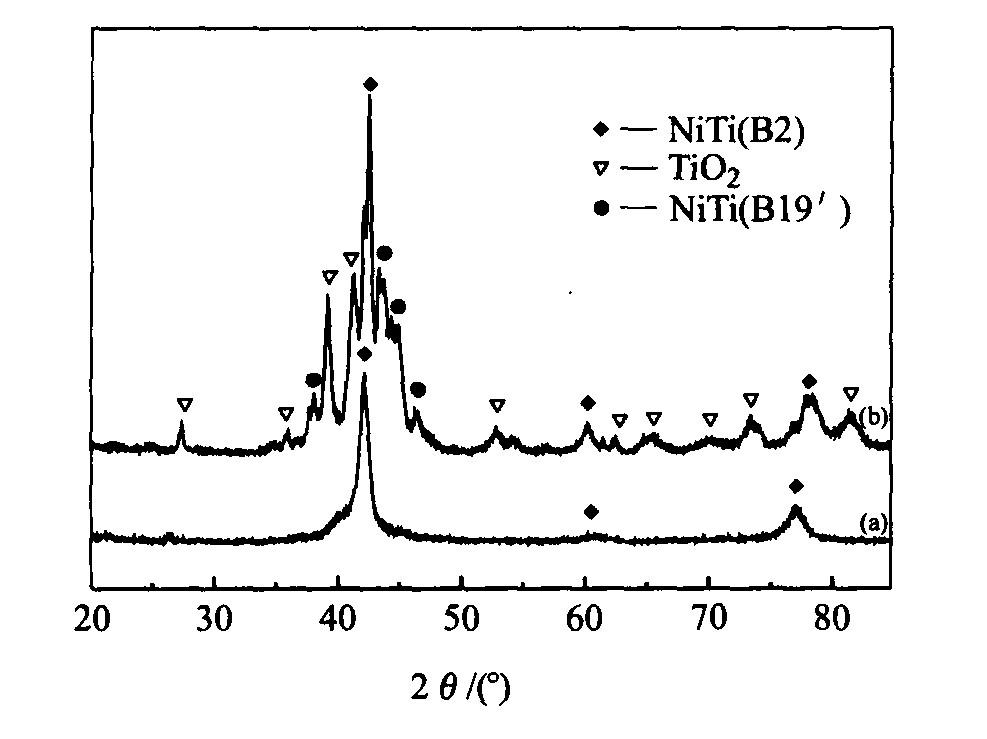
; 在350 ℃左右有一放热峰, 为锐钛矿向金红石结构转变开始温度; 至500 ℃曲线已经基本保持稳定, 说明锐钛矿向金红石转变已基本完成。 图2所示的XRD谱证实了制备的TiO2 膜为金红石型, 涂膜前NiTi在室温为母相状态, M s 和A s 温度都在室温以下, 涂膜后并经500 ℃热处理1 h, 基体可能出现少量富Ni析出相, 基体的成分发生变化, 改变了相变温度, 冷却至室温出现了B19′马氏体。
2.3 TiO2薄膜的血液相容性
图1 TiO2凝胶DSC曲线
Fig.1 DSC curve of TiO2 gel
图2 TiO2凝胶XRD谱
Fig.2 XRD patterns of TiO2 gel (a)—As-received NiTi; (b)—NiTi after sol-gel treatment
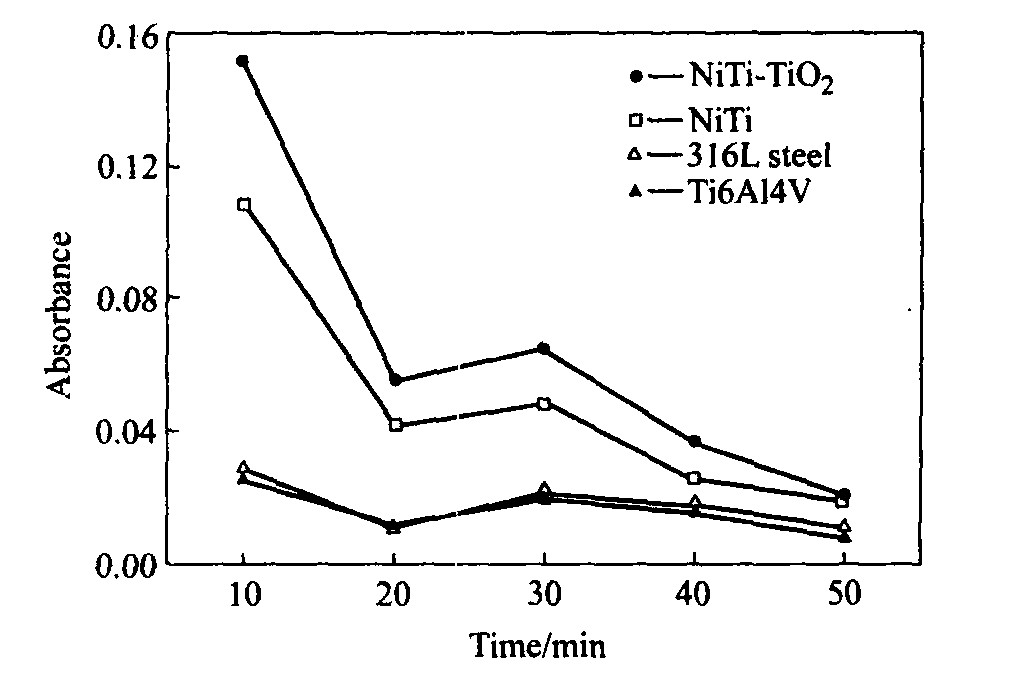
图3所示为动态凝血时间测试结果, 可以看出, 与血液的接触时间相同时, 表面制备TiO2 薄膜的NiTi合金比NiTi基体、 316L不锈钢、 Ti6Al4V合金的吸光度值高, 当材料与血液接触时发生溶血反应, 未凝血的红细胞溶解在水中, 溶解在水中的自由的红细胞越多, 吸光度值越高, 从而凝结在样品上的红细胞数量就少, 说明材料的抗凝血作用越强, 显然TiO2 薄膜有较好的抗凝血性。 凝血过程大体上分为3个阶段: 因子X(Stuart factor)的激活和凝血酶原激活物的形成; 凝血酶原激活成为凝血酶; 纤维蛋白原转变成为纤维蛋白。 血液凝固过程起主要作用的是第3阶段, 即凝血酶催化纤维蛋白原分解, 使每一分子纤维蛋白原脱去4个小分子肽, 转变成纤维蛋白单体。 这些单体互相交织、 形成疏松的网状(可溶、 不稳定), 在激活因子作用下, 单体间以共价键形成纤维蛋白多聚体, 即不溶于水的血纤维。 凝血曲线整体呈下降趋势说明血液逐渐凝固, 但在30 min时几种材料吸光度值都有少许升高, 这与一些研究者的实验结果类似
[11 ,12 ,17 ,18 ]
。 凝血过程的前2个阶段及血小板栓子形成时都需有Ca2+ 的参与, TiO2 的等电点为6.2
[13 ]
, 在血液pH=7.4下, 呈负电性, 负电性表面将不会吸附带有负电荷的血小板等组分。 血液与TiO2 膜表面接触触发内源性血液凝固反应, 呈负电性的TiO2 薄膜具有诱导血液中Ca2+ 的作用, 经一定时间接触后, 血液中Ca2+ 逐渐吸附到TiO2 薄膜表面, 血液中Ca2+ 减少, 凝固速度减慢, 血液中的抗凝因子发挥作用, 血纤维蛋白溶酶是血浆中活性最强的蛋白溶解酶, 能将蛋白质溶解分割成许多可
图3 吸光度值随材料与 血液接触时间的变化曲线
Fig.3 Absorbance of different materials versus time
溶性小分子肽, 血凝块中的纤维蛋白在血纤维蛋白溶酶的作用下变成纤维蛋白原降解产物(FDP), 从而使血凝块逐渐溶解消失。
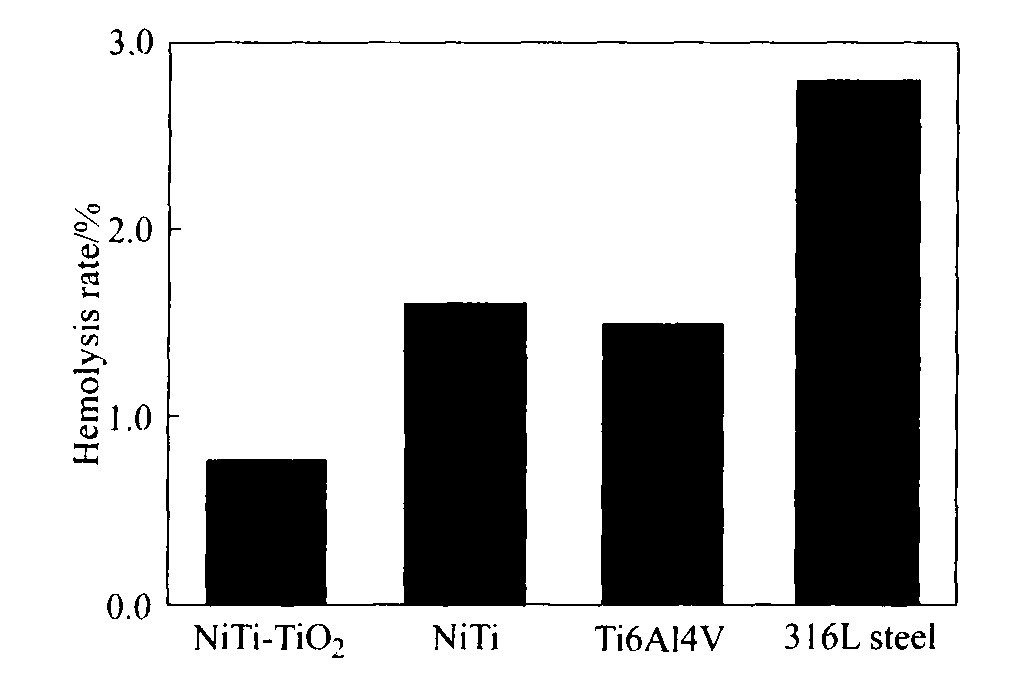
图4所示为涂TiO2 薄膜的NiTi合金和未涂膜的NiTi合金、 316L不锈钢、 Ti6Al4V合金的溶血率测试结果。 由图4可知, 表面涂有TiO2 薄膜后, NiTi合金的溶血率显著下降, 并且溶血率<1%, 满足医学标准所规定的植入物溶血率<5%的要求。 溶血率越小表明材料对血红细胞的破坏程度越轻, 血液相容性越好。
图4 不同材料的溶血率
Fig.4 Hemolysis rate of different materials
有学者
[14 ]
认为血液相容性是材料表面能和功函数共同作用的结果, 表面能决定对蛋白质的吸附, 而功函数决定蛋白质分解, 材料对纤维蛋白吸附越少, 抗凝性越好。 纤维蛋白吸附后, 延长其分解是提高抗凝性的有效手段。 纤维蛋白原是一种类似于本征半导体的材料
[15 ]
, 和它接触的生物材料必须具有较小的功函数, 才能阻止电荷从蛋白质向生物材料转移, 抑制其分解。 对氧化钛进行N型掺杂或引入大量的氧缺位、 钛填隙能提高氧化钛的费米能级, 从而减小氧化钛的功函数。 尽管有研究表明锐钛矿相比金红石相的TiO2 晶体的费米能级高0.1 eV
[16 ]
, 但金红石型二氧化钛比锐钛矿型结构致密, 表面均匀, 有利于血液相容性的提高。
有研究
[14 ]
表明, 氧化钛薄膜中O/Ti比值越小, 费米能级越接近导带, 其抗凝血性越好。 材料对可见光的吸收亦与费米能级高低有关, 费米能级越高, 氧化钛薄膜所能吸收的光子能量越高, 也就是说, 对光的吸收增强向短波方向移动, 例如对于颜色分别为蓝色和金黄色的2种薄膜, 金黄色薄膜的费米能级更高。 由此推断, 对于同样致密度和厚度的氧化钛薄膜来说, 薄膜颜色不同, 抗凝血性能也是不同的, 相比之下, 金黄色氧化钛薄膜的血液相容性更好。 当然, 这还需进一步的实验证实。
3 结论
1) 用溶胶-凝胶法在NiTi合金表面制备的TiO2 薄膜结构为金红石型。
2) 表面制备TiO2 膜后的NiTi合金与NiTi基体、 316L不锈钢、 Ti6Al4V相比, 抗凝血性更好, 红细胞的破坏作用更轻, 说明TiO2 薄膜改善了NiTi合金的血液相容性。
参考文献
[1] 黄 楠,杨 萍,曾晓兰,等.离子束合成Ti O薄膜对热解碳生物材料表面改性的研究[J].中国生物医学工程学报,1997,16(3):199205.HUANGNan,YANGPing,ZENGXiao lan,etal.SurfacemodificationofLTIcarbonbytitanium oxidecoatingsynthesisedbyionbeam[J].ChineseJournalofBiomedicalEngineering,1997,16(3):199205.
[2] YuhiaT,KikutaY,MitamuraY,etal.Bloodcompatibilityofsputterdepositedaluminafilms[J].BiomedMaterRes,1994,28(2):217224.
[3] AmonM,BolzA,SchaldachM.Improvementofstentingtherapywithasiliconcarbidecoatedtantalumstent[J].MaterSciMaterMed,1996,7(5):273278.
[4] ShirkhanzaehM.XRDandXPScharacterizationofsuperplasticTiO2coatingspreparedonTi6Al4Vsurgicalalloybyanelectrochemicalmethod[J].MaterSciMaterMed,1995,6(4):206210.
[5] ThierryB,TabrizianM,SavadogoO,etal.EffectsofsterilizationprocessesonNiTialloy:Surfacecharacterization[J].JBiomedMaterRes,2000,49:8898.
[6] ChengFT,ShiP,ManHC.ApreliminarystudyofTiO2depositiononNiTibyahydrothermalmethod[J].SurfaceandCoatingsTechnology,2004,181(1):2632.
[7] WANGXiang hui,FENGZhang,LIChang rong,etal.Improvementofbloodcompatibilityofartificialheartvalvesviatitaniumoxidefilmcoatedonlowtemperatureisotropiccarbon[J].SurfaceandCoatingsTechnology,2000,128129:3642.
[8] 于向阳,程继健,杜永娟.TiO2光催化薄膜的制备法[J].玻璃与搪瓷,2001,29(1):3741.YUXiang yang,CHENGJi jian,DUYong juan.WaysofformingTiO2photocatalyticfilm[J].Glass&Enamel,2001,29(1):3741.
[9] 闫继娜,余桂郁,杨南如.溶胶 凝胶法制备TiO2分离膜的研究[J].硅酸盐通报,1997,3:1317.YANJi na,YUGui yu,YANGNan ru.StudyonthepreparationofTiO2separationmembraneusingsol geltechnique[J].BulletinoftheChineseCeramicSociety,1997,3:1317..
[10] 吴凤清,阮圣平,李晓平,等.纳米TiO2的制备,表征及光催化性能的研究[J].功能材料,2001,32(1):6971.WUFeng qing,RUANSheng ping,LIXiao ping,etal.Synthesis,characterizationandphotocatalyticdegradationpropertiesofTiO2nanocrystalline[J].FunctionalMaterials,2001,32(1):6971.
[11] 刘敬肖,杨大智,史 非,等.金属表面TiO2薄膜的溶胶 凝胶法制备及其血液相容性研究[J].中国生物医学工程学报,2002,21(5):398403.LIUJing xiao,YANGDa zhi,SHIFei,etal.PreparationofTiO2filmonmetallicsubstratesbysol gelmethodandstudyonitshemocompatibility[J].ChineseJournalofBiomedicalEngineering,2002,21(5):398403.
[12] ChenJY,LengYX,TianXB,etal.AntithrombogenicinvestigationofsurfaceenergyandopticalbandgapandhemocompatibilitymechanismofTi(Ta+5)O2thinfilms[J].Biomaterials,2002,23:25452552.
[13] ShirkhanzadehM.Nanoporousalkoxy derivedtitaniumoxidecoating:areactiveoverlayerforfunctionalizingtitaniumsurface[J].MaterSciMaterMed,1998,9(6):355362.
[14] 张 峰,李昌荣,王向晖.氧化钛薄膜的血液相容性机理探讨[J].生物医学工程学杂志,2000,17(2):146150.ZHANGFeng,LIChang rong,WANGXiang hui,etal.Studyonthemechanismofhemocompatibilityoftitaniumoxidefilms[J].JournalofBiomedicalEngineering,2000,17(2):146150.
[15] EleyD,SpiveyD.Thesemiconductivityoforganicsubstances,part6[J].TransFransFaradaySoc,1960,56:14321433.
[16] AttiaSM,吴广明,马建华,等.热处理对溶胶 凝胶TiO2薄膜的特性影响[J].同济大学学报,2001,29
(11):13271330.AttiaSM,WUGuang ming,MAJian hua,etal.EffectofheattreatmentonpropertiesofTiO2filmspreparedwithsolgelmethod[J].JournalofTongjiUniversity,2001,29
(11):13271330.