文章编号: 1004-0609(2005)04-0643 -07
溶胶-凝胶法制备钙钛矿型纳米钛酸锶
张文魁, 童希立, 黄 辉, 甘永平, 黄 娜
(浙江工业大学 化学工程与材料学院, 杭州 310014)
摘 要: 以硝酸锶和钛酸丁酯为原料, 采用溶胶-凝胶法制备了钙钛矿型纳米SrTiO3。 采用红外光谱、 差热分析、 X射线衍射、 扫描电镜及紫外吸收等测试手段, 研究了影响溶胶-凝胶过程的诸因素, 对制备的SrTiO3粉体的结构和性质进行了表征。 结果表明: 乙醇、 冰醋酸、 水、 丙三醇、 温度及pH值均对溶胶-凝胶过程有明显影响, 其中反应温度对胶体形成时间长短和胶体质量影响最明显。 钙钛矿型SrTiO3晶体于650℃时生成, 随着热处理温度的升高, 粉体的物相组成将发生变化, 粉体的尺寸也有所增加, 相应的紫外吸收峰也出现红移现象。
关键词: 钙钛矿型催化剂; 钛酸锶; 溶胶-凝胶; 晶体结构 中图分类号: TB321
文献标识码: A
Preparation of perovskite-type nano-SrTiO3 by sol-gel process
ZHANG Wen-kui, TONG Xi-li, HUANG Hui, GAN Yong-ping, HUANG Na
(College of Chemical Engineering and Material Science,Zhejiang University of Technology, Hangzhou 310014, China)
Abstract: By using Sr(NO3)2 and Ti(OBu)4 as raw materials, nano-sized SrTiO3 powder was prepared by the sol-gel process. By means of IR, TG-DTA, XRD, SEM and UV analysis, the different factors affecting the sol-gel process were investigated, and the crystal structure and characteristics of the as-prepared SrTiO3 powder were analyzed. The experimental results show that the factors including alcohol, acetic acid, water, propyl alcohol, temperature and pH value have obvious influence in sol-gel process, especially, in which the reaction temperature is the most important factor for the gelation time and quality of the gel. Perovskite SrTiO3 is formed at heat treatment temperature of 650℃. With the increase of heat treatment temperature, the phase abundance of SrTiO3 is improved and the SrTiO3 crystal grows as well. A red shift phenomenon is observed in UV spectrum for the corresponding powder.
Key words: perovskite catalyst; strontium titanate; sol-gel; crystal structure
钛酸锶(SrTiO3)具有典型的钙钛矿型结构, 是一种用途广泛的电子功能陶瓷材料, 具有介电常数高、 介电损耗低、 热稳定性好等特点, 广泛应用于电子、 机械和陶瓷工业[1]。 同时, 作为一种功能材料, 钛酸锶具有禁带宽度高(3.2eV)、 光催化活性优良等特点, 在光催化分解水制氢[2]、 光催化降解有机污染物[3]和光化学电池[4]等光催化领域也得到了广泛的应用。 为了提高SrTiO3的光催化活性,将SrTiO3进行纳米化是一种有效的途径, 近年来 国内外已经研究了许多制备纳米SrTiO3的新方法[5-11]。 本文作者采用溶胶-凝胶技术, 以硝酸锶和钛酸丁酯为原料, 在低温下合成了高纯、 超细单一钙钛矿型SrTiO3粉末作为光化学电池用光催化剂, 并对其影响因素和基本特性进行了初步研究。
1 实验
将硝酸锶溶解在水和冰醋酸的混合液中, 形成均匀透明的溶液A。 将钛酸丁酯均匀分散在无水乙醇中形成溶液B。 再把溶液B滴到溶液A中, 并不断搅拌, 滴完后加入丙三醇继续搅拌0.5h, 然后静置成胶, 在60℃水浴锅中干燥, 最后在马弗炉中煅烧获得SrTiO3粉体。 实验中采用的原料均为分析纯试剂。
样品的X射线衍射实验采用Thermo ARL SCINTAG XTRA粉末衍射仪, CuKα辐射, 连续扫描方式采样, 扫描速度为2.4(°)/min, 2θ角度扫描范围为15°~70°。 扫描电镜实验在Hitachi S-4700Ⅱ型扫描电子显微镜上进行。
干凝胶的红外吸收光谱采用Nicolet公司的NEXUS 670红外光谱仪测定, KBr压片。 干凝胶的差热分析实验采用美国PE公司的Pyris diamond TG/DTA测试仪, N2气氛, 升温速度为10℃/min, 气体流速为100mL/min, 环境温度为25℃。
SrTiO3粉末的紫外吸收测试采用VARIN CARY-50紫外吸收光谱仪, 将纳米SrTiO3粉末溶解在无水乙醇中, 用超声波分散5min, 然后进行紫外吸收特性测试。
2 结果与讨论
2.1 影响溶胶-凝胶法制备SrTiO3的因素
在溶胶-凝胶过程中, 金属醇盐的水解和缩聚是最重要的反应, 两者同时发生, 金属醇盐的水解和缩聚反应是均相溶液转变为溶胶的根本原因[12]。 YAN等[13]认为水解和缩聚过程主要受相应的溶剂浓度、 冰醋酸及水等因素影响。 实际上, 溶液的pH值、 反应温度等因素也会对金属醇盐的水解和缩聚反应产生明显影响。 因此, 本实验在参考前人结果的基础上[13], 通过改变单一影响因素的大小来评价该参数对溶胶-凝胶法制备SrTiO3的影响。
2.1.1 乙醇
无水乙醇是一种很好的分散剂, 表面张力小, 有利于后期三维网状胶体的干燥。 取Sr(NO3)2和Ti(OBu)4各0.01mol, CH3COOH 20mL, H2O 20mL, 温度20℃, 甘油6mL, 通过改变无水乙醇的量研究其对成胶时间的影响, 结果列于表1。
表1乙醇量与成胶时间的关系
Table 1 Relationship between gelation time and amount of C2H5OH

无水乙醇的主要作用是分散Ti(OBu)4(见表1), 当无水乙醇量不足时, Ti(OBu)4将与空气中的水分反应, 使溶液变浑; 而当无水乙醇与冰醋酸的比例超过1∶2后, 进一步增加乙醇的量对成胶时间的影响不大。
2.1.2 冰醋酸
冰醋酸是溶胶-凝胶法制备SrTiO3的主要溶剂, 作为螯合剂来控制金属醇盐的水解和缩聚反应的速率。 取Sr(NO3)2和Ti(OBu)4各0.01mol, CH3CH2OH 40mL, H2O20mL, 甘油6mL, 温度为40℃, 通过改变冰醋酸的量研究其对成胶时间的影响, 结果列于表2。
表2冰醋酸加入量与成胶时间的关系
Table 2Relationship between gelation time and amount of CH3COOH
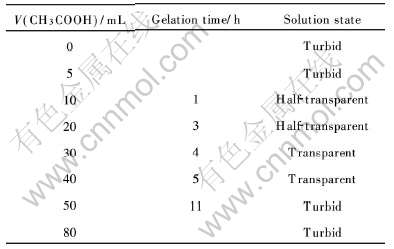
由表2可见, 随着冰醋酸浓度的增加, 成胶时间不断延长, 这是由于醋酸根的负离子具有强亲核性, 而Ti(OBu)4具有强亲电性, 因此醋酸与Ti(OBu)4发生如下反应:
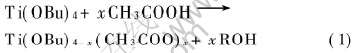
醋酸根逐步取代Ti(OBu)4中的—OBu形成二配位基团, 反应进程取决于溶液中的醋酸含量。 所形成的Ti(OBu)4-x(CH3COO)x比Ti(OBu)4难以水解缩聚, 因此凝胶时间延长。 当冰醋酸量过少时, 过量的Ti(OBu)4将同H2O反应生成TiO2·H2O沉淀, 使溶液变浑浊; 而冰醋酸的量过多时, 最终将生成Ti(CHCOO)4沉淀, 也使得溶液变浑浊。
2.1.3 水
在溶胶-凝胶过程中, 水可以溶解原料盐, 并使溶胶和凝胶得以形成。 同样取Sr(NO3)2和Ti(OBu)4各0.01mol, CH3COOH20mL, CH3CH2OH40mL, 甘油6mL, 温度为40℃, 通过改变水的加入量来研究其对成胶时间的影响, 结果列于表3。
表3水加入量与成胶时间的关系
Table 3Relationship between gelation time and amount of H2O
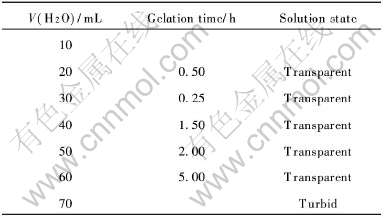
由表3可见, 成胶时间先随水量增加而减小, 然后随水量增加而延长, 最后溶液变浑浊。 —OH基团易于取代—OBu基团, 有利于分子间聚合, 加快成胶步骤。 当水量少时, 发生—OH基团取代—OBu基团的反映, 如式(2)所示。 当水量继续加大时, 将发生—OH基团取代—CH3COO基团的反应, 使分子间聚合速度减慢, 导致成胶时间延长。 当水量过多时, 将生成Ti(OH)4沉淀, 使溶液变浑浊, 反应式如下:
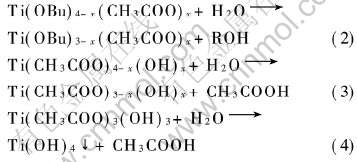
2.1.4 丙三醇
丙三醇是一种醇盐粒子的有机添加剂, 具有强粘性、 吸附性和低的挥发性。 取Sr(NO3)2和Ti(OBu)4各0.01mol, CH3COOH 20mL, CH3CH2OH 40mL, H2O 20mL, 温度为20℃, 通过改变丙三醇的加入量研究其对成胶时间的影响, 结果列于表4。
表4 丙三醇加入量与成胶时间的关系
Table 4 Relationship between gelation time and amount of propyl alcohol
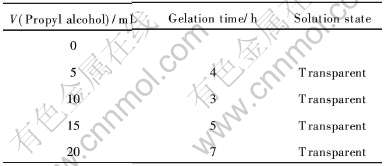
从表4可以看出, 当不加入丙三醇时, 溶液稳定不成胶, 这是由于凝胶的形成是通过溶胶中单体间的聚合完成的, 而聚合只有在单体间相互接触时才能发生[14]。 不存在丙三醇时, 单体间接触少且不稳定, 聚合现象不易发生, 分子间的聚合-分离是可逆的, 反应没有超过溶胶-凝胶的转变点[15]。 加入丙三醇后, 将吸附溶胶中的单体, 使单体易接触且不易分开, 反应将超过溶胶-凝胶的转变点, 最终形成凝胶。 从表4中还看出, 成胶时间随着丙三醇量的增加先减少随后上升, 可能是由于开始时少量的丙三醇可吸附水和胶粒, 并抑制冰醋酸的挥发, 促进水解缩聚反应; 但随着丙三醇量的加大, 它将与醇盐之间发生醇解反应, 生成金属醇盐并产生分子缔合, 比原来的金属醇盐更难水解, 从而使成胶时间延长。
2.1.5 温度
取Sr(NO3)2和Ti(OBu)4各0.01mol, CH3COOH 20mL, CH3CH2OH 40mL, H2O 20mL, 丙三醇6mL, 研究温度对成胶时间的影响, 结果列于表5。
表5 温度对成胶时间的影响
Table 5 Effect of temperature on gelation time

由表5可见, 随着温度的升高, 成胶时间迅速缩短, 表明温度对成胶时间的影响比其他因素更明显。 温度升高, 将增强粒子的热运动和相互之间的接触, 促进水解和缩聚反应。 同时, 溶胶-凝胶过程是吸热过程, 温度升高, 可促进反应进行, 因此提高温度可大幅度减少成胶时间。 但温度过高, 将发生多种形式的水解-聚合反应, 同时使胶体开裂, 影响胶体的质量。 因此, 溶胶-凝胶过程中, 不宜采用太高的温度, 一般取40℃以下较合适。
2.1.6 pH值
取Sr(NO3)2和Ti(OBu)4各0.01mol, CH3COOH 20mL, CH3CH2OH 40mL, H2O 20mL, 丙三醇6mL, 温度为20℃, 通过加减HNO3和NH3·H2O来研究pH值对溶胶-凝胶过程的影响, 结果列于表6。
表6 pH值对成胶时间的影响
Table 6 Effect of pH on gelation time
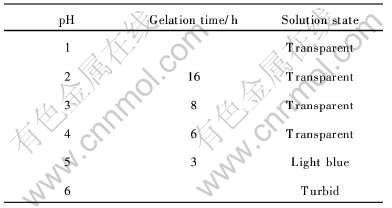
由表6可见, 当pH≤1或pH≥6时, 不能形成胶体。 当2〈pH〈6时, 成胶时间随pH值升高而缩短, 表明H+浓度过高将限制CH3COO-产生, 使以下反应难以发生:
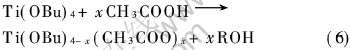
因此pH过小时, 不能形成胶体。 而pH值增大时, 此反应加快, 使成胶时间缩短。 但是当pH值超过一定范围时, 将发生如下反应:
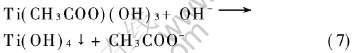
从而使溶液变浑浊, 因此pH值对溶胶-凝胶过程的影响非常重要。
2.1.7 影响溶胶-凝胶法制备SrTiO3的各因素评价
通过以上各因素的分析和比较, 乙醇、 冰醋酸、 水、 丙三醇、 温度及pH值均对溶胶-凝胶过程有明显影响, 其中反应温度对胶体形成时间和胶体质量影响最明显, 提高溶胶-凝胶过程的反应温度, 可大幅度降低成胶时间。 因此, 要获得优质的前驱体, 在确定乙醇、 冰醋酸、 水、 丙三醇及pH值等因素的前提下, 需要严格控制反应温度。
2.2 凝胶的红外吸收光谱分析
图1所示为前驱体和700℃热处理2h后制备的SrTiO3粉末的红外吸收光谱。 可见, 前驱体在2920cm-1附近出现的吸收峰对应CH-3和CH-2基团的伸缩振动吸收峰, 3400cm-1左右是OH-伸缩振动峰。 700℃热处理2h后, 2920cm-1附近出现的吸收峰则几乎消失, 3400cm-1左右的吸收峰也明显减弱且向高频偏移, 表明热处理后有机物基本分解, 氢键作用明显减弱。 CH3COOH的两个吸收峰对应图中的1719.91cm-1和1268.31cm-1位置, 550.09cm-1左右位置的峰是Ti—O, Sr—O键振动峰。 在1650cm-1和1200cm-1之间则是COO-根与Sr或Ti结合振动峰。 前驱体在1400cm-1和800cm-1之间的大量峰存在, 说明凝胶中含有大量的烷基团、 醋酸以及醋酸根, 这些基团在700℃热处理2h后基本分解完毕。
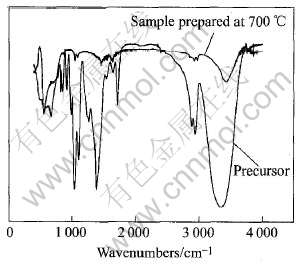
图1前驱体和700℃热处理2h后制备的SrTiO3的红外吸收光谱
Fig.1IR spectra of precursor and SrTiO3 powder prepared at 700℃ for 2h
2.3 干凝胶的差热分析
图2所示为干凝胶的TG—DTA—DTG曲线。 图中ws为样品的质量分数, 整个过程可以分成为5个阶段: 1)50~150℃, 样品质量损失率为2.38%, 这是干凝胶的脱水过程; 2)150~400℃, 样品质量损失率为20.12%, 主要是有机物的热分解, 如冰醋酸, 正丁醇, 丙三醇等, 因此在DTG上有许多杂峰; 3)400~560℃, 样品质量损失率为1.32%, 残留有机物的进一步分解, 质量损失少; 4)560~680℃, 样品质量损失率为11.49%, 对应DTA曲线上650℃处的吸热峰是SrCO3和TiO2反应生成SrTiO3晶体和放出CO2气体的吸热峰; 5)680~800℃, 样品质量损失率仅为0.51%, 表明样品已基本稳定。
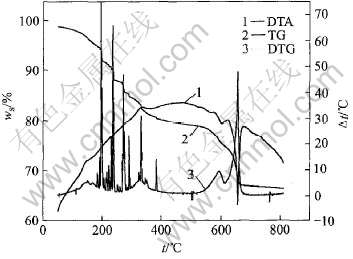
图2 干凝胶的TG—DTA—DTG曲线
Fig.2 TG—DTA—DGT cuves of drying gel
2.4 SrTiO3粉末的X射线衍射和原子力显微镜分析
图3所示为不同温度处理后的钛酸锶凝胶的X射线衍射谱。 可见, 前驱体的热处理温度低于400℃时, 得到的样品为非晶态, 同时X射线衍射谱中有Sr(NO3)2衍射峰存在, 表明Sr(NO3)2尚未完全分解。 热处理温度为600℃时, 出现部分的SrTiO3衍射峰, 表明此温度下钙钛矿型结构SrTiO3开始生成, 同时Sr(NO3)2的衍射峰完全消失, 说明Sr(NO3)2已经分解完。 但同时样品中SrCO3对应的衍射峰达到最强, 说明SrCO3不仅已经形成而且是产物中的主要成分。 热处理温度超过700℃后, SrCO3的衍射峰逐渐减弱, 在1000℃时基本完全消失, 表明SrCO3已完全分解。 SrTiO3的衍射峰强度随着温度升高不断增强, 衍射峰的半峰宽变窄, 表明SrTiO3的结晶性提高。 SrTiO3的晶粒大小根据Scherrer公式计算[15]:
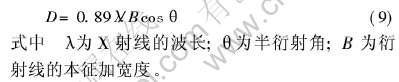
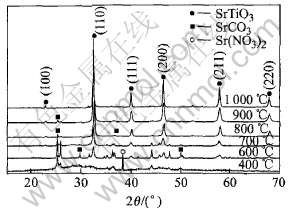
图3 凝胶热处理时间为1h时不同温度处理后钛酸锶凝胶的X射线衍射谱
Fig.3 XRD patterns of strontium titanate prepared at different temperatures for 1h
根据式(9), 可以计算出经过800℃热处理1h后得到SrTiO3粉末, 垂直于(110)、 (200)、 (211)晶面的晶粒平均厚度分别为19.7, 14.7, 14.9nm, 制得的晶体为纳米级。
图4所示为热处理温度对SrTiO3晶格常数的影响。 随着热处理温度的升高, SrTiO3的晶格参数有增大的倾向, 表明热处理温度的升高促进晶体生长。 图5所示为700℃热处理2h后制备的SrTiO3粉末的原子力显微镜照片。 可见, 热处理后的 SrTiO3粉末有团聚现象(图5(a)), 经过超声波分 散后, 团聚的SrTiO3粉末被分散成单一的颗粒, 平均粒径约为180nm(图5(b))。
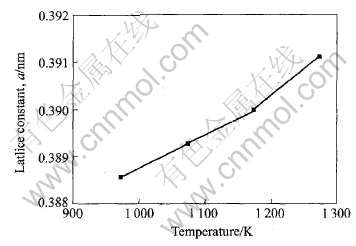
图4 热处理温度对SrTiO3晶格常数的影响
Fig.4 Effect of heat treatment temperature on lattice constant of SrTiO3
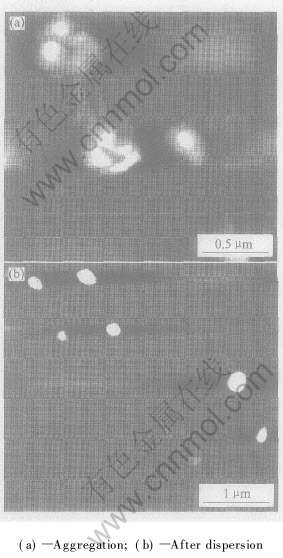
图5 700℃热处理2h后制备的SrTiO3粉末的原子力显微镜像
Fig.5 AFM images of SrTiO3 powder prepared at 700℃ for 1h
2.5 SrTiO3粉体的紫外分析
图6所示为不同温度下制备的SrTiO3粉末的紫外吸收光谱。 结果表明, 本实验制备的SrTiO3粉末在紫外区200~220nm区域存在明显的吸收峰。 对600℃热处理的样品, 其吸收峰位置约为203.6nm, 当热处理温度为700~900℃时, 吸收峰的位置向长波方向偏移, 分别约为204.5, 204.8和205.1nm, 且吸收峰的强度也随着热处理温度的升高而增加, 表明SrTiO3粉末的紫外光最大吸收位置发生红移。 根据纳米材料的量子尺寸效应可知, 随着粒子尺寸减少, 吸收峰将会发生蓝移, 而粒子尺寸增加, 则吸收峰发生红移。 本实验结果表明, 随着温度升高, 晶体生长造成晶粒变大, 因此, 吸收峰发生红移, 与紫外吸收的结果一致。
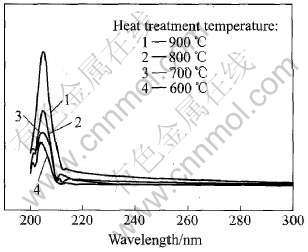
图6 不同温度热处理后SrTiO3粉末的紫外吸收光谱
Fig.6 UV spectra of SrTiO3 powder heat-treated at different temperatures for 1h
3 结论
1) 纳米SrTiO3粉体可以通过溶胶-凝胶法制得, 乙醇、 冰醋酸、 水、 丙三醇、 温度及pH值均对溶胶-凝胶过程有明显影响, 其中反应温度对胶体形成时间和胶体质量影响最明显, 提高溶胶-凝胶过程的反应温度, 可大幅度降低成胶时间。 因此, 要获得优质的前驱体, 在乙醇、 冰醋酸、 水、 丙三醇及pH值等因素确定的前提下, 需要严格控制反应温度。
2) 溶胶-凝胶法制备的SrTiO3粉体粒径分布均匀, 随着热处理温度的升高, SrTiO3粉体的晶型更加完整, 颗粒度和晶格常数增大, 相应的紫外光最大吸收位置发生红移。
REFERENCES
[1] Sabolsky E M, Jame A R, Kowom S, et al. Piezoelectric properties of 〈001〉 textured Pb(Mg1/3Nb2/3)O3-PbTiO3[J]. Appl Phys Lett, 2001, 78(17): 2551-2553.
[2] Avudaithai M, Kutty T R N. Ultrafine powders of SrTiO3 from the hydrothermal preparation and their catalytic in the photolysis of water[J]. Materials Research Bulletin, 1987, 22(5): 641-650.
[3] Kato H, Kudo A. Visible-light-response and photocatalytic activities of TiO2 and SrTiO3 photocatalysts codoped with antimony and chromium[J]. J Phys Chem B, 2002, 106: 5029-5034.
[4] Akuto K, Sakurai Y A. Photochargeable metal hydride/air battery[J]. J Electrochem Soc, 2001, 148(2): A121-A125.
[5] ZHANG Shi-cheng, LIU Jia-xiang, HAN Yue-xin, et al. Formation mechanism of SrTiO3 nanoparticles under hydrothermal conditions[J]. Material Science and Engineering B, 2004, 110: 11-17.
[6] LIU Han-xing, SUN Xiao-qin, ZHAO Qing-lin, et al. The syntheses and microstructures of tabular SrTiO3 crystal[J]. Solid-state Electronics, 2003, 47: 2295-2298.
[7] WANG Jin-shu, YIN Shu, Komatsu M, et al. Preparation and characterization of nitrogen doped SrTiO3 photocatalyst[J]. Journal of Photochemistry and Photobiology A, 2004, 165: 149-156.
[8] Wang X W, Zhang Z Y, Zhou S X. Preparation of nano-crystalline SrTiO3 powder in sol-gel process[J]. Material Science and Engineering B, 2001, 86: 29-33.
[9] Selvaraj U, Alamanda V, Sridhar K, et al. Sol-gel processing of oriented SrTiO3 thin films[J]. Materials Letters, 1995, 23: 123-137.
[10] Poth J, Haberkorn R, Beck H P. Combustion-synthesis of SrTiO3[J]. Journal of the European Ceramic Society, 2000, 20: 707-713.
[11] GAO Yan-feng, Yoshitake M, Tetsu Y, et al. Preparation of SrTiO3 thin films by the liquid phase deposition[J]. Materials Science and Engineering B, 2003, 99: 290-293.
[12] 周祖康, 顾惕人, 马季铭. 胶体化学基础[M]. 北京: 北京大学出版社, 1987. 321.
ZHOU Zu-kang, GU Ti-ren, MA Ji-ming. Basis of Collochemistry[M]. Beijing: Beijing University Press, 1987. 321.
[13] YAN Xiu-ru, WANG Jun-zhen, WANG Jian-ping, et al. The preparation of perovskite type steontium titanate by sol-gel process[J]. Transactions of Tianjin University, 1995, 1(2): 139-144.
[14] YAN Hong-wei, YUAN Qi-hua, OUYANG Shi-xi, et al. Preparation of pure PbTiO3 powder by sol-gel techique[J]. Functional Materials, 1994, 25(4): 338.
[15] 张志焜, 崔作林. 纳米技术和纳米材料[M]. 北京: 国防工业出版社, 2000. 134.
ZHANG Zhi-kun, CUI Zuo-lin. Nanotechnology and Nanomaterials[M]. Beijing: National Defence Industry Press, 2000. 134.
基金项目: 国家自然科学基金资助项目(50201016, 50402020)
收稿日期: 2004-09-08; 修订日期: 2004-12-14
作者简介: 张文魁(1969-), 男, 博士, 教授.
通讯作者: 张文魁, 教授; 电话: 0571-88320394; 传真: 0571-88320394; E-mail: echem@zjut.edu.cn
(编辑 陈爱华)


