中国有色金属学报 2004,(12),2125-2130 DOI:10.19476/j.ysxb.1004.0609.2004.12.026
锂离子电池电解液过充添加剂的行为
中南大学冶金科学与工程学院,中南大学冶金科学与工程学院,中南大学冶金科学与工程学院,中南大学冶金科学与工程学院 长沙410083 ,长沙410083 ,长沙410083 ,长沙410083
摘 要:
制备了 3种 1mol/LLiPF6电解液 ,溶剂组成分别为 :1)碳酸乙烯酯 ,碳酸二甲酯和碳酸甲乙酯 ;2 )碳酸乙烯酯 ,碳酸二甲酯 ,碳酸甲乙酯和 4 %联苯 ;3)碳酸乙烯酯 ,碳酸二甲酯 ,碳酸甲乙酯和 4 %环己基苯。采用线性电压扫描法、锂循环效率法、锂离子电池的循环性能法和 3C倍率过充的方法测试了联苯与环己基苯电解液过充添加剂的行为。结果表明 :环己基苯是一种较实用的锂离子电池电解液过充添加剂 ,环己基苯的电化学稳定性比联苯的高 ,环已基苯的氧化电势为 4 .72V(vsLi/Li+ ) ,联苯的为 4 .5 4V(vsLi/Li+ ) ;以 1mA电流循环 2 0次后 ,联苯的铂电极锂循环效率为 15 .7% ,环己基苯的为 5 9.3% ;锂离子电池以 1C循环 15 0次后 ,环己基苯的容量保持率为 88% ,联苯的为 76 .3%。环己基苯与联苯添加剂都改善了锂离子电池的耐过充性能 ,且两者的效果十分接近
关键词:
中图分类号: TM911
作者简介:胡传跃(1972),男,博士研究生.电话:07318836633;Email:huchuanyue@vip.sina.com;
收稿日期:2004-06-18
Behavior of overcharging additives for electrolyte used in Li-ion batteries
Abstract:
Three kinds of 1 mol/L LiPF6 electrolytes were prepared in various mixed solvents. The components of the electrolytes were as follows: 1) ethylene carbonate (EC), dimethylene carbonate (DMC), ethylmethyl carbonate (EMC); 2) EC, DMC, EMC+4% biphenyl (BP); 3) EC, DMC, EMC+4% cyclohexylbenzene (CB). The behaviors of electrolytes were analyzed by linear sweep voltage, lithium cycling efficiency, cycling performance and overcharging with 3C of lithium-ion batteries. The results show that CB is a kind of practical overcharging additive for electrolyte. The CB exhibits better electrochemical stability than BP due to the oxidation potential 4.72 V vs Li/Li+ for CB and 4.54 V vs Li/Li+ for BP. The lithium cycling efficiency of Pt electrode is 15.7% for BP electrolyte and 59.3% for CB electrolyte after 20 cycles with 1 mA. The capacity holding ratio of prismatic lithium-ion batteries is 88% for CB electrolyte and (76.3%)for BP electrolyte after 150 cycles at 1C. The overcharging tolerance of the lithium-ion batteries with CB and BP electrolyte are improved, and both of efficiencies are similar.
Keyword:
biphenyl; cyclohexylbenzene; electrolyte; lithium-ion battery; overcharging;
Received: 2004-06-18
4.2 V锂离子电池电解液通常以采用碳酸丙烯酯(PC)、 碳酸二乙酯(DEC)、 碳酸乙烯酯(EC)、 碳酸二甲酯(DMC)或碳酸甲乙酯(EMC)等碳酸酯类溶剂混合物, 电解质盐为LiPF6。 对电解液的安全性研究
二茂铁衍生物(ferrocene derivatives)可作为3 V级锂电池(如Li/TiS2和Li/MnO2)的过充添加剂, 但二茂铁衍生物因氧化电势为3.2~3.6 V(vs Li/Li+)而不能应用至4 V级锂离子电池
1实验
1.1试剂和仪器
所用试剂: 1 mol/L LiPF6 EC, DMC, EMC标准电解液(溶质为LiPF6, 浓度为1 mol/L, 溶剂的质量比为m(EC)∶m(DMC)∶m(EMC)=1∶1∶1)为市场电池级, 联苯(BP, 色谱纯), 环己基苯(CB, 色谱纯), LiCoO2和MCMB及其他电池材料(均为电池级)。
所用仪器: 真空干燥箱(DZG-404型, 天津天宇技术实业有限公司), 手套箱(MB150B-G, 德国MBRAUN公司), 电池程控测试仪(武汉力兴电源有限公司), 1DC Power Supply (DF1730SC5A), CHI660(上海辰华仪器公司)。
1.2样品的制备
将作为添加剂的联苯和环己基苯于80 ℃真空中干燥15 h后, 分别加进标准电解液中。 电解液和添加剂按100∶4(质量比)混合均匀, 静置24 h后,制成2种含添加剂的电解液。 所有操作均在充满高纯氩气的干燥手套箱中进行(水分小于2×10-5)。 电解液中水分以卡尔费休法测量不超过1×10-5。 将聚偏二氟乙烯, 导电剂乙炔黑和LiCoO2按质量比为7∶5∶88混合, 以N-甲基吡咯烷酮为分散剂, 制备LiCoO2电极, 基体为20 μm厚的铝箔。 将聚偏二氟乙烯, 导电剂乙炔黑和MCMB按质量比为9∶4∶87混合, 以N-甲基吡咯烷酮为分散剂, 制备MCMB电极, 基体为10 μm厚的铜箔, 以不锈钢为外壳, 组装3组700 mAh的063048方形锂离子电池(电解液分别为标准电解液, 标准电解液+4%联苯, 标准电解液+4%环己基苯)。
1.3氧化电势的测量
采用三电极模拟电池体系与线性电压扫描法测量1 mol/L LiPF6电解液和过充添加剂的氧化电势。 扫描速率为4 mV/s, 温度为25 ℃。 对电极和参比电极为锂金属片(厚度为0.3 mm), 工作电极采用直径为2 mm标准铂电极。 氧化电势数据根据电流—电压曲线上的肩峰进行处理。 氧化电势数值是电流—电压曲线上电流快速增大处的切线与电压基线的交点。
1.4方形锂离子电池的过充测试
通过已制备为063048方形锂离子电池测试电解液中添加剂对电池耐过充性能的影响。 电池以1C倍率恒流恒压方式充电至4.2 V, 下限电流达到10 mA时终止; 通过恒流恒压源以3 C (2.1 A)倍率进行恒流充电至10 V, 当电压达到10 V时即关闭电源。 在测试过程中, 当电压达5 V前每隔30 s记录一次电压和温度, 当电压达5 V后每隔5 s记录一次数据。
1.5锂循环效率及电池循环性能的测量
以测试氧化电势的同一电池测量电解液的锂循环效率, 温度为25 ℃。 以恒流充放电方式测量锂在铂电极上的循环效率, 充放电效率为放电容量与充电容量的比值。 充放电电流为1 mA, 充电时间为2 min, 放电终止电压为1.5 V(vs Li/Li+)。 063048方形锂离子电池以1 C倍率进行充放电循环。 充放电制度为: 以700 mA恒流充电至4.2 V后, 以4.2 V恒压充电至下限电流20 mA; 以700 mA恒流放电至下限电压为3.0 V时终止; 电池在充电与放电之间静置10 min。
2结果与讨论
2.1电解液的氧化电势
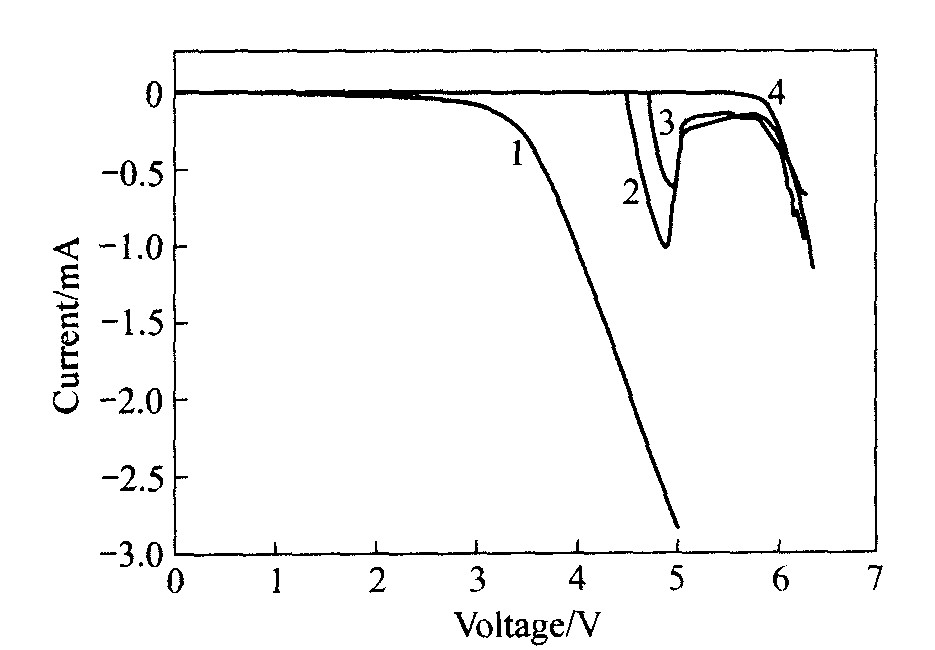
电解液氧化电势是电解液在一定条件下开始氧化分解的电位。 电解液氧化电流是当达到电解液的氧化电势时, 电解液氧化分解产生电流。 氧化电流值反应电解液氧化分解反应速率的大小。 电解液过充添加剂的氧化电流愈大, 氧化分解反应速率就愈快, 对电解液的过充保护效果就愈好。 因而, 当电池被过充时, 增大电池内部气体产生速率与温度升高速率, 在最短的时间内启动电池内部的限流装置或防爆装置, 从而防止电池中的钴酸锂分解释放氧气以及电解液的氧化分解与燃烧, 达到改善电池安全性的目的。 图1所示为电解液的线性电压扫描曲线。 由图可知, 在电解液中, 氧化电势分别为: LiCoO2(3.30 V), BP(4.54 V), CB(4.72 V); 标准电解液在铂电极的氧化电势为5.85 V, 说明BP和CB的氧化电势比石墨/ LiCoO2锂离子电池标准满充电电压高(4.2 V(vs C6Li), 4.3 V(vs Li/Li+)), 同时比标准电解液的氧化电势低, 满足锂离子电池电解液过充添加剂的条件。 因此, 过充添加剂BP与CB可防止电解液氧化分解即释放大量反应热, 提高电池被过充时的热稳定性(安全性)。 环己基苯和联苯的最大氧化电流分别为-6.23×10-4 A和-1.02×10-3 A, 说明联苯的氧化反应速度比环己基苯的氧化反应速度快。 由于联苯的一个芳香环被氢化生成环己基苯, 这种芳香环的氢化减少了化合
图1 1 mol/L LiPF6标准电解液的线性电压扫描曲线 Fig.1 Linear sweep potential curves of 1 mol/L LiPF6 standard electrolyte at 25 ℃ 1—LiCoO2; 2—Standard electrolyte+4%BP; 3—Standard electrolyte+4%CB; 4—Standard electrolyte 4%CB
物的π电子数, 导致氧化性降低, 化合物的电化学聚合反应速率降低。 因此, 单纯就氧化反应速率而言, 联苯比环己基苯对电解液的过充保护效果更好。
实验发现, 对含过充添加剂联苯或环己基苯的电解液进行线性电压扫描时, 在金属铂电极表面及附近有黑色絮状沉淀物生成, 同时电极金属锂片上有大量气泡产生。 然而, 对不含过充保护的标准电解液进行线性电压扫描时, 没有观察到明显的沉淀物与气泡产生。 根据式(1)与式(2)可知, 气体可能是H2, 黑色絮状沉淀物可能是联苯或环己基苯所生成的聚合物。
BP+(BP)n→(BP)n+1+2H++2e-
或 CB+(CB)n→(CB)n+1+2H++2e- (1)
2H++2e-→H2 (2)
2.2电解液的锂循环效率
影响锂金属负极在非水电解液中循环效率的主要因素有电解液与锂的反应, 锂沉积的形态, 电流密度, 电极堆积压力, 工作温度和电极位置等。 本文作者采用小量锂沉积, 大量电解液, 在没有堆积压力的条件下测试电解液的锂循环效率。 在这种实验条件下, 主要是在充电过程中新沉积的具有电化学活性的金属锂与有机溶剂反应, 生成电化学惰性的锂化合物, 消耗沉积锂, 从而导致锂循环效率低。 如果反应能生成一层Li+离子导体膜, 这种膜是锂离子导体, 电子绝缘体, 且溶剂分子不可以通过, 从而可抑制后续循环中电解液被锂还原。 研究表明, 由碳和氢原子组成的如萘、 芘和蒽等芳香环化合物被锂还原可形成稳定的原子团阴离子(1个电子转移产物)和原子团二价阴离子(2电子转移产物), 发生芳香环分裂的不可逆还原反应, 从而形成可抑制反应持续进行的表面膜
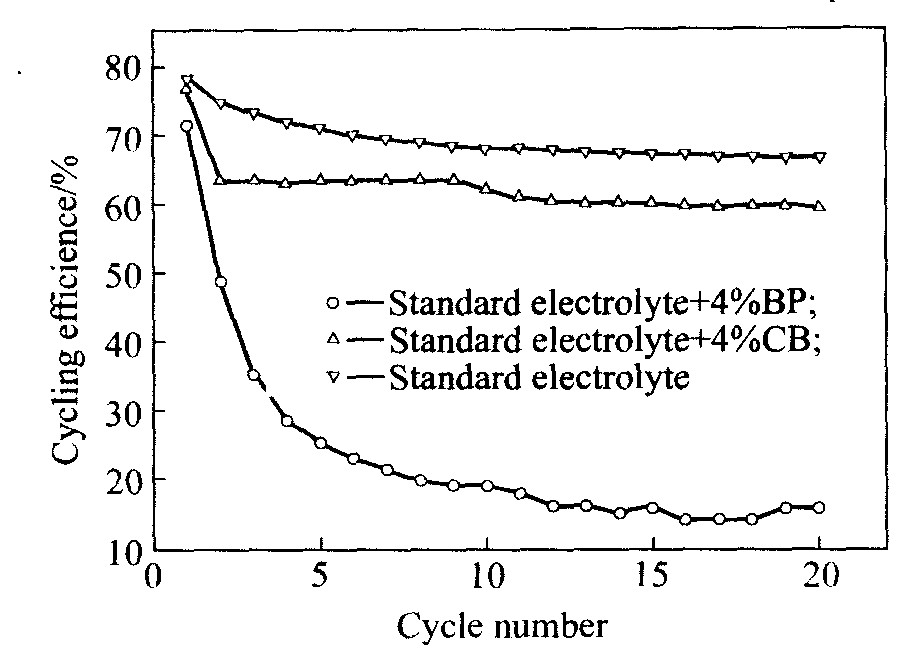
图2所示为不同电解液的锂循环效率曲线。 由图可看出, 在标准电解液中加入联苯后, 电解液锂循环效率迅速降低。 BP容易被碱金属还原形成一个转移了一个电子的稳定还原产物(BP-, Li+)。 在非水溶液中, 由于BP-和Li+的溶解度高, 因而大量BP被消耗直至在锂负极表面形成一层由不溶物组成的表面膜。 锂负极形成的这种表面膜与碳负极表面形成的SEI膜是不同的。 碳负极与电解液之间的反应容易在碳负极形成一层中间相固体电解质膜(SEI膜), 这层表面膜一旦形成就能阻止后续循环中碳负极与电解液反应。 然而, 对锂金属负极每次充电过程都出现纯锂表面, 同时消耗锂, 从而导致每次充放电循环中BP均被锂还原。 因此, 随着
图2 不同电解液的锂循环效率曲线 Fig.2 Lithium cycling efficiency curves of different electrolytes
循环数的增加, 锂负极的放电容量迅速降低。
图2数据表明, 环己基苯电解液的锂循环效率比联苯电解液的锂循环效率高许多, 与标准电解液的锂循环效率接近, 说明在改善锂循环效率方面, 环己基苯过充添加剂比联苯过充添加剂好, 因为联苯的一个芳香环被氢化后, 其还原反应性的降低增强了环己基苯在锂电极的电化学稳定性, 如环己基苯的氧化电势为4.72 V, 联苯的氧化电势为4.54 V。
2.3锂离子电池的过充性能
当充电器失去功效或使用质量不好的充电器时, 锂离子电池可能因充电控制系统的错误监测而被过充。 锂离子电池被过充时, 钴酸锂正极中剩余的锂离子(标准满充电态为Li0.5CoO2)在4.3~4.7 V时脱嵌, 比标准满充电条件下(如式3和4)有更多的锂离子在碳负极嵌入
由于电解液分解或隔膜收缩至微孔关闭, 电池阻抗增大。 当过充电流较小或电池处于热稳定状态时, 电池不会冒烟。 如果锂离子电池因碳负极沉积大量锂枝晶刺穿隔膜导致软短路, 则电池温度不会升高, 仅因内部短路转变成电压为零的电池而失效。 如果电池被以高倍率(如3 C倍率)过充或电池热稳定性极低时, 电池则可能出现冒烟、 燃烧或爆炸等事故。
标准满充电:
过充电:
钴酸锂分解:
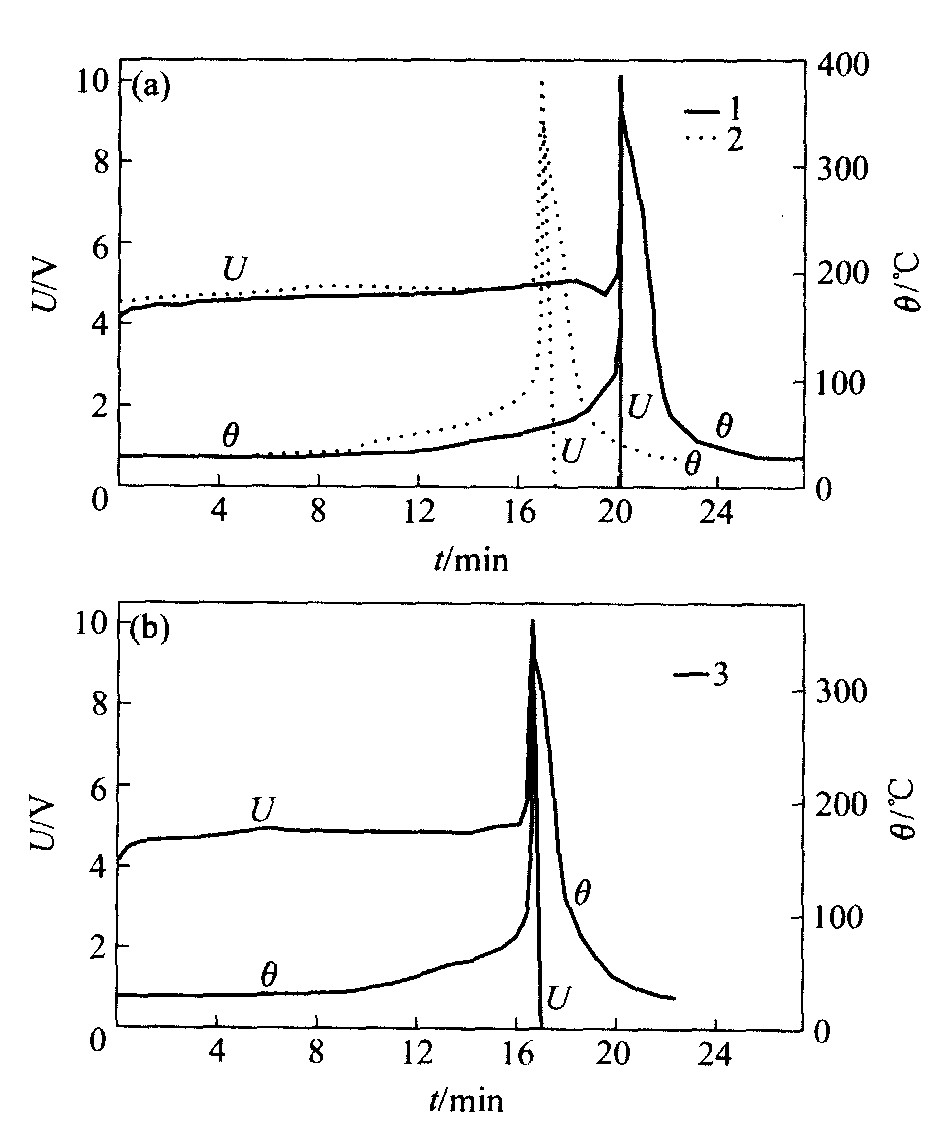
图3所示为以3 C倍率(2.1 A)的电流将电池过充至10 V的结果。 由图3(a)和(b)可见, 过充添加剂联苯或环己基苯对电池耐过充性能的影响是十分相近的。 在标准电解液中加入过充添加剂后, 电池被过充至10 V时电池的温度更低, 所需时间更短。 由于过充添加剂的氧化电势较电解液的氧化电势低, 在电解液尚未氧化分解时, 过充添加剂开始在
图3 方形锂离子电池的3 C倍率过充曲线 Fig.3 Overcharging test results of prismatic lithium-ion batteries with 3 C 1—Standard electrolyte; 2—Standard electrolyte +4% BP; 3—Standard electrolyte +4% CB
正极发生电化学聚合反应并释放出大量氢气和热量, 从而迅速增大电池的内压与温度, 当达到一定温度时, 聚合物隔膜的微孔关闭, 阻止锂离子在正、 负极间迁移, 从而截断电池的内部电流回路, 增大电池阻抗与电池的极化电势。 因此, 电解液中加入过充添加剂后, 电池被过充至10 V时, 钴酸锂正极的锂离子尚未完全脱嵌, 电解液和钴酸锂尚未完全分解, 从而改善了电池的安全性。
2.4锂离子电池的循环性能
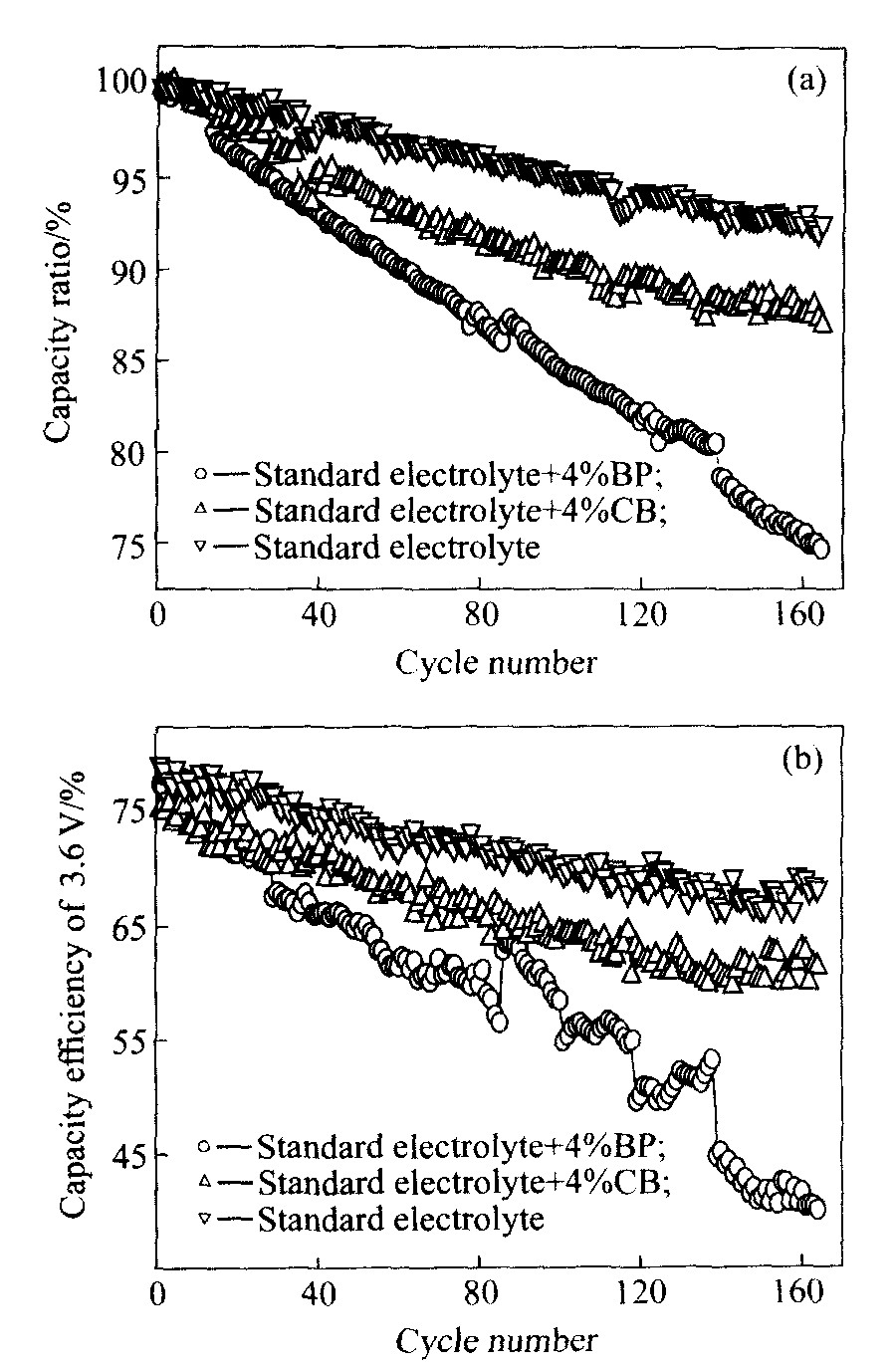
图4所示为联苯或环己基苯添加剂对063048方形锂离子电池的循环性能的影响。 其中图(a)为锂离子电池容量保持率与循环次数的关系; 图(b)为锂离子电池3.6 V电压平台效率与循环次数的关系, 3.6 V电压平台效率指电池放电至3.6 V时的容量与电池的总放电容量的比值。 从图中可看出, 1 C倍率循环150次后, 采用标准电解液时, 锂离子电池的容量保持率为93.1%, 电压平台效率为
图4 联苯与环己苯电解液添加剂对 锂离子电池循环性能的影响 Fig.4 Influence of biphenyl and cyclohexylbenzene additives on cycling performance of lithium-ion batteries
66.4%; 在标准电解液中加入4%联苯后, 电池容量保持率为76.3%, 电压平台效率为41.2%; 在标准电解液中加入4%环己基苯后, 电池的容量保持率为88%, 电压平台效率为60.3%。
以上结果表明, 联苯过充添加剂显著降低了电池的循环性能, 尤其是电池的电压平台效率衰减非常快。 当将电解液中的联苯改用环己基苯的过充添加剂后, 电池容量保持率和电压平台效率明显得到改善, 且与采用没有加过充添加剂的标准电解液的电池容量保持率和平台效率非常接近。 由于将联苯中的一个芳香环氢化生成的环己基苯的还原反应性较低所致, 与图2中不同电解液的锂循环效率的结果相一致, 但063048方形锂离子电池的循环性能更好。 因此, 环己基苯较好地改善了锂离子电池的循环性能。
3结论
1) 环己基苯的氧化电势(4.72 V(vs Li/Li+))比联苯的氧化电势(4.54 V(vs Li/Li+))高, 在锂离子电池正常工作条件下, 环己基苯电解液更稳定。
2) 在三电极锂电池体系中, 环己基苯在铂电极上的锂循环效率比联苯在铂电极上的锂循环效率高, 说明环己基苯过充添加剂可能改善锂离子电池的循环性能, 而联苯对锂离子电池的循环性能影响很大。
3) 063048方形锂离子电池以1C循环150次后, 采用环己基苯过充添加剂的电池容量保持率和3.6 V电压平台效率分别达88%与60.3%, 而采用联苯过充添加剂的电池容量保持率和3.6 V电压平台效率分别只有76.3%与41.2%, 说明联苯加入电解液中显著降低了锂离子电池的循环性能, 而环己基苯在改善电池安全性的同时对电池的循环性能的影响不大。
参考文献
[1] TobishimaSI,YamakiJI .Aconsiderationoflithiumcellsafety[J].JPowerSources,1999,8182:882886.
[2] TobishimaS ,TakeiK ,SakuraiY ,etal.Lithiumioncellssafety[J].JPowerSources,2000,90(2):188195.