文章编号:1004-0609(2010)10-1989-09
新型医用Mg-Nd-Zn-Zr镁合金在模拟体液中的降解行为
张 佳1,宗 阳1,袁广银1, 2,常建卫1,付鹏怀1,丁文江1, 2
(1. 上海交通大学 轻合金精密成型国家工程研究中心,上海 200240;
2. 上海交通大学 金属基复合材料国家重点实验室,上海 200240)
摘 要:
采用光学显微镜、扫描电子显微镜、析氢实验和电化学实验等研究高纯Mg、AZ91D和新开发的Mg-Nd-Zn-Zr(JDBM)合金在模拟体液中的腐蚀行为。结果表明:JDBM和高纯Mg的平均腐蚀速率远低于AZ91D的,且前二者的腐蚀表面较平整,为一种均匀腐蚀方式;而AZ91D的表面有许多贯连的腐蚀深坑,是一种典型的点蚀方式。动电位极化曲线、电化学阻抗谱和析氢实验也表明,JDBM和高纯Mg的耐蚀性比AZ91D的好,JDBM合金在模拟体液中的腐蚀性能接近于高纯镁的。力学性能测试表明,JDBM镁合金具有优良的综合力学性能,满足生物材料对力学性能的要求。
关键词:
中图分类号:R318.08 文献标志码:A
Degradable behavior of new-type medical Mg-Nd-Zn-Zr magnesium alloy in simulated body fluid
ZHANG Jia1, ZONG Yang1, YUAN Guang-yin1, 2, CHANG Jian-wei1,
FU Peng-huai1, DING Wen-jiang1, 2
(1. National Engineering Research Center of Light Alloy Net Forming, Shanghai Jiao Tong University, Shanghai 200240, China;
2. Key State Laboratory of Metal Matrix Composite, Shanghai Jiao Tong University, Shanghai 200240, China)
Abstract: The corrosion behaviors of pure Mg, AZ91D and Mg-Nd-Zn-Zr (JDBM) alloys in simulated body fluid (SBF) were studied by the optical microscopy, scanning electron microscopy (SEM), hydrogen evolution test and electrochemical technique. The results show that the average corrosion rate of JDBM or pure Mg is much lower than that of AZ91D, and the surfaces of JDBM and pure Mg samples after immersion test are smooth, while the surface of AZ91D sample show many conjoint deep pits. The potentiodynamic polarization, electrochemical impedance spectroscopy (EIS) and hydrogen evolution tests also show that JDBM and pure Mg exhibit better corrosion resistance than AZ91D, while the corrosion behavior of JDBM is similar to that of pure Mg. The JDBM alloy has excellent mechanical properties to meet the requirements of implant biomaterials. And the JDBM alloy is a kind of promising magnesium alloy which is suitable to be applied as degradable biomaterials.
Key words: Mg alloy; biomaterial; simulated body fluid; degradable behavior; mechanical properties
金属材料与高分子、陶瓷材料等相比,具有较高的机械强度、韧性、刚性,并且具有导电性,因此在医用植入材料领域,金属材料在人工关节、骨骼接合材料和人工牙齿等需要附加质量的结构材料中得到应用,同时在心脏起搏器以及人工内耳的电极等功能材料中得到应用[1-4]。
目前,应用的这些金属材料的局限性是,它们可能会在腐蚀或者磨损的过程中释放有毒性的金属离子或者粒子,从而引发炎症反应,降低材料的生物相容性以及造成组织损伤。此外,目前的金属生物材料的弹性模量与自然骨不能良好的匹配,这样会产生应力屏蔽效应,使新骨生长所需的刺激减少,导致愈合迟缓,甚至植入失败[1-4]。
Mg是一种非常轻的金属,它的密度是1.74 g/cm3,在所有的结构材料中密度最小,与人体骨的密度接近。表1所列为几种植入材料在物理机械性能方面同人骨的对比[5]。从表1中可以看出,镁的断裂韧性比陶瓷生物材料羟基磷灰石要高,而其弹性模量和抗压屈服强度则比其它金属植入材料更接近人体骨,作为骨接板植入人体后,能有效降低“应力遮挡效应”[5-6]。由此可见,镁及镁合金作为生物植入材料具有非常广阔的应用前景。事实上,镁的降解行为使得它作为生物可降解植入材料具有很大的吸引力。早期的临床应用证实镁金属具有良好的生物相容性及应用于生物医用材料的可行性。据报道,镁能在体液中形成可溶的、无毒的氧化物,然后随尿液排出体外[7]。然而,镁合金的耐蚀性能较差,在Cl-存在的腐蚀环境中或者当介质的pH值小于11.5时,其腐蚀尤为严重。作为生物植入材料,镁合金必须在服役期间严格满足必要的力学与形态学要求,因此,其腐蚀速率不宜过快。人体内环境的正常pH值在7.4左右,而且体液中存在大量的Cl-,加之人体内是一个复杂的腐蚀环境,这些都会造成镁合金在人体内的腐蚀速率的变化[8]。因此,研究镁及其合金在模拟体液中的腐蚀行为非常有必要。
近年来,镁合金作为生物材料的研究取得了较快的进展。在新合金开发方面,ZHANG等[9]就Mg-Zn合金作为可降解生物材料进行系统的研究。研究结果表明,Mg-6Zn合金的挤压态屈服强度和伸长率分别为169.5MPa和18.8%。在SBF浸泡试验过程中,Mg-6Zn合金表面生成了一层由HA和Mg/Ca磷酸盐组成的保护层。动物植入实验结果显示,Mg-6Zn合金的植入部位有氢气包产生,6周后消失。植入部位有新的骨组织和造骨细胞生成。KIM等[10]通过析氢实验研究Ca元素的加入对镁生物材料腐蚀行为的影响。结果表明,随着Ca含量的增加,Mg-Ca合金的析氢速度也随之增加。原因是Mg基体上析出越来越多的Mg2Ca相,而Mg2Ca相会与Mg基体形成微电池,加速Mg基体的溶解。在表面改性方面,乔丽英等[11]采用硬脂酸对Mg和Mg-Ca合金进行热-自组装单分子膜表面改性。实验结果表明,热-自组装膜改善镁基生物材料的耐腐蚀能力和生物活性。颜廷亭等[12]采用正交实验研究以CeCl3为主盐的镁合金稀土转化膜处理工艺。结果表明,经该工艺处理后的AZ31B镁合金在生理盐水及Hank’s溶液中,均具有良好的耐蚀性能;表面稀土转化膜具有良好的抗凝血性能。GU等[13]采用碱液表面改性和热处理结合的方法处理Mg-Ca合金,控制其在模拟体液中的降解速率。研究结果显示,在经过处理的试样表面形成了不同厚度的MgO2层,试样的耐蚀性得到有效的提高。但他们并没有报道该合金的力学性能。
在可降解医用植入镁合金研究领域,如果材料具有良好的耐蚀性能,同时力学性能特别是塑性变形能力也很好,那么这种材料将会具有很好的应用前景。而对于这几点要求,现在已经存在的工业用镁合金材料很难同时满足。本课题组新近开发出一种耐蚀性能很好且力学性能表现优异的新型Mg-Nd-Zn-Zr生物医用镁合金,有望作为一种生物植入材料用于制备可降解骨科内植物(接骨板和骨钉)及可降解心血管支架等。本文作者将Mg-Nd-Zn-Zr镁合金、高纯镁和AZ91D进行对比,研究3种合金在模拟体液中的腐蚀行为,为开发新型可降解医用植入镁合金材料提供参考。
表1 几种植入材料在物理力学性能方面同人骨的对比[5]
Table 1 Comparison of physical and mechanical properties of various implant materials with natural bone[5]

1 实验
实验采用高纯镁(99.99%)、AZ91D、镁钕锌锆(Mg-3.0Nd-0.2Zn-0.4Zr,JDBM)3种合金。高纯镁为铸态,取自铸锭;AZ91D与JDBM均为高温固溶处理(T4)态。AZ91D固溶处理工艺为415 ℃保温16 h后水淬冷却,JDBM固溶处理工艺为540 ℃保温10 h后水淬冷却。
模拟体液(SBF)采用Hank’s模拟体液,在恒温水箱中保持溶液温度在(37±0.5) ℃,采用盐酸和NaOH调节模拟体液的初试pH值为7.5。溶液成分为:NaCl (8.00 g)+KCl (0.40 g)+CaCl2 (0.14 g)+NaHCO3 (0.35 g)+MgCl2·6H2O (0.1 g)+MgSO4·7H2O (0.06 g)+KH2PO4 (0.06 g)+Na2HPO4·12H2O (0.06 g)+H2O (1 L)。清洗腐蚀产物的铬酸溶液成分为200 g/L CrO3+10 g/L AgNO3+蒸馏水。
拉伸性能测试试样是按照ASTM-E8-04的标准加工的,测试以1 mm/min的拉伸速度在SHIMADZU AG-100KNA材料测试仪上进行。
将经过热处理后的适当大小的试样镶样,经800#水砂纸和220#金相砂纸打磨,再用抛光机抛光,磨至试样表面呈现出无划痕的镜面。试样表面用无水乙醇清洗,用吹风机吹干。试样表明经腐蚀液腐蚀后,在金相显微镜下观察金相组织形貌。
生物环境浸泡实验样品尺寸为d 25 mm×3 mm的圆片,靠近边缘处钻d 2 mm孔,方便穿线以便将试样悬挂于模拟体液中。试样先后用220#和800#水磨砂纸打磨,再经丙酮和酒精超声清洗10 min,用吹风机吹干,称取质量后备用。根据ASTM G31-72的浸泡实验标准,溶液体积与试样表面积之比应该为20~40 mL/cm2。在实验过程中,溶液试样表面积为30 mL/cm2,满足ASTM G31-72标准规定。SBF要定期更换,使其pH值不超过8。浸泡实验周期为10 d。试样取出后用沸腾的铬酸洗去表面腐蚀产物,然后,分别经丙酮和酒精超声清洗10 min,吹风机吹干,称取质量。
酸洗工艺:腐蚀后的样品首先用蒸馏水冲洗干净,然后,在温度为100 ℃的铬酸溶液中清洗7 min以去除样品表面的腐蚀产物。
析氢实验样品尺寸为d10 mm×3 mm的圆片,先后用220#和800#水磨砂纸打磨,再经丙酮和酒精超声清洗10 min,用吹风机吹干、备用。溶液体积与试样表面积之比为30 mL/cm2。试样被放置在装有Hank’s溶液的烧杯中,漏斗倒扣住试样以保证将所有生成的氢气收集起来,最后将装满Hank’s溶液的滴定管接在漏斗出口处,滴定管用蝴蝶夹固定,这样就可以测定在模拟体液中浸泡过程中所析出的氢气量。SBF要定期更换,使其pH值不超过8。实验周期为10 d。
用于pH值变化测试实验样品尺寸为d 25 mm×3 mm的圆片,试样经220#和800#耐水砂纸打磨,分别经丙酮和酒精超声清洗10 min后,浸泡在盛有模拟体液的广口瓶中,广口瓶密闭以防止水分蒸发。溶液体积与试样表面积之比为30 mL/cm2,实验周期为5 d。
电化学测试工作装置采用美国普林斯顿应用研究所(PAR)的K47腐蚀电池系统。测试电极采用装有圆柱试样(d12 mm×5 mm)的K105平板试样架,辅助电极为高密度的石墨棒,参比电极为饱和甘汞电极。所有的电化学测试均在PARSTAT 2273 电化学工作站上进行。开路电位的测量在电化学阻抗谱(EIS)和动电位极化曲线测试之前进行,以确保后两者在测试前电位达到稳定值。EIS使用PARSTAT 2273的Power Sine 软件进行测试,这种软件的频率范围可以从1 MHz到10 μHz之间进行。本实验使用Single-Sine技术,频率范围为100 kHz到100 mHz,交流电的振幅为10 mV,测试点为150个。所有的测试都是在开路电位测试完成后立刻进行的。动电位极化曲线的测试在开路电位和EIS测试完毕之后进行,一般情况下,测试样品已经在溶液中浸泡了1 h左右。测试电位从相对于开路电位-250 mV开始,扫描至大约-1.3 V (SCE),扫描速率为1 mV/s。因为镁合金的自腐蚀电位一般在-1.6 V左右,因此我们所测试的电位范围足以获得镁合金腐蚀过程中的电化学信息。
2 结果与分析
JDBM为上海交通大学开发出的室温变形能力达到20%~35%同时兼具优异耐腐蚀性能的高塑性生物镁合金材料,非常好地满足可降解镁合金心血管支架以及骨科内植物材料的性能要求。图1所示为上海交通大学开发的生物镁合金JDBM在不同挤压变形条件的力学性能。由图1可看出,镁合金JDBM经540 ℃固溶4 h后再在350 ℃进行挤压,JDBM的屈服强度可达225 MPa,伸长率可达25%;随着挤压温度的升高,JDBM的屈服强度降低,而伸长率增大。

图1 JDBM镁合金材料室温下的拉伸性能曲线
Fig.1 Tensile property curves of JDBM magnesium alloys at room temperature
图2所示为试验合金分别在铸态和固溶处理态的光学显微组织形貌。从图2可以看出,对于AZ91D合金,经固溶处理后,晶界上分布的β-Mg17Al12相和(α+β)共晶相重新固溶入了基体α-Mg中,基本看不见了[14-15]:对于JDBM合金,经固溶处理后,晶界上的Mg12Nd相消失,溶入基体α-Mg之中[16]。另外,可以看出,无论是铸态还是固溶态,JDBM合金的晶粒尺寸均比AZ91D的要小,具备拥有优异力学性能的必要条件。
图3所示为3种材料在模拟体液中浸泡240 h并洗去腐蚀产物后腐蚀区的SEM像。从图3可看出,AZ91D样品的腐蚀比较严重,为局部腐蚀,表面已经形成了很多很深的点蚀坑,并且坑与坑之间已经联通; 与AZ91D的表面形貌对比发现,高纯Mg基本上为均匀的全面腐蚀,腐蚀情况最轻,表面基本上没有点蚀

图2 AZ91D与JDBM合金铸态及固溶态的光学显微组织
Fig.2 Optical micrographs of as-cast and solution-treated AZ91D and JDBM alloys: (a) As-cast AZ91D; (b) Solution-treated AZ91D; (c), (d) As-cast JDBM; (e), (f) Solution-treated JDBM

图3 试样在37 ℃SBF中浸泡240 h并洗去腐蚀产物后腐蚀区的SEM像
Fig.3 SEM images of Mg ((a), (b)), AZ91D ((c), (d)) and JDBM ((e), (f)) after immersion in SBF at 37 ℃ for 240 h and being acid cleaned
坑;JDBM的表面情况比较接近高纯Mg的,没有出现很深的点蚀,为均匀的全面腐蚀。
图4所示为试样Mg、AZ91D和JDBM在37 ℃SBF中浸泡240 h后的腐蚀断面光学显微照片。从图4可看出,JDBM和Mg的腐蚀边界比较平整,腐蚀主要集中在表面,且腐蚀是往四周扩展,不往纵深方向发展;AZ91D腐蚀较严重,腐蚀表面很粗糙,腐蚀方式为点蚀,腐蚀往纵深方向发展。
平均腐蚀速度ν采用以下公式计算:
![]() (1)
(1)
式中:m为质量损失,mg;ρ为金属密度,g/cm3;A为试样暴露在溶液中的面积,cm2;t为浸泡时间,h。
图5所示为试样Mg、AZ91D和JDBM在37 ℃SBF中的平均腐蚀速率。腐蚀速度结果由(1)式换算后得到。从图5可明显看出,JDBM的腐蚀速度大约为0.25 mm/a,高纯Mg的腐蚀速度大约为0.20 mm/a,而AZ91D的腐蚀速度最快,达到了2.64 mm/a。JDBM和高纯Mg的腐蚀速度与AZ91D的腐蚀速度相差一个数量级。
图6所示为浸泡有高纯Mg、AZ91D和JDBM试样SBF的pH值随时间的变化曲线。从图6中可以看出,浸泡有JDBM和高纯Mg的溶液的pH值变化比较缓慢,从开始的7.40在10 h内上升至8.3左右,然后在110 h内缓慢地从8.3左右上升至8.6左右;而浸泡有AZ91D溶液的pH值变化比较迅速,在最初的10
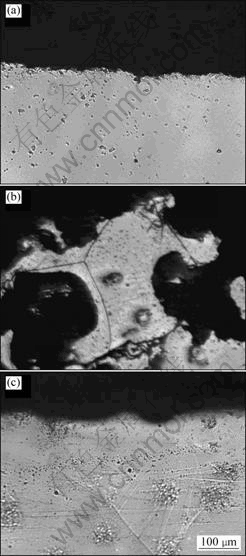
图4 试样在37 ℃SBF中浸泡240 h后的腐蚀断面形貌
Fig.4 Corrosion section morphologies of Mg (a), AZ91D (b) and JDBM (c) after immersion in SBF at 37 ℃ for 240 h
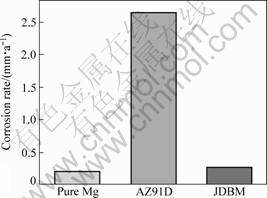
图5 高纯Mg、AZ91D和JDBM在37 ℃SBF中的平均腐蚀速率
Fig.5 Average corrosion rates of pure Mg, AZ91D and JDBM in SBF at 37 ℃
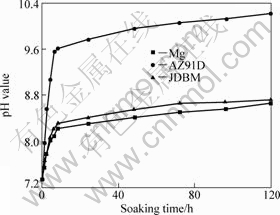
图6 浸泡有高纯Mg、AZ91D和JDBM试样SBF的pH值随时间的变化
Fig.6 Variations of pH values of SBF incubating Mg, AZ91D and JDBM samples with immersion time
h内,从7.40迅速上升至9.6左右,然后在120 h时上升至10.2左右。由此可以看出,若3种材料均植入体内,AZ91D会引起植入部位的pH值发生很大变化,而JDBM和高纯Mg所引起的变化则较小。
图7所示为高纯Mg、AZ91D和JDBM在SBF中的析氢量随浸泡时间的变化。从图7可以看出,AZ91D的变化曲线接近一条直线,也就是说,在实验进行的250 h内,AZ91D几乎始终保持相同的溶解速度;而高纯Mg和JDBM的析氢速度在刚开始时比较快,且随着时间的延长,都呈现出减缓的趋势。总体来说,AZ91D的析氢速率最快,而高纯Mg的析氢速率最慢,JDBM则介于二者之间,比高纯Mg稍快些。
图8所示为高纯Mg、AZ91D和JDBM试样在37
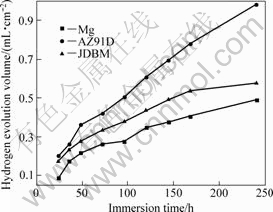
图7 SBF中高纯Mg、AZ91D和JDBM的析氢量随浸泡时间的变化
Fig.7 Variations of hydrogen evolution volumes of Mg, AZ91D and JDBM samples in SBF with immersion time
℃SBF中的极化曲线。由图8可看出,在阴极区内,高纯镁与JDBM的腐蚀行为类似,在相同的电位下,Mg与JDBM的腐蚀电流远远小于AZ91D的腐蚀电流。这表明Mg与JDBM合金的阴极析氢过电位高于AZ91D的析氢过电位,即阴极析氢反应更容易在AZ91D合金的表面进行。在阳极区内,3种合金的极化曲线具有相似的形状,即在阳极极化曲线上存在一个明显的“拐点”,在“拐点”之前,腐蚀电流随电位的增加,升高的速度非常缓慢;而在“拐点”之后,腐蚀电流在很小的电位变化范围内就急剧增大,表明其腐蚀产物层开始破裂。这些“拐点”的出现表明合金表面的腐蚀产物对基体具有一定程度的保护作用,这些拐点对应着腐蚀产物开始破裂的电位。
高纯Mg、AZ91D和JDBM试样在37℃SBF中的阻抗频谱(EIS)用Nyqiust曲线表示,如图9所示,3种
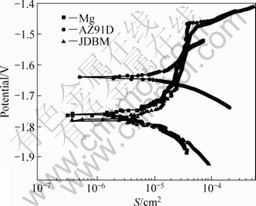
图8 Mg、AZ91D和JDBM试样在37 ℃SBF中的极化曲线
Fig.8 Potentiodynamic polarization curves of Mg, AZ91D and JDBM samples tested in SBF at 37 ℃
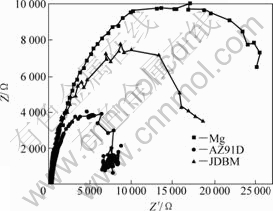
图9 高纯Mg、AZ91D和JDBM试样在37 ℃SBF中的电阻抗频谱
Fig.9 Electrochemical impedance spectroscopies of pure Mg, AZ91D and JDBM samples tested in SBF at 37 ℃
试样的阻抗频谱曲线在高频区都有一个容抗半环。MAKAR等[17]提出镁合金的Nyqiust谱线上的高频容抗半环与腐蚀速率的关系,结果发现大多数Nyqiust曲线的分析结果与质量损失腐蚀速率相吻合,即高频容抗半圆可以表示耐蚀性的强弱,半径越大,其腐蚀速率越小,合金的耐蚀性越好。从图9可清楚地看到,高纯Mg的容抗半圆的半径最大,JDBM的其次,AZ91D的最小,这与浸泡实验结果一致。
3 讨论
当镁及其合金浸泡在含有水的腐蚀介质中时,腐蚀过程主要是金属与水的电化学反应,总的腐蚀反应方程式如下[18]:
Mg+H2O→Mg(OH)2+H2↑ (2)
其中包含如下几个分步反应:
阳极反应:
Mg→Mg2++e- (3)
阴极反应:
H2O+e-→H2↑+OH- (4)
生成产物反应:
Mg2++OH-→Mg(OH)2 (5)
因此,镁合金在模拟体液中的溶解总是伴随着H2的析出。在试验过程中发现,3种试样一放入模拟体液中后,表面就源源不断地有气泡产生。而随着时间的延长,高纯Mg和JDBM在相同时间段内析出的气泡的数量逐渐减少,而AZ91D试样析出气泡的现象没有较大变化。这说明高纯Mg和JDBM 2种试样的溶解速度正在逐渐降低,而AZ91D的溶解速度变化不大。这种现象与图7显示的结果是一致的。
JDBM在SBF中的腐蚀速率为0.25 mm/a,与高纯镁相差不大,腐蚀断面也相当平整(见图3、4和5)。这种腐蚀方式是希望在生物镁合金中看到的,而不是AZ91D的那种速率大且点蚀严重的腐蚀方式。点蚀对力学性能的危害是致命的,一旦出现点蚀,力学性能就无法保证,材料随时都有可能出现失效。这对于生物植入材料是不可接受的。
下面讨论一下这3种材料的腐蚀机理。高纯镁的金相由于全部是基体α-Mg,没有第二相的影响,所以,腐蚀过程严格遵循上述的几个反应式,腐蚀表面基本保持平滑。但是由于其中不可避免地会含有很少量的Mn、Cu、Fe和Si等杂质元素,从而可能引起微坑的产生。对于JDBM,从各个方面的测试结果来看,其特性均和高纯镁很接近。这可能是因为晶界上的Mg12Nd相经过固溶处理,全部融入到基体α-Mg之中,避免了其与基体之间产生微电池效应,从而得到平整的腐蚀表面。对于AZ91D试样,之所以产生如此严重的点蚀,其原因可能是晶界上的(α+β)共晶相和β-Mg17Al12相没有完全固溶入基体,在晶界上仍然有这些相的残留,而这2种相的腐蚀电位均高于基体α-Mg的,在模拟体液介质的作用下,发生微电池效应,基体α-Mg作为阳极被腐蚀,从而导致点蚀坑洞的 产生。
ERINC等[19]研究了现有商用系列镁合金作为生物植入材料的可行性,建立一套镁合金作为可降解生物植入材料的鉴定标准:1) 在37 ℃模拟体液中,腐蚀速率应小于0.5 mm/a,有效服役期在3~6个月;2) 室温屈服强度大于200 MPa,伸长率大于15%。JDBM在Hank’s模拟体液中的腐蚀速率为0.25 mm/a,只有上述标准的一半。JDBM的力学性能可以在屈服强度为225 MPa的状态下,保证伸长率达到25%。所以,本课题组新近开发的生物医用镁合金JDBM优异的耐蚀性和力学性能很好地符合了上述标准,很有希望在可降解生物医用材料领域获得应用。
4 结论
1) 本课题组自行设计了JDBM镁合金,JDBM合金具有很好的塑性变形能力,满足人体植入材料的力学性能要求。
2) 在固溶状态下,JDBM的腐蚀速率可以达到0.25 mm/a,接近高纯Mg的腐蚀速度(0.20 mm/a),说明固溶态JDBM的耐蚀性达到比较高的标准。
3) 装有JDBM与高纯镁试样的SBF的pH值变化幅度和规律均很接近,在120 h内从最初的7.4到最后的8.6左右,而AZ91D则在最后达到了10.2左右。
4) 高纯镁和JDBM的腐蚀方式为均匀腐蚀,AZ91D的腐蚀方式为点蚀。
5) AZ91D的析氢速率最快,而高纯Mg的析氢速率最慢,JDBM析氢速度也较慢,介于AZ91D也高纯Mg二者之间,比高纯Mg稍快一些。
6) 在极化曲线的阴极区内,高纯Mg与JDBM合金的阴极析氢过电位高于AZ91D的析氢过电位,即阴极析氢反应更容易在AZ91D合金的表面进行;在阳极区内,3种合金的极化曲线上都存在一个明显的“拐点”。这些“拐点”的出现表明合金表面的腐蚀产物对基体具有一定程度的保护作用。在阻抗频谱中,高频区的容抗半圆的半径按照AZ91D、JDBM和高纯镁的顺序依次增大,表面耐蚀性也依次增强。
REFERENCES
[1] JACOBS J J, GILBERT J L, URBAN R M. Corrosion of metal orthopaedic implants[J]. J Bone Joint Surg, 1998, 80: 268-282.
[2] JACOBS J J, HALLAB N J, SKIPOR A K, URBAN R M. Metal degradation products: A cause for concern in metal-metal bearings[J]. Clin Orthop Relat Res, 2003, 417: 139-147.
[3] OKAZAKI Y, GOTOH E. Comparison of metal release from various metallic biomaterials in vitro[J]. Biomaterials, 2005, 26: 11-21.
[4] LHOTKA C, SZEKERES T, STEFFAN I, ZHUBER K, ZWEYMULLER K. Four-year study of cobalt and chromium blood levels in patients managed with two different metal-on-metal total hip replacements[J]. J Orthop Res, 2003, 21: 189-195.
[5] STAIGER M P, PIETAK A M, HUADMAI J, DIAS G. Magnesium and its alloys as orthopedic biomaterials: A review[J]. Biomaterial, 2006, 27: 1728-1734.
[6] 黎文献. 镁及镁合金[M]. 长沙: 中南大学出版社, 2005: 501-503.
LI Wen-xian. Magnesium and its alloys[M]. Changsha: Central South University Press, 2005: 501-503.
[7] KANNAN M B, RAMAN R K S. In vitro degradation and mechanical integrity of calcium-containing magnesium alloy in modified-simulated body fluid[J]. Biomaterials, 2008, 29: 2306-2314.
[8] 黄晶晶, 杨 柯. 镁合金的生物医用研究[J]. 材料导报, 2006, 20(4): 67-69.
HUANG Jing-jing, YANG Ke. Biomedical research of magnesium alloy[J]. Materials Review, 2006, 20(4): 67-69.
[9] ZHANG Shao-xiang, ZHANG Xiao-nong, ZHAO Chang-li, LI Jia-nan, SONG Yang, et al. Research on an Mg-Zn alloy as a degradable biomaterial[J/OL]. Acta Biomater, 2009, doi: 10.1016/j.actbio. 2009-06-028.
[10] KIM W C, KIM J G, LEE J Y, SEOK H K. Influence of Ca on the corrosion properties of magnesium for biomaterials[J]. Materials Letters, 2008, 62: 4146-4148.
[11] 乔丽英, 高家诚, 王 勇. 热-自组装单分子膜表面改性镁生物材料的腐蚀降解[J]. 材料研究学报, 2009, 23(2): 153-157.
QIAO Li-ying, GAO Jia-cheng, WANG Yong. Corrosion degradation of surface modified bio-magnesium materials by heat-self-assembled monolayer[J]. Chinese Journal of Material Research, 2009, 23(2): 153-157.
[12] 颜廷亭, 谭丽丽, 熊党生, 龚明明, 张炳春, 杨 柯. 生物医用AZ31B镁合金表面稀土转化膜的制备及其性能研究[J]. 稀有金属材料与工程, 2009, 38(5): 918-923.
YAN Ting-ting, TAN Li-li, XIONG Dang-sheng, GONG Ming-ming, ZHANG Bing-chun, YANG Ke. Preparation and properties studies of rare earth conversion coating on bio-medical AZ31B magnesium alloy[J]. Rare Metal Materials and Engineering, 2009, 38(5): 918-923.
[13] GU X N, ZHENG W, CHENG Y, ZHENG Y F. A study on alkaline heat treated Mg-Ca alloy for the control of the biocorrosion rate[J]. Acta Biomaterialia, 2009, 5: 2790-2799.
[14] 樊 昱, 吴国华, 高洪涛, 李冠群, 翟春泉. La 对 AZ91D 镁合金力学性能和腐蚀性能的影响[J]. 金属学报, 2006, 42(1): 35-40.
FAN Yi, WU Guo-hua, GAO Hong-tao, LI Guan-qun, ZHAI Chun-quan. Effect of La on the mechanical property and corrosion resistance of AZ91D magnesium alloy[J]. Acta Metallurgica Sinica, 2006, 42(1): 35-40.
[15] CHANG J, PENG L, GUO X, ATRENS A, FU P, DING W, WANG X. Comparison of the corrosion behaviour in 5% NaCl solution of Mg alloys NZ30K and AZ91D[J]. Journal of Applied Electrochemistry, 2008, 38(2): 207-214.
[16] CHANG J, GUO X, FU P, PENG L, DING W. Effect of heat treatment on corrosion and electrochemical behaviour of Mg-3Nd-0.2 Zn-0.4 Zr (wt.%) alloy[J]. Electrochimica Acta, 2007, 52(9): 3160-3167.
[17] MAKAR G L, KRUGER J, JOSHI A. Advances in magnesium alloys and composites[J]. Magnesium Technology, 1988: 105-121.
[18] SONG G, ATRENS A. Corrosion mechanisms of magnesium alloys[J]. Advanced Engineering Materials, 1999, 1(1): 11-33.
[19] ERINC M, SILLEKENS W H, MANNENS R G T M, WERKHOVEN R J. Applicability of existing magnesium alloys as biomedical implant materials[J]. Magnesium Technology, 2009: 209-214.
基金项目:上海市重点基础研究资助项目(08JC141412200)
收稿日期:2009-10-16;修订日期:2010-02-04
通信作者:袁广银,教授,博士;电话:021-34203051;E-mail:gyyuan@sjtu.edu.cn


