文章编号: 1004-0609(2006)06-1058-06
粒径可控金红石型纳米二氧化钛的制备及表征
蒋银花, 殷恒波, 邱凤仙, 姜廷顺, 凌 祺, 曹 阳
(江苏大学 化学化工学院, 镇江 212013)
摘 要:
以成本低廉的偏钛酸为起始反应物, 含羧基或羟基的有机化合物为修饰剂, 采用水热合成法进行了纳米金红石型二氧化钛的合成研究, 利用XRD和TEM等对制得的纳米二氧化钛进行表征。 结果表明: 含羧基或羟基的有机化合物在修饰剂条件下都制得了纳米金红石型二氧化钛, 且修饰剂的加入抑制了棒状纳米二氧化钛的颗粒大小, 其中修饰剂的空间位阻效应在控制合成小尺寸二氧化钛纳米棒中起主要作用, 且修饰剂的羟基和羧基的络合作用对颗粒的生长也起到抑制作用。
关键词: 偏钛酸; 粒径可控金红石型TiO2; 有机修饰剂 中图分类号: TQ134.435
文献标识码: A
Preparation and characterization of
size-controlled rutile TiO2 nanoparticles
JIANG Yin-hua, YIN Heng-bo, QIU Feng-xian, JIANG Ting-shun, LING Qi, CAO Yang
(Faculty of Chemistry and Chemical Engineering, Zhenjiang 212013, China)
Abstract: The size-controlled hydrothermal synthesis of phase-pure rutile TiO2 nanoparticles was carried out using low cost metatitanic acid and hydroxyl and carboxyl group-containing organic compounds as starting material and modifiers, respectively. The specimens were characterized by X-ray diffractometry (XRD) and transmission electron microscopy (TEM). The results show that the phase-pure rutile TiO2 is synthesized by the hydroxyl and carboxyl group-containing modifiers, and the average length and diameter of prepared rod-like rutile TiO2 nanoparticles decrease. The space oriented blocks of modifiers favor the formation of small-sized rutile TiO2 nano-rods, at the same time, the coordination between carboxyl or hydroxyl group of modifiers and TiO2 nanoparticles also inhibit the TiO2 crystal growth, resulting in small-sized rutile nanoparticles.
Key words: metatitanic acid; size controlled rutile TiO2; organic modifiers
纳米二氧化钛由于其纳米材料效应和其独特的性质具有各种用途, 例如作为光催化剂[1, 2]、 电子材料[3]、 颜料[4]和涂层[5]等。 在二氧化钛的3种晶形(板钛矿型、 锐钛型和金红石型)中, 金红石型和锐钛矿型是最普遍的两种, 其中金红石型是晶型中热力学最稳定的, 因此金红石型纳米二氧化钛的合成成为研究的热点。
纳米金红石型二氧化钛的合成已有文献报道, 如Pedraza等[6]用TiCl3直接氧化法制备出金红石 型TiO2; Komarneni 等[7]用四氯化钛为原料, 采用微波水热法法合成了纳米金红石型二氧化钛; Tang等[8]用Ti(OC4H9)4溶液强酸性条件下水低温制得了金红石型二氧化钛; Yin等[9]用Ti(C3H7O)4用低温溶解-沉淀法合成金红石型二氧化钛; Yin等[10]以无定型TiO2为原料低温水热法合成金红石型二氧化钛。 这些方法通常以TiCl3、 四氯化钛、 钛醇盐和无定型TiO2为起始反应物, 但成本较高, 且颗粒的尺寸难以控制。 以成本较低的含钛化合物为原料与形貌可控合成纳米二氧化钛成为研究人员的关注热点。 偏钛酸是一种价格低廉的钛白粉生产中间体, 是一种制备纳米二氧化钛的理想原料, 以偏钛酸为原料进行低温制备金红石型纳米二氧化钛的文献报道则很少。 仅Zhang等[11]报道用偏钛酸为原料采用直接水解法制备出金红石型纳米二氧化钛, 但对形貌控制未加以探讨。 含氨基[12]、 羧基[10, 13, 14]、 羟基[12, 14]的有机物或聚合物等有机修饰剂广泛应用于制备纳米二氧化钛, 控制其形貌和性质, 但有机修饰剂对水热合成的金红石型二氧化钛的影响则很少有人研究。 本文作者主要以成本低廉的偏钛酸为原料, 采用低温水热法制备金红石型纳米二氧化钛, 研究了含羟基和羧基的有机修饰剂对二氧化钛形貌的控制。
1 实验
1.1 实验材料
本研究所用偏钛酸由江苏钛白粉集团公司提供, 其中含有2%(质量分数)粒径为2~5nm的锐钛矿型二氧化钛晶种。 柠檬酸、 甘油、 乙酸、 甲酸、 月桂酸、 草酸、 丁二酸、 苯甲酸和没食子酸均为分析纯试剂, 由上海化学试剂有限公司提供。 浓硫酸、 浓盐酸、 乙醇和碳酸钠均为分析纯, 也由上海化学试剂有限公司提供。 实验用水均为蒸馏水。
1.2 制备方法
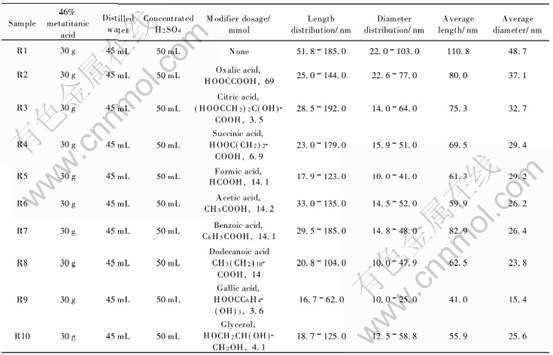
称取含有2%(质量分数)的锐钛矿型纳米二氧化钛晶种的偏钛酸湿物料30g (含TiO2, 质量分数为46%), 加到一定量的蒸馏水中配制成偏钛酸悬浮液, 加入50mL浓硫酸, 于80℃水浴加热溶解, 得溶液, 逐滴加入2mol/L的Na2CO3水溶液, 调pH至0左右, 抽滤, 得澄清滤液。 在滤液中继续逐滴加2mol/L的Na2CO3 水溶液, 直至 pH为9左右, 得到的沉淀经X射线衍射分析为无定型TiO2。 加入碱液后的无定型TiO2悬浮液在搅拌下加入按偏钛酸与有机修饰剂中羟基的摩尔比为10∶1的有机物修饰剂, 于60℃老化1h。 用蒸馏水洗涤沉淀至滤液的电导率小于 20mS/m, 抽滤得滤饼。 称取25g上述滤饼, 加入浓盐酸(38%, 质量分数)和蒸馏水到体积为100mL, 调pH 为 0.4。 室温老化4h。 将老化后的悬浮液放入聚四氟乙烯衬里的不锈钢水解釜中, 于220℃ 反应18h, 离心分离得样品。 具体实验条件如表1所列。
表1 金红石纳米二氧化钛的制备条件和粒子的分布
Table 1 Preparation conditions and size distributions of nanosized rutile TiO2
1.3 结构与形貌表征
用Rigaku, D-max 2200型X-射线粉末衍射仪对制得的样品进行组成、 晶型分析, CuKα(λ=0.15406nm)射线, 石墨单色器, 管电压50kV, 管电流100mA, 扫描速度为7(°)/min。
取少量样品置于无水乙醇中, 超声分散10min后, 然后将其滴在喷有无定型石墨的铜网上, 待晾干, 用Phillips TENCNAI-12型透射电子显微镜(TEM, 加速电压为120kV)观察粒子形貌、 团聚状况及单个粒子的大小。 测量了TEM图中所有可分辨的粒子, 用加权平均法计算二氧化钛颗粒的平均长度、 平均粒径及分布。
2 结果和讨论
2.1 结构、 形貌和颗粒粒径分布
图1所示为金红石型纳米TiO2 R1~R10的X射线衍射谱。 以偏钛酸为起始反应物, 完全酸溶后, 以未加修饰剂(R1)和草酸(R2)、 柠檬酸(R3)、 丁二酸(R4)、 甲酸(R5)、 乙酸(R6)、 苯甲酸(R7)、 月桂酸(R8)、 没食子酸(R9)及甘油(R10)为表面修饰剂所制备出的金红石型纳米二氧化钛样品R1~R10的X射线衍射谱。 所有合成出的二氧化钛都是纯金红石型二氧化钛(PDF# 21-1276金红石型TiO2)。 从图1上还可看出, 除每个样品第一峰的强度相同外, 其余各峰的强度各不相同, 可能与各晶面的生长取向有关。 Yin等[10]的研究表明, 用TiCl4作起始原料制备出的纯无定型二氧化钛在用柠檬酸做修饰剂时, 若pH小于1.27时可得纯金红石型二氧化钛; 而以柠檬酸做修饰剂, 只有当pH不大于0.4时, 才能得到纯金红石型二氧化钛; 当pH高于0.4时, 同等条件下只能得到锐钛矿型二氧化钛和金红石型二氧化钛的混合物。 很明显, 偏钛酸中存在的少量锐钛矿型二氧化钛晶种, 虽然用硫酸溶解后, 其数量大大减少, 但由于极少量的锐钛矿型二氧化钛微晶也能诱导锐钛矿型二氧化钛的生成, 因此只有在酸性更强的条件下才能得到纯金红石型二氧化钛。
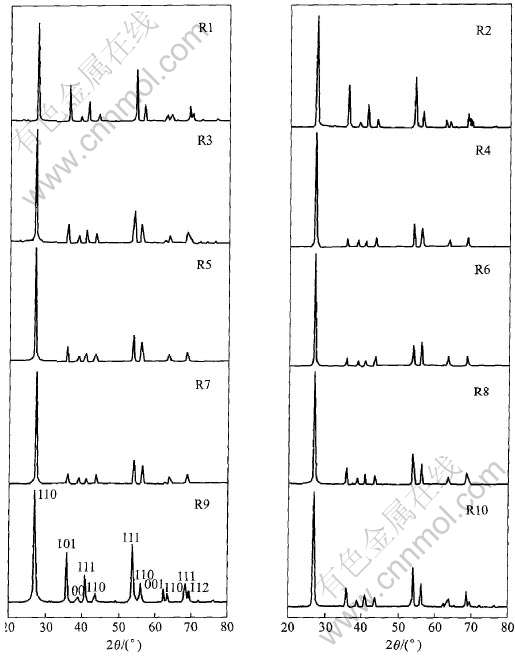
图1 金红石型纳米二氧化钛R1~R10的X射线衍射谱
Fig.1 XRD patterns of samples R1-R10
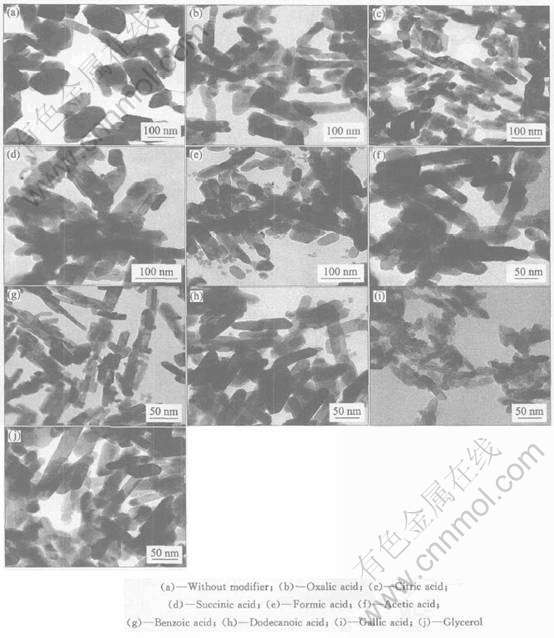
图2 金红石型纳米二氧化钛R1~R10的TEM像
Fig.2 TEM images of R1-R10 prepared by different modifiers
从样品R1至R10的TEM像(图2)可看出, 合成出的金红石型二氧化钛是棒状的, 长和直径均为纳米级。 图3所示为样品R1至R10的粒子大小分布图。
2.2 修饰剂的分子结构对纳米金红石型二氧化钛颗粒形成的影响
在存在修饰剂的条件下合成的棒状纳米二氧化钛平均长度和平均直径均小于无修饰剂条件下制得的纳米二氧化钛粒子的平均长度和平均直径, 说明在含羟基和羧基的修饰剂中, 羧基、 羟基与二氧化钛颗粒发生络合作用, 抑制了颗粒的生长[10, 13, 15]。
当草酸、 柠檬酸、 丁二酸、 甲酸和乙酸为修饰剂时, 这些修饰剂对降低棒状纳米二氧化钛平均直径与平均长度的强弱顺序为草酸、 柠檬酸、 丁二酸、 甲酸和乙酸。 一般认为, 质子酸催化了水热合成过程中水溶性离子的缩合过程[16], 促进了成核与晶体生长。 在本研究中, 当有机酸为修饰剂时, 生成的纳米二氧化钛颗粒较小, 除了配合到二氧化钛微晶上的有机酸的空间位阻作用降低了生成的纳米二氧化钛颗粒尺寸外, 其所含的质子催化了溶液中钛离子的快速缩合成核, 形成了大量的小尺寸纳米二氧化钛颗粒。

图3 R1~R10金红石型纳米二氧化钛的粒径分布
Fig.3 Size distributions of R1-R10 rutile TiO2
当以苯甲酸、 月桂酸和没食子酸作为修饰剂时, 修饰剂对生成的纳米二氧化钛的晶体生长抑制能力的强弱顺序为苯甲酸、 月桂酸和没食子酸, 修饰剂分子的空间位阻效应在控制晶体生长过程中起到了重要作用。 没食子酸与苯甲酸相比, 更有利于小颗粒纳米二氧化钛的生成, 除了羧基配位到纳米二氧化钛上抑制了晶体生长外, 没食子酸苯环上的3个羟基亦应和纳米二氧化钛表面有作用, 从而进一步抑制晶体的生长。 用含3个羟基的甘油做修饰剂合成的二氧化钛比同样含有3个羟基的没食子酸做修饰剂时合成的二氧化钛的平均直径大, 甘油中除了具有羟基的抑制颗粒生长的作用外, 无羧基的络合作用, 且位阻影响小, 因此粒子的直径稍大一些。
3 结论
以低成本的偏钛酸为原料, 有机化合物为修饰剂在220℃下水热合成小尺寸纯金红石型二氧化钛。 修饰剂的空间位阻效应在控制合成小尺寸纳米二氧化钛中起重要作用, 同时修饰剂的羟基和羧基的络合作用也对颗粒的生长起到抑制作用, 通过选用不同修饰剂可制得不同粒径的纳米金红石型二氧化钛。
REFERENCES
[1]Chen J S, Liu M C, Zhang J D, et al. Photocatalytic degradation of organic wastes by electrochemically assisted TiO2 photocatalytic system[J]. J Environ Management, 2004, 70: 43-47.
[2]钱东, 闫早学, 石毛, 等. 溶胶凝胶法制备TiO2纳米颗粒及其光催化性能[J]. 中国有色金属学报, 2005, 15(5): 817-822.
QIAN Dong, YAN Zao-xue, SHI Mao, et al. Sol-gel preparation and photocatalytic activities of TiO2 nano-particles[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(5): 817-822.
[3]Wu J M. Low-temperature preparation of titania nanorods through direct oxidation of titanium with hydrogen peroxide[J]. J Cryst Growth, 2004, 269: 347-355.
[4]Seo D S, Lee J K, Lee E G, et al. Effect of aging agents on the formation of TiO2 nanocrystalline powder[J]. Mater Lett, 2001, 51: 115-119.
[5]Fallet M, Mahdjoub H, Gautier B, et al. Electrochemical behaviour of ceramic sol-gel coatings on mild steel[J]. J Non-Cryst Solids, 2001, 293-295: 527-533.
[6]Pedraza F, Vazquez A. Obtention of TiO2 rutile at room temperature through direct oxidation of TiCl3[J]. J Phys Chem Solids, 1999, 60: 445-448.
[7]Komarneni S, Rajha R K, Katsuki H. Microwave-hydrothermal processing of titanium dioxide[J]. Mater Chem Phys, 1999, 61: 50-54.
[8]Tang Z L, Zhang J Y, Cheng Z, et al. Synthesis of nanosized rutile TiO2 powder at low temperature[J]. Mater Chem Phys, 2002, 77: 314-317.
[9]Yin S, Li R X, He Q L, et al. Low temperature synthesis of nanosize rutile titania crystal in liquid media[J]. Mater Chem Phys, 2002, 75: 76-80.
[10]Yin H B, Wada Y, Kitamura T, et al. Hydrothermal synthesis of nanosized anatase and rutile TiO2 using amorphous phase TiO2[J]. J Mater Chem, 2001, 11: 1694-1703.
[11]Zhang R B, Gao L. Effect of peptization on phase transformation of TiO2 nanoparticles[J]. Mater Res Bull, 2001, 36: 1957-1965.
[12]Andersson M, sterlund L, Ljungstrm S, et al. Preparation of nanosize anatase and rutile TiO2 by hydrothermal treatment of microemulsions and their activity for photocatalytic wet oxidation of phenol[J]. J Phys Chem B, 2002, 106: 10674-10679.
[13]Wu X D, Wang D P, Yang S R. Preparation and characterization of stearate-capped titanium dioxide nanoparticles[J]. J Colloids Inter Sci, 2000, 222: 37-40.
[14]Jiang B P, Yin, H B, Jiang T S, et al. Size-controlled synthesis of anatase TiO2 nanoparticles by carboxylic acid group-containing organics[J]. Mater Chem Phys, 2005, 92: 595-599.
[15]Lim K T, Hwang H S, Ryoo W, et al. Synthesis of TiO2 nanoparticles utilizing hydrated reverse micelles in CO2[J]. Langmuir, 2004, 20: 2466-2471.
[16]Wu M, Lin G, Chen D, et al. Sol-hydrothermal synthesis and hydrothermally structural evolution of nanocrystal titanium dioxide[J]. Chem Mater, 2002, 14: 1974-1980.
基金项目: 江苏省新产品研发基金资助项目(200470)
收稿日期: 2005-11-17; 修订日期: 2006-02-21
通讯作者: 殷恒波, 教授, 博士; 电话: 0511-8791800; 传真: 0511-8791708; E-mail: jyinhua@126.com


