文章编号:1004-0609(2007)08-1255-05
采用PITT与EIS技术测定锂离子电池正极材料LiFePO4中锂离子扩散系数
曲 涛1, 2,田彦文3,翟玉春3
(1. 中山大学 物理科学与工程技术学院,广州 510275;
2. 江门三捷电池实业有限公司 博士后工作站,江门 529000;
3. 东北大学 材料与冶金学院,沈阳 110004)
摘 要:
采用恒电位间歇滴定法(PITT)和电化学阻抗谱技术(EIS)测定锂离子电池正极材料LiFePO4中Li+扩散系数。结果表明:随着嵌锂量的变化,锂离子的扩散系数(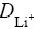 )先出现一个极大值,然后出现一个极小值,随后随嵌锂量的增加而增大;扩散系数在10?13 cm2/s~10?16 cm2/s数量级范围内变化;2种方法计算得到的扩散系数在数量级上相符合。
)先出现一个极大值,然后出现一个极小值,随后随嵌锂量的增加而增大;扩散系数在10?13 cm2/s~10?16 cm2/s数量级范围内变化;2种方法计算得到的扩散系数在数量级上相符合。
关键词:
中图分类号:TM 912.9 文献标识码:A
Measurement of diffusion coefficient of lithium in LiFePO4
cathode material for Li-ion battery by PITT and EIS
QU Tao1, 2, TIAN Yan-wen3, ZHAI Yu-chun3
(1. School of Physics and Engineering, Sun Yat-Sen University, Guangzhou 510275, China;
2. Postdoctoral Workstation, Jiangmen JJJ Battery Co. Ltd., Jiangmen 529000, China;
3. School of Materials and Metallurgy, Northeastern University, Shenyang 110004, China)
Abstract: The chemical diffusion coefficient of Li-ion in LiFePO4 cathode material was measured by potentiostatic intermittent titration technique (PITT) and electrochemical impedance spectrum (EIS). The results show that the diffusion coefficient ranges in 10?13?10?16 cm2/s. With the change of Li content the diffusion coefficient appears an extremely large value firstly, latter appears a minimum, then increases. The calculated values by PITT are in agreement with those by EIS.
Key words: LiFePO4; diffusion coefficient; potentiostatic intermittent titration technique(PITT); electrochemical impedance spectrum(EIS)
锂离子二次电池以其高能量密度、高放电电压、比容量大和自放电率低等优点迅速在便携式计算机、移动电话等小型电器领域取代了传统电池[1]。LiFePO4正极材料具有原料资源丰富、价格便宜、无吸湿性、无毒、环境友好、热稳定性好和安全性高等优点,其理论容量是170 mA?h/g,相对于锂金属负极的稳定放电平台为3.4 V左右[2]。
锂离子的扩散系数是评价电极活性材料的一个重要参数。电化学研究中,根据Fick第二定律,可用多种方法测定锂离子的扩散系数,常用的电化学测试方法有电流脉冲弛豫法(CPR)、电位脉冲弛豫法(PPR)[3]、恒电流间歇滴定法(GITT)[4]、电化学阻抗谱法(EIS)[5]、恒电位间歇滴定法(PITT)[6]和电位阶跃法(PSCA)[7]。其中,CPR技术、PPR技术、GITT技术、PITT技术和PSCA技术适用于电极过程的控制步骤为扩散控制;EIS技术可以通过不同的频率范围来分析电极过程的速率控制步骤,对于一些速率控制步骤难以确定的电极反应,EIS技术是一种非常有效的方法。Shaju等[8]分别采用EIS和GITT技术测定了锂离子在Li2/3(Ni1/3Mn2/3)O2中的扩散系数为10?11 cm2/s~10?10 cm2/s,而且研究发现采用GITT测得的扩散系数比采用EIS方法测得的小。Levi等[9]采用PITT和EIS方法研究了Li1?xCoO2嵌脱锂动力学过程,发现锂离子化学扩散系数与电位有关,且电荷转移阻抗随嵌锂电位的升高而减小。
在以上研究方法中,GITT和EIS技术已经被应用到锂离子在LiFePO4正极材料中的扩散系数研究中[10-13],而PITT法的相关应用研究却未见报道。本文作者采用恒电位间歇滴定法(PITT)和电化学阻抗谱技术(EIS),对锂离子在LiFePO4材料中的扩散系数进行研究。
1 实验
1.1 电极的制备与实验电池的装配
实验所用活性物质为优化合成工艺条件下制备的橄榄石型LiFePO4[14]。
将活性物质、导电剂炭黑和粘合剂聚偏氟乙烯,按质量比80?10?10比例混合,加入一定量的N?甲基吡咯烷酮(NMP)调匀,均匀涂布在铝箔上,烘干后辊压,剪成1 cm2工作电极(正极)片;采用金属锂片作辅助电极(负极)和参比电极;电解液为1 mol/L LiPF6/EC+DMC(质量比为1?1)。
采用1286 Electrochemical Interface和1255 HF Frequency Response Analyzer进行电池材料的PITT和EIS研究。在进行PITT测试前,先对实验电池以0.1 mA?cm2(对工作电极)的电流密度经一次充放电,对电池材料进行电化学活化,静置12 h,当电池的开路电位在30 min内的变化不超过0.1 mV时,即认为电极基本达到平衡。测试时,对工作电极施加阶跃电位ΔE=E1?E2,得到电流对时间的计时电流曲线(I—t曲线),当电流衰减到小于最大阶跃电流的1%时,终止该次阶跃实验,阶跃电位控制在30 mV之内。将电池静置一段时间,当电极基本达到平衡,再进行下一次PITT测试。进行电池材料的交流阻抗研究时,频率变化范围为0.01 Hz~100 kHz,正弦波交流电压扰动信号的幅值为5 mV,每次进行测试之前,先测试电池的开路电位,当电池的开路电位在30 min内的变化不超过0.1 mV,即认为电极基本达到平衡,进行材料的电化学阻抗谱测试。
1.2 PITT法测定锂离子扩散系数(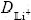 )的基本原理
)的基本原理
根据Fick第二定律,平面电极的一维有限扩散模型为

根据文献[15],这一扩散问题的解为

锂离子在电解质/氧化物电极的界面的浓度梯度所决定的电流为

在较长的时间条件下(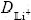 t/(4L2)>0.1),对式(4)进行合理的近似,取其首项得到:
t/(4L2)>0.1),对式(4)进行合理的近似,取其首项得到:

1.3 EIS法测定锂离子扩散系数(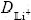 )的基本原理
)的基本原理
根据平面电极的半无限扩散阻抗模型[16]可知:Warburg阻抗Zw可表示为
对于Fick第二定律,Ho等[17]根据平面电极的半无限阻抗模型来求解,结合Fick第一定律、EIS测试条件下的阻抗计算式和Butler-Volmer方程可得到Warburg系数σ的计算公式:

2 结果与讨论
2.1 PITT法研究LiFePO4电极材料中锂离子扩散系数
图1所示为LiFePO4在不同的嵌锂条件下,采用恒电位阶跃的计时电流曲线(温度为20 ℃)。图2所示为图1在60 s内的ln(I)—t曲线。电位的阶跃幅度为ΔE=30 mV,电极活性物质的涂层厚度为L=30 μm。图3所示为根据式(7)和ln(I)—t曲线的斜率计算出的不同嵌锂条件下的扩散系数,LiFePO4的扩散系数为10?13 cm2/s~10?16 cm2/s数量级。由图3可以看出(x=1为锂离子完全脱出态,x=0为锂离子完全嵌入态,该图由右向左看),LiFePO4电极材料在嵌锂过程中先后出现极大值和极小值,这可能是由于以下原因造成的:1) 电极活性材料在进行电化学过程时存在电化学活化过程,在这一过程中扩散系数会随嵌锂量的增加而增大;2) 随着锂离子嵌入量的增大,材料逐渐由单相转变为两相共存区,而两相共存区的扩散系数要小于单相区,因而形成极大值。当锂离子嵌入量大于0.65(x<0.35)后,活性材料逐渐向单相区转变,扩散系数逐渐增大,因而出现了极小值。

图1 Li1?xFePO4电极的电位阶跃测试的计时电流曲线
Fig.1 Plot of chronoamperometry obtained by step voltage of Li1?xFePO4
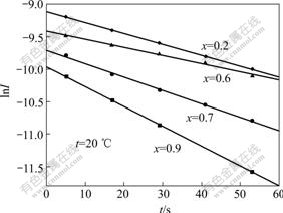
图2 Li1?xFePO4电极的lnI—t曲线
Fig.2 Plot of lnI and t for Li1?xFePO4
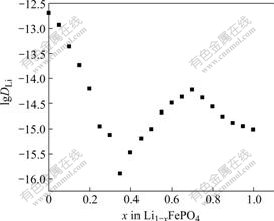
图3 PITT法测定的Li1?xFePO4扩散系数与嵌锂量的关系
Fig.3 Plot of lithium chemical diffusion coefficients obtained by PITT as function of lithium content x in Li1?xFePO4
2.2 电极材料的阻抗特性
图4所示为LiFePO4在不同嵌锂量条件下的阻抗谱。由图4可以看出,在嵌锂初始阶段,随着嵌锂量的增加材料的阻抗增大,达到一定值后便随着嵌锂量的增大,阻抗开始逐渐变小。这是由于在初始阶段,随着嵌锂量增加,材料的电化学极化增大,阻抗变大,当阻抗达到极大值后,随着电化学过程的进行,材料被逐渐活化,阻抗开始降低。
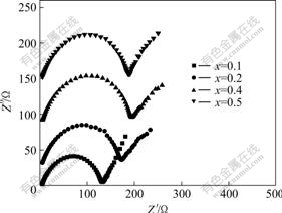
图4 不同嵌锂量的Li1?xFePO4阻抗谱
Fig.4 Impedance spectra for Li1?xFePO4 at various lithium content x
2.3 EIS法测得的电极材料的扩散系数
图5所示为LiFePO4的库仑滴定曲线。图6所示为嵌锂量为0.1(x=0.9)时,Warburg阻抗实部与角频率平方根的关系图。根据式(8),用Warburg阻抗实部对与角频率平方根作图,如图6所示,可得到一定嵌锂量条件下的Warburg系数σ,在确定Warburg系数σ和dE/dn后,由式(9)可求得活性材料的化学扩散系数。由于电极活性物质涂层较薄(30 μm),因而采用电极的几何表面积代替。
采用EIS法测定的Li1?xFePO4的扩散系数![]() 与嵌锂量的关系如图7所示。由图可知,锂离子在LiFePO4活性材料中的化学扩散系数的变化范围在10?13 cm2/s~10?16 cm2/s之间。与PITT测试得到的趋势相似(x=1为锂离子完全脱出态,x=0为锂离子完全嵌入态,该图由右向左看),曲线中
与嵌锂量的关系如图7所示。由图可知,锂离子在LiFePO4活性材料中的化学扩散系数的变化范围在10?13 cm2/s~10?16 cm2/s之间。与PITT测试得到的趋势相似(x=1为锂离子完全脱出态,x=0为锂离子完全嵌入态,该图由右向左看),曲线中![]() 先出现一个极大值,后出现一个极小值,随后随嵌锂量的增加而增大。这可能是由于电化学活化过程与相间相互转化共同作用的结果。
先出现一个极大值,后出现一个极小值,随后随嵌锂量的增加而增大。这可能是由于电化学活化过程与相间相互转化共同作用的结果。
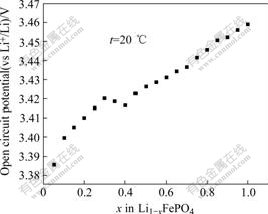
图5 Li1?xFePO4库仑滴定曲线
Fig.5 Quasi-equilibrium potential vs Li+/Li in Li1?xFePO4 as function of lithium content x
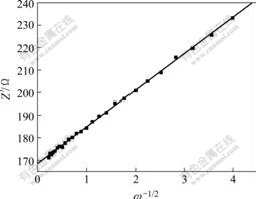
图6 Li0.1FePO4 Warburg阻抗实部与角频率方根的关系
Fig.6 Plot of imaginary resistance as function of inverse square root of angular speed for Li0.1FePO4
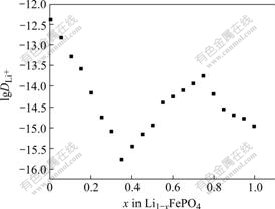
图7 EIS法测定的Li1?xFePO4化学扩散系数与嵌平锂量的关系
Fig.7 Plot of lithium chemical diffusion coefficients obtained by EIS as function of lithium content x in Li1?xFePO4
表1对采用PITT和EIS法测得的活性材料的![]() 进行了比较。由表1可知,采用电化学阻抗谱技术得到的
进行了比较。由表1可知,采用电化学阻抗谱技术得到的![]() 与 PITT法得到的
与 PITT法得到的![]() 数量级相同。
数量级相同。
3 结论
1)随着嵌锂量的变化,扩散系数![]() 先出现一个极大值,后出现一个极小值,随后增大。扩散系数在10?13 cm2/s~10?16 cm2/s范围内变化。
先出现一个极大值,后出现一个极小值,随后增大。扩散系数在10?13 cm2/s~10?16 cm2/s范围内变化。
表1 采用PITT和EIS法测得的Li1?xFePO4扩散系数
Table 1 Chemical diffusion coefficients of lithium in Li1?xFePO4 calculated by PITT and EIS/(cm2?s?1)

2) PITT和EIS法计算得到的数值在数量级上相符合。
[1] Whittingham M S. Lithium batteries and cathode materials[J]. Chemical Reviews, 2004, 104(10): 4271?4301.
[2] Padhi A K, Nanjundawamy K S, Masquelier C , Okada S , Goodenough J B. Effect of structure on the Fe3+/Fe2+ redox couple in iron phosphates[J]. J Electrochem Soc, 1997, 144(5): 1609?1613.
[3] 吴梅银, 王建明, 张鉴清, 曹楚南. 掺锰氢氧化镍的结构与电化学性能[J]. 物理学学报, 2005, 21(5): 523?527.
WU Mei-yin, WANG Jian-ming, ZHANG Jian-qing, CAO Chu-nan. Structure and electrochemical performance of Mn-substituted nickel hydroxide[J]. Acta Physico Chimica Sinica, 2005, 21(5): 523?527.
[4] Liu P, Wu H Q. Diffusion of lithium in carbon[J]. Solid State Ionics, 1996, 92(1/2): 91?97.
[5] Umeda M, Dokko K, Fujita Y, Mohamedi M, Uchida I, Selman J R. Electrochemical impedance study of Li-ion insertion into mesocarbon microbead single particle electrode(part I): Graphitized carbon[J]. Electrochimica Acta , 2001, 47(6): 885?890.
[6] Deiss E. Spurious potential dependence of diffusion coefficients in Li+ insertion electrodes measured with PITT[J]. Eelctrochimica Acta, 2002, 47(25): 4027?4034.
[7] Bohnke C, Bohnke O, Fourquet J L. Electrochemical intercalation of lithium into LiLaNb2O7[J]. J Electrochem Soc, 1997, 144(4): 1151?1158.
[8] Shaju K M, Rao G V S, Chowdari B V R Electrochemical Kinetic Studies of Li-ion in O2-structured Li2/3(Ni1/3Mn2/3)O2 and Li(2/3)+x(Ni1/3Mn2/3)O2 and Li2/3+x(Ni1/3Mn2/3)O2 by EIS and GITT[J]. J Electrochem Soc, 2003, 150(1): A1?A13.
[9] Levi M D, Salitra G, Markovsky B. Solid-state electrochemical kinetics of li-ion intercalation into Li1?xCoO2: Simultaneous application of electroanalytical techniques SSCV, PITT, and EIS[J]. J Electrochem Soc, 1999, 146(4): 1279?1289.
[10] Prosini P P, Lisi M, Zane D, Pasquali M. Determination of the chemical diffusion coefficient of lithium in LiFePO4[J]. Solid State Ionics, 2002, 148(1/2): 45?51.
[11] Choi D, Kumta P N. Surfactant based sol-gel approach to nanostructured LiFePO4 for high rate Li-ion batteries[J]. Journal of Power Sources, 2007, 163(2): 1064?1069.
[12] Ma J X, Wang C S, Wroblewski S. Kinetic characteristics of mixed conductive electrodes for lithium ion batteries[J]. Journal of Power Sources, 2007, 164(2): 849?856.
[13] Hong J, Wang C S, Kasavajjula U. Kinetic behavior of LiFeMgPO4 cathode material for Li-ion batteries[J]. Journal of Power Sources, 2006, 162(2): 1289?1296.
[14] Qu T, Tian Y W, Ding Y, Zhong C Y, Zhai Y C. Optimized synthesis technology of LiFePO4 for Li-ion battery[J]. Trans Nonferrous Met Soc China, 2005, 15(3): 583?588.
[15] 刘恩辉. 锂离子电池正极材料钒氧基化合物的制备及电化学性能研究[D]. 长沙: 中南大学, 2004: 100?101.
LIU En-hui. Research on preparation and electro-chemical performance of vanadium oxides-based compound as cathode materials in secondary lithium ion battery[D] . Changsha: Central South University, 2004: 100?101.
[16] Pyun S I, Bae J S. The AC impedance study of electrochemical lithium intercalation into porous vanadium oxide electrode[J]. Electrochimica Acta , 1996, 41(6): 919?925.
[17] Ho C, Raistrick I D, Huggins R A. Application of AC techniques to the study of lithium diffusion in tungsten trioxide thin films[J]. J Electrochem Soc, 1980, 127(2): 343?350.
基金项目:辽宁省科技厅攻关资助项目(2003224005)
收稿日期:2006-12-28;修订日期:2007-06-04
通讯作者:曲 涛,博士;电话:0750-3534405-611; E-mail: qvtao@126.com
摘 要:采用恒电位间歇滴定法(PITT)和电化学阻抗谱技术(EIS)测定锂离子电池正极材料LiFePO4中Li+扩散系数。结果表明:随着嵌锂量的变化,锂离子的扩散系数(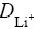 )先出现一个极大值,然后出现一个极小值,随后随嵌锂量的增加而增大;扩散系数在10?13 cm2/s~10?16 cm2/s数量级范围内变化;2种方法计算得到的扩散系数在数量级上相符合。
)先出现一个极大值,然后出现一个极小值,随后随嵌锂量的增加而增大;扩散系数在10?13 cm2/s~10?16 cm2/s数量级范围内变化;2种方法计算得到的扩散系数在数量级上相符合。


