Li4Ti5O12的合成及其影响因素
杨建文,钟 晖,钟海云,李 荐,戴艳阳
(中南大学 冶金科学与工程学院, 湖南 长沙,410083)
摘 要:
O2为原料,反应物无需压制,在1000 ℃反应8 h制得性能较好的纯尖晶石相Li4Ti5O12, 充放电电流为0.5c时比容量为127 mA·h·g-1,0.1c时比容量达145 mA·h·g-1。正交实验结果表明,固相反应合成条件对Li4Ti5O12循环容量影响从大到小的顺序为:温度,时间,n(Li)/n(Ti)和原料特性;在800~1000 ℃之间,原料特性决定最佳反应温度,温度决定反应时间,反应物最佳摩尔比约为0.84。
关键词: Li4Ti5O12; 无定形TiO2; 合成
中图分类号:TM912.9 文献标识码:A 文章编号: 1672-7207(2005)01-0055-05
Synthesis and Influential Factors of Li4Ti5O12
YANG Jian-wen, ZHONG Hui, ZHONG Hai-yun, LI Jian, DAI Yan-yang
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: At 1000 ℃, through one step and no pressing pellet for reactants, the pure cubic-spinel phase Li4Ti5O12 was prepared with amorphous-TiO2+Li2CO3 for 8 h in air. The specific capacitance is 127 mA·h·g-1 at 0.5c current, and 145 mA·h·g-1 at 0.1c current. The sequence of influential factors for Li4Ti5O12 preparation is temperature, time, molar ratio of lithium to titanium (n(Li)/n(Ti)), and the characteristics of raw materials. At 800-1000 ℃, temperature should be adjusted with the materials, and time with the temperature. The n(Li)/n(Ti) of raw materials is about 0.84.
Key words: Li4Ti5O12; amorphous TiO2; synthesis
Li4Ti5O12 是一种尖晶石结构“零应变”嵌入型电极材料, 循环性能非常稳定,其表面不形成钝化膜, 避免了金属锂晶枝的形成, 因此,其安全性能优于碳负极材料,而且其化学扩散系数比碳负极材料大1个数量级, 充放电速度很快[1-3]。Li4Ti5O12作为负极材料与LiCoO2,LiMn2O4,LiNiO2和活性炭等可以组成锂离子电池、全固态电池、混合型超级电容器[4-9], 表现出良好性能。此外,Li4Ti5O12的合成原料丰富, 对环境无污染。Li4Ti5O12合成方法有传统固相反应法、高能球磨法[10]、溶胶-凝胶法等。固相反应法具有规模化生产优势[11],因而人们对其研究较多。固相反应合成Li4Ti5O12的原料对其产物性能具有重要影响,一般采用具有较高反应活性的纳米级锐钛型TiO2为原料,但是纳米锐钛型TiO2价格较高。无定形TiO2为化学反应活性较高的亚稳态物质,是生产各种二氧化钛产品的中间体,其合成工艺简单,因而价格低廉。在此,作者用无定形TiO2制备纯立方尖晶石相Li4Ti5O12,用正交实验方法对Li4Ti5O12制备工艺的主要影响因素进行研究。 -
1 实验方法
1.1 Li4Ti5O12的合成
锐钛型TiO2、无定形TiO2和Li2CO3、溶胶-凝胶前驱体[12,13]等均为分析纯。按实验配比称取反应物,并分散于乙醇中, 用玛瑙三头研磨机连续研磨2 h,为了与溶胶-凝胶前驱体比较, 对反应混合物不进行预先压块,将蒸去乙醇的糊状混合物直接置于马弗炉中升温至所需温度,升温速度为8~10 ℃/min,焙烧一定时间得纯白色产物, 研磨2 h,保存于干燥器中备用。正交设计实验的因素和水平如表1 所示,以第5次循环容量为指标。
表 1 因素水平表
Table 1 Factors and their levels 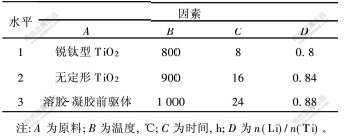
1.2 Li4Ti5O12性能测试
按质量比8∶1∶1分别称取Li4Ti5O12、乙炔碳黑、粘结剂(PVDF), 用溶剂(NMP)调浆, 然后涂布于铝箔上烘干, 碾压后裁剪成直径为16 mm的正极片。 以直径为16 mm、厚度为0.5 mm的电池级锂片作负极, 以1 mol/L LiPF6的2DMC+DEC+2EC溶液为电解液,采用钮扣式电池模具,在充氩气的干燥箱中装配。在室温下, 用HDV-7C晶体管恒电位仪进行充放电,充放电电流0. 5c(1c按150 mA·h·g-1计),电位区间0.8 ~ 3.0 V。
用X射线衍射仪对合成样品进行结构测定,测定条件为:电压50 kV,电流100 mA;Cu-Kα1,波长λ=0.154056 nm。
2 实验结果与讨论
2.1 正交实验结果
正交实验结果如图1所示。可见,A,B,C和D4个因素的极差依次为9.0, 33.0, 23.3, 10.6, 因此,各因素对指标影响大小次序为:B>C>D>A。
选择各因素指标值较大者为优选水平,所以,优选方案应该为A2B3C1D2,即以无定形TiO2+Li2CO3为原料,温度1000 ℃, 时间8 h,n(Li)/n(Ti)=0.84。
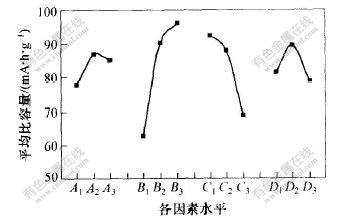
图 1 各因素水平变化趋势
Fig. 1 Varying trend to levels of every factors
2.2 温度和原料对合成Li4Ti5O15的影响
当反应温度高于(1015±5) ℃时,Li4Ti5O12将发生分解生成h-Li2TiO4和Li2Ti3O7[14], 所以,Li4Ti5O12制备温度一般控制在800~1100 ℃。从图1可见,循环容量随着温度升高而增大,900 ℃和1000 ℃时的循环容量比800 ℃时的循环比容量明显增大,但1000 ℃和900 ℃时的循环比容量相差不大。
图2 所示为各实验样品的放电曲线。可见,800 ℃时,固相反应产物的电位平台不明显,为斜线。采用溶胶-凝胶前驱体合成的样品在1.5 V(vs. Li/Li+)附近具有电位平台,说明在较低温度下溶胶-凝胶前驱体的固相反应比较容易进行,Li4Ti5O12生成量较多, 晶粒较细, 有利于大电流充放电。图3 所示为合成样品X射线衍射图谱,图3(b)中的Li4Ti5O12吸收峰比图3(a)中的更尖,说明在800 ℃时,溶胶-凝胶前驱体已经生成结晶比较完全的Li4Ti5O12。从图2可见,900 ℃时,各样品在1.5 V左右均具有比较明显的电位平台,表明此时生成的Li4Ti5O12量增多。溶胶-凝胶前驱体合成样品的平台电位略低于1.5 V,其原因可能是产物晶粒长大,当进行大电流放电时,极化电位较大。在1000 ℃时,各样品的电位平台进一步变宽,放电曲线变得较分散。其中以无定形TiO2为原料的样品电位平台最宽,比容量高达115 mA·h·g-1,比较适合大电流充放电;以锐钛型TiO2为原料的样品,电位平台窄,比容量较小,为72 mA·h·g-1;以溶胶-凝胶前驱体为原料的样品,平台电位明显偏离1.5 V,比容量为101 mA·h·g-1。
可见,实验采用的3种原料均可合成[CM(22] Li4Ti5O12,反应温度需视原料特点进行适当选择。

(a)—800 ℃; (b)—900 ℃; (c)—1000 ℃
1—锐钛型TiO2; 2—无定形TiO2; 3—溶胶-凝胶前驱体;
图 2 Li4Ti5O12样品的放电曲线
Fig. 2 Discharge curves of Li4Ti5O12 samples
与以锐钛型TiO2为原料的固相反应法相比较,采用无定形TiO2为原料,反应时间可缩短至8 h,无需二段反应,也无需预先将反应物压块,因此,更具有规模化生产优势。这是由于无定形TiO2属非晶态,比表面积大,在反应过程中结构容易变化,因而具有很高的反应活性[15,16]。采用溶胶-凝胶前驱体也可以制备Li4Ti5O12,其反应物是分子水平的混合,反应容易进行,反应温度可选择800 ℃左右。
2.3 反应时间对合成Li4Ti5O12的影响
固相反应受扩散过程控制, 在反应温度下, 时间越长, 晶体生长越完整, 晶粒越粗大, 产物的循环容量也将越大, 但与微细粒晶体相比, 粗晶粒的锂离子嵌入反应路径较长, 不利于大电流充、放电。[CM(22] 图1中时间因素(C)水平变化趋势显示,反应时间较短时,样品的循环容量较大;反应时间较长时,容量较小。这种容量随着反应时间延长而减小的关系,主要是由于采用放电电流为0.5c属大电流过程(一般采用0.04~0.10c),极化程度严重影响容量测定值。在1000 ℃反应8 h可得到较理想的目标产物, 说明较高温度时, 采取较短时间, 合成产物为微细晶粒,有利于大电流充放电,因而测得容量最大;相反,采用较长反应时间,产物极化严重,测得容量较小。可见, 反应时间对Li4Ti5O12性能也有较大影响。在固相反应温度范围内,为了合成能够进行大电流充放电的Li4Ti5O12, 固相反应时间应根据反应温度确定。
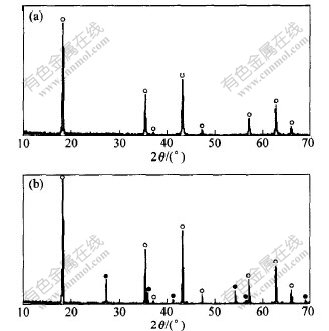
○—Li4Ti5O12; ●—金红石TiO2;
(a)—无定形TiO2+Li2CO3固相反应,n(Li)/n(Ti)=0.84, 1000 ℃, 8 h;
(b)—溶胶-凝胶前驱体反应,n(Li)/n(Ti)=0.8,800 ℃,8 h
图 3 合成Li4Ti5O12样品的XRD图谱
Fig. 3 XRD patterns for Li4Ti5O12 samples
2.4 锂钛的摩尔比n(Li)/n(Ti)对合成Li4Ti5O12的影响
反应物的摩尔比直接影响产物的组成。SUTOMU研究了Li-Ti-O三元系化合物的首次放电和循环比容量,研究结果表明锂钛的摩尔比变化范围为0.5~2.0。在0.5≤n(Li)/n(Ti)≤0.8时,首次放电比容量为常数,循环比容量随n(Li)/n(Ti)增大而逐渐上升;在0.8≤n(Li)/n(Ti)≤2.0时, 首次放电比容量和循环容量都随n(Li)/n(Ti)增大而逐渐下降; n(Li)/n(Ti)=0.8时,循环比容量最大[1]。
本实验中,n(Li)/n(Ti)值参照Li4Ti5O12化学计量比选择。为了补偿高温时锂氧化物的挥发损失,反应物的摩尔比设定为0.80,0.84和0.88。从图1可知,当n(Li)/n(Ti)≈0.84时,产物循环比容量最大(约为115 mA·h·g-1)。从图3可见,图3(a)与文献[9,11]中的图谱较吻合,样品中为纯立方尖晶石相,说明固相反应的反应物的摩尔比采用0.84比较合理;图3(b)所示为n(Li)/n(Ti)=0.8时溶胶-凝胶前驱体合成产物的 X射线衍射图谱,其中包含明显的金红石特征峰, 说明锂不足,钛过剩,其实验比容量约87 mA·h·g-1。
2.5 混料时间对合成Li4Ti5O12的影响
固相反应以固体颗粒为初始原料,化学反应主要受扩散控制,因此,反应前应尽量使反应物混合均匀。研磨时间对Li4Ti5O12充放电性能的影响如图4所示。可见,当反应混合物预研磨1 h时,产物比容量约为90 mA·h·g-1;当反应物分别研磨2 h,3 h和4 h时,产物比容量在125~130 mA·h·g-1之间,放电曲线非常接近。说明反应物研磨2 h后,延长时间对产物性能无较大影响。
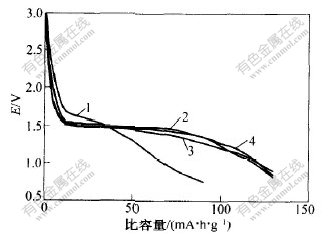
1—1 h; 2—2 h; 3—3 h; 4—4 h
图 4 混料时间对Li4Ti5O12性能的影响
Fig. 4 Effect of griding time on capacity
of Li4Ti5O12
2.6 电化学性能测试
根据正交实验选定的最优条件,对以无定形TiO2为原料的高温固相反应重复实验样品进行电化学性能测试,结果如图5所示。可以看出,Li4Ti5O12电极材料放电平台宽,平台容量占总容量的80%以上,平均电位约1.55 V(vs.Li/Li+),循环性能稳定。以0.5c电流充放电,首次比容量达187 mA·h·g-1,第50次循环比容量容量为127 mA·h·g-1;接着以0.1c充放电,充放电区间为1.2~3.0 V,测得比容量145 mA·h·g-1。由图5还可以看出,以0.5c电流充放电时极化比较严重,比容量降低较多,其主要原因可能是Li4Ti5O12导电性较差。另外,Li4Ti5O12粉末粒度、粒度分布、浆料的配制、电解液以及电极制作工艺等,都会影响其充放电比容量,所以,在Li4Ti5O12掺杂改性以及电极制作工艺等方面还有待进一步研究。
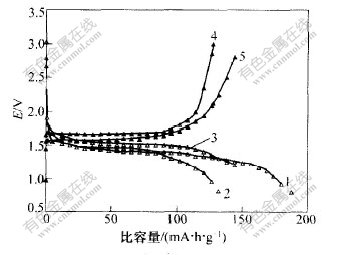
1—放电1次; 2—循环放电50次; 3—循环放电51次;
4—循环充电50次; 5—循环充电51次
图 5 Li4Ti5O12的充放电曲线
Fig. 5 Charge and discharge curves of Li4Ti5O12
3 结 论
a. 以锐钛型TiO2、无定形TiO2、溶胶-凝胶前驱体等为原料的固相反应法均可以合成Li4Ti5O12。各因素对Li4Ti5O12性能影响从大到小的顺序为:温度、时间、n(Li)/n(Ti)、原料类型。 反应温度应该根据原料特性适当选择,反应时间与反应温度有关,温度较低时采用较长反应时间,温度较高时采用较短反应时间。锂与钛的摩尔比约为0.84时,Li4Ti5O12循环充放电比容量最大。
b. 无定形TiO2与Li2CO3混合物不需要进行预先压块,一段固相反应在1000 ℃反应8 h, 可以合成纯立方尖晶石相Li4Ti5O12。
c. Li4Ti5O12电位平台较宽,循环性能稳定,但是其比容量较低,导电性差,需进一步进行掺杂改性和电极优化。
参考文献:
[1]OHZUKU T, UEDA A, YAMAMOTO N. Zero-strain Insertion Material of Li[Li1/3Ti5/3]O4 for Rechargeable Lithium Cells[J]. J Electrochem Soc, 1995, 142(5):1431-1435.
[2]WANG G X, BRADHURST D H, DOU S X, et al. Spinel Li[Li1/3Ti5/3]O4 as an Anode Material for Lithium Ion Batteries[J]. J Power Sources, 1999, 83(1-2):156-161.
[3]雷永泉, 万群, 石永康. 新能源材料[M]. 天津: 天津大学出版社, 2000.
LEI Yong-quan, WAN Qun, SHI Yong-kang. New Energy Materials[M]. Tianjin: Tianjin University Press, 2000.
[4]MAJIMA M, UJIIE S, YAGASAKI E, et al. Development of Long Life Lithium Ion Battery for Power Storage[J]. J Power Sources, 2001, 101(1): 53-59.
[5]JANSEN A N, KAHAIAN A J, KEPLER K D, et al. Development of a High-power Lithium-ion Battery[J]. J Power Sources, 1999, 81-82: 902-905.
[6]PROSINI P P, MANCINI R, PETRUCCI L, et al. Li4Ti5O12 as Anode in All-solid-state, Plastic, Lithium-ion Batteries for Low-power Applications[J]. Solid State Ionics, 2001, 144(1-2): 185-192.
[7]GLENN G, AMATUCCI, FADWA B, et al. An Asymmetric Hybrid Nonaqueous Energy Storage Cell[J]. J Electrochem Soc, 2001, 148(8): A930-A939.
[8]DU P A, PLITA I, GURAL J, et al. Characteristics and Performance of 500F Asymmetric Hybrid Advanced Supercapacitor Prototypes[J]. J Power Sources, 2003, 113(1): 62-71.
[9]KAVAN L, GRTZEL M. Facile Synthesis of Nanocrystalline Li4Ti5O12(spinel) Exhibiting Fast Li Insertion[J]. Electrochemical and Solid-State Letters, 2002, 5(2): A39-A42.
[10]ZAGHIB K, SIMONEAU M, ARMAND M, et al. Electrochemical Study of Li4Ti5O12 as Negative Electrode for Li-ion Polymer Rechargeable Batteries[J]. J Power Sources, 1999, 81-82: 300-305.
[11]ESAKA T, HAYASHI M, SAKAGUCHI H, et al. Analysis of Lithium Ion Distribution in Electrolyzed Li1.33Ti1.67O4 by Neutron Computed Tomography[J]. Solid State Ionics, 2002, 147(1-2): 107-114.
[12]BACH S, PEREIRA-RAMOS J, BAFFIER P N. Electrochemical Properties of Sol-gel Li4/3Ti5/3O12[J]. J Power Sources, 1999, 81-82: 273-276.
[13]LI Hu-lin, SHEN Cheng-min, ZHANG Xiao-gang, et al. Preparation and Characterization of Nanocrystalline Li4Ti5O12 by Sol-gel Method[J]. Materials Chemistry and Physics, 2002, 78(2): 437-441.
[14]CHEN C, SPEARS M, WONDRE F, et al. Crystal Growth and Superconductivity of LiTi2O4 and Li1+1/3Ti2-1/3O4[J]. Journal of Crystal Growth, 2003, 250(1-2): 139-145.
[15]MA Zhen, YUE Ying-hong, DONG Xing-yi, et al. Nanosized Anatase TiO2 as Precursor for Preparation of Sulfated Titania Catalysts[J]. Journal of Molecular Catalysis A: Chemical, 2002, 178(1-2): 97-104.
[16]徐如人, 庞文琴. 无机合成与制备化学[M]. 北京: 高等教育出版社, 2002.
XU Ru-ren, PANG Wen-qin. Inorganic Synthesis and Preparation Chemistry[M]. Beijing: Higher Education Press, 2002.
收稿日期:2004-09-05
作者简介:杨建文(1968-),男,甘肃宁县人,博士研究生,从事有色金属冶金、材料研究
论文联系人: 杨建文,男,博士研究生;电话:0731-8830423(O)
摘要: 以无定形TiO2为原料,反应物无需压制,在1000 ℃反应8 h制得性能较好的纯尖晶石相Li4Ti5O12, 充放电电流为0.5c时比容量为127 mA·h·g-1,0.1c时比容量达145 mA·h·g-1。正交实验结果表明,固相反应合成条件对Li4Ti5O12循环容量影响从大到小的顺序为:温度,时间,n(Li)/n(Ti)和原料特性;在800~1000 ℃之间,原料特性决定最佳反应温度,温度决定反应时间,反应物最佳摩尔比约为0.84。
关键词: Li4Ti5O12; 无定形TiO2; 合成
中图分类号:TM912.9 文献标识码:A 文章编号: 1672-7207(2005)01-0055-05


