氨基改性Fe3O4@SiO2核壳结构的DNA吸附特性
徐慧,颜文晶,张鹏华,黄伟荣
(中南大学 物理与科学技术学院,湖南 长沙,410083)
摘 要:
法,以平均粒径20 nm的Fe3O4纳米颗粒为种子,在碱性环境下催化正硅酸乙酯(TEOS)水解制备Fe3O4@SiO2核壳结构纳米复合粒子;并采用前接枝方式在40 ℃水浴温度下,APTES为硅烷偶联剂,制备氨基功能化Fe3O4@SiO2纳米复合材料;通过透射电镜和红外光谱仪对材料的形貌和结构进行表征,并通过凝胶电泳,生物分光光度计等实验手段研究材料氨基改性前后对质粒DNA的吸附性能。研究结果表明:氨基改性后的纳米复合材料比没有改性的材料对质粒DNA具有更加良好的吸附性能,改性后的材料在吸附量和吸附速率上均有大幅度提高,且随着材料的用量加大,其最终的吸附效果也更好,并且由于材料良好的磁性能,使得被吸附的DNA能够更有效更方便地被回收。
关键词:
中图分类号:O613.72 文献标志码:A 文章编号:1672-7207(2012)01-0100-05
Adsorption property of amino-modified Fe3O4@SiO2 core-shell structure about DNA
XU Hui, YAN Wen-jing, ZHANG Peng-hua, HUANG Wei-rong
(School of Physics Science and Technology, Central South University, Changsha 410083, China)
Abstract: Core-shell structural Fe3O4@SiO2 nanocomposite particles were prepared by sol-gel method, in which the hydrolysis of TEOS was conducted on the surface of Fe3O4 with the aid of basic catalyst. The amino-modified Fe3O4@SiO2 nanocomposite materials were prepared by pre-graft method at the water bath temperature of 40 ℃, in which APTES was the coupling agent. The structure and morphology of these particles were characterized by infrared spectrum and transmission electron microscopy, and the adsorption property of these core-shell particles before and after amino-modified about plasmid DNA was investigated by gel-electrophoresis and bio-spectrophotometer. The results show that the amino-modified nanocomposite materials have a better adsorption performance about the plasmid DNA than the unmodified materials, the adsorption capacity and adsorption rate of modified materials were improved. Moreover, with the increase of the amount of materials, the final effect is better, and because of the excellent magnetic properties of materials, the DNA which was adsorbed can be recycled more efficiently and more conveniently.
Key words: Fe3O4@SiO2; amino-modified; adsorption property; plasmid DNA
由于Fe3O4纳米粒子具有良好的磁学性质,采用无定型SiO2包覆磁性纳米粒子不仅可以改善和调控核心纳米粒子的性质,同时也能带来许多新功能[1-3]。由于SiO2具有良好的生物相容性和化学稳定性[4],采用SiO2包覆Fe3O4纳米粒子也使得包裹后的复合磁性纳米粒子在靶向药物载体、细胞分离、生物分子纯化等生物领域具有广阔的应用前景[5-7]。虽然Fe3O4@SiO2纳米复合材料在生物领域得到重视,然而目前对于各种功能基团改性后的Fe3O4@SiO2纳米复合材料对于DNA的吸附性能的研究并采用这种方法来回收DNA的方法则鲜有报道。目前有些研究工作者采用SiO2纳米球体来吸附回收DNA[8],采用这种方法能够实现DNA吸附效率在80%左右,然而由于其在回收过程中需要通过离心,而DNA片段在离心过程中也有可能被沉积下来,所以这种方法很难被吸附的DNA完全回收,并且其回收过程较为繁琐,如果能在保证材料生物安全性的前提下使材料带有磁性,会使回收变得更加易于操作更加有效。为此,本文作者采用溶胶-凝胶法制备壳层较厚,稳定性好的Fe3O4@SiO2纳米复合粒子,采用前接枝方式氨基改性复合粒子表面,并研究了材料对于酵母菌质粒DNA的吸附性能。
1 实验
1.1 实验试剂
Fe3O4纳米颗粒(平均粒径为20 nm),南京埃普瑞纳米材料有限公司生产;C6H5Na3O7.2H2O(二水合柠檬酸三钠),汕头市西陇化工厂有限公司生产,分析纯;无水乙醇、TEOS,天津市大茂化学试剂厂生产,分析纯;氨水、盐酸,湖南省株洲市化学工业研究所生产,分析纯;APTES(3-氨丙基三乙氧基硅烷),南京曙光化工有限公司生产;酵母菌质粒DNA、EB染料、琼脂糖,由中南大学湘雅医学院遗传学国家重点实验室提供。
1.2 Fe3O4@SiO2复合纳米粒子的制备
配制100 mL 0.1 mol/L的稀盐酸溶液,分3次清洗Fe3O4纳米颗粒,并用磁分离的方式倒去上清液,用无水乙醇和去离子水清洗活化后的材料数次,并配制0.5 mol/L的柠檬酸钠溶液400 mL,将材料和柠檬酸钠转移至三口瓶中60 ℃水浴反应3~6 h,反应完毕后用磁分离方式倒去上清液,并用无水乙醇和去离子水清洗数次,然后用适量的去离子水将材料配制成30 mg/L的稳定的Fe3O4胶体溶液。取30 mL上述胶体溶液加入60 mL的去离子水,240 mL的无水乙醇,3 mL的氨水,超声分散均匀,搅拌缓慢加入6 mL的TEOS,40 ℃水浴使TEOS预水解0.5 h后滴加0.6 mL的APTES,继续搅拌反应3~4 h,磁分离可得Fe3O4@SiO2复合纳米粒子。
1.3 吸附实验
将制备的材料分为同样的两大组(共包括4个小组),在十四孔道的琼脂糖凝胶中同时进行实验,其中,1和14孔道为空白对照孔道(只添加DNA不添加材料),第一大组样品编号:(2, 3, 4),(5, 6, 7);第二大组样品编号:(8, 9, 10),(11, 12, 13);其中(2, 3, 4),(11, 12, 13)均为氨基功能化的材料;而(5, 6, 7),(8, 9, 10)均为没有功能化的材料;并且每个小组材料的添加量从左至右依次递增,即(2, 3, 4)对应添加材料量为:2,4和6 mg;其他3个小组添加材料方式均相同;最后让这2个大组材料进行凝胶电泳实验,通过凝胶分子成像系统观测这两组样品的DNA电泳状态,并在电泳实验进行到40 min时拍摄电泳照片,对比分析实验结果;此外,还进行了另一个吸附实验,将6 mg的氨基功能化材料浸泡于3 mL的3种不同序列不同片段长度的DNA中,采用生物分光光度计测量其浸泡材料前后的DNA浓度。
1.4 表征
用Tecnai公司G2-20-ST型透射电镜(Transmission electron microscopy,TEM)表征样品的形貌,加速电压为200 kV。红外光谱分析采用NICOLET公司FT-5700型傅里叶变换红外光谱仪,KBr压片测定。琼脂糖凝胶电泳采用北京君意东方电泳设备有限公司JY300c型电泳仪进行实验。质粒DNA溶液浓度采用Eppendorf公司的AG-22331-Hamburg型紫外生物分光光度计测定。
2 结果与讨论
2.1 TEM及红外光谱分析结果
图1所示为样品的透射电镜像。从图1可以看出:复合纳米粒子的粒径约为100 nm,包裹的SiO2壳层比较厚,由于SiO2的具有良好的生物稳定性和安全性,这样也使得复合粒子的生物稳定性和安全性变的更好,同时也更易于修饰,整个壳层不容易被破坏,在球体的外面还有一些不容易分离的二氧化硅碎片,这些是TEOS水解后形成的无定型碎片,由于在反应进行的过程中,这些无定型碎片与二氧化硅微球之间比较容易团聚并粘附在一起,所以通过多次清洗的方式磁彻底分离这些碎片还存在一定难度,最终的样品里依然会存在一些少量的碎片。
图2所示为氨基改性前后Fe3O4@SiO2复合纳米粒子的红外光谱。从图2可以看出:样品在569.945 2 cm-1处有一个较弱的吸收峰,这个峰对应着Fe3O4的特征吸收峰,在1 065.964 6 cm-1处有一个强吸收峰,这个峰归结于Si—O—Si的伸缩振动吸收峰,而在1 543.905 3 cm-1处出现的一个新的弱吸收峰可归属于氨基改性后接枝在氧化硅表面的—NH2功能基团的剪式振动峰[9],这说明氨基功能基团成功的嫁接到复合纳米粒子的氧化硅壳层表面上。

图1 Fe3O4@SiO2纳米复合粒子的TEM像
Fig.1 TEM images of amino-modified Fe3O4@SiO2 nanocomposite particles
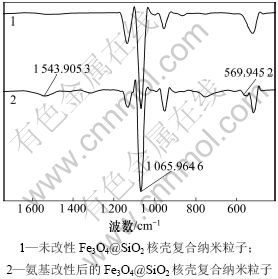
图2 氨基改性前后Fe3O4@SiO2纳米复合粒子的红外光谱
Fig.2 FTIR spectra of Fe3O4@SiO2 nanocomposite particles before and after amino-modified
2.2 复合粒子吸附实验研究
图3所示为2个大组样品的琼脂糖凝胶电泳照片。该实验是在高盐溶度低pH的缓冲液中进行,在照片中从左到右分别编号为1, 2, 3, 4, …, 13, 14;14个孔道中加入的DNA量一定,实验所用DNA均是从酵母菌质粒中提取而来,DNA被吸附在纳米材料的表面以后,那么结合在材料上的DNA在琼脂糖电泳中就会滞留在加样孔中,没有结合上的DNA就会迁移出来,通过EB染色最后再通过凝胶分子成像系统加以观测。从图3可以看出:(2, 3, 4)及(11, 12, 13)孔道中跑出加样孔DNA的荧光强度明显比(5, 6, 7)和(8, 9, 10)中的弱,说明在(2, 3, 4)及(11, 12, 13)这两组的加样孔中滞留的DNA比另外两组的多,即被吸附在(2, 3, 4)及(11, 12, 13)样品表面的DNA比(5, 6, 7)和(8, 9, 10)两组样品的多,同时每个小组中随着样品用量增加,其荧光强度也呈现阶梯性变弱,这说明样品用量越大的话,其能够吸附DNA的量也相应增加,这个实验也充分说明了氨基改性后的Fe3O4@SiO2纳米复合粒子比之没有改性的材料对于DNA具有更加良好的吸附性能,这主要是因为氨基改性后的材料较之没有改性的材料多出了—NH2基团与DNA之间的库仑力作用。
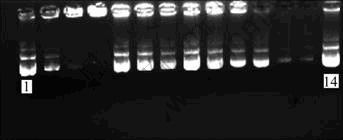
图3 氨基改性Fe3O4@SiO2纳米复合粒子吸附质粒DNA的琼脂糖凝胶电泳像
Fig.3 Agarose gel electrophoresis image of amino-modified Fe3O4@SiO2 nanocomposite particles adsorb plasmid DNA
表1所示为氨基改性和未改性的Fe3O4@SiO2纳米复合粒子浸泡在酵母菌质粒DNA高盐溶度低pH的溶液中10 min以后的浓度及初始浓度的对比值,其中B1,B2和B3分别代表不同序列不同片段长度的酵母菌质粒DNA(片段长度由大到小顺序为B3,B2,B1),从表1可以看出:氨基改性后材料对于不同片段长度的DNA都有着良好的吸附效率,其吸附效率能达90%以上,而相比之下,10 min后未改性的材料只有约50%的吸附效率。同时延长吸附时间至20 min,如表2所示,改性后的材料浸泡的溶液中DNA溶度几乎不变,说明改性的材料对于DNA的吸附在前10 min内就已经达到饱和,而未改性的材料在20 min后相比前10 min其吸附效率上升到了约70%,继续延长吸附时间至 30 min,发现未改性的材料所浸泡的溶液中DNA溶度也几乎不再改变,说明在前20 min的时候未改性材料对于DNA的吸附也达到饱和。可见:改性后的材料不仅仅在吸附效率上要高于未改性的材料,同时在吸附速率上也要明显快于未改性的材料,改性后的材料最终能够实现的吸附量要明显高于未改性的材料。
表1 Fe3O4@SiO2纳米复合粒子吸附酵母菌质粒DNA溶液10 min后
Table 1 Fe3O4@SiO2 nanocomposite particles adsorb Yeast plasmid DNA solution after 10 min

表2 Fe3O4@SiO2纳米复合粒子吸附酵母菌质粒DNA溶液20及30 min后
Table 2 Fe3O4@SiO2 nanocomposite particles adsorb Yeast plasmid DNA solution after 20 min and 30 min
图4所示为材料磁性能的示意图。从图4可以看出:材料的分散性良好,这主要是因为材料本身的粒度较小,并且有大量的二氧化硅存在,也使得材料的相对密度减小,从而能够较好的悬浮在水溶液当中。材料均匀分散后在PE管右侧放置一块磁铁,大约10 s后可以发现材料几乎全部往聚集在右侧PE管壁上,这充分的说明材料具有的良好的磁性能,在此基础之上,根据在低盐高pH溶液环境下DNA分子解离的特性,吸附DNA后的材料可以重新浸泡于低盐溶度高pH的溶液中一段时间,将吸附的DNA重新溶解到溶液中,并采用磁分离方式取出上清液,加以纯化,可以非常方便的回收得到纯化的DNA。

图4 Fe3O4@SiO2纳米复合粒子磁性能示意照片
Fig.4 Schematic images of magnetic property for Fe3O4@SiO2 nanocomposite particles
2.3 氨基改性Fe3O4@SiO2复合粒子吸附质粒DNA作用机理分析
根据SiO2微球在高盐溶度低pH溶液环境下结合DNA分子,在低盐溶度高pH溶液环境下与DNA解离的特性[10],在适当的溶液环境中单纯的SiO2微球也能吸附回收DNA,然而因为质粒DNA磷酸骨架呈负电性[11],而APTES水解后的产物通过缩聚反应会在Fe3O4@SiO2纳米复合粒子表面接枝大量连接碳链的—NH2基团,在低pH的情况下,氨基很容易结合氢离子而带上正电荷[12],从而使得DNA在SiO2微球吸附作用之外,同时也与这些带正电的基团通过基团之间的库仑力作用而被固定在氧化硅壳层上,从而获得一个更加良好的吸附效果,图5所示为吸附作用机理的示意图。
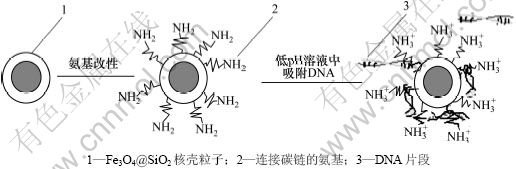
图5 氨基改性Fe3O4@SiO2复合粒子吸附质粒DNA作用机理示意图
Fig.5 Schematic illustration of mechanism for amino-modified Fe3O4@SiO2 nanocomposite particles adsorb plasmid DNA
3 结论
(1) 采用溶胶-凝胶法合成了厚壳层Fe3O4@SiO2纳米复合粒子,通过前接枝方法成功的在SiO2壳层表面修饰了—NH2基团,氨基改性后的Fe3O4@SiO2纳米复合粒子由于SiO2微球及—NH2基团对DNA的库仑力作用,较之没有氨基改性的Fe3O4@SiO2纳米复合粒子对DNA具有更加良好的吸附性能,并且材料使用量增加能够吸附的DNA量也相应增加。
(2) 氨基改性后的Fe3O4@SiO2纳米复合粒子对不同片段长度的DNA均具有更高的吸附效率和吸附速率,吸附效率高达90%以上。
(3) 由于Fe3O4@SiO2磁性能良好,通过磁分离方式也很便于被吸附后的DNA加以回收利用。
(4) 基于这种材料模型,由于其较好的生物安全性、稳定性及可修饰性,如果在壳层表面修饰特定的功能基团,将在蛋白质纯化,靶向基因治疗等生物医学领域具有很高的应用价值。
参考文献:
[1] 马明, 张宇, 顾宁. 反胶束体系中Fe3O4/SiO2核壳结构纳米粒子的制备和表征[J]. 东南大学学报: 自然科学版, 2009, 39(4): 799-802.
MA Ming, ZHANG Yu, GU Ning. Synthesis and characterization of Fe3O4/SiO2 core-shell nanoparticles in reverse micelles[J]. Journal of Southeast University: Science and Technology, 2009, 39(4): 799-802.
[2] Hardikar V V, Matijevic E. Coating of nanosize silver particles with silica[J]. J Colloid Interface Sci, 2000, 221(1): 133-136.
[3] ZHI Ping-xu, QING Hua-zeng, GAO Qing-lu, et al. Inorganic nanoparticles as carriers for efficient cellular delivery[J]. Chemical Engineering Science, 2006, 61(1): 1027-1040.
[4] YU Lu, YIN Ya-dong, LI Zhi-yuan, et al. Synthesis and self-assembly of Au/SiO2 core-shell colloids[J]. Nano Letters, 2002, 2(7): 785-788.
[5] 刘冰, 王德平, 姚爱华, 等. 溶胶-凝胶法制备核壳Fe3O4/SiO2复合纳米粒子的研究[J]. 无机材料学报, 2008, 23(1): 33-38.
LIU Bing, WANG De-ping, YAO Ai-hua, et al. Preparation of core-shell Fe3O4/SiO2 nanocomposite particles via sol-gel approach[J]. Journal of Inorganic Materials, 2008, 23(1): 33-38.
[6] Park M E, Chang J H. High throughput human DNA purification with a minosilanes tailored silica-coated magnetic nano- particles[J]. Materials Science and Engineering C, 2007, 27(3): 1232-1235.
[7] Lee J H, Huh Y M, Jun Y W, et al. Artificially engineered magnetic nanoparticles for ultra-sensitive molecular imaging[J]. Nature Medicine, 2007, 13(1): 95-99.
[8] 丛宪玲, 张德宝, 吴秀丽, 等. 采用二氧化硅微球法回收DNA的实验研究[J]. 中国免疫学杂志, 2004, 20(5): 341-342.
CONG Xian-ling, ZHANG De-bao, WU Xiu-li, et al. Study on DNA recovery by silica beads[J]. Chinese Journal of Immunology, 2004, 20(5): 341-342.
[9] 杨娜, 朱申敏, 张荻, 等. 氨基改性介孔二氧化硅的制备及其吸附性能研究[J]. 无机化学学报, 2007, 23(9): 1627-1630.
YANG Na, ZHU Shen-min, ZHANG Di, et al. Macroporous silica: Surface modification and adsorption properties[J]. Chinese Journal of Inorganic Chemistry, 2007, 23(9): 1627-1630.
[10] Boom R, Sol C J, Salimans M M, et al. Rapid and simple method for purification of nucleic acids[J]. J Clin Microbiol, 1990, 28(2): 495-503.
[11] Roy I, Ohulchanskyy T Y, Bharali D J, et al. Optical tracking of organically modified silica nanoparticles as DNA carriers: A nonviral, nanomedicine approach for gene delivery[J]. PNAS, 2005, 102(2): 279-284.
[12] Yan G, Dalhaimer P, Cai S S, et al. Shape effects of ?laments versus spherical particles in ?ow and drug delivery[J]. Nature Nanotechnology, 2007, 2(3): 249-255.
(编辑 杨幼平)
收稿日期:2011-01-04;修回日期:2011-03-28
基金项目:湖南省科技计划项目(2009FJ3004);高等学校博士学科点专项科研基金资助项目(20070533075)
通信作者:徐慧(1958-),男,湖南常德人,博士,教授,从事无序系统及无机材料研究;电话:0731-88836762;E-mail: xuhui@csu.edu.cn
摘要:采用溶胶-凝胶法,以平均粒径20 nm的Fe3O4纳米颗粒为种子,在碱性环境下催化正硅酸乙酯(TEOS)水解制备Fe3O4@SiO2核壳结构纳米复合粒子;并采用前接枝方式在40 ℃水浴温度下,APTES为硅烷偶联剂,制备氨基功能化Fe3O4@SiO2纳米复合材料;通过透射电镜和红外光谱仪对材料的形貌和结构进行表征,并通过凝胶电泳,生物分光光度计等实验手段研究材料氨基改性前后对质粒DNA的吸附性能。研究结果表明:氨基改性后的纳米复合材料比没有改性的材料对质粒DNA具有更加良好的吸附性能,改性后的材料在吸附量和吸附速率上均有大幅度提高,且随着材料的用量加大,其最终的吸附效果也更好,并且由于材料良好的磁性能,使得被吸附的DNA能够更有效更方便地被回收。


